KNOX2遺伝子は陸上植物の世代交代において複相から単相への移行を抑制する
榊原恵子1・John L. Bowman 2
(1広島大学大学院理学研究科 生物科学専攻,2オーストラリアMonash大学School of Biological Sciences)
email:榊原恵子
DOI: 10.7875/first.author.2013.024
KNOX2 genes regulate the haploid-to-diploid morphological transition in land plants.
Keiko Sakakibara, Sayuri Ando, Hoichong Karen Yip, Yosuke Tamada, Yuji Hiwatashi, Takashi Murata, Hironori Deguchi, Mitsuyasu Hasebe, John L. Bowman
Science, 339, 1067-1970 (2013)
陸上植物は単相と複相の両方において多細胞体制を構築し,それを核相の変化にともない交互にくり返し形成する世代交代を行う.それぞれの世代の発生プログラムは厳密に制御されており,減数分裂と受精により開始される.陸上植物のうち,コケ植物では単相の配偶体が優占しているが,裸子植物や被子植物を含む維管束植物では複相の胞子体が優占しており,陸上植物に近縁のシャジクモでは単相は多細胞体制をもつが複相は単細胞であることから,陸上植物の世代交代は,受精ののち減数分裂の開始が遅れて,新規に複相に特有の発生プログラムが獲得されたことにより誕生したと考えられている.この研究において,コケ植物ヒメツリガネゴケにて転写因子KNOX2をコードする遺伝子を欠損させたところ,複相における胚発生の途中で発生が停止し,減数分裂なしに配偶体様の組織を形成した.このことから,KNOX2遺伝子は複相において単相に特異的な発生プログラムを抑制するはたらきを担っていると推測された.KNOX2遺伝子の獲得は陸上植物の世代交代の獲得に必須であったと考えられた.
陸上植物は動物と異なり,単相(1n,配偶体)と複相(2n,胞子体)の両方において多細胞体制である配偶体と胞子体を形成する.1851年,配偶子である卵細胞や精子(あるいは,花粉)を形成する配偶体と,減数分裂により胞子を形成する胞子体が,陸上植物の生活において交互に出現することが発見され,現在では世代交代とよばれている1).単相と複相それぞれの発生プログラムは厳密に制御されており,減数分裂と受精により開始されるが,それを制御する遺伝子に関しては最近まで謎であった.
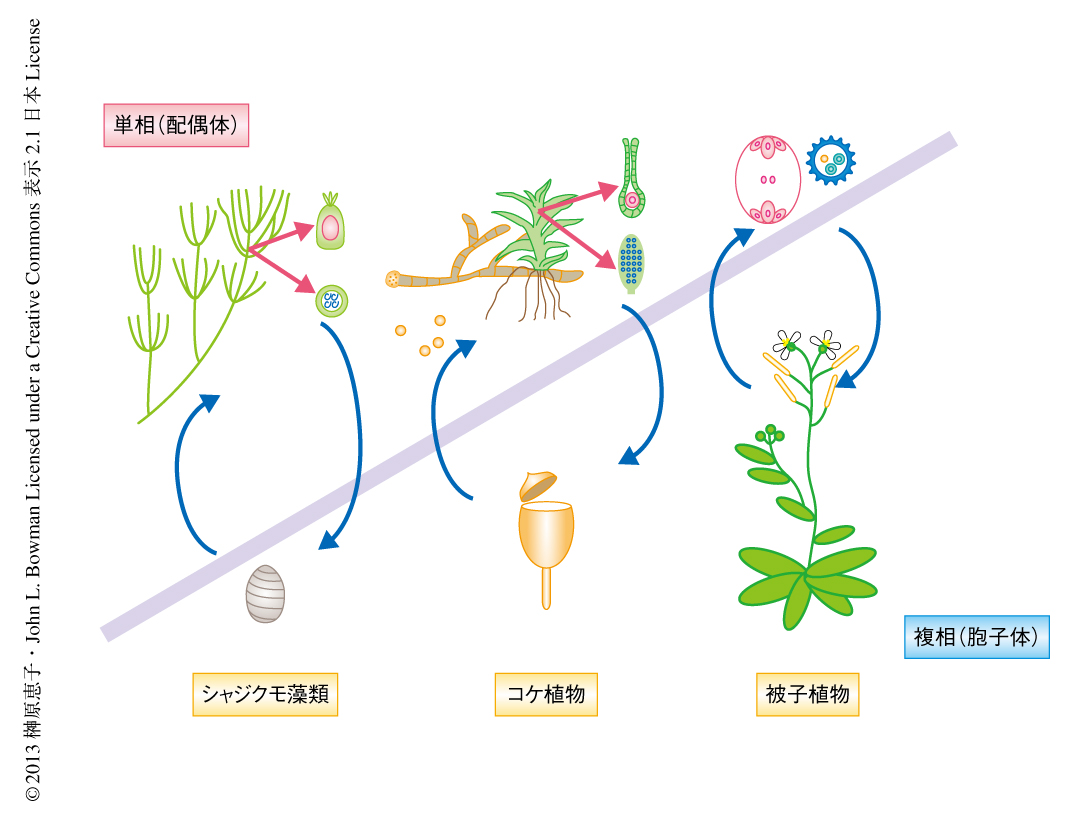
陸上植物の進化の初期に分岐したと考えられているコケ植物は単相が優占しているが,維管束植物(シダ植物と種子植物)では複相が優占している.陸上植物に近縁とされるシャジクモ藻類では単相において多細胞となるが複相は単細胞の受精卵のみであることから,陸上植物の祖先において,受精卵が体細胞分裂できるようになり,減数分裂のタイミングが遅れることで複相の多細胞化が起こり2),さらに,陸上植物の一部の系統では複相が複雑化することで,現在のような陸上植物の多様性が生まれたと考えられる(図1).それでは,どのような遺伝子の変化により,現在のような世代交代が成立したのだろうか.
陸上植物の世代交代を制御する遺伝子を考えるうえで,陸上植物と十数年前に分岐した単細胞緑藻クラミドモナスから興味深い報告がある.クラミドモナスは配偶子がプラスとマイナスの性別をもち,その単相から複相への移行においては2つのTALE型ホメオボックス転写因子,BELLとKNOXが重要な役割を担っている.プラス配偶子はBELL(GSP1:gamete-specific plus1)を,マイナス配偶子はKNOX(GSM1:gamete-specific minus1)を,それぞれ特異的に発現しており,配偶子の時期にはこれらの転写因子は細胞質に局在するが,接合により相互作用が可能となると複合体を形成して核へと移行し,複相に特異的な遺伝子発現を制御する3).GSP1遺伝子の機能欠損株では接合子において複相の発生プログラムが機能せず4),GSP1遺伝子の過剰発現株では単相において複相の発生プログラムがはたらいてしまうため5),クラミドモナスの生活環においてBELL遺伝子とKNOX遺伝子は単相から複相への転換に必須であると考えられる.BELL遺伝子とKNOXは陸上植物でも報告されており,その相互作用も被子植物において保存されていることから6),これらの陸上植物の生活環への関与が推測されていた3).
クラミドモナスからは1個のKNOXが報告されているが,陸上植物は遺伝子重複により生じたKNOX1遺伝子とKNOX2遺伝子の遺伝子亜族を持ち,さらに,それぞれの遺伝子亜族のなかでも複数回の遺伝子重複が起こっている7).KNOX1遺伝子は複相に形成される分裂組織の形成および維持に機能しており,筆者らは,その発現制御がより複雑化することにより維管束植物における複相の巨大化および複雑化が起こったのではないかと推測している8,9).一方で,KNOX2遺伝子についてはその役割がよくわかっていなかった.
遺伝子改変の容易なコケ植物であるヒメツリガネゴケ(Physcomitrella patens)を用いてKNOX2遺伝子の機能解析を行った.まず,ヒメツリガネゴケのゲノムに含まれる2つのKNOX2遺伝子,MKN1遺伝子とMKN6遺伝子をクローニングしその発現様式を調べたところ,いずれの遺伝子も単相の卵細胞と複相の胞子体の発生において発現していた.
KNOX2遺伝子の機能を調べるため,MKN1遺伝子あるいはMKN6遺伝子の単独破壊株,および,MKN1遺伝子とMKN6遺伝子の二重破壊株を作出した.いずれの破壊株でも単相においては顕著な表現型はみられなかったが,MKN6遺伝子単独破壊株,およびMKN1遺伝子とMKN6遺伝子の二重破壊株では,複相において胞子体の発生が途中で停止し,胚の一部から配偶体様の組織が形成された(図2).これを培養してみたところ,単相としてどんどん成長し,生殖器を誘導すると,野生株と同様の頻度で生殖器である造卵器および造精器を形成した.さらに,受精に必要な水をあたえておくと自家受精により胚を形成したことから,MKN6遺伝子の単独破壊株,および,MKN1遺伝子とMKN6遺伝子の二重破壊株の複相の組織から形成された配偶体様の組織は,単相と同様にふるまうことがわかった.ただし,このようにして得られた胞子体は途中で発生が停止し,ふたたび配偶体様の組織を形成した.
このような減数分裂を介さない胞子体から配偶体への異時的な移行はアポスポリー(apospory)とよばれ,自然界や実験環境下において起こる.アポスポリーでは染色体やDNAの量は複相を維持したまま,異時的に単相様の組織を形成する.そこで,MKN1遺伝子とMKN6遺伝子の二重破壊株の胚から異時的に形成された単相様の組織のDNA含有量を調べてみたところ,通常の単相の組織の2倍のDNAを含んでいた.すなわち,KNOX2遺伝子破壊株では,核相は複相であっても単相の表現型を示していることがわかった.KNOX2遺伝子は通常は胚において発現していることから,複相において単相の発生プログラムがはたらかないよう抑制していると考えられる.
緑藻クラミドモナスでは転写因子であるKNOXとBELLが相互作用し,複相の発生プログラムを機能させることが知られている.ヒメツリガネゴケのKNOX2遺伝子の産物もBELLとの相互作用により機能している可能性を調べるため,ヒメツリガネゴケのゲノムからみつかっている4個のBELL遺伝子の発現様式を調べたところ,3個のBELL遺伝子はおもに複相において発現していることがわかった.これらのBELL遺伝子の産物はKNOX2遺伝子の産物と相互作用して機能している可能性があり,その詳細な解析は今後の課題である.
ヒメツリガネゴケにおいて,KNOX2遺伝子の機能欠損株がアポスポリーをひき起こす一方,PRC2複合体をコードする遺伝子の機能欠損株は受精をへずに単相から胞子体を直接に誘導するアポガミー(apogamy)をひき起こす10,11).PRC2複合体はエピジェネティックな発現抑制に関与していることから,世代交代の制御がエピジェネティックかつゲノムワイドに制御されている可能性が示されていた.一方,KNOX2は世代移行の鍵となる転写因子なので,今後,KNOX2の標的遺伝子を調べていくことにより,世代交代の制御ネットワークの全貌が明らかにできるものと期待される.また,被子植物であるシロイヌナズナは4個のKNOX2遺伝子をもち,胞子体のさらに複雑化した被子植物における機能がわかれば,品種改良などにたいへん有用なツールとなる.
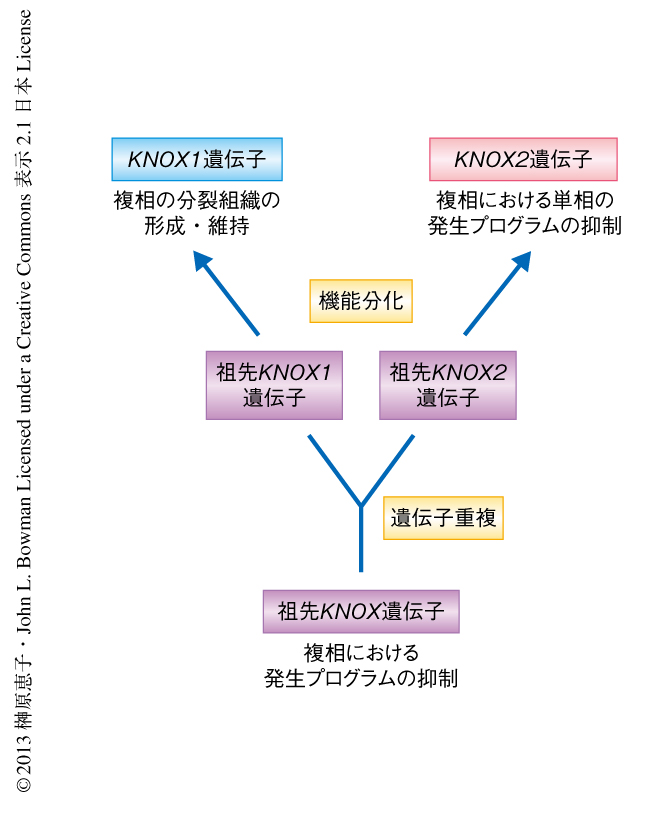
KNOX1遺伝子とKNOX2遺伝子は,緑藻と陸上植物との分岐ののち陸上植物の系統においてKNOXの重複により生じたと考えられる.そののちの機能分化により,KNOX1遺伝子は複相において分裂組織の維持に,KNOX2遺伝子は複相において単相の発生プログラムの抑制に機能するようになり,複相における多細胞体制が獲得されたのではないかと推測される(図3).その結果,現在のような陸上植物の世代交代が成立したのであろう.
世代交代は生物の進化の過程において複数回にわたり独立に生じたと考えられており,陸上植物だけでなく,褐藻,紅藻,ほかの緑藻からも報告されている12).褐藻シオミドロ(Ectocarpus siliculosus)からも世代交代にかかわる変異体が単離されている13).シオミドロは2010年にゲノム解読されており14),これらの新しい材料を使うことにより,生物進化における世代交代の成立のしくみの共通性が明らかにされていくものと期待される.
略歴:2003年 総合研究大学院大学生命科学研究科博士課程 修了,2004年 広島大学大学院理学研究科 研究員,2007年 オーストラリアMonash大学 リサーチフェロー,2009年 ERATO長谷部分化全能性進化プロジェクト 技術参事を経て,2011年より広島大学大学院理学研究科 特任助教.
研究テーマ:陸上植物の発生進化.
関心事:同じような形態や現象が進化の過程で複数回にわたり生じるしくみ.つねに新しいこと,おもしろいこと,チャレンジンングなことをしていきたい.
John L. Bowman
オーストラリアMonash大学 教授.
© 2013 榊原恵子・John L. Bowman Licensed under CC 表示 2.1 日本
(1広島大学大学院理学研究科 生物科学専攻,2オーストラリアMonash大学School of Biological Sciences)
email:榊原恵子
DOI: 10.7875/first.author.2013.024
KNOX2 genes regulate the haploid-to-diploid morphological transition in land plants.
Keiko Sakakibara, Sayuri Ando, Hoichong Karen Yip, Yosuke Tamada, Yuji Hiwatashi, Takashi Murata, Hironori Deguchi, Mitsuyasu Hasebe, John L. Bowman
Science, 339, 1067-1970 (2013)
要 約
陸上植物は単相と複相の両方において多細胞体制を構築し,それを核相の変化にともない交互にくり返し形成する世代交代を行う.それぞれの世代の発生プログラムは厳密に制御されており,減数分裂と受精により開始される.陸上植物のうち,コケ植物では単相の配偶体が優占しているが,裸子植物や被子植物を含む維管束植物では複相の胞子体が優占しており,陸上植物に近縁のシャジクモでは単相は多細胞体制をもつが複相は単細胞であることから,陸上植物の世代交代は,受精ののち減数分裂の開始が遅れて,新規に複相に特有の発生プログラムが獲得されたことにより誕生したと考えられている.この研究において,コケ植物ヒメツリガネゴケにて転写因子KNOX2をコードする遺伝子を欠損させたところ,複相における胚発生の途中で発生が停止し,減数分裂なしに配偶体様の組織を形成した.このことから,KNOX2遺伝子は複相において単相に特異的な発生プログラムを抑制するはたらきを担っていると推測された.KNOX2遺伝子の獲得は陸上植物の世代交代の獲得に必須であったと考えられた.
はじめに
陸上植物は動物と異なり,単相(1n,配偶体)と複相(2n,胞子体)の両方において多細胞体制である配偶体と胞子体を形成する.1851年,配偶子である卵細胞や精子(あるいは,花粉)を形成する配偶体と,減数分裂により胞子を形成する胞子体が,陸上植物の生活において交互に出現することが発見され,現在では世代交代とよばれている1).単相と複相それぞれの発生プログラムは厳密に制御されており,減数分裂と受精により開始されるが,それを制御する遺伝子に関しては最近まで謎であった.
陸上植物の進化の初期に分岐したと考えられているコケ植物は単相が優占しているが,維管束植物(シダ植物と種子植物)では複相が優占している.陸上植物に近縁とされるシャジクモ藻類では単相において多細胞となるが複相は単細胞の受精卵のみであることから,陸上植物の祖先において,受精卵が体細胞分裂できるようになり,減数分裂のタイミングが遅れることで複相の多細胞化が起こり2),さらに,陸上植物の一部の系統では複相が複雑化することで,現在のような陸上植物の多様性が生まれたと考えられる(図1).それでは,どのような遺伝子の変化により,現在のような世代交代が成立したのだろうか.
陸上植物の世代交代を制御する遺伝子を考えるうえで,陸上植物と十数年前に分岐した単細胞緑藻クラミドモナスから興味深い報告がある.クラミドモナスは配偶子がプラスとマイナスの性別をもち,その単相から複相への移行においては2つのTALE型ホメオボックス転写因子,BELLとKNOXが重要な役割を担っている.プラス配偶子はBELL(GSP1:gamete-specific plus1)を,マイナス配偶子はKNOX(GSM1:gamete-specific minus1)を,それぞれ特異的に発現しており,配偶子の時期にはこれらの転写因子は細胞質に局在するが,接合により相互作用が可能となると複合体を形成して核へと移行し,複相に特異的な遺伝子発現を制御する3).GSP1遺伝子の機能欠損株では接合子において複相の発生プログラムが機能せず4),GSP1遺伝子の過剰発現株では単相において複相の発生プログラムがはたらいてしまうため5),クラミドモナスの生活環においてBELL遺伝子とKNOX遺伝子は単相から複相への転換に必須であると考えられる.BELL遺伝子とKNOXは陸上植物でも報告されており,その相互作用も被子植物において保存されていることから6),これらの陸上植物の生活環への関与が推測されていた3).
クラミドモナスからは1個のKNOXが報告されているが,陸上植物は遺伝子重複により生じたKNOX1遺伝子とKNOX2遺伝子の遺伝子亜族を持ち,さらに,それぞれの遺伝子亜族のなかでも複数回の遺伝子重複が起こっている7).KNOX1遺伝子は複相に形成される分裂組織の形成および維持に機能しており,筆者らは,その発現制御がより複雑化することにより維管束植物における複相の巨大化および複雑化が起こったのではないかと推測している8,9).一方で,KNOX2遺伝子についてはその役割がよくわかっていなかった.
1.ヒメツリガネゴケのKNOX2遺伝子は複相の胚発生において発現する
遺伝子改変の容易なコケ植物であるヒメツリガネゴケ(Physcomitrella patens)を用いてKNOX2遺伝子の機能解析を行った.まず,ヒメツリガネゴケのゲノムに含まれる2つのKNOX2遺伝子,MKN1遺伝子とMKN6遺伝子をクローニングしその発現様式を調べたところ,いずれの遺伝子も単相の卵細胞と複相の胞子体の発生において発現していた.
2.KNOX2遺伝子破壊株では胞子体から異所的に配偶体様の組織が形成される
KNOX2遺伝子の機能を調べるため,MKN1遺伝子あるいはMKN6遺伝子の単独破壊株,および,MKN1遺伝子とMKN6遺伝子の二重破壊株を作出した.いずれの破壊株でも単相においては顕著な表現型はみられなかったが,MKN6遺伝子単独破壊株,およびMKN1遺伝子とMKN6遺伝子の二重破壊株では,複相において胞子体の発生が途中で停止し,胚の一部から配偶体様の組織が形成された(図2).これを培養してみたところ,単相としてどんどん成長し,生殖器を誘導すると,野生株と同様の頻度で生殖器である造卵器および造精器を形成した.さらに,受精に必要な水をあたえておくと自家受精により胚を形成したことから,MKN6遺伝子の単独破壊株,および,MKN1遺伝子とMKN6遺伝子の二重破壊株の複相の組織から形成された配偶体様の組織は,単相と同様にふるまうことがわかった.ただし,このようにして得られた胞子体は途中で発生が停止し,ふたたび配偶体様の組織を形成した.
3.KNOX2遺伝子破壊株の胞子体に由来する単相様の組織のDNA含有量は通常の単相の組織の2倍である
このような減数分裂を介さない胞子体から配偶体への異時的な移行はアポスポリー(apospory)とよばれ,自然界や実験環境下において起こる.アポスポリーでは染色体やDNAの量は複相を維持したまま,異時的に単相様の組織を形成する.そこで,MKN1遺伝子とMKN6遺伝子の二重破壊株の胚から異時的に形成された単相様の組織のDNA含有量を調べてみたところ,通常の単相の組織の2倍のDNAを含んでいた.すなわち,KNOX2遺伝子破壊株では,核相は複相であっても単相の表現型を示していることがわかった.KNOX2遺伝子は通常は胚において発現していることから,複相において単相の発生プログラムがはたらかないよう抑制していると考えられる.
4.ヒメツリガネゴケのBELL遺伝子はおもに複相において発現する
緑藻クラミドモナスでは転写因子であるKNOXとBELLが相互作用し,複相の発生プログラムを機能させることが知られている.ヒメツリガネゴケのKNOX2遺伝子の産物もBELLとの相互作用により機能している可能性を調べるため,ヒメツリガネゴケのゲノムからみつかっている4個のBELL遺伝子の発現様式を調べたところ,3個のBELL遺伝子はおもに複相において発現していることがわかった.これらのBELL遺伝子の産物はKNOX2遺伝子の産物と相互作用して機能している可能性があり,その詳細な解析は今後の課題である.
おわりに
ヒメツリガネゴケにおいて,KNOX2遺伝子の機能欠損株がアポスポリーをひき起こす一方,PRC2複合体をコードする遺伝子の機能欠損株は受精をへずに単相から胞子体を直接に誘導するアポガミー(apogamy)をひき起こす10,11).PRC2複合体はエピジェネティックな発現抑制に関与していることから,世代交代の制御がエピジェネティックかつゲノムワイドに制御されている可能性が示されていた.一方,KNOX2は世代移行の鍵となる転写因子なので,今後,KNOX2の標的遺伝子を調べていくことにより,世代交代の制御ネットワークの全貌が明らかにできるものと期待される.また,被子植物であるシロイヌナズナは4個のKNOX2遺伝子をもち,胞子体のさらに複雑化した被子植物における機能がわかれば,品種改良などにたいへん有用なツールとなる.
KNOX1遺伝子とKNOX2遺伝子は,緑藻と陸上植物との分岐ののち陸上植物の系統においてKNOXの重複により生じたと考えられる.そののちの機能分化により,KNOX1遺伝子は複相において分裂組織の維持に,KNOX2遺伝子は複相において単相の発生プログラムの抑制に機能するようになり,複相における多細胞体制が獲得されたのではないかと推測される(図3).その結果,現在のような陸上植物の世代交代が成立したのであろう.
世代交代は生物の進化の過程において複数回にわたり独立に生じたと考えられており,陸上植物だけでなく,褐藻,紅藻,ほかの緑藻からも報告されている12).褐藻シオミドロ(Ectocarpus siliculosus)からも世代交代にかかわる変異体が単離されている13).シオミドロは2010年にゲノム解読されており14),これらの新しい材料を使うことにより,生物進化における世代交代の成立のしくみの共通性が明らかにされていくものと期待される.
文 献
- Hofmeister, W. F. B.: On the Germination, Development, and Fructification of the Higher Cryptogamia, and on the Fructification of the Coniferae. Ray Society, London (1862)
- Bower, F. O.: Origin of a Land Flora: a Theory Based on the Facts of Alternation. MacMillan, London (1908)
- Lee, J. -H., Lin, H., Joo, S. et al.: Early sexual origins of homeoprotein heterodimerization and evolution of the plant KNOX/BELL family. Cell, 133, 829-840 (2008)[PubMed]
- Nishimura, Y., Shikanai, T., Nakamura, S. et al.: Gsp1 triggers the sexual developmental program including inheritance of chloroplast DNA and mitochondrial DNA in Chlamydomonas reinhardtii. Plant Cell, 24, 2401-2414 (2012)[PubMed]
- Zhao, H., Lu, M, Singh, R. et al.: Ectopic expression of a Chlamydomonas mt+-specific homeodomain protein in mt- gametes initiates zygote development without gamete fusion. Genes Dev., 15, 2767-2777 (2001)[PubMed]
- Bellaoui, M., Pidkowich, M. S., Samach, A. et al.: The Arabidopsis BELL1 and KNOX TALE homeodomain proteins interact through a domain conserved between plants and animals. Plant Cell, 13, 2455-2470 (2001)[PubMed]
- Mukherjee, K., Brocchieri, L. & Burglin, T. R.: A comprehensive classification and evolutionary analysis of plant homeobox genes. Mol. Biol. Evol., 26, 2775-2794 (2009)[PubMed]
- Sakakibara, K., Nishiyama, T., Deguchi, H. et al.: Class 1 KNOX genes are not involved in shoot development in the moss Physcomitrella patens but do function in sporophyte development. Evol. Dev., 10, 555-566 (2008)[PubMed]
- 榊原恵子: コケ植物のエボデボから見えてきた胞子体の複雑化. 遺伝, 67, 39-44 (2013)
- Mosquna, A., Katz, A., Decker, E. L. et al.: Regulation of stem cell maintenance by the Polycomb protein FIE has been conserved during land plant evolution. Development, 136, 2433-2444 (2009)[PubMed]
- Okano, Y., Aono, N., Hiwatashi, Y. et al.: A polycomb repressive complex 2 gene regulates apogamy and gives evolutionary insights into early land plant evolution. Proc. Natl. Acad. Sci. USA, 106, 16321-16326 (2009)[PubMed]
- Friedman, W. E.: One genome, two ontogenies. Science, 339, 1045-1046 (2013)[PubMed]
- Coelho, S. M., Godfroy, O., Arun, A. et al.: OUROBOROS is a master regulator of the gametophyte to sporophyte life cycle transition in the brown alga Ectocarpus. Proc. Natl. Acad. Sci. USA, 108, 11518-11523 (2011)[PubMed]
- Cock, J. M., Sterck, L., Rouze, P. et al.: The Ectocarpus genome and the independent evolution of multicellularity in brown algae. Nature, 465, 617-621 (2010)[PubMed]
著者プロフィール
略歴:2003年 総合研究大学院大学生命科学研究科博士課程 修了,2004年 広島大学大学院理学研究科 研究員,2007年 オーストラリアMonash大学 リサーチフェロー,2009年 ERATO長谷部分化全能性進化プロジェクト 技術参事を経て,2011年より広島大学大学院理学研究科 特任助教.
研究テーマ:陸上植物の発生進化.
関心事:同じような形態や現象が進化の過程で複数回にわたり生じるしくみ.つねに新しいこと,おもしろいこと,チャレンジンングなことをしていきたい.
John L. Bowman
オーストラリアMonash大学 教授.
© 2013 榊原恵子・John L. Bowman Licensed under CC 表示 2.1 日本