上皮細胞におけるSTAT3-IκB-ζシグナル伝達経路の破綻によるアポトーシスの亢進はSjögren症候群様の自己免疫疾患を誘導する
大熊敦史・牟田達史
(東北大学大学院生命科学研究科 生命機能科学専攻細胞認識応答分野)
email:牟田達史
DOI: 10.7875/first.author.2013.025
Enhanced apoptosis by disruption of the STAT3-IκB-ζ signaling pathway in epithelial cells induces Sjögren's syndrome-like autoimmune disease.
Atsushi Okuma, Katsuaki Hoshino, Tomoyuki Ohba, Sawako Fukushi, Setsuya Aiba, Shizuo Akira, Masao Ono, Tsuneyasu Kaisho, Tatsushi Muta
Immunity, 38, 450-460 (2013)
Sjögren症候群は涙腺炎および唾液腺炎によりドライアイおよびドライマウスをきたす自己免疫疾患である.その病態はリンパ球の浸潤をともなう外分泌腺炎と特異的な自己抗体の産生などにより特徴づけられるが,その発症機構はほとんど不明である.今回,筆者らは,転写制御因子IκB-ζを欠損するマウスがSjögren症候群様の自己免疫疾患を発症することを見い出した.さらに,その原因は上皮細胞においてIκB-ζの欠損によりひき起こされる,涙腺における過剰なアポトーシスであることを示した.また,涙腺におけるIκB-ζの発現の維持にはSTAT3が必須であることを示し,涙腺における恒常性維持の分子機構の一端を明らかにした.
Sjögren症候群はドライアイおよびドライマウスといった症状を主訴とする自己免疫疾患であり,その罹患率は0.5%にものぼる1).病理学的な特徴として,上皮組織,とくに涙腺や唾液腺といった外分泌腺へのリンパ球の浸潤があげられることから,自己免疫性上皮炎ともよばれ,炎症の標的となる組織が上皮組織に限定されることはSjögren症候群における主要な謎のひとつであった2).また,抗SSA抗体および抗SSB抗体はSjögren症候群に特徴的な自己抗体であり,その診断にも用いられる3).しかし,これらの自己抗原は上皮細胞だけでなく全身に発現しており,Sjögren症候群における標的組織の特異性の原因とは考えにくい.これまでに,Sjögren症候群様の症状を示す多数のモデルマウスが報告されているが,その多くはリンパ球を中心とした免疫細胞の異常が原因であり,これらの研究でも標的組織の特異性を十分には説明できていない4).そこで,標的組織である外分泌腺それ自体の異常についても研究が進められている.Sjögren症候群の患者の外分泌腺において,過剰なアポトーシス,および,抗原提示に必要なMHCクラスII分子や共刺激タンパク質の発現上昇などが報告されているが,それらがSjögren症候群の直接の原因であるかどうかについてはいまだ明らかではない2).
筆者らが独自に発見し解析を進めている核内IκBファミリータンパク質でIκB-ζは5),マクロファージ6,7) やナチュラルキラー細胞8),T細胞9) などにおいて,炎症刺激により発現が誘導され,転写制御因子として機能する.IκB-ζノックアウトマウスは眼裂の周囲に特徴的な炎症症状を自然発症することが知られていたが,その原因は不明であった6).この研究では,IκB-ζノックアウトマウスがSjögren症候群様の自己免疫疾患を発症すること,その原因はIκB-ζを欠損した上皮細胞においてアポトーシスが亢進するためであることを明らかにした.
IκB-ζノックアウトマウスはSPF(specific pathogen free,特定病原体不在)環境において眼裂の周囲に炎症症状を自然発症する.この炎症は性別に関係なく,生後8週までにはすべてのIκB-ζノックアウトマウスにおいて観察される.病理組織学的な解析により,このノックアウトマウスの眼裂の周囲の皮膚や結膜においてリンパ球の著しい浸潤が観察された.さらに,リンパ球を欠損したIκB-ζノックアウトマウスにおいてその炎症症状が劇的に改善したことから,リンパ球がこの症状に対し重要なはたらきをしていると考えられた.
そこで,自己免疫疾患の可能性を想定し自己抗体の有無について検討した.炎症の標的組織である眼裂の周囲の皮膚を,野生型マウスまたはIκB-ζノックアウトマウスに由来する血清により染色したところ,IκB-ζノックアウトマウスに由来する血清でのみ種々の細胞の核が染色された.さらに,ELISA法により抗核抗体の存在が確認された.さらに,抗核抗体の一種でありSjögren症候群の診断にも用いられる抗SSA抗体および抗SSB抗体について検討したところ,ともにIκB-ζノックアウトマウスの末梢血において検出された.そこで,外分泌腺について検討したところ,IκB-ζノックアウトマウスの涙腺の導管の周囲に,Sjögren症候群の患者において観察される外分泌腺炎の浸潤像と酷似したリンパ球の浸潤が観察された.さらに,涙の分泌量も低下していることが明らかになり,IκB-ζノックアウトマウスはSjögren症候群様の自己免疫疾患を発症していることが判明した.
炎症の誘導に直接に関与する異常な細胞の同定を行った.リンパ球を欠損したマウスまたはリンパ球を欠損したIκB-ζノックアウトマウスに,野生型マウスまたはIκB-ζノックアウトマウスに由来する脾臓細胞を移入したところ,リンパ球を欠損したマウスにIκB-ζノックアウトマウスに由来する脾臓細胞を移入しても炎症は発症しなかったが,リンパ球を欠損したIκB-ζノックアウトマウスに移入した場合には,IκB-ζノックアウトマウスに由来する脾臓細胞を用いた場合だけでなく,野生型マウスに由来する脾臓細胞を用いた場合においても,すみやかに炎症を発症した.この炎症の発症に必要な移入細胞について検討したところ,野生型マウスに由来するCD4陽性ヘルパーT細胞の移入だけで十分であることが示された.
さらに,造血細胞の全体でIκB-ζを欠損する骨髄キメラマウスや,T細胞に特異的なIκB-ζノックアウトマウス,B細胞に特異的なIκB-ζノックアウトマウス,ミエロイド系細胞に特異的なIκB-ζノックアウトマウスを作製したが,眼裂の周囲の炎症は観察されなかった.これらの結果を総合すると,この炎症の発症にはリンパ球の存在は必須であるが,リンパ球を含めた血球細胞におけるIκB-ζの欠損はその原因ではないことが明らかになった.
炎症を発症する標的となる細胞の異常について検討した.IκB-ζノックアウトマウスにおける炎症は涙腺,結膜,顔面の皮膚といった上皮組織に限局していたので,上皮細胞に特異的なIκB-ζコンディショナルノックアウトマウスを作製した.このノックアウトマウスの涙腺,結膜,皮膚においてIκB-ζの発現が低下していることを確認したうえで,その表現型を観察した.上皮細胞に特異的なIκB-ζノックアウトマウスは,全身性のIκB-ζノックアウトマウスに比べ発症時期の遅延,炎症の軽減はみられるものの,例外なく眼裂の周囲に炎症が観察され,眼裂の周囲の皮膚や結膜,涙腺へのリンパ球の浸潤が確認された.さらに,抗SSA抗体価および抗SSB抗体価の上昇も確認され,全身においてIκB-ζを欠損するマウスと同様に,Sjögren症候群様の自己免疫疾患を発症することが示された.つまり,今回,観察されたSjögren症候群様の炎症は上皮細胞におけるIκB-ζの欠損が原因であることが判明した.
これまで,Sjögren症候群に関連する上皮組織の異常として,外分泌腺における過剰なアポトーシスが報告されている10).そこで,涙腺におけるアポトーシスについて検討した.IκB-ζノックアウトマウスの涙腺では,TUNEL陽性細胞の増加と活性化型カスパーゼ3の存在が確認され,アポトーシスの顕著に亢進していることが示された.また,顕著な炎症を示さないリンパ球を欠損したIκB-ζノックアウトマウスにおいても同様にアポトーシスの亢進が認められたことから,IκB-ζの欠損による涙腺におけるアポトーシスの亢進は,リンパ球の浸潤など炎症には依存していないことが明らかになった.また,in vitroにおいて,IκB-ζを過剰発現したケラチノサイトではアポトーシスが抑制されることが判明し,IκB-ζのアポトーシス制御における機能が示された.
さらに,IκB-ζノックアウトマウスにおける過剰なアポトーシスがその炎症に直接に関与しているのかどうか検証するため,アポトーシスを抑制するカスパーゼ阻害剤をIκB-ζノックアウトマウスの眼底の静脈に投与し炎症症状の変化を観察した.カスパーゼ阻害剤を投与したマウスには涙腺におけるアポトーシス細胞の減少が認められ,それにともない,リンパ球の浸潤を含めた炎症症状や涙の分泌が大きく改善した.この結果から,過剰なアポトーシスがIκB-ζノックアウトマウスにおけるSjögren症候群様の自己免疫疾患の原因であることが明らかになった.
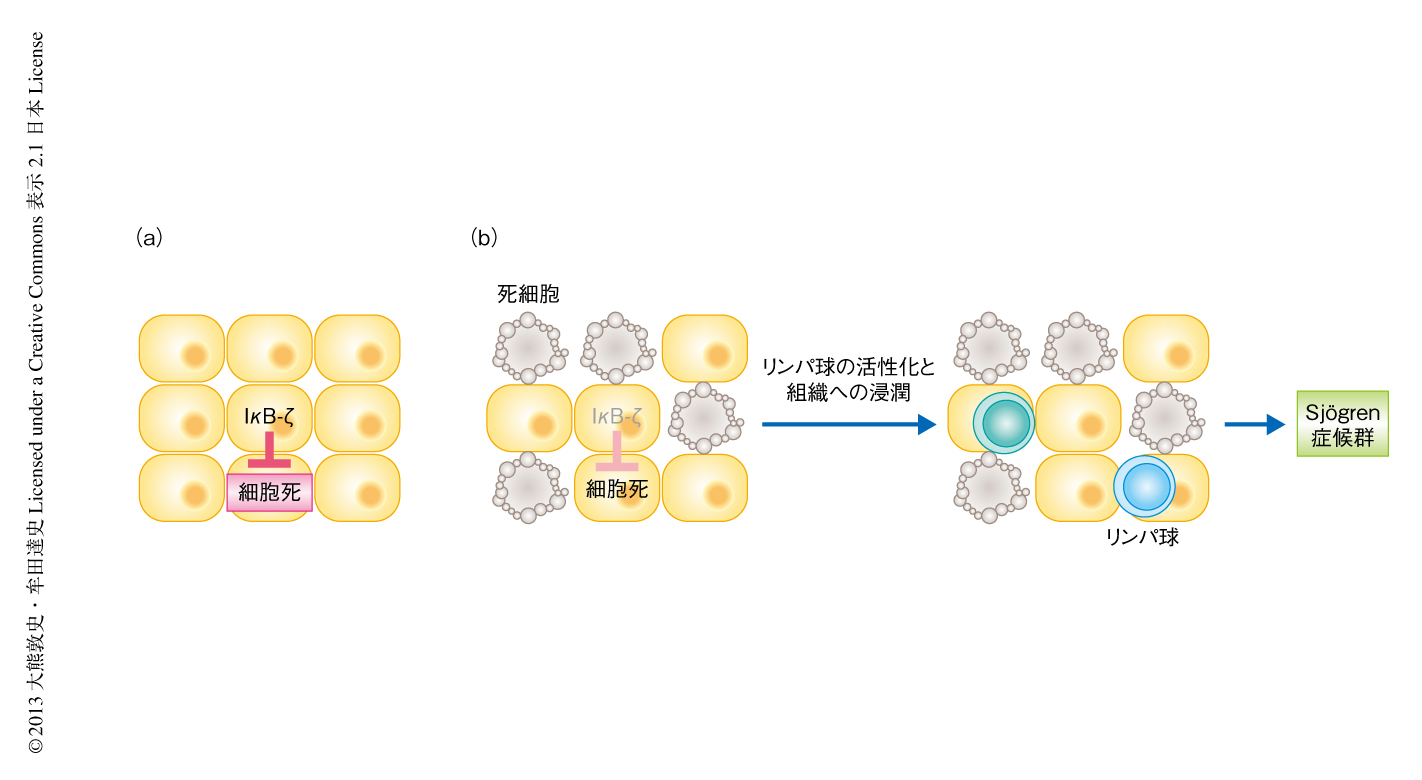
従来の研究により,IκB-ζの発現は病原体のセンサーであるToll様受容体の刺激に代表されるMyD88依存的なシグナル伝達経路,および,インターロイキン6の刺激に代表されるSTAT3依存的なシグナル伝達経路により誘導されることが知られていた5-7).そこで,上皮細胞,とくに涙腺におけるIκB-ζの発現機構について検討した.すると,上皮細胞に特異的なSTAT3ノックアウトマウスの涙腺ではIκB-ζの発現が消失していることが判明した.さらには,この上皮細胞に特異的なSTAT3欠損マウスもまたSjögren症候群様の症状を示すことが明らかになった.この結果から,STAT3に依存的なIκB-ζの発現が涙腺における恒常性維持に必須であり,その破綻によりSjögren症候群がひき起こされると考えられた(図1).
今回の筆者らの研究により,IκB-ζをコードする遺伝子がSjögren症候群の原因遺伝子となりうることが示された.IκB-ζノックアウトマウスでは免疫細胞の異常ではなく,標的組織である上皮組織における過剰なアポトーシスによりSjögren症候群様の炎症が誘導されていることが証明された.この発症機序は,Sjögren症候群など自己免疫疾患における組織に特異的な炎症を説明することができた.また,これまでに複数の研究者により提唱されてきた,上皮組織の異常に端を発してSjögren症候群がひき起こされるとする仮説を裏づけるはじめての実例となった.さらにこの研究は,アポトーシスの抑制がSjögren症候群の治療の有効なターゲットになりうることを示した.今後は,STAT3-IκB-ζシグナル伝達経路を含めた上皮組織における恒常性の維持機構と,過剰なアポトーシスによる自己応答性のリンパ球の活性化機序の解明が重要であり,こうした研究がSjögren症候群に代表される自己免疫疾患の治療や予防に貢献すると予想される.
略歴:2013年 東北大学大学院生命科学研究科博士課程 修了.
研究テーマ:自己免疫疾患における攻撃細胞と標的細胞との相互作用.
関心事:老化と自己免疫疾患との関係.
牟田 達史(Tatsushi Muta)
東北大学大学院生命科学研究科 教授.
研究室URL:http://www.biology.tohoku.ac.jp/lab-www/muta_lab/index.html
© 2013 大熊敦史・牟田達史 Licensed under CC 表示 2.1 日本
(東北大学大学院生命科学研究科 生命機能科学専攻細胞認識応答分野)
email:牟田達史
DOI: 10.7875/first.author.2013.025
Enhanced apoptosis by disruption of the STAT3-IκB-ζ signaling pathway in epithelial cells induces Sjögren's syndrome-like autoimmune disease.
Atsushi Okuma, Katsuaki Hoshino, Tomoyuki Ohba, Sawako Fukushi, Setsuya Aiba, Shizuo Akira, Masao Ono, Tsuneyasu Kaisho, Tatsushi Muta
Immunity, 38, 450-460 (2013)
要 約
Sjögren症候群は涙腺炎および唾液腺炎によりドライアイおよびドライマウスをきたす自己免疫疾患である.その病態はリンパ球の浸潤をともなう外分泌腺炎と特異的な自己抗体の産生などにより特徴づけられるが,その発症機構はほとんど不明である.今回,筆者らは,転写制御因子IκB-ζを欠損するマウスがSjögren症候群様の自己免疫疾患を発症することを見い出した.さらに,その原因は上皮細胞においてIκB-ζの欠損によりひき起こされる,涙腺における過剰なアポトーシスであることを示した.また,涙腺におけるIκB-ζの発現の維持にはSTAT3が必須であることを示し,涙腺における恒常性維持の分子機構の一端を明らかにした.
はじめに
Sjögren症候群はドライアイおよびドライマウスといった症状を主訴とする自己免疫疾患であり,その罹患率は0.5%にものぼる1).病理学的な特徴として,上皮組織,とくに涙腺や唾液腺といった外分泌腺へのリンパ球の浸潤があげられることから,自己免疫性上皮炎ともよばれ,炎症の標的となる組織が上皮組織に限定されることはSjögren症候群における主要な謎のひとつであった2).また,抗SSA抗体および抗SSB抗体はSjögren症候群に特徴的な自己抗体であり,その診断にも用いられる3).しかし,これらの自己抗原は上皮細胞だけでなく全身に発現しており,Sjögren症候群における標的組織の特異性の原因とは考えにくい.これまでに,Sjögren症候群様の症状を示す多数のモデルマウスが報告されているが,その多くはリンパ球を中心とした免疫細胞の異常が原因であり,これらの研究でも標的組織の特異性を十分には説明できていない4).そこで,標的組織である外分泌腺それ自体の異常についても研究が進められている.Sjögren症候群の患者の外分泌腺において,過剰なアポトーシス,および,抗原提示に必要なMHCクラスII分子や共刺激タンパク質の発現上昇などが報告されているが,それらがSjögren症候群の直接の原因であるかどうかについてはいまだ明らかではない2).
筆者らが独自に発見し解析を進めている核内IκBファミリータンパク質でIκB-ζは5),マクロファージ6,7) やナチュラルキラー細胞8),T細胞9) などにおいて,炎症刺激により発現が誘導され,転写制御因子として機能する.IκB-ζノックアウトマウスは眼裂の周囲に特徴的な炎症症状を自然発症することが知られていたが,その原因は不明であった6).この研究では,IκB-ζノックアウトマウスがSjögren症候群様の自己免疫疾患を発症すること,その原因はIκB-ζを欠損した上皮細胞においてアポトーシスが亢進するためであることを明らかにした.
1.IκB-ζノックアウトマウスはSjögren症候群様の自己免疫疾患を発症する
IκB-ζノックアウトマウスはSPF(specific pathogen free,特定病原体不在)環境において眼裂の周囲に炎症症状を自然発症する.この炎症は性別に関係なく,生後8週までにはすべてのIκB-ζノックアウトマウスにおいて観察される.病理組織学的な解析により,このノックアウトマウスの眼裂の周囲の皮膚や結膜においてリンパ球の著しい浸潤が観察された.さらに,リンパ球を欠損したIκB-ζノックアウトマウスにおいてその炎症症状が劇的に改善したことから,リンパ球がこの症状に対し重要なはたらきをしていると考えられた.
そこで,自己免疫疾患の可能性を想定し自己抗体の有無について検討した.炎症の標的組織である眼裂の周囲の皮膚を,野生型マウスまたはIκB-ζノックアウトマウスに由来する血清により染色したところ,IκB-ζノックアウトマウスに由来する血清でのみ種々の細胞の核が染色された.さらに,ELISA法により抗核抗体の存在が確認された.さらに,抗核抗体の一種でありSjögren症候群の診断にも用いられる抗SSA抗体および抗SSB抗体について検討したところ,ともにIκB-ζノックアウトマウスの末梢血において検出された.そこで,外分泌腺について検討したところ,IκB-ζノックアウトマウスの涙腺の導管の周囲に,Sjögren症候群の患者において観察される外分泌腺炎の浸潤像と酷似したリンパ球の浸潤が観察された.さらに,涙の分泌量も低下していることが明らかになり,IκB-ζノックアウトマウスはSjögren症候群様の自己免疫疾患を発症していることが判明した.
2.血球細胞におけるIκB-ζの欠損は炎症の原因ではない
炎症の誘導に直接に関与する異常な細胞の同定を行った.リンパ球を欠損したマウスまたはリンパ球を欠損したIκB-ζノックアウトマウスに,野生型マウスまたはIκB-ζノックアウトマウスに由来する脾臓細胞を移入したところ,リンパ球を欠損したマウスにIκB-ζノックアウトマウスに由来する脾臓細胞を移入しても炎症は発症しなかったが,リンパ球を欠損したIκB-ζノックアウトマウスに移入した場合には,IκB-ζノックアウトマウスに由来する脾臓細胞を用いた場合だけでなく,野生型マウスに由来する脾臓細胞を用いた場合においても,すみやかに炎症を発症した.この炎症の発症に必要な移入細胞について検討したところ,野生型マウスに由来するCD4陽性ヘルパーT細胞の移入だけで十分であることが示された.
さらに,造血細胞の全体でIκB-ζを欠損する骨髄キメラマウスや,T細胞に特異的なIκB-ζノックアウトマウス,B細胞に特異的なIκB-ζノックアウトマウス,ミエロイド系細胞に特異的なIκB-ζノックアウトマウスを作製したが,眼裂の周囲の炎症は観察されなかった.これらの結果を総合すると,この炎症の発症にはリンパ球の存在は必須であるが,リンパ球を含めた血球細胞におけるIκB-ζの欠損はその原因ではないことが明らかになった.
3.上皮細胞におけるIκB-ζの欠損がSjögren症候群様の炎症の原因である
炎症を発症する標的となる細胞の異常について検討した.IκB-ζノックアウトマウスにおける炎症は涙腺,結膜,顔面の皮膚といった上皮組織に限局していたので,上皮細胞に特異的なIκB-ζコンディショナルノックアウトマウスを作製した.このノックアウトマウスの涙腺,結膜,皮膚においてIκB-ζの発現が低下していることを確認したうえで,その表現型を観察した.上皮細胞に特異的なIκB-ζノックアウトマウスは,全身性のIκB-ζノックアウトマウスに比べ発症時期の遅延,炎症の軽減はみられるものの,例外なく眼裂の周囲に炎症が観察され,眼裂の周囲の皮膚や結膜,涙腺へのリンパ球の浸潤が確認された.さらに,抗SSA抗体価および抗SSB抗体価の上昇も確認され,全身においてIκB-ζを欠損するマウスと同様に,Sjögren症候群様の自己免疫疾患を発症することが示された.つまり,今回,観察されたSjögren症候群様の炎症は上皮細胞におけるIκB-ζの欠損が原因であることが判明した.
4.涙腺における過剰なアポトーシスが炎症に関係する
これまで,Sjögren症候群に関連する上皮組織の異常として,外分泌腺における過剰なアポトーシスが報告されている10).そこで,涙腺におけるアポトーシスについて検討した.IκB-ζノックアウトマウスの涙腺では,TUNEL陽性細胞の増加と活性化型カスパーゼ3の存在が確認され,アポトーシスの顕著に亢進していることが示された.また,顕著な炎症を示さないリンパ球を欠損したIκB-ζノックアウトマウスにおいても同様にアポトーシスの亢進が認められたことから,IκB-ζの欠損による涙腺におけるアポトーシスの亢進は,リンパ球の浸潤など炎症には依存していないことが明らかになった.また,in vitroにおいて,IκB-ζを過剰発現したケラチノサイトではアポトーシスが抑制されることが判明し,IκB-ζのアポトーシス制御における機能が示された.
さらに,IκB-ζノックアウトマウスにおける過剰なアポトーシスがその炎症に直接に関与しているのかどうか検証するため,アポトーシスを抑制するカスパーゼ阻害剤をIκB-ζノックアウトマウスの眼底の静脈に投与し炎症症状の変化を観察した.カスパーゼ阻害剤を投与したマウスには涙腺におけるアポトーシス細胞の減少が認められ,それにともない,リンパ球の浸潤を含めた炎症症状や涙の分泌が大きく改善した.この結果から,過剰なアポトーシスがIκB-ζノックアウトマウスにおけるSjögren症候群様の自己免疫疾患の原因であることが明らかになった.
5.涙腺におけるIκB-ζの発現はSTAT3に依存する
従来の研究により,IκB-ζの発現は病原体のセンサーであるToll様受容体の刺激に代表されるMyD88依存的なシグナル伝達経路,および,インターロイキン6の刺激に代表されるSTAT3依存的なシグナル伝達経路により誘導されることが知られていた5-7).そこで,上皮細胞,とくに涙腺におけるIκB-ζの発現機構について検討した.すると,上皮細胞に特異的なSTAT3ノックアウトマウスの涙腺ではIκB-ζの発現が消失していることが判明した.さらには,この上皮細胞に特異的なSTAT3欠損マウスもまたSjögren症候群様の症状を示すことが明らかになった.この結果から,STAT3に依存的なIκB-ζの発現が涙腺における恒常性維持に必須であり,その破綻によりSjögren症候群がひき起こされると考えられた(図1).
おわりに
今回の筆者らの研究により,IκB-ζをコードする遺伝子がSjögren症候群の原因遺伝子となりうることが示された.IκB-ζノックアウトマウスでは免疫細胞の異常ではなく,標的組織である上皮組織における過剰なアポトーシスによりSjögren症候群様の炎症が誘導されていることが証明された.この発症機序は,Sjögren症候群など自己免疫疾患における組織に特異的な炎症を説明することができた.また,これまでに複数の研究者により提唱されてきた,上皮組織の異常に端を発してSjögren症候群がひき起こされるとする仮説を裏づけるはじめての実例となった.さらにこの研究は,アポトーシスの抑制がSjögren症候群の治療の有効なターゲットになりうることを示した.今後は,STAT3-IκB-ζシグナル伝達経路を含めた上皮組織における恒常性の維持機構と,過剰なアポトーシスによる自己応答性のリンパ球の活性化機序の解明が重要であり,こうした研究がSjögren症候群に代表される自己免疫疾患の治療や予防に貢献すると予想される.
文 献
- Fox, R. I.: Sjögren's syndrome. Lancet, 366, 321-331 (2005)[PubMed]
- Mitsias, D. I., Kapsogeorgou, E. K. & Moutsopoulos, H. M.: Sjögren's syndrome: why autoimmune epithelitis? Oral Dis., 12, 523-532 (2006)[PubMed]
- Chiorini, J. A., Cihakova D., Ouellette C. E. et al.: Sjögren syndrome: advances in the pathogenesis from animal models. J. Autoimmun., 33, 190-196 (2009)[PubMed]
- Shiboski, S. C., Shiboski, C. H., Criswell, L. et al.: American College of Rheumatology classification criteria for Sjögren's syndrome: a data-driven, expert consensus approach in the Sjögren's International Collaborative Clinical Alliance cohort. Arthritis Care Res., 64, 475-87 (2012)[PubMed]
- Yamazaki, S., Muta, T. & Takeshige, K.: A novel IκB protein, IκB-ζ, induced by proinflammatory stimuli negatively regulates nuclear factor-κB in the nuclei. J. Biol. Chem., 276, 27657-27662 (2001)[PubMed]
- Yamamoto, M., Yamazaki, S., Uematsu, S. et al.: Regulation of Toll/IL-1-receptor-mediated gene expression by the inducible nuclear protein IκB-ζ. Nature, 430, 218-222 (2004)[PubMed]
- Motoyama, M., Yamazaki, S., Eto-Kimura, A. et al.: Positive and negative regulation of nuclear factor-κB-mediated transcription by IκB-ζ, an inducible nuclear protein. J. Biol. Chem., 280, 7444-7451 (2005)[PubMed]
- Miyake, T., Satoh, T., Kato, K. et al.: IκB-ζ is essential for natural killer cell activation in response to IL-12 and IL-18. Proc. Natl. Acad. Sci. USA, 107, 17680-17685 (2010)[PubMed]
- Okamoto, K., Iwai, Y., Oh-Hora, M. et al.: IκB-ζ regulates T H17 development by cooperating with ROR nuclear receptors. Nature, 464, 1381-1385 (2010)[PubMed]
- Manganelli, P. & Fietta, P.: Apoptosis and Sjögren syndrome. Semin. Arthritis Rheum., 33, 49-65 (2003)[PubMed]
著者プロフィール
略歴:2013年 東北大学大学院生命科学研究科博士課程 修了.
研究テーマ:自己免疫疾患における攻撃細胞と標的細胞との相互作用.
関心事:老化と自己免疫疾患との関係.
牟田 達史(Tatsushi Muta)
東北大学大学院生命科学研究科 教授.
研究室URL:http://www.biology.tohoku.ac.jp/lab-www/muta_lab/index.html
© 2013 大熊敦史・牟田達史 Licensed under CC 表示 2.1 日本