内在性siRNA経路における新規の細胞質顆粒体D2ボディの構成タンパク質R2D2の機能
西田知訓・塩見美喜子
(慶應義塾大学医学部 分子生物学教室)
email:西田知訓,塩見美喜子
DOI: 10.7875/first.author.2013.016
Roles of R2D2, a cytoplasmic D2 body component, in the endogenous siRNA pathway in Drosophila.
Kazumichi M. Nishida, Keita Miyoshi, Akiyo Ogino, Tomohiro Miyoshi, Haruhiko Siomi, Mikiko C. Siomi
Molecular Cell, 49, 680-691 (2013)
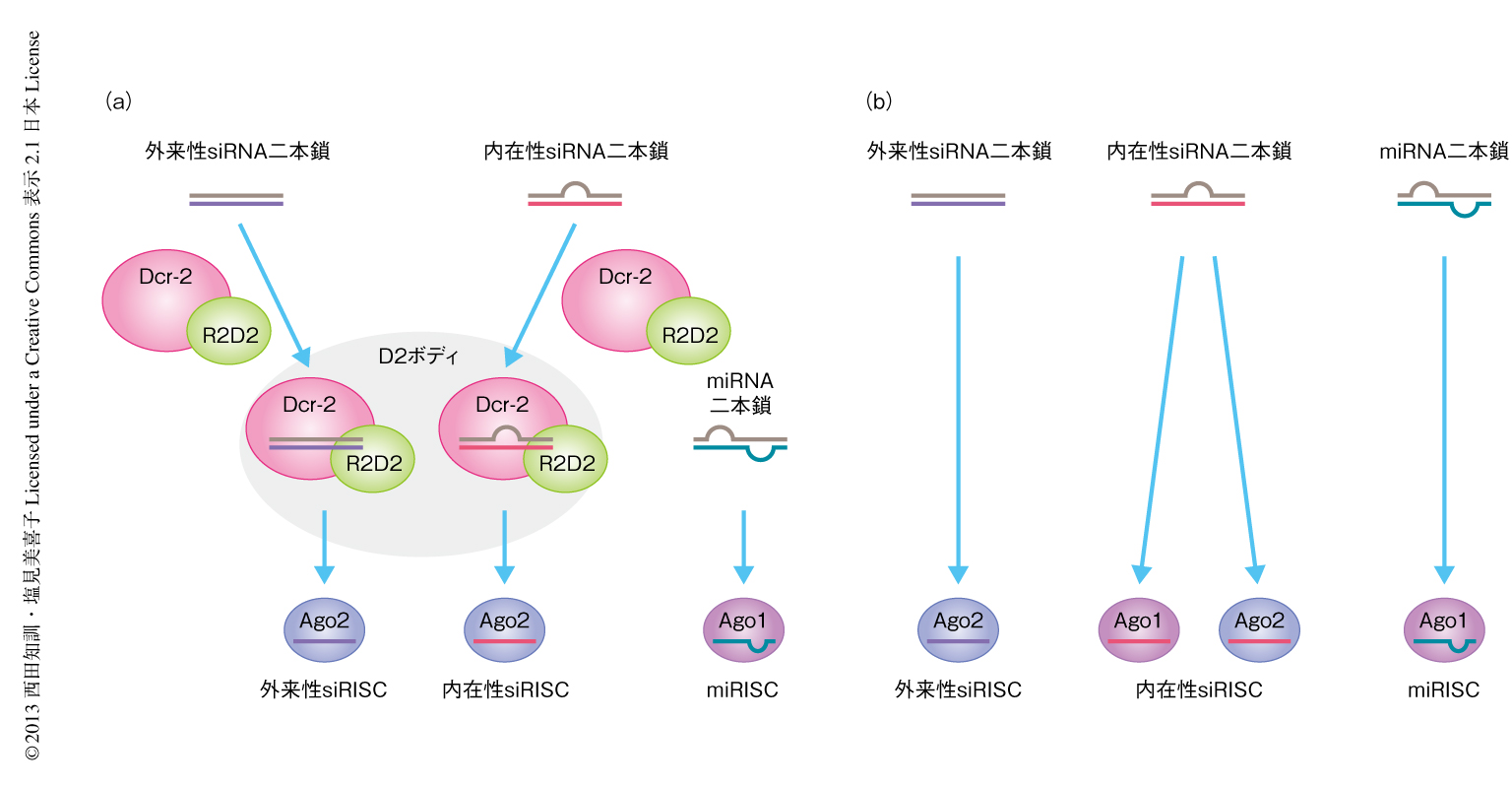
内在性siRNAはDcr-2により前駆体から切り出されたのち,Dcr-2-R2D2複合体によりAgo2に特異的に受け渡される.r2d2欠失変異体では内在性siRNAはAgo2ではなくAgo1へとあやまって受け渡されてしまうことが示された.つまり,内在性siRNAのAgo2への特異的な受け渡しにはR2D2が必須である.しかし,その制御機構は明らかになっていない.筆者らは,ショウジョウバエS2細胞においてDcr-2とR2D2が新規の細胞質顆粒体であるD2ボディに局在することを見い出した.D2ボディの形成にはDcr-2とともに,R2D2の二本鎖RNAとの結合能とC末端側にあるAuxiliary領域とが必要であることが判明した.Dcr-2あるいはR2D2をノックダウンしたS2細胞ではD2ボディは消失し,内在性siRNAはAgo2のみならずAgo1とも結合した.一方,miRNAのAgo1への受け渡し,外来性siRNAのAgo2への受け渡し,内在性および外来性siRNAにおけるガイド鎖の選択は,R2D2の欠損により影響をうけなかった.R2D2はDcr-2とともに内在性siRNAをD2ボディへと局在化することにより,内在性siRNAがAgo1へとあやまって受け渡されるのを防いでいると考えられた.また,外来性siRNAのガイド鎖のAgo2への特異的な受け渡しは,S2細胞においてはDcr-2およびR2D2に非依存的に起こりうることも判明した.
小分子RNAはArgonaute(Ago)いうタンパク質と結合してRISC(RNA-induced silencing complex)とよばれる複合体を形成することにより標的遺伝子の発現を抑制する1).動物は,miRNA(microRNA),内在性のsiRNA(small interfering RNA),piRNA(PIWI-interacting RNA)という3種類の小分子RNAを発現する.ショウジョウバエにおいて,miRNAは一次前駆体であるpri-miRNA(primary miRNA)からRNaseIIIであるDroshaにより二次前駆体であるmiRNA前駆体へと変換されたのち,Dicer-1(Dcr-1)によりさらに切断され成熟型のmiRNAとなる2)(図1a).成熟型miRNAはAgo1と結合することによりmiRISCを形成し標的遺伝子の翻訳を抑制する.一方,内在性のsiRNAはDicer-2(Dcr-2)に依存して前駆体から切り出され3),Ago2と結合することによりRISCを形成し,標的遺伝子の転写産物を切断する(図1b).内在性siRNAの多くはトランスポゾンと相補的な配列をもつ.つまり,転移因子を標的としてその発現を抑制する.この内在性siRNAのはたらきにより,ゲノムはトランスポゾンによる損傷から守られている.
DicerなどRNaseIIIは小分子RNAの生合成の過程において二本鎖RNA結合ドメイン(dsRNA-binding domain:dsRBD)をもつタンパク質と複合体を形成する.miRNAの生合成に必須であるdsRBDタンパク質Loquacious(Loqs)は,Dcr-1と特異的に相互作用することによりmiRNAの成熟にかかわる.Loqsには4種類のアイソフォーム,Loqs-PA,Loqs-PB,Loqs-PC,Loqs-PDが存在する.Loqs-PBはDcr-1と特異的に結合してmiRNAの生合成にかかわる一方,Loqs-PDはDcr-2との特異的な結合を介してsiRNAの前駆体からの切り出しを促進する4).Dcr-2は別のdsRBDタンパク質であるR2D2とも結合する5).Dcr-2-R2D2複合体はRLC(RISC-loading complex)を形成しsiRNAのAgo2への受け渡しを促進する5,6).RLCはsiRNAのガイド鎖とパッセンジャー鎖とを選択するセンサーとして機能すると報告されている7).最近,r2d2欠失変異体では内在性siRNAがAgo1へとあやまって取り込まれてしまうと報告された8).つまり,R2D2は内在性siRNAのAgo2への特異的な受け渡しに必須であると考えられるが,その分子機構は明らかになっていない.
抗Dcr-2抗体を用いてショウジョウバエS2細胞を染色したところ,細胞質に顆粒体が観察された.この顆粒体はDcr-2のノックダウンにより消失した.Dcr-2陽性の顆粒体は大きさや数がPボディと類似していたため,Pボディの形成に影響をあたえるシクロヘキシミドとピューロマイシンにより処理したS2細胞を抗Dcr-2抗体およびPボディのマーカーである抗Dcp1抗体を用いて共染色した.Pボディはシクロヘキシミドにより処理したS2細胞において細胞質の全体に分散するが,ピューロマイシンにより処理したS2細胞において巨大化する.しかしながら,シクロヘキシミドとピューロマイシンによりDcr-2陽性の顆粒体に変化はみられなかった.そこで,この顆粒体はPボディとは異なる顆粒体であると判断した.さらなる解析により,Dcr-2陽性の顆粒体は細胞ストレスにより肥大する細胞質顆粒体であるストレスボディとも異なることが判明した.このDcr-2陽性の顆粒体を新規の細胞質顆粒体とみなし“D2ボディ”(D2 body)と名づけた.
R2D2はDcr-2と強く相互作用するため,R2D2もD2ボディに局在すると予想された.S2細胞を抗R2D2抗体および抗Dcr-2抗体で共染色したところ,2つのシグナルは一致したことから,R2D2はD2ボディの構成タンパク質であると判断した.RNAi法によりDcr-2あるいはR2D2をノックダウンするとD2ボディは消失した.R2D2のノックダウンによりDcr-2のシグナルは細胞質の全体にひろがった.dcr-2欠失変異体ではR2D2の発現量は著しく減少することから,Dcr-2はR2D2の安定化に寄与することが知られている6).Dcr-2をノックダウンしたS2細胞においてDcr-2とR2D2のタンパク質量を調べたところ,ともに劇減していた.以上の結果から,D2ボディの形成にはDcr-2とR2D2の両者が必要であるが,その要求性は異なること,つまり,Dcr-2はR2D2の安定化に,R2D2はDcr-2をD2ボディへ局在化させるために,必要であることが判明した.Dcr-2を欠損した条件においてFlag標識したR2D2を強制発現させたところ,D2ボディ様の顆粒体が観察されたことから,R2D2はD2ボディの形成における中核タンパク質であると考えられた.Loqs-PDはDcr-2と結合するが,D2ボディには局在しない4).また,Loqs-PDのノックダウンによりD2ボディは消失しなかった.内在性siRNAの前駆体からの切り出し反応は,D2ボディの外で,D2ボディに非依存的に起こると考えられた.
R2D2がD2ボディに局在するために必要な領域をR2D2の変異体を作製することで調べたところ,2つ目のdsRNA結合ドメイン(dsRBD2)と,C末端側に存在するAuxiliary(Aux)領域とが必要であることがわかった.dsRBD2のもつ二本鎖RNA結合能を欠失したR2D2変異体はD2ボディへと局在しなかったことから,R2D2のもつ二本鎖RNA結合能がR2D2のD2ボディへの局在に必要であると考えられた.
二本鎖RNA結合能を欠損したR2D2変異体は,野生型と比べ比較的弱いもののDcr-2と結合することがわかった.つまり,R2D2のもつ二本鎖RNA結合能は,Dcr-2との相互作用には不要であるが,D2ボディへの局在には必要であった.R2D2のもつ二本鎖RNA結合能はDcr-2とsiRNA二本鎖との結合に重要であることが示されている6).この研究において,Ago2はD2ボディに局在することも判明した.以上の結果から,1)Dcr-2-R2D2複合体はDcr-2-Loqs-PD複合体により切り出されたsiRNA二本鎖と細胞質において結合しD2ボディへと局在化する,2)Dcr-2-R2D2複合体はD2ボディにおいてAgo2へとsiRNAを受け渡す,3)siRNA二本鎖から遊離したDcr-2-R2D2複合体は新しいsiRNA二本鎖をもとめてD2ボディから離れる,というモデルを提唱した.
r2d2欠失変異体において内在性siRNAはAgo1へと受け渡される8).R2D2をノックダウンしたS2細胞においてFlag標識したAgo1またはAgo2を発現させ内在性siRNAとの結合を検討したところ,内在性siRNAのガイド鎖はAgo1とAgo2の両方に結合していたが,パッセンジャー鎖はどちらとも結合していなかった.これは,内在性siRNAにおけるガイド鎖とパッセンジャー鎖との選択にR2D2は必須でないことを示した.
外来性siRNAのR2D2への依存性について検討した.R2D2をノックダウンしたS2細胞においてFlag標識したAgo1またはAgo2を発現させ,同時に外来性siRNAを導入したのち,Ago1複合体またはAgo2複合体に含まれるRNAをノーザンブロット法により解析した.R2D2の非存在下においても外来性siRNAはAgo2と特異的に結合していた.さらに,Dcr-2とR2D2を同時に欠損させても,外来性siRNAのAgo2への特異的な受け渡しに影響はみられなかった.つまり,外来性siRNAのAgo2への特異的な受け渡しは,RLCに非依存的にD2ボディの外で起こっていた.R2D2を欠損したときも外来性siRNAのガイド鎖のみがAgo2へと受け渡されるため,R2D2は内在性あるいは外来性にかぎらず,siRNAにおけるガイド鎖とパッセンジャー鎖との選択に必要ではないことが判明した.外来性siRNA二本鎖は完全に相補的なRNA二本鎖であるのに対し,内在性siRNA二本鎖は完全に相補的ではない.つまり,内在性siRNA二本鎖は形態においてmiRNA二本鎖とより類似しており,このことが原因でmiRNAの機能性パートナーであるAgo1へとあやまって結合してしまう.これを回避するため,Dcr-2-R2D2複合体はD2ボディを形成し,内在性siRNAとAgo2をD2ボディへと局在化させることにより,内在性siRNAはAgo2へと特異的に受け渡されるのだと考えられた.
R2D2の欠損によりD2ボディは消失し,内在性siRNAはAgo1とあやまって結合してしまった.この表現型は野生型R2D2の強制発現により回復したが,二本鎖RNAに結合できないR2D2変異体を強制発現させても回復しなかった.この結果は,Dcr-2-R2D2複合体がD2ボディを形成するにはR2D2のsiRNA二本鎖への結合を必要とすること,また,内在性siRNA二本鎖をD2ボディへと局在化させることにより内在性siRNAのAgo1へのあやまった結合を回避していることを裏づけた.
この研究をとおして筆者らは,R2D2は内在性siRNA二本鎖とAgo2をD2ボディに局在化させることにより,内在性siRNAのAgo1へのあやまった取り込みを防ぐ,つまり,内在性siRNAを本来の機能性パートナーであるAgo2のみに“振り分ける”タンパク質であることを示した(図2).内在性siRNAのAgo1とのあやまった結合は,miRNAのAgo1への結合,つまり,miRISCの形成ひいては細胞の機能を阻害する.これを回避するため,R2D2は内在性siRNAをAgo2へと振り分ける役割を担い,その役割を的確に遂行するためDcr-2とともにD2ボディを形成し,内在性siRNAとAgo2をD2ボディへと集約させるしくみを獲得したと考えられる.今後は,D2ボディの新規の構成因子を同定することにより,このしくみをより深く理解していきたい.
略歴:2010年 徳島大学大学院医学教育部博士課程 修了,同年より慶應義塾大学医学部 特任助教.
研究テーマ:RNAサイレンシングをひき起こす小分子RNAの生合成機構.
塩見 美喜子(Mikiko C. Siomi)
東京大学大学院理学系研究科 教授.
© 2013 西田知訓・塩見美喜子 Licensed under CC 表示 2.1 日本
(慶應義塾大学医学部 分子生物学教室)
email:西田知訓,塩見美喜子
DOI: 10.7875/first.author.2013.016
Roles of R2D2, a cytoplasmic D2 body component, in the endogenous siRNA pathway in Drosophila.
Kazumichi M. Nishida, Keita Miyoshi, Akiyo Ogino, Tomohiro Miyoshi, Haruhiko Siomi, Mikiko C. Siomi
Molecular Cell, 49, 680-691 (2013)
要 約
内在性siRNAはDcr-2により前駆体から切り出されたのち,Dcr-2-R2D2複合体によりAgo2に特異的に受け渡される.r2d2欠失変異体では内在性siRNAはAgo2ではなくAgo1へとあやまって受け渡されてしまうことが示された.つまり,内在性siRNAのAgo2への特異的な受け渡しにはR2D2が必須である.しかし,その制御機構は明らかになっていない.筆者らは,ショウジョウバエS2細胞においてDcr-2とR2D2が新規の細胞質顆粒体であるD2ボディに局在することを見い出した.D2ボディの形成にはDcr-2とともに,R2D2の二本鎖RNAとの結合能とC末端側にあるAuxiliary領域とが必要であることが判明した.Dcr-2あるいはR2D2をノックダウンしたS2細胞ではD2ボディは消失し,内在性siRNAはAgo2のみならずAgo1とも結合した.一方,miRNAのAgo1への受け渡し,外来性siRNAのAgo2への受け渡し,内在性および外来性siRNAにおけるガイド鎖の選択は,R2D2の欠損により影響をうけなかった.R2D2はDcr-2とともに内在性siRNAをD2ボディへと局在化することにより,内在性siRNAがAgo1へとあやまって受け渡されるのを防いでいると考えられた.また,外来性siRNAのガイド鎖のAgo2への特異的な受け渡しは,S2細胞においてはDcr-2およびR2D2に非依存的に起こりうることも判明した.
はじめに
小分子RNAはArgonaute(Ago)いうタンパク質と結合してRISC(RNA-induced silencing complex)とよばれる複合体を形成することにより標的遺伝子の発現を抑制する1).動物は,miRNA(microRNA),内在性のsiRNA(small interfering RNA),piRNA(PIWI-interacting RNA)という3種類の小分子RNAを発現する.ショウジョウバエにおいて,miRNAは一次前駆体であるpri-miRNA(primary miRNA)からRNaseIIIであるDroshaにより二次前駆体であるmiRNA前駆体へと変換されたのち,Dicer-1(Dcr-1)によりさらに切断され成熟型のmiRNAとなる2)(図1a).成熟型miRNAはAgo1と結合することによりmiRISCを形成し標的遺伝子の翻訳を抑制する.一方,内在性のsiRNAはDicer-2(Dcr-2)に依存して前駆体から切り出され3),Ago2と結合することによりRISCを形成し,標的遺伝子の転写産物を切断する(図1b).内在性siRNAの多くはトランスポゾンと相補的な配列をもつ.つまり,転移因子を標的としてその発現を抑制する.この内在性siRNAのはたらきにより,ゲノムはトランスポゾンによる損傷から守られている.
DicerなどRNaseIIIは小分子RNAの生合成の過程において二本鎖RNA結合ドメイン(dsRNA-binding domain:dsRBD)をもつタンパク質と複合体を形成する.miRNAの生合成に必須であるdsRBDタンパク質Loquacious(Loqs)は,Dcr-1と特異的に相互作用することによりmiRNAの成熟にかかわる.Loqsには4種類のアイソフォーム,Loqs-PA,Loqs-PB,Loqs-PC,Loqs-PDが存在する.Loqs-PBはDcr-1と特異的に結合してmiRNAの生合成にかかわる一方,Loqs-PDはDcr-2との特異的な結合を介してsiRNAの前駆体からの切り出しを促進する4).Dcr-2は別のdsRBDタンパク質であるR2D2とも結合する5).Dcr-2-R2D2複合体はRLC(RISC-loading complex)を形成しsiRNAのAgo2への受け渡しを促進する5,6).RLCはsiRNAのガイド鎖とパッセンジャー鎖とを選択するセンサーとして機能すると報告されている7).最近,r2d2欠失変異体では内在性siRNAがAgo1へとあやまって取り込まれてしまうと報告された8).つまり,R2D2は内在性siRNAのAgo2への特異的な受け渡しに必須であると考えられるが,その分子機構は明らかになっていない.
1.Dcr-2は新規の細胞質顆粒体であるD2ボディに局在する
抗Dcr-2抗体を用いてショウジョウバエS2細胞を染色したところ,細胞質に顆粒体が観察された.この顆粒体はDcr-2のノックダウンにより消失した.Dcr-2陽性の顆粒体は大きさや数がPボディと類似していたため,Pボディの形成に影響をあたえるシクロヘキシミドとピューロマイシンにより処理したS2細胞を抗Dcr-2抗体およびPボディのマーカーである抗Dcp1抗体を用いて共染色した.Pボディはシクロヘキシミドにより処理したS2細胞において細胞質の全体に分散するが,ピューロマイシンにより処理したS2細胞において巨大化する.しかしながら,シクロヘキシミドとピューロマイシンによりDcr-2陽性の顆粒体に変化はみられなかった.そこで,この顆粒体はPボディとは異なる顆粒体であると判断した.さらなる解析により,Dcr-2陽性の顆粒体は細胞ストレスにより肥大する細胞質顆粒体であるストレスボディとも異なることが判明した.このDcr-2陽性の顆粒体を新規の細胞質顆粒体とみなし“D2ボディ”(D2 body)と名づけた.
2.R2D2はD2ボディの形成における中核タンパク質である
R2D2はDcr-2と強く相互作用するため,R2D2もD2ボディに局在すると予想された.S2細胞を抗R2D2抗体および抗Dcr-2抗体で共染色したところ,2つのシグナルは一致したことから,R2D2はD2ボディの構成タンパク質であると判断した.RNAi法によりDcr-2あるいはR2D2をノックダウンするとD2ボディは消失した.R2D2のノックダウンによりDcr-2のシグナルは細胞質の全体にひろがった.dcr-2欠失変異体ではR2D2の発現量は著しく減少することから,Dcr-2はR2D2の安定化に寄与することが知られている6).Dcr-2をノックダウンしたS2細胞においてDcr-2とR2D2のタンパク質量を調べたところ,ともに劇減していた.以上の結果から,D2ボディの形成にはDcr-2とR2D2の両者が必要であるが,その要求性は異なること,つまり,Dcr-2はR2D2の安定化に,R2D2はDcr-2をD2ボディへ局在化させるために,必要であることが判明した.Dcr-2を欠損した条件においてFlag標識したR2D2を強制発現させたところ,D2ボディ様の顆粒体が観察されたことから,R2D2はD2ボディの形成における中核タンパク質であると考えられた.Loqs-PDはDcr-2と結合するが,D2ボディには局在しない4).また,Loqs-PDのノックダウンによりD2ボディは消失しなかった.内在性siRNAの前駆体からの切り出し反応は,D2ボディの外で,D2ボディに非依存的に起こると考えられた.
3.D2ボディの形成におけるR2D2のもつ機能ドメインの要求性
R2D2がD2ボディに局在するために必要な領域をR2D2の変異体を作製することで調べたところ,2つ目のdsRNA結合ドメイン(dsRBD2)と,C末端側に存在するAuxiliary(Aux)領域とが必要であることがわかった.dsRBD2のもつ二本鎖RNA結合能を欠失したR2D2変異体はD2ボディへと局在しなかったことから,R2D2のもつ二本鎖RNA結合能がR2D2のD2ボディへの局在に必要であると考えられた.
二本鎖RNA結合能を欠損したR2D2変異体は,野生型と比べ比較的弱いもののDcr-2と結合することがわかった.つまり,R2D2のもつ二本鎖RNA結合能は,Dcr-2との相互作用には不要であるが,D2ボディへの局在には必要であった.R2D2のもつ二本鎖RNA結合能はDcr-2とsiRNA二本鎖との結合に重要であることが示されている6).この研究において,Ago2はD2ボディに局在することも判明した.以上の結果から,1)Dcr-2-R2D2複合体はDcr-2-Loqs-PD複合体により切り出されたsiRNA二本鎖と細胞質において結合しD2ボディへと局在化する,2)Dcr-2-R2D2複合体はD2ボディにおいてAgo2へとsiRNAを受け渡す,3)siRNA二本鎖から遊離したDcr-2-R2D2複合体は新しいsiRNA二本鎖をもとめてD2ボディから離れる,というモデルを提唱した.
4.内在性siRNAのAgo2への特異的な受け渡しはD2ボディに依存的に起こる
r2d2欠失変異体において内在性siRNAはAgo1へと受け渡される8).R2D2をノックダウンしたS2細胞においてFlag標識したAgo1またはAgo2を発現させ内在性siRNAとの結合を検討したところ,内在性siRNAのガイド鎖はAgo1とAgo2の両方に結合していたが,パッセンジャー鎖はどちらとも結合していなかった.これは,内在性siRNAにおけるガイド鎖とパッセンジャー鎖との選択にR2D2は必須でないことを示した.
外来性siRNAのR2D2への依存性について検討した.R2D2をノックダウンしたS2細胞においてFlag標識したAgo1またはAgo2を発現させ,同時に外来性siRNAを導入したのち,Ago1複合体またはAgo2複合体に含まれるRNAをノーザンブロット法により解析した.R2D2の非存在下においても外来性siRNAはAgo2と特異的に結合していた.さらに,Dcr-2とR2D2を同時に欠損させても,外来性siRNAのAgo2への特異的な受け渡しに影響はみられなかった.つまり,外来性siRNAのAgo2への特異的な受け渡しは,RLCに非依存的にD2ボディの外で起こっていた.R2D2を欠損したときも外来性siRNAのガイド鎖のみがAgo2へと受け渡されるため,R2D2は内在性あるいは外来性にかぎらず,siRNAにおけるガイド鎖とパッセンジャー鎖との選択に必要ではないことが判明した.外来性siRNA二本鎖は完全に相補的なRNA二本鎖であるのに対し,内在性siRNA二本鎖は完全に相補的ではない.つまり,内在性siRNA二本鎖は形態においてmiRNA二本鎖とより類似しており,このことが原因でmiRNAの機能性パートナーであるAgo1へとあやまって結合してしまう.これを回避するため,Dcr-2-R2D2複合体はD2ボディを形成し,内在性siRNAとAgo2をD2ボディへと局在化させることにより,内在性siRNAはAgo2へと特異的に受け渡されるのだと考えられた.
R2D2の欠損によりD2ボディは消失し,内在性siRNAはAgo1とあやまって結合してしまった.この表現型は野生型R2D2の強制発現により回復したが,二本鎖RNAに結合できないR2D2変異体を強制発現させても回復しなかった.この結果は,Dcr-2-R2D2複合体がD2ボディを形成するにはR2D2のsiRNA二本鎖への結合を必要とすること,また,内在性siRNA二本鎖をD2ボディへと局在化させることにより内在性siRNAのAgo1へのあやまった結合を回避していることを裏づけた.
おわりに
この研究をとおして筆者らは,R2D2は内在性siRNA二本鎖とAgo2をD2ボディに局在化させることにより,内在性siRNAのAgo1へのあやまった取り込みを防ぐ,つまり,内在性siRNAを本来の機能性パートナーであるAgo2のみに“振り分ける”タンパク質であることを示した(図2).内在性siRNAのAgo1とのあやまった結合は,miRNAのAgo1への結合,つまり,miRISCの形成ひいては細胞の機能を阻害する.これを回避するため,R2D2は内在性siRNAをAgo2へと振り分ける役割を担い,その役割を的確に遂行するためDcr-2とともにD2ボディを形成し,内在性siRNAとAgo2をD2ボディへと集約させるしくみを獲得したと考えられる.今後は,D2ボディの新規の構成因子を同定することにより,このしくみをより深く理解していきたい.
文 献
- Siomi, H. & Siomi, M. C.: On the road to reading the RNA-interference code. Nature, 457, 396-404 (2009)[PubMed]
- Lee, Y. S, Nakahara, K., Pham, J. W. et al.: Distinct roles for Drosophila Dicer-1 and Dicer-2 in the siRNA/miRNA silencing pathways. Cell, 117, 69-81 (2004)[PubMed]
- Kawamura, Y., Saito, K., Kin, T. et al.: Drosophila endogenous small RNAs bind to Argonaute 2 in somatic cells. Nature, 453, 793-797 (2008)[PubMed]
- Miyoshi, K., Miyoshi, T., Hartig, J. V. et al.: Molecular mechanisms that funnel RNA precursors into endogenous small-interfering RNA and microRNA biogenesis pathways in Drosophila. RNA, 16, 506-515 (2010)[PubMed]
- Liu, Q., Rand, T. A., Kalidas, S. et al.: R2D2, a bridge between the initiation and effector steps of the Drosophila RNAi pathway. Science, 301, 1921-1925 (2003)[PubMed]
- Liu, X., Jiang, F., Kalidas, S. et al.: Dicer-2 and R2D2 coordinately bind siRNA to promote assembly of the siRISC complexes. RNA, 12, 1514-1520 (2006)[PubMed]
- Tomari, Y., Du, T. & Zamore, P. D.: Sorting of Drosophila small silencing RNAs. Cell, 130, 299-308 (2007)[PubMed]
- Okamura, K., Robine, N., Liu, Y. et al.: R2D2 organizes small regulatory RNA pathways in Drosophila. Mol. Cell. Biol., 31, 884-986 (2011)[PubMed]
著者プロフィール
略歴:2010年 徳島大学大学院医学教育部博士課程 修了,同年より慶應義塾大学医学部 特任助教.
研究テーマ:RNAサイレンシングをひき起こす小分子RNAの生合成機構.
塩見 美喜子(Mikiko C. Siomi)
東京大学大学院理学系研究科 教授.
© 2013 西田知訓・塩見美喜子 Licensed under CC 表示 2.1 日本