思春期のストレスはグルココルチコイドを介してドーパミン作動性ニューロンをエピジェネティックに修飾する
丹羽美苗1・鍋島俊隆2・澤 明1
(1米国Johns Hopkins大学School of Medicine,Department of Psychiatry and Behavioral Sciences,2名城大学薬学部 地域医療薬学講座)
email:澤 明
DOI: 10.7875/first.author.2013.012
Adolescent stress-induced epigenetic control of dopaminergic neurons via glucocorticoids.
Minae Niwa, Hanna Jaaro-Peled, Stephanie Tankou, Saurav Seshadri, Takatoshi Hikida, Yurie Matsumoto, Nicola G. Cascella, Shin-ichi Kano, Norio Ozaki, Toshitaka Nabeshima, Akira Sawa
Science, 339, 335-339 (2013)
精神疾患の発症にかかわる可能性があると示唆されるDISC1遺伝子の変異型過剰発現マウスに対し,思春期に隔離飼育による心理的なストレスを負荷したときの神経化学的および行動学的な変化を観察した.DISC1遺伝子変異型過剰発現マウスを隔離飼育すると,ドーパミンの合成における律速酵素であるチロシンヒドロキシラーゼの遺伝子のDNAメチル化の促進による中脳皮質系ドーパミン作動性ニューロンの異常および行動障害が観察された.興味深いことに,隔離飼育ののち成熟期まで通常の飼育を行ってもこのエピジェネティックな変化は維持されていた.これらの変化は,通常飼育されたDISC1遺伝子変異型過剰発現マウスや思春期に隔離飼育を行った野生型マウスでは認められず,環境因子と遺伝因子の相乗作用があるものと考えられた.観察された神経化学的な異常および行動障害は,ストレスホルモンであるグルココルチコイドの血中における増加をともなっており,グルココルチコイド受容体の拮抗薬により緩解された.これらの結果から,精神疾患に関連する遺伝要因をもつ個体は,通常では異常をひき起こさないようなレベルの思春期のストレスに対し脆弱となり,ストレスホルモンによるニューロンのエピジェネティックな遺伝子発現制御をとおして,成熟期にまで持続的な行動障害を生じることが明らかになった.
統合失調症や気分障害など多くの精神疾患は成人期,とくに成人初期に発症することが多く,疫学的な研究は思春期におけるストレスの影響を示唆してきた1).しかし,その機構が明らかでないため,これまで明確な概念は得られていなかった.一方,精神疾患の発症には遺伝因子と環境因子の両方の相互作用が重要であることも,遺伝学および疫学による間接的な証拠により示唆されていた2).この研究は,こうした疑問あるいは仮説に対し,マウスを用い分子機構をとおして答えることを目的とした.
マウスは集団で生活しているためグループで飼育するのが一般的だが,あえて隔離飼育することにより心理的なストレスを負荷したモデルが報告されている3).このモデルでは,マウスを生後2週齢から8週齢まで長期に隔離飼育した結果,顕著な神経化学的な異常および行動障害の観察されることが明らかになっている3).今回の研究では,精神疾患の脆弱性にかかわる可能性のあるDISC1遺伝子変異型過剰発現マウスに対し,野生型マウスでは行動障害が観察されない程度の短期の隔離飼育を,ヒトの思春期にあたる生後5週齢から8週齢に行い,神経化学的および行動学的な変化を観察した.隔離飼育を行わない野生型マウス(対照群),思春期に3週間の隔離飼育を行った野生型マウス(環境因子群),隔離飼育を行わないDISC1遺伝子変異型過剰発現マウス(遺伝因子群),思春期に3週間の隔離飼育を行ったDISC1遺伝子変異型過剰発現マウス(遺伝環境相互作用群)の4つのグループに対して検討を行った.
それぞれのグループのマウスの8週齢において,プレパルス抑制試験,強制水泳試験,自発運動量測定試験を行ったところ,隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスにおいて,注意力,情動性,刺激に対する反応性など,行動障害が観察された.一方,そのほかの群においては顕著な行動障害は観察されなかった.これらの結果から,思春期における遺伝環境相互作用は,行動の表現型において相乗作用を示すことが明らかになった.
隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスにおいて観察された行動障害に関連する分子機構を検討した.このマウスモデルでは神経伝達における機能的な変化が起こっているのではないかと仮説をたてた.実際,このマウスモデルでは,意志決定や注意に関係する前頭皮質において,対照となるマウスと比較して,ドーパミンの含有量および細胞外のドーパミン量が有意に減少していた.前頭皮質におけるノルアドレナリンの含有量およびセロトニンの含有量に変化はなかったことから,隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスにおける神経化学的な変化はドーパミン作動性ニューロンに特異的であることが明らかになった.また,このマウスモデルの線条体におけるドーパミン含有量はそのほかの群と比較して変化はなかったことより,このドーパミン作動性ニューロンの変化は,腹側被蓋野を起始核とする投射系に対し特異的であることも明らかになった.ドーパミン量の変化に一致して,隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスの前頭皮質では,対照となるマウスと比較して,ドーパミン合成における律速酵素であるチロシンヒドロキシラーゼの発現量が有意に減少し,ドーパミンD2受容体の発現量が代償的に増加していた.腹側被蓋野を起始核とする投射系には,中脳皮質系ドーパミン作動性ニューロンと中脳辺縁系ドーパミン作動性ニューロンがある4,5).中脳辺縁系ドーパミン作動性ニューロンの投射先である側坐核において,隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスでは,チロシンヒドロキシラーゼおよびドーパミンD2受容体の発現量に変化はみられなかった.さらに,このマウスモデルでは幻覚症状や妄想症状に関係する側坐核において,対照となるマウスと比較して,刺激時に細胞外のドーパミン量が有意に増加した.よって,細胞外のドーパミン量の変化により自発運動量の増加が起こったものと考えられた.これらの結果から,隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスでは,中脳皮質系ドーパミン作動性ニューロンと中脳辺縁系ドーパミン作動性ニューロンが異なる影響をうけていることが明らかになった.
ストレス条件下では血中のグルココルチコイド(ヒトではコルチゾール,げっ歯類ではコルチコステロン)の量の増加することが報告されている6).隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスにおいて,グルココルチコイドがドーパミン作動性ニューロンの異常および行動障害に影響をあたえているのかどうか検討した.このマウスモデルでは血中のグルココルチコイドの量が有意に増加していた.一方,そのほかの群において変化はみられなかった.増加したグルココルチコイドがドーパミン作動性ニューロンの変化に影響をあたえているのかどうか検討するため,隔離飼育を行った5週齢から8週齢のあいだ,グルココルチコイド受容体の拮抗薬であるRU38486を1日1回皮下投与したところ,神経化学的な異常および行動障害は緩解した.これらの結果から,隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスの腹側被蓋野を起始核とする2つの投射系,中脳皮質系ドーパミン作動性ニューロンおよび中脳辺縁系ドーパミン作動性ニューロンは,増加したグルココルチコイドにより異なる制御をうけていることが明らかになった.
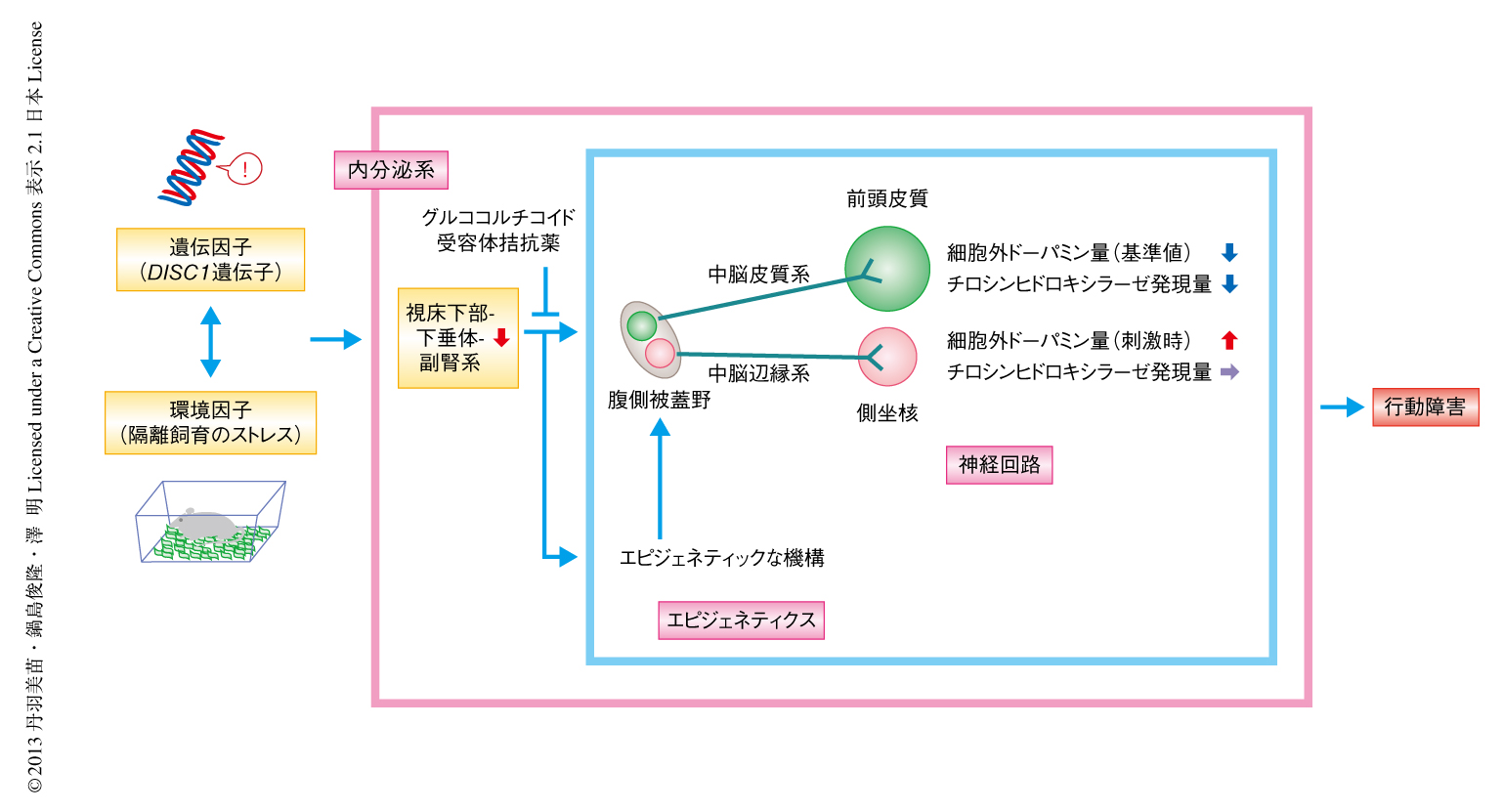
隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスの前頭皮質におけるチロシンヒドロキシラーゼの発現低下はドーパミン含有量の低下およびドーパミンD2受容体の代償的な発現増加につながることから,チロシンヒドロキシラーゼ遺伝子の発現制御におけるグルココルチコイドの影響について検討した.グルココルチコイドが中脳皮質系ドーパミン作動性ニューロンおよび中脳辺縁系ドーパミン作動性ニューロンに対し異なる遺伝子発現制御をしているのではないかと仮説をたて,投射先の部位から起始核へと逆行性に移行するビーズ4) を用いて検討を行った.緑色のビーズを中脳皮質系ドーパミン作動性ニューロンの投射先である前頭皮質へ,赤色のビーズを中脳辺縁系ドーパミン作動性ニューロンの投射先である側坐核へ注入したところ,起始核の腹側被蓋野においてチロシンヒドロキシラーゼ陽性細胞の大部分は緑色のビーズあるいは赤色のビーズを含有しており,それぞれ中脳皮質系ドーパミン作動性ニューロンおよび中脳辺縁系ドーパミン作動性ニューロンであることを示した.腹側被蓋野を取り出し,緑色のビーズおよび赤色のビーズを含有した細胞をフローサイトメトリーにより分取した.中脳皮質系ドーパミン作動性ニューロンにおけるチロシンヒドロキシラーゼ遺伝子のDNAのメチル化パターンおよび発現レベルを検討した結果,隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスではそのほかの群と比較してDNAメチル化において有意な上昇が観察された.一方,中脳辺縁系ドーパミン作動性ニューロンにおけるチロシンヒドロキシラーゼ遺伝子のDNAのメチル化パターンおよび発現レベルにおいては,いずれの群にも変化は認められなかった.これらの結果は,前頭皮質および側坐核におけるチロシンヒドロキシラーゼの発現量と一致していた.この中脳辺縁系ドーパミン作動性ニューロンにおけるエピジェネティックな変化は,グルココルチコイド受容体拮抗薬であるRU38486により緩解した.興味深いことに,思春期にあたる5週齢から8週齢の一時的な隔離飼育ののち,マウスの成熟期である20週齢まで通常のグループ飼育を行っても,このエピジェネティックな変化は持続していた.これらの結果から,精神疾患に関連する遺伝要因があるとストレスに対し脆弱となり,思春期の心理的なストレスはグルココルチコイドを介して中脳皮質系ドーパミン作動性ニューロンにおいて特異的にチロシンヒドロキシラーゼ遺伝子の発現に持続的な変化をひき起こし,成熟期において行動障害をもたらすことが明らかになった(図1).
思春期におけるストレスは遺伝的な脆弱性とかかわりあって精神疾患の発症の背景となることが知られている7-9).今回のマウス実験系は,それらの精神疾患の発症前および前駆期を含む発症機構の研究や,新たな予防法および治療法の開発に有用であると考えられた.環境要因を制御することにより,精神疾患の予防戦略への道が開かれることも期待される.とくに,グルココルチコイド受容体拮抗薬であるRU38486は幻覚症状あるいは妄想症状をともなう難治性のうつ病性障害に対する治療薬としての試みがなされていることから10),こうした疾患に対する治療法の開発に有用なツールとなる可能性もある.
略歴:2007年 名古屋大学大学院医学系研究科博士課程 修了,同年 名城大学大学院薬学研究科 博士研究員,2008年 名古屋大学大学院医学系研究科 博士研究員を経て,2009年より米国Johns Hopkins大学School of Medicine博士研究員.
研究テーマ:精神疾患の病態機構の解明とモデル動物の作製.
抱負:内分泌系,神経ネットワーク,および,エピジェネティックな機構に着目して,精神疾患の病態の解明,また,予防治療法の確立をめざしていきたい.
鍋島 俊隆(Toshitaka Nabeshima)
名城大学薬学部 特任教授.
研究室URL:http://www.ccp-koza-meijo-u.jp/
澤 明(Akira Sawa)
米国Johns Hopkins大学School of Medicine教授.
研究室URL:http://www.hopkinsmedicine.org/psychiatry/specialty_areas/schizophrenia/
© 2013 丹羽美苗・鍋島俊隆・澤 明 Licensed under CC 表示 2.1 日本
(1米国Johns Hopkins大学School of Medicine,Department of Psychiatry and Behavioral Sciences,2名城大学薬学部 地域医療薬学講座)
email:澤 明
DOI: 10.7875/first.author.2013.012
Adolescent stress-induced epigenetic control of dopaminergic neurons via glucocorticoids.
Minae Niwa, Hanna Jaaro-Peled, Stephanie Tankou, Saurav Seshadri, Takatoshi Hikida, Yurie Matsumoto, Nicola G. Cascella, Shin-ichi Kano, Norio Ozaki, Toshitaka Nabeshima, Akira Sawa
Science, 339, 335-339 (2013)
要 約
精神疾患の発症にかかわる可能性があると示唆されるDISC1遺伝子の変異型過剰発現マウスに対し,思春期に隔離飼育による心理的なストレスを負荷したときの神経化学的および行動学的な変化を観察した.DISC1遺伝子変異型過剰発現マウスを隔離飼育すると,ドーパミンの合成における律速酵素であるチロシンヒドロキシラーゼの遺伝子のDNAメチル化の促進による中脳皮質系ドーパミン作動性ニューロンの異常および行動障害が観察された.興味深いことに,隔離飼育ののち成熟期まで通常の飼育を行ってもこのエピジェネティックな変化は維持されていた.これらの変化は,通常飼育されたDISC1遺伝子変異型過剰発現マウスや思春期に隔離飼育を行った野生型マウスでは認められず,環境因子と遺伝因子の相乗作用があるものと考えられた.観察された神経化学的な異常および行動障害は,ストレスホルモンであるグルココルチコイドの血中における増加をともなっており,グルココルチコイド受容体の拮抗薬により緩解された.これらの結果から,精神疾患に関連する遺伝要因をもつ個体は,通常では異常をひき起こさないようなレベルの思春期のストレスに対し脆弱となり,ストレスホルモンによるニューロンのエピジェネティックな遺伝子発現制御をとおして,成熟期にまで持続的な行動障害を生じることが明らかになった.
はじめに
統合失調症や気分障害など多くの精神疾患は成人期,とくに成人初期に発症することが多く,疫学的な研究は思春期におけるストレスの影響を示唆してきた1).しかし,その機構が明らかでないため,これまで明確な概念は得られていなかった.一方,精神疾患の発症には遺伝因子と環境因子の両方の相互作用が重要であることも,遺伝学および疫学による間接的な証拠により示唆されていた2).この研究は,こうした疑問あるいは仮説に対し,マウスを用い分子機構をとおして答えることを目的とした.
マウスは集団で生活しているためグループで飼育するのが一般的だが,あえて隔離飼育することにより心理的なストレスを負荷したモデルが報告されている3).このモデルでは,マウスを生後2週齢から8週齢まで長期に隔離飼育した結果,顕著な神経化学的な異常および行動障害の観察されることが明らかになっている3).今回の研究では,精神疾患の脆弱性にかかわる可能性のあるDISC1遺伝子変異型過剰発現マウスに対し,野生型マウスでは行動障害が観察されない程度の短期の隔離飼育を,ヒトの思春期にあたる生後5週齢から8週齢に行い,神経化学的および行動学的な変化を観察した.隔離飼育を行わない野生型マウス(対照群),思春期に3週間の隔離飼育を行った野生型マウス(環境因子群),隔離飼育を行わないDISC1遺伝子変異型過剰発現マウス(遺伝因子群),思春期に3週間の隔離飼育を行ったDISC1遺伝子変異型過剰発現マウス(遺伝環境相互作用群)の4つのグループに対して検討を行った.
1.思春期に隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスには行動障害が観察される
それぞれのグループのマウスの8週齢において,プレパルス抑制試験,強制水泳試験,自発運動量測定試験を行ったところ,隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスにおいて,注意力,情動性,刺激に対する反応性など,行動障害が観察された.一方,そのほかの群においては顕著な行動障害は観察されなかった.これらの結果から,思春期における遺伝環境相互作用は,行動の表現型において相乗作用を示すことが明らかになった.
2.隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスにはドーパミン作動性ニューロンの異常がみられる
隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスにおいて観察された行動障害に関連する分子機構を検討した.このマウスモデルでは神経伝達における機能的な変化が起こっているのではないかと仮説をたてた.実際,このマウスモデルでは,意志決定や注意に関係する前頭皮質において,対照となるマウスと比較して,ドーパミンの含有量および細胞外のドーパミン量が有意に減少していた.前頭皮質におけるノルアドレナリンの含有量およびセロトニンの含有量に変化はなかったことから,隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスにおける神経化学的な変化はドーパミン作動性ニューロンに特異的であることが明らかになった.また,このマウスモデルの線条体におけるドーパミン含有量はそのほかの群と比較して変化はなかったことより,このドーパミン作動性ニューロンの変化は,腹側被蓋野を起始核とする投射系に対し特異的であることも明らかになった.ドーパミン量の変化に一致して,隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスの前頭皮質では,対照となるマウスと比較して,ドーパミン合成における律速酵素であるチロシンヒドロキシラーゼの発現量が有意に減少し,ドーパミンD2受容体の発現量が代償的に増加していた.腹側被蓋野を起始核とする投射系には,中脳皮質系ドーパミン作動性ニューロンと中脳辺縁系ドーパミン作動性ニューロンがある4,5).中脳辺縁系ドーパミン作動性ニューロンの投射先である側坐核において,隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスでは,チロシンヒドロキシラーゼおよびドーパミンD2受容体の発現量に変化はみられなかった.さらに,このマウスモデルでは幻覚症状や妄想症状に関係する側坐核において,対照となるマウスと比較して,刺激時に細胞外のドーパミン量が有意に増加した.よって,細胞外のドーパミン量の変化により自発運動量の増加が起こったものと考えられた.これらの結果から,隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスでは,中脳皮質系ドーパミン作動性ニューロンと中脳辺縁系ドーパミン作動性ニューロンが異なる影響をうけていることが明らかになった.
3.隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスにおけるドーパミン作動性ニューロンの異常および行動障害はグルココルチコイドの影響による
ストレス条件下では血中のグルココルチコイド(ヒトではコルチゾール,げっ歯類ではコルチコステロン)の量の増加することが報告されている6).隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスにおいて,グルココルチコイドがドーパミン作動性ニューロンの異常および行動障害に影響をあたえているのかどうか検討した.このマウスモデルでは血中のグルココルチコイドの量が有意に増加していた.一方,そのほかの群において変化はみられなかった.増加したグルココルチコイドがドーパミン作動性ニューロンの変化に影響をあたえているのかどうか検討するため,隔離飼育を行った5週齢から8週齢のあいだ,グルココルチコイド受容体の拮抗薬であるRU38486を1日1回皮下投与したところ,神経化学的な異常および行動障害は緩解した.これらの結果から,隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスの腹側被蓋野を起始核とする2つの投射系,中脳皮質系ドーパミン作動性ニューロンおよび中脳辺縁系ドーパミン作動性ニューロンは,増加したグルココルチコイドにより異なる制御をうけていることが明らかになった.
4.隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスにおけるドーパミン作動性ニューロンの異常はエピジェネティックな制御によりひき起こされる
隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスの前頭皮質におけるチロシンヒドロキシラーゼの発現低下はドーパミン含有量の低下およびドーパミンD2受容体の代償的な発現増加につながることから,チロシンヒドロキシラーゼ遺伝子の発現制御におけるグルココルチコイドの影響について検討した.グルココルチコイドが中脳皮質系ドーパミン作動性ニューロンおよび中脳辺縁系ドーパミン作動性ニューロンに対し異なる遺伝子発現制御をしているのではないかと仮説をたて,投射先の部位から起始核へと逆行性に移行するビーズ4) を用いて検討を行った.緑色のビーズを中脳皮質系ドーパミン作動性ニューロンの投射先である前頭皮質へ,赤色のビーズを中脳辺縁系ドーパミン作動性ニューロンの投射先である側坐核へ注入したところ,起始核の腹側被蓋野においてチロシンヒドロキシラーゼ陽性細胞の大部分は緑色のビーズあるいは赤色のビーズを含有しており,それぞれ中脳皮質系ドーパミン作動性ニューロンおよび中脳辺縁系ドーパミン作動性ニューロンであることを示した.腹側被蓋野を取り出し,緑色のビーズおよび赤色のビーズを含有した細胞をフローサイトメトリーにより分取した.中脳皮質系ドーパミン作動性ニューロンにおけるチロシンヒドロキシラーゼ遺伝子のDNAのメチル化パターンおよび発現レベルを検討した結果,隔離飼育を行ったDISC1遺伝子変異型過剰発現マウスではそのほかの群と比較してDNAメチル化において有意な上昇が観察された.一方,中脳辺縁系ドーパミン作動性ニューロンにおけるチロシンヒドロキシラーゼ遺伝子のDNAのメチル化パターンおよび発現レベルにおいては,いずれの群にも変化は認められなかった.これらの結果は,前頭皮質および側坐核におけるチロシンヒドロキシラーゼの発現量と一致していた.この中脳辺縁系ドーパミン作動性ニューロンにおけるエピジェネティックな変化は,グルココルチコイド受容体拮抗薬であるRU38486により緩解した.興味深いことに,思春期にあたる5週齢から8週齢の一時的な隔離飼育ののち,マウスの成熟期である20週齢まで通常のグループ飼育を行っても,このエピジェネティックな変化は持続していた.これらの結果から,精神疾患に関連する遺伝要因があるとストレスに対し脆弱となり,思春期の心理的なストレスはグルココルチコイドを介して中脳皮質系ドーパミン作動性ニューロンにおいて特異的にチロシンヒドロキシラーゼ遺伝子の発現に持続的な変化をひき起こし,成熟期において行動障害をもたらすことが明らかになった(図1).
おわりに
思春期におけるストレスは遺伝的な脆弱性とかかわりあって精神疾患の発症の背景となることが知られている7-9).今回のマウス実験系は,それらの精神疾患の発症前および前駆期を含む発症機構の研究や,新たな予防法および治療法の開発に有用であると考えられた.環境要因を制御することにより,精神疾患の予防戦略への道が開かれることも期待される.とくに,グルココルチコイド受容体拮抗薬であるRU38486は幻覚症状あるいは妄想症状をともなう難治性のうつ病性障害に対する治療薬としての試みがなされていることから10),こうした疾患に対する治療法の開発に有用なツールとなる可能性もある.
文 献
- Paus, T., Keshavan, M. & Giedd, J. N.: Why do many psychiatric disorders emerge during adolescence? Nat. Rev. Neurosci., 9, 947-957 (2008)[PubMed]
- Caspi, A. & Moffitt, T. E.: Gene-environment interactions in psychiatry: joining forces with neuroscience. Nat. Rev. Neurosci., 7, 583-590 (2006)[PubMed]
- Niwa, M., Matsumoto, Y., Mouri, A. et al.: Vulnerability in early life to changes in the rearing environment plays a crucial role in the aetiopathology of psychiatric disorders. Int. J. Neuropsychopharmacol., 14, 459-477 (2011)[PubMed]
- Lammel, S., Hetzel, A., Hackel, O. et al.: Unique properties of mesoprefrontal neurons within a dual mesocorticolimbic dopamine system. Neuron, 57, 760-773 (2008)[PubMed]
- Niwa, M., Kamiya, A., Murai, R. et al.: Knockdown of DISC1 by in utero gene transfer disturbs postnatal dopaminergic maturation in the frontal cortex and leads to adult behavioral deficits. Neuron, 65, 480-489 (2010)[PubMed]
- Fleshner, M., Deak, T., Spencer, R. L. et al.: A long-term increase in basal levels of corticosterone and a decrease in corticosteroid-binding globulin after acute stressor exposure. Endocrinology, 136, 5336-5342 (1995)[PubMed]
- van Os, J., Kenis, G. & Rutten, B. P.: The environment and schizophrenia. Nature, 468, 203-212 (2010)[PubMed]
- Moffitt, T. E., Caspi, A. & Rutter, M.: Strategy for investigating interactions between measured genes and measured environments. Arch. Gen. Psychiatry, 62, 473-481 (2005)[PubMed]
- de Kloet, E. R., Joels, M. & Holsboer, F.: Stress and the brain: from adaptation to disease. Nat. Rev. Neurosci., 6, 463-475 (2005)[PubMed]
- Flores, B. H., Kenna, H., Keller, J. et al.: Clinical and biological effects of mifepristone treatment for psychotic depression. Neuropsychopharmacology, 31, 628-636 (2006)[PubMed]
著者プロフィール
略歴:2007年 名古屋大学大学院医学系研究科博士課程 修了,同年 名城大学大学院薬学研究科 博士研究員,2008年 名古屋大学大学院医学系研究科 博士研究員を経て,2009年より米国Johns Hopkins大学School of Medicine博士研究員.
研究テーマ:精神疾患の病態機構の解明とモデル動物の作製.
抱負:内分泌系,神経ネットワーク,および,エピジェネティックな機構に着目して,精神疾患の病態の解明,また,予防治療法の確立をめざしていきたい.
鍋島 俊隆(Toshitaka Nabeshima)
名城大学薬学部 特任教授.
研究室URL:http://www.ccp-koza-meijo-u.jp/
澤 明(Akira Sawa)
米国Johns Hopkins大学School of Medicine教授.
研究室URL:http://www.hopkinsmedicine.org/psychiatry/specialty_areas/schizophrenia/
© 2013 丹羽美苗・鍋島俊隆・澤 明 Licensed under CC 表示 2.1 日本