上皮の形態形成における分裂期球形化の新たな役割
近藤武史・林 茂生
(理化学研究所発生・再生科学総合研究センター 形態形成シグナル研究グループ)
email:近藤武史,林 茂生
DOI: 10.7875/first.author.2013.010
Mitotic cell rounding accelerates epithelial invagination.
Takefumi Kondo, Shigeo Hayashi
Nature, 494, 125-129 (2013)
動物の細胞は分裂期に進入するとその形態を球形へと変化させる.この分裂期球形化はディッシュ上の培養細胞から組織中の上皮細胞にまで普遍的にみられる現象である.その細胞形態の大きな変化は適切な細胞分裂に必須である一方,細胞の協調的なふるまいが必要とされる間期の細胞による組織の形態形成運動を干渉してしまうと考えられていた.筆者らは,上皮シートの陥入機構のさらなる理解をめざしてショウジョウバエにおける気管原基の陥入を解析する過程において,分裂期への進入が適切な形態形成運動に必須であることを見い出した.変異体,阻害剤,および,物理的な微小破壊を用いた解析により,気管原基では密に配置された間期の細胞が陥入の中心にむかって圧力を高め,分裂期球形化がその圧力を解放することにより上皮シートの急激な落ち込みを誘導し,陥入を加速していることを明らかにした.これは細胞分裂とは独立した,形態形成運動における分裂期球形化の新たな役割であった.
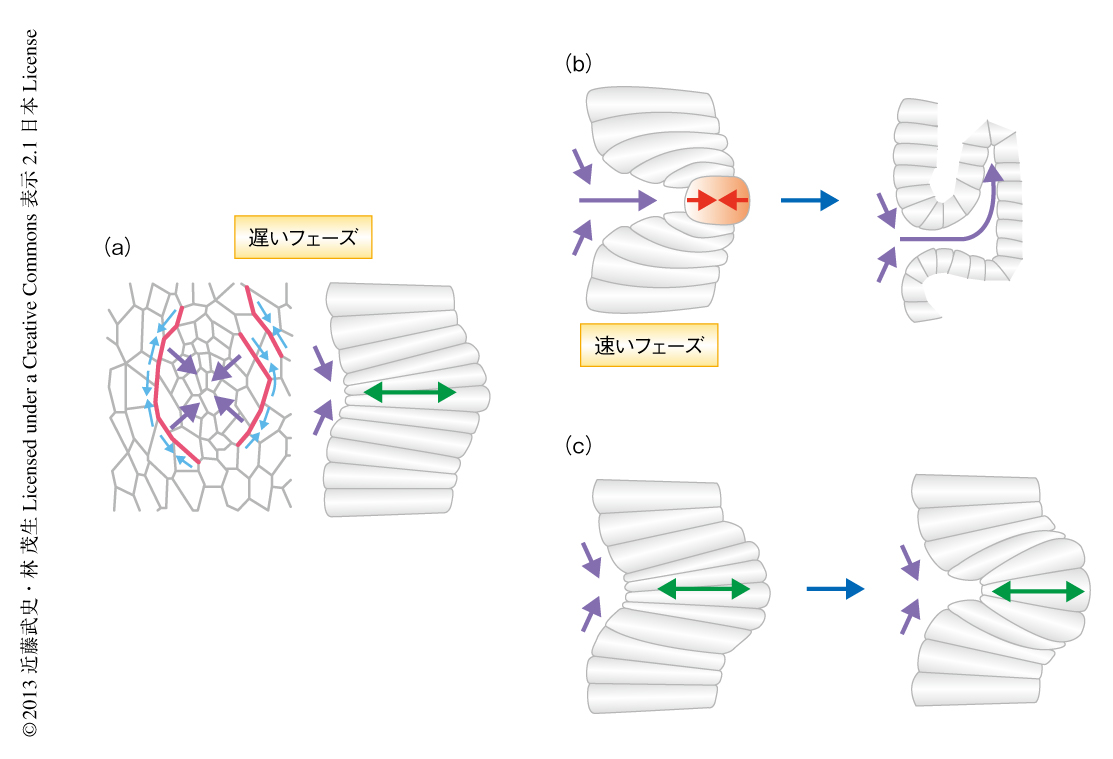
からだは連続する上皮組織からなりたっており,発生の過程では上皮シートが変形することにより形態形成は進行する.陥入や折りたたみ,伸長といった上皮シートの変形は,個々の細胞の形態変化が協調的に組み合わさることによりなしとげられる.その際,細胞はその運命にしたがってそれぞれ固有の骨格構造を構築し,接着分子やモータータンパク質とともに力を生み出すことにより変形する.また,器官形成には組織の成長も必須であり,細胞分裂がおもな役割を担う.このように,細胞が変形と分裂とをくり返していくことで発生は進行するのであるが,そこにはひとつの問題がある.細胞の変形と分裂はそれぞれに特異な細胞骨格を必要とするという事実である.たとえば,アクチン骨格とミオシンによる細胞の頂端面の収縮が上皮シートの陥入をひき起こす1).一方で,細胞は分裂期に進入すると表層アクチンを再編成し細胞全体の表面張力を高めることにより,間期における細胞形態にかかわらず球形に変化する分裂期球形化(mitotic cell rounding)をひき起こす2)(図1a).さらに,紡錘体を形成するため微小管も再構築され,アクチン骨格はさらに変化して収縮環となる.つまり,分裂期への進入は間期における細胞骨格の破壊につながり,細胞の変形ひいては組織の変形を阻害してしまうと考えられている.実際にショウジョウバエにおいて,原腸陥入期に異所的な細胞分裂の起こる変異体では中胚葉組織の陥入に異常をきたすことが知られている3).このような知見に反して,筆者らは,詳細な生細胞観察をつうじて,ショウジョウバエにおける気管原基の陥入では細胞分裂がむしろ積極的に形態形成運動に貢献していることを見い出した.
上皮シートの陥入は基本的な形態形成運動のひとつであり,二次元的なシートを三次元的な管構造へと変換する.上皮細胞が頂端部を収縮させることにより陥入のはじまることはよく知られているが1),陥入の達成のためには頂端部の収縮だけで十分であるのか,それ以外にも必要だとすればどのような細胞のふるまいが関与しているのかについては,いまだ不明な点が多く残されている.その理由のひとつとして,陥入は立体的な形態変化であるにもかかわらず,生細胞観察による細胞動態の解析は頂端の平面にとどまっており,三次元的なふるまいについてはあまり理解の進んでいないことがあげられる.筆者らは,上皮シートの陥入機構のさらなる理解をめざして,ショウジョウバエの胚発生期の気管原基をモデルとして,シートが管構造へと変換される過程を立体的に生細胞観察する実験系を構築し細胞の三次元動態を解析した.
ショウジョウバエの胚において上皮組織は1層に配置された柱状の上皮細胞で構成されており,そのなかから体節あたり2対,計20対の気管原基領域が決定される.それぞれの気管原基は約40個の細胞からなり,それぞれが内部へ陥入し,分岐,融合することで体中に酸素を送るネットワーク管構造をつくりだす4).カドヘリン-GFP融合タンパク質を用いて頂端接着部位を標識し頂端面が内部へ入り込んでいくようすを観察すると,陥入の速度により気管原基の陥入は2つの段階,遅いフェーズ(slow phase)と速いフェーズ(fast phase)にて進行することがわかった.遅いフェーズでは原基中心に位置する細胞の頂端面が徐々に収縮していき,それと同時に小さなくぼみをゆっくりと形成した(図2a).30~60分の遅いフェーズののち陥入の速度は上昇して頂端面は急激に内部へ落ち込んでいき(速いフェーズ),最終的に管構造へと変換された.速いフェーズの引き金となる要因を探るため,ヒストン-RFP融合タンパク質を用いて同時に染色体の観察も行ったところ,速いフェーズに入ったときには必ず,陥入の底に染色体が凝集した分裂期の細胞の現われることが明らかになった.そこで,細胞膜全体をGFPにより標識し三次元的な細胞の形態変化を観察したところ,中心にある頂端の収縮している細胞が分裂期に進入してその形態を柱状から球状へと変化させていく過程と同時に,その頂端面が内部へ入り込んでいくようすが観察された(図2b).これらの観察から,分裂期球形化が陥入の加速に重要な役割をはたしているとの仮説をたてた.
ショウジョウバエの胚発生の過程において,気管細胞を含む多くの細胞は16回の細胞分裂を行い,陥入の加速とともにみられる分裂は最後の16回目に相当する.以前の研究により,サイクリンAの変異体(CycA変異体)では16回目の分裂期にのみ進入ができなくなること,DNA複製にかかわるdup遺伝子の変異体では16回目の複製が長びくことにより分裂期への進入が大幅に遅延することが知られていた.そこで,気管原基の陥入における細胞分裂の貢献を検証するため,これらの変異体の生細胞観察を行った.すると,遅いフェーズは正常に開始するが,そののちの陥入が正常な胚と比較して遅れることが明らかになり,分裂期への進入は陥入に対して積極的に寄与していることが明らかになった.一方で,これらの変異体では遅延はするものの,陥入の速度は遅れて上昇し,いっけん正常な管構造をつくりだすことから,陥入を制御する未知の機構の存在が示唆された.
陥入を完了し1本の管となった気管原基は,周辺の細胞から分泌されるFGFにむかって走化性を示し分岐する4).FGFシグナルは陥入には寄与しないと考えられており,実際に,FGFシグナルの変異体を解析しても陥入の速度に異常は認められなかった.しかしながら,FGFシグナルの変異とCycA変異との二重変異体を解析したところ,CycA変異体と比較してさらに陥入は遅延し,管構造への変換にも異常をきたすことが明らかになった(図2c).これらの結果から,分裂期への進入が陥入の加速および管構造への変換に必須であり,FGFシグナルは細胞分裂の不全により遅延した陥入を補助するバックアップ機構としてはたらくと結論した.また,気管原基の陥入は頂端の収縮による遅いフェーズのみでは不十分であると考えられた.
分裂期球形化と細胞分裂それ自体の貢献とを区別するための実験を行った.微小管阻害剤であるコルヒチンを用いて紡錘体の形成を阻害することにより,細胞は分裂期に進入して球形になるものの,そののちの分裂は進行しない状況をつくりだすことができる.この方法を用いて細胞分裂を特異的に阻害したところ,正常な胚と同様に,分裂期球形化とともに陥入は加速し,気管細胞が内部へ入り込んでいくようすが観察された.よって,陥入の加速を誘導するためには細胞分裂は必要なく,分裂期球形化で十分であることが明らかになった.
では,なぜ分裂期球形化により陥入は加速されるのだろうか.柱状の上皮細胞は分裂期に入ると頂端側において球形となり,組織の頂端面は平面を保つ5)(図1b).一方で,気管原基の場合には,基底側の位置をほとんど変えることなく分裂期球形化と同時に頂端面が内部へ落ち込む.つまり問題は,なぜ気管原基の陥入期にかぎって球形化した細胞が落ち込むのか,といい換えることができる.1つ目の可能性として,気管細胞は基底面を基底膜や中胚葉細胞など内部の構造に強く接着させているのではないかと考えた.そこで,基底膜との接着を失うインテグリンの変異体,および,中胚葉細胞を形成できないsnail twist二重変異体の観察を行ったが,ともに分裂期球形化にともなう陥入の加速が認められたことから,この可能性はきわめて低いと考えられた.
第2の可能性として,原基中心は周辺からの圧力により頂端側から内部へ押し込まれていることを考えた.上皮の形態形成において,その駆動力を生み出すための重要なタンパク質のひとつに非筋ミオシンIIがある.筆者らは以前に,気管原基ではEGFシグナルの制御のもと非筋ミオシンIIが陥入の中心をとりかこむようにして細胞接着面に局在することを見い出していた6)(図2a).一方で,頂端部が収縮している中心細胞ではミオシンの強い局在はみられず,EGFシグナルの変異体において円周状のミオシンの局在が消失すると中心細胞の頂端の収縮も誘導されず遅いフェーズははじまらない.これらの事実から,ミオシンが円周状に収縮力を発生させることにより中心にむかう圧力を生み出し,その結果として,中心部は受動的に圧迫されていると考えた.そこで,この内向きの圧力と分裂期球形化との関係を探るため,EGFシグナルの変異体において分裂期に進入した細胞がどの位置で球形となるのかを観察したところ,気管原基は分裂期への進入の直前まで平面を維持し,さらに,分裂期に進入したはじめの数細胞は頂端側において球形化した.この結果は,分裂期球形化にともなう陥入の加速にはEGFシグナルが必要であることを示しており,ミオシンを介した圧力により球形化した細胞が内部へ押し込まれていることを示唆していた.また,紫外線パルスレーザーを用いた微小破壊により遅いフェーズにある中心細胞に摂動をあたえると人為的な陥入の加速が誘発されたことから,中心細胞は内部へ入り込もうとする力に拮抗していると考えられた.
これらの事実から,筆者らは以下のモデルを考えている.1)遅いフェーズでは円周状に局在するミオシンにより内向きの圧力が形成されるが,柱状の中心細胞がそれに抵抗するため,原基中心に内向きの圧力が蓄積していく.2)中心細胞が分裂期に進入し細胞骨格の再編成の起こることにより抵抗は消失し,蓄積していた圧力が解放される.3)同時に,分裂期球形化により細胞の背丈(頂端-基底軸の長さ)が短縮することにより,上皮シートの急激な変形がひき起こされ,頂端面が一気に内部に入り込んでいく.この過程は,工学分野で扱われる弾性体の座屈として理解することができる.このように,EGFシグナルによる平面の圧力と分裂期球形化による抵抗力の低下が時空間的に協調して作用することのより,スムーズな陥入が達成されているものと考えられた(図2b).
以前の報告により,EGFとFGFの両方を欠失した場合においても気管原基は部分的に陥入できることが示されていた7).この陥入に細胞分裂が関与しているかどうかを調べるため,EGFシグナルの変異,FGFシグナルの変異にくわえ,CycA変異も導入した三重変異体を作製し解析したところ,陥入構造は形成されず平らな頂端面が維持された.つまり,気管原基はEGFシグナルあるいはFGFシグナルが活性化してない状況であっても,細胞分裂に依存して陥入できることが明らかになった.では,どのように陥入しているのだろうか.さきに述べたように,EGFシグナルの変異体では,はじめの分裂細胞は頂端側において球形となり内部へ入り込まない.そののち気管原基の観察をつづけたところ,ひきつづいて分裂期に入る細胞の一部が内部で球形化することにより頂端面が落ち込んでいくようすが観察された.この内部で球形化する細胞は直前に頂端面の減少する傾向があり,これはさきだって頂端側において球形化した細胞により押されたためと考えられた.これらの結果から,まわりから圧迫された細胞が内側で球形化するという正常な胚と共通の機構により,頂端面の落ち込みがひき起こされていることが明らかになった.
また,EGFシグナルの変異とCycA変異との二重変異体においては,通常はFGFシグナルがはたらいて分岐のはじまる時期に気管原基が陥入を開始することも明らかになった.これらのことは,EGFシグナル,細胞分裂,FGFシグナルはそれぞれ単独で,質の異なる機構を介して気管原基の陥入の引き金を引きうることを示していた.EGFシグナルやFGFシグナルは気管細胞において特異的に活性化するが,細胞分裂は周辺の上皮細胞でも同様に起こる.一方で,気管原基でみられる分裂期への進入による陥入は周辺の上皮細胞では観察されない.つまり,EGFシグナルおよびFGFシグナルの非存在下であっても気管原基は分裂期にともなう陥入を達成するため,まわりとは異なる性質を獲得しているものと考えられた.その要因を明らかにすることは,さまざまな引き金による陥入を保障する上皮の形態形成における新たな原理の解明につながるだろう.
一般的に,頂端の収縮は細胞の能動的な形態変化ととらえられているが,少なくとも,気管原基では受動的にまわりから圧迫されることにより頂端の収縮を達成している.さきに述べたように,ショウジョウバエの原腸期では異所的な細胞分裂により中胚葉組織の陥入が阻害されているが3),この場合は,細胞は頂端部にミオシンを局在させることにより能動的に収縮している8).陥入における分裂期球形化の作用の差はこの頂端の収縮機構の違いに起因すると考えられ,能動的な収縮力は分裂期への進入により消失してしまうが,気管原基の受動的な収縮の場合には入り込む力には影響せずむしろ加速に貢献できる.つまり,同じ上皮シートの陥入という現象であっても,生物はさまざまな方法をもちあわせており,その状況にあわせ選択しているようである.また,分裂期への進入は細胞骨格や形態のほかにも,核膜の崩壊など数々の変化をひき起こす.それらが,自らを正確に分割するという細胞のもっとも根幹的な作業に必要な変化であることはいうまでもないが,細胞分裂とは独立した未知の役割をも担っている可能性は十分にある.この研究はその一部を垣間みたにすぎないが,分裂期の新たな意義を考えるきっかけになれば幸いである.
略歴:2008年 奈良先端科学技術大学院大学バイオサイエンス研究科博士後期課程 修了,同年 基礎生物学研究所 研究員を経て,2009年より理化学研究所発生・再生科学総合研究センター 研究員.
研究テーマ:上皮の形態形成.
関心事:分裂期.
林 茂生(Shigeo Hayashi)
理化学研究所発生・再生科学総合研究センター グループディレクター.
研究室URL:http://www.cdb.riken.jp/signal/
© 2013 近藤武史・林 茂生 Licensed under CC 表示 2.1 日本
(理化学研究所発生・再生科学総合研究センター 形態形成シグナル研究グループ)
email:近藤武史,林 茂生
DOI: 10.7875/first.author.2013.010
Mitotic cell rounding accelerates epithelial invagination.
Takefumi Kondo, Shigeo Hayashi
Nature, 494, 125-129 (2013)
要 約
動物の細胞は分裂期に進入するとその形態を球形へと変化させる.この分裂期球形化はディッシュ上の培養細胞から組織中の上皮細胞にまで普遍的にみられる現象である.その細胞形態の大きな変化は適切な細胞分裂に必須である一方,細胞の協調的なふるまいが必要とされる間期の細胞による組織の形態形成運動を干渉してしまうと考えられていた.筆者らは,上皮シートの陥入機構のさらなる理解をめざしてショウジョウバエにおける気管原基の陥入を解析する過程において,分裂期への進入が適切な形態形成運動に必須であることを見い出した.変異体,阻害剤,および,物理的な微小破壊を用いた解析により,気管原基では密に配置された間期の細胞が陥入の中心にむかって圧力を高め,分裂期球形化がその圧力を解放することにより上皮シートの急激な落ち込みを誘導し,陥入を加速していることを明らかにした.これは細胞分裂とは独立した,形態形成運動における分裂期球形化の新たな役割であった.
はじめに
からだは連続する上皮組織からなりたっており,発生の過程では上皮シートが変形することにより形態形成は進行する.陥入や折りたたみ,伸長といった上皮シートの変形は,個々の細胞の形態変化が協調的に組み合わさることによりなしとげられる.その際,細胞はその運命にしたがってそれぞれ固有の骨格構造を構築し,接着分子やモータータンパク質とともに力を生み出すことにより変形する.また,器官形成には組織の成長も必須であり,細胞分裂がおもな役割を担う.このように,細胞が変形と分裂とをくり返していくことで発生は進行するのであるが,そこにはひとつの問題がある.細胞の変形と分裂はそれぞれに特異な細胞骨格を必要とするという事実である.たとえば,アクチン骨格とミオシンによる細胞の頂端面の収縮が上皮シートの陥入をひき起こす1).一方で,細胞は分裂期に進入すると表層アクチンを再編成し細胞全体の表面張力を高めることにより,間期における細胞形態にかかわらず球形に変化する分裂期球形化(mitotic cell rounding)をひき起こす2)(図1a).さらに,紡錘体を形成するため微小管も再構築され,アクチン骨格はさらに変化して収縮環となる.つまり,分裂期への進入は間期における細胞骨格の破壊につながり,細胞の変形ひいては組織の変形を阻害してしまうと考えられている.実際にショウジョウバエにおいて,原腸陥入期に異所的な細胞分裂の起こる変異体では中胚葉組織の陥入に異常をきたすことが知られている3).このような知見に反して,筆者らは,詳細な生細胞観察をつうじて,ショウジョウバエにおける気管原基の陥入では細胞分裂がむしろ積極的に形態形成運動に貢献していることを見い出した.
1.ショウジョウバエにおける気管原基の陥入は急激な加速をともなう
上皮シートの陥入は基本的な形態形成運動のひとつであり,二次元的なシートを三次元的な管構造へと変換する.上皮細胞が頂端部を収縮させることにより陥入のはじまることはよく知られているが1),陥入の達成のためには頂端部の収縮だけで十分であるのか,それ以外にも必要だとすればどのような細胞のふるまいが関与しているのかについては,いまだ不明な点が多く残されている.その理由のひとつとして,陥入は立体的な形態変化であるにもかかわらず,生細胞観察による細胞動態の解析は頂端の平面にとどまっており,三次元的なふるまいについてはあまり理解の進んでいないことがあげられる.筆者らは,上皮シートの陥入機構のさらなる理解をめざして,ショウジョウバエの胚発生期の気管原基をモデルとして,シートが管構造へと変換される過程を立体的に生細胞観察する実験系を構築し細胞の三次元動態を解析した.
ショウジョウバエの胚において上皮組織は1層に配置された柱状の上皮細胞で構成されており,そのなかから体節あたり2対,計20対の気管原基領域が決定される.それぞれの気管原基は約40個の細胞からなり,それぞれが内部へ陥入し,分岐,融合することで体中に酸素を送るネットワーク管構造をつくりだす4).カドヘリン-GFP融合タンパク質を用いて頂端接着部位を標識し頂端面が内部へ入り込んでいくようすを観察すると,陥入の速度により気管原基の陥入は2つの段階,遅いフェーズ(slow phase)と速いフェーズ(fast phase)にて進行することがわかった.遅いフェーズでは原基中心に位置する細胞の頂端面が徐々に収縮していき,それと同時に小さなくぼみをゆっくりと形成した(図2a).30~60分の遅いフェーズののち陥入の速度は上昇して頂端面は急激に内部へ落ち込んでいき(速いフェーズ),最終的に管構造へと変換された.速いフェーズの引き金となる要因を探るため,ヒストン-RFP融合タンパク質を用いて同時に染色体の観察も行ったところ,速いフェーズに入ったときには必ず,陥入の底に染色体が凝集した分裂期の細胞の現われることが明らかになった.そこで,細胞膜全体をGFPにより標識し三次元的な細胞の形態変化を観察したところ,中心にある頂端の収縮している細胞が分裂期に進入してその形態を柱状から球状へと変化させていく過程と同時に,その頂端面が内部へ入り込んでいくようすが観察された(図2b).これらの観察から,分裂期球形化が陥入の加速に重要な役割をはたしているとの仮説をたてた.
2.分裂期への進入は陥入の加速に必須である
ショウジョウバエの胚発生の過程において,気管細胞を含む多くの細胞は16回の細胞分裂を行い,陥入の加速とともにみられる分裂は最後の16回目に相当する.以前の研究により,サイクリンAの変異体(CycA変異体)では16回目の分裂期にのみ進入ができなくなること,DNA複製にかかわるdup遺伝子の変異体では16回目の複製が長びくことにより分裂期への進入が大幅に遅延することが知られていた.そこで,気管原基の陥入における細胞分裂の貢献を検証するため,これらの変異体の生細胞観察を行った.すると,遅いフェーズは正常に開始するが,そののちの陥入が正常な胚と比較して遅れることが明らかになり,分裂期への進入は陥入に対して積極的に寄与していることが明らかになった.一方で,これらの変異体では遅延はするものの,陥入の速度は遅れて上昇し,いっけん正常な管構造をつくりだすことから,陥入を制御する未知の機構の存在が示唆された.
陥入を完了し1本の管となった気管原基は,周辺の細胞から分泌されるFGFにむかって走化性を示し分岐する4).FGFシグナルは陥入には寄与しないと考えられており,実際に,FGFシグナルの変異体を解析しても陥入の速度に異常は認められなかった.しかしながら,FGFシグナルの変異とCycA変異との二重変異体を解析したところ,CycA変異体と比較してさらに陥入は遅延し,管構造への変換にも異常をきたすことが明らかになった(図2c).これらの結果から,分裂期への進入が陥入の加速および管構造への変換に必須であり,FGFシグナルは細胞分裂の不全により遅延した陥入を補助するバックアップ機構としてはたらくと結論した.また,気管原基の陥入は頂端の収縮による遅いフェーズのみでは不十分であると考えられた.
3.分裂期球形化は陥入の加速に十分である
分裂期球形化と細胞分裂それ自体の貢献とを区別するための実験を行った.微小管阻害剤であるコルヒチンを用いて紡錘体の形成を阻害することにより,細胞は分裂期に進入して球形になるものの,そののちの分裂は進行しない状況をつくりだすことができる.この方法を用いて細胞分裂を特異的に阻害したところ,正常な胚と同様に,分裂期球形化とともに陥入は加速し,気管細胞が内部へ入り込んでいくようすが観察された.よって,陥入の加速を誘導するためには細胞分裂は必要なく,分裂期球形化で十分であることが明らかになった.
4.分裂期球形化は上皮シートの座屈を誘導する
では,なぜ分裂期球形化により陥入は加速されるのだろうか.柱状の上皮細胞は分裂期に入ると頂端側において球形となり,組織の頂端面は平面を保つ5)(図1b).一方で,気管原基の場合には,基底側の位置をほとんど変えることなく分裂期球形化と同時に頂端面が内部へ落ち込む.つまり問題は,なぜ気管原基の陥入期にかぎって球形化した細胞が落ち込むのか,といい換えることができる.1つ目の可能性として,気管細胞は基底面を基底膜や中胚葉細胞など内部の構造に強く接着させているのではないかと考えた.そこで,基底膜との接着を失うインテグリンの変異体,および,中胚葉細胞を形成できないsnail twist二重変異体の観察を行ったが,ともに分裂期球形化にともなう陥入の加速が認められたことから,この可能性はきわめて低いと考えられた.
第2の可能性として,原基中心は周辺からの圧力により頂端側から内部へ押し込まれていることを考えた.上皮の形態形成において,その駆動力を生み出すための重要なタンパク質のひとつに非筋ミオシンIIがある.筆者らは以前に,気管原基ではEGFシグナルの制御のもと非筋ミオシンIIが陥入の中心をとりかこむようにして細胞接着面に局在することを見い出していた6)(図2a).一方で,頂端部が収縮している中心細胞ではミオシンの強い局在はみられず,EGFシグナルの変異体において円周状のミオシンの局在が消失すると中心細胞の頂端の収縮も誘導されず遅いフェーズははじまらない.これらの事実から,ミオシンが円周状に収縮力を発生させることにより中心にむかう圧力を生み出し,その結果として,中心部は受動的に圧迫されていると考えた.そこで,この内向きの圧力と分裂期球形化との関係を探るため,EGFシグナルの変異体において分裂期に進入した細胞がどの位置で球形となるのかを観察したところ,気管原基は分裂期への進入の直前まで平面を維持し,さらに,分裂期に進入したはじめの数細胞は頂端側において球形化した.この結果は,分裂期球形化にともなう陥入の加速にはEGFシグナルが必要であることを示しており,ミオシンを介した圧力により球形化した細胞が内部へ押し込まれていることを示唆していた.また,紫外線パルスレーザーを用いた微小破壊により遅いフェーズにある中心細胞に摂動をあたえると人為的な陥入の加速が誘発されたことから,中心細胞は内部へ入り込もうとする力に拮抗していると考えられた.
これらの事実から,筆者らは以下のモデルを考えている.1)遅いフェーズでは円周状に局在するミオシンにより内向きの圧力が形成されるが,柱状の中心細胞がそれに抵抗するため,原基中心に内向きの圧力が蓄積していく.2)中心細胞が分裂期に進入し細胞骨格の再編成の起こることにより抵抗は消失し,蓄積していた圧力が解放される.3)同時に,分裂期球形化により細胞の背丈(頂端-基底軸の長さ)が短縮することにより,上皮シートの急激な変形がひき起こされ,頂端面が一気に内部に入り込んでいく.この過程は,工学分野で扱われる弾性体の座屈として理解することができる.このように,EGFシグナルによる平面の圧力と分裂期球形化による抵抗力の低下が時空間的に協調して作用することのより,スムーズな陥入が達成されているものと考えられた(図2b).
5.分裂期球形化はEGFシグナルおよびFGFシグナルとは独立に気管原基の陥入を誘導できる
以前の報告により,EGFとFGFの両方を欠失した場合においても気管原基は部分的に陥入できることが示されていた7).この陥入に細胞分裂が関与しているかどうかを調べるため,EGFシグナルの変異,FGFシグナルの変異にくわえ,CycA変異も導入した三重変異体を作製し解析したところ,陥入構造は形成されず平らな頂端面が維持された.つまり,気管原基はEGFシグナルあるいはFGFシグナルが活性化してない状況であっても,細胞分裂に依存して陥入できることが明らかになった.では,どのように陥入しているのだろうか.さきに述べたように,EGFシグナルの変異体では,はじめの分裂細胞は頂端側において球形となり内部へ入り込まない.そののち気管原基の観察をつづけたところ,ひきつづいて分裂期に入る細胞の一部が内部で球形化することにより頂端面が落ち込んでいくようすが観察された.この内部で球形化する細胞は直前に頂端面の減少する傾向があり,これはさきだって頂端側において球形化した細胞により押されたためと考えられた.これらの結果から,まわりから圧迫された細胞が内側で球形化するという正常な胚と共通の機構により,頂端面の落ち込みがひき起こされていることが明らかになった.
また,EGFシグナルの変異とCycA変異との二重変異体においては,通常はFGFシグナルがはたらいて分岐のはじまる時期に気管原基が陥入を開始することも明らかになった.これらのことは,EGFシグナル,細胞分裂,FGFシグナルはそれぞれ単独で,質の異なる機構を介して気管原基の陥入の引き金を引きうることを示していた.EGFシグナルやFGFシグナルは気管細胞において特異的に活性化するが,細胞分裂は周辺の上皮細胞でも同様に起こる.一方で,気管原基でみられる分裂期への進入による陥入は周辺の上皮細胞では観察されない.つまり,EGFシグナルおよびFGFシグナルの非存在下であっても気管原基は分裂期にともなう陥入を達成するため,まわりとは異なる性質を獲得しているものと考えられた.その要因を明らかにすることは,さまざまな引き金による陥入を保障する上皮の形態形成における新たな原理の解明につながるだろう.
おわりに
一般的に,頂端の収縮は細胞の能動的な形態変化ととらえられているが,少なくとも,気管原基では受動的にまわりから圧迫されることにより頂端の収縮を達成している.さきに述べたように,ショウジョウバエの原腸期では異所的な細胞分裂により中胚葉組織の陥入が阻害されているが3),この場合は,細胞は頂端部にミオシンを局在させることにより能動的に収縮している8).陥入における分裂期球形化の作用の差はこの頂端の収縮機構の違いに起因すると考えられ,能動的な収縮力は分裂期への進入により消失してしまうが,気管原基の受動的な収縮の場合には入り込む力には影響せずむしろ加速に貢献できる.つまり,同じ上皮シートの陥入という現象であっても,生物はさまざまな方法をもちあわせており,その状況にあわせ選択しているようである.また,分裂期への進入は細胞骨格や形態のほかにも,核膜の崩壊など数々の変化をひき起こす.それらが,自らを正確に分割するという細胞のもっとも根幹的な作業に必要な変化であることはいうまでもないが,細胞分裂とは独立した未知の役割をも担っている可能性は十分にある.この研究はその一部を垣間みたにすぎないが,分裂期の新たな意義を考えるきっかけになれば幸いである.
文 献
- Sawyer, J. M., Harrell, J. R., Shemer, G. et al.: Apical constriction: a cell shape change that can drive morphogenesis. Dev. Biol., 341, 5-19 (2010)[PubMed]
- Stewart, M. P., Helenius, J., Toyoda, Y. et al.: Hydrostatic pressure and the actomyosin cortex drive mitotic cell rounding. Nature, 469, 226-230 (2011)[PubMed]
- Dobens, L. L. & Bouyain, S.: Developmental roles of tribbles protein family members. Dev. Dyn., 241, 1239-1248 (2012)[PubMed]
- Affolter, M. & Caussinus, E.: Tracheal branching morphogenesis in Drosophila: new insights into cell behaviour and organ architecture. Development, 135, 2055-2064 (2008)[PubMed]
- Meyer, E. J., Ikmi, A. & Gibson, M. C.: Interkinetic nuclear migration is a broadly conserved feature of cell division in pseudostratified epithelia. Curr. Biol., 21, 485-491 (2011)[PubMed]
- Nishimura, M., Inoue, Y. & Hayashi, S.: A wave of EGFR signaling determines cell alignment and intercalation in the Drosophila tracheal placode. Development, 134, 4273-4282 (2007)[PubMed]
- Brodu, V. & Casanova, J.: The RhoGAP crossveinless-c links trachealess and EGFR signaling to cell shape remodeling in Drosophila tracheal invagination. Genes Dev., 20, 1817-1828 (2006)[PubMed]
- Martin, A. C., Kaschube, M. & Wieschaus, E. F.: Pulsed contractions of an actin-myosin network drive apical constriction. Nature, 457, 495-499 (2009)[PubMed]
著者プロフィール
略歴:2008年 奈良先端科学技術大学院大学バイオサイエンス研究科博士後期課程 修了,同年 基礎生物学研究所 研究員を経て,2009年より理化学研究所発生・再生科学総合研究センター 研究員.
研究テーマ:上皮の形態形成.
関心事:分裂期.
林 茂生(Shigeo Hayashi)
理化学研究所発生・再生科学総合研究センター グループディレクター.
研究室URL:http://www.cdb.riken.jp/signal/
© 2013 近藤武史・林 茂生 Licensed under CC 表示 2.1 日本