Jdp2は破骨細胞および好中球の正常な分化に必須である
丸山健太・審良静男
(大阪大学免疫学フロンティア研究センター 自然免疫学)
email:丸山健太
DOI: 10.7875/first.author.2012.155
The transcription factor Jdp2 controls bone homeostasis and antibacterial immunity by regulating osteoclast and neutrophil differentiation.
Kenta Maruyama, Masahiro Fukasaka, Alexis Vandenbon, Tatsuya Saitoh, Takumi Kawasaki, Takeshi Kondo, Kazunari K. Yokoyama, Hiroyasu Kidoya, Nobuyuki Takakura, Daron Standley, Osamu Takeuchi, Shizuo Akira
Immunity, 37, 1024-1036 (2012)
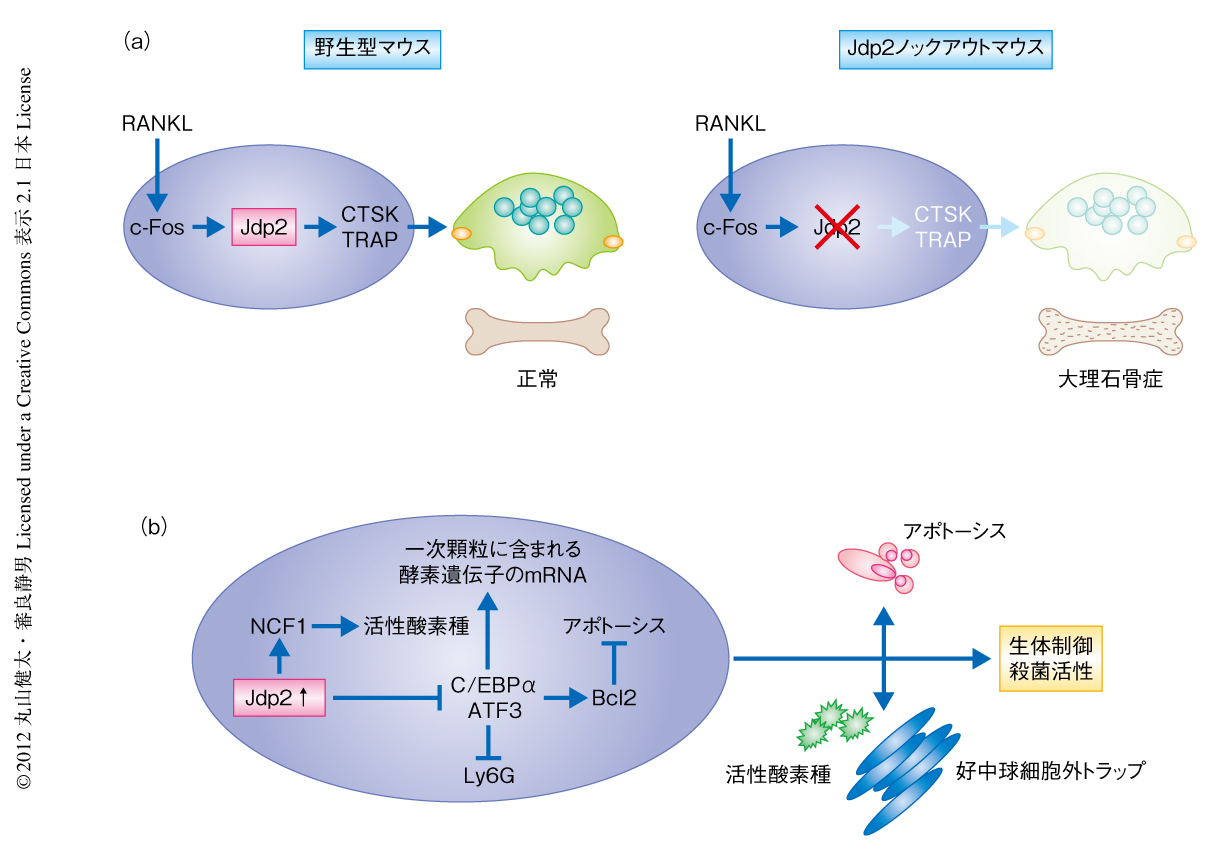
Jdp2はAP-1ファミリーに属する転写因子であり,細胞死やヒストンアセチル化の制御に関与することが知られている.しかし,多様な細胞分化におけるその機能や個体レベルでの生理的な意義については謎につつまれていた.今回,筆者らは,Jdp2ノックアウトマウスが大理石骨病を発症すると同時に,黄色ブドウ球菌やカンジダ菌に対し易感染性となることを発見した.この2つの形質はそれぞれ破骨細胞および好中球の分化障害に起因するものと考えられ,DNA chipやChIP-seq法を用いた網羅的なゲノム解析により,Jdp2はこれら2つの細胞系譜に特異的な遺伝子発現を,転写およびエピジェネティックな制御の2つのレベルにおいて複雑に制御していることが明らかになった.
多彩な刺激応答性をもつ転写因子AP-1(activator protein 1)は,AP-1ファミリーに属する複数のタンパク質がヘテロ二量体あるいはホモ二量体を形成したものの総称であり,AP-1ファミリータンパク質からなるプールの組合せによりその標的遺伝子の精緻な発現制御がなされている.骨を吸収する破骨細胞は,骨形成を担う骨芽細胞に存在するRANKLにより分化誘導されるが,その際にAP-1が強く活性化される.そのため,AP-1ファミリータンパク質の遺伝子改変マウスの多くで破骨細胞の分化異常が報告されている.筆者らは,これまでに,RANKLやAP-1が破骨細胞の分化のみならず自然免疫系においても重要な役割をはたしていることを報告しており1,2),これらが“骨自然免疫系”制御タンパク質として機能していることが明らかになりつつある.
AP-1ファミリータンパク質のひとつであるJdp2(Jun dimerization protein 2)は,これまでに破骨細胞の分化を促進するタンパク質として3),一方では,紫外線により誘導されるアポトーシスを抑制するタンパク質として報告されていた4).また,Jdp2はほかのAP-1ファミリータンパク質であるc-Jun,JunD,JunB,ATF2と結合し,これらパートナータンパク質の活性を抑制することから転写抑制因子とも考えられていた5).さらに近年,Jdp2はヒストンアセチル化酵素活性を抑制することが見い出され,エピジェネティックな制御タンパク質としての機能にも注目があつまっていた6).しかし,Jdp2の多様な細胞分化における役割や個体レベルでの生理的な機能についてはほとんど明らかにされていなかった.筆者らは,Jdp2ノックアウトマウスを作製し詳細に解析した.その結果,Jdp2は破骨細胞のみならず好中球の最終分化の一端を制御することにより,骨代謝と感染防御の双方を制御していることが判明した.
Jdp2はミエロイド系細胞においてその発現が高く,なかでも,破骨細胞においてはRANKLによる刺激にともない発現が強く誘導された.さらに,破骨細胞の分化に必須のAP-1ファミリータンパク質であるc-Fosをノックダウンするとこの発現誘導は消失した.Jdp2ノックアウトマウスを作製しin vitroにおいてRANKL誘導性の破骨細胞の分化を観察したところ,驚くべきことに,破骨細胞はまったく形成されなかった.Jdp2ノックアウトマウスに由来する細胞ではRANKLによるc-Fosの活性化は正常に生じている一方で,破骨細胞のマーカーであるCTSKやTRAPの誘導は起こらなかったことから,Jdp2はc-Fosに依存的な発現制御をうけており,同時に,破骨細胞に特異的な遺伝子の発現誘導に必須であることが明らかになった.
Jdp2ノックアウトマウスの骨を解析したところ骨量および骨密度の上昇が認められ,軽度の大理石骨病を呈していることが判明した.組織学的な解析では,骨形成の速度や骨芽細胞に異常は認められなかった一方で,破骨細胞の量と骨吸収活性の低下が確認された.過去に報告のあるTREM2などによるRANKL共刺激シグナル7) ではin vitroにおけるJdp2ノックアウトマウスに由来する細胞におけるRANKL誘導性の破骨細胞の分化をレスキューできなかったことから,in vivoにおいては,破骨細胞の分化障害はRANKL以外の未知のシグナルによりある程度まで代償されていることも明らかになった.
破骨細胞以外の血球を各種の細胞表面マーカーにより精査したところ,Jdp2ノックアウトマウスのリンパ球,樹状細胞,マクロファージの分化には明らかな異常のないことがわかった.分化にともないJdp2の発現の上昇する好中球に着目したところ,Jdp2ノックアウトマウスの好中球においては分化マーカーであるLy6Gの細胞表面における発現が顕著に低下していることが明らかになった.この形質は骨髄のみならず脾臓や腹腔といった末梢の好中球でも認められ,放射線を照射したのちJdp2ノックアウトマウスの骨髄を移植した野生型マウスでも同様の形質が再現された.また,レトロウイルスを用いた遺伝子導入によりJdp2ノックアウトマウスの好中球にJdp2を補うとLy6Gの細胞表面における発現は回復した.Jdp2ノックアウトマウスの骨髄から得たミエロイド系の各種の血球のin vitroにおけるコロニー形成能は正常で,好中球の分化に必須のサイトカインであるG-CSFに対するシグナル伝達も正常に生じていたことから,この形質は好中球に内在するJdp2の欠損に起因した最終分化における異常であると考えられた.興味深いことに,Ly6Gの細胞表面における発現の低い野生型マウスの好中球は未分化であり形態学的に円形の核をもつが,Jdp2ノックアウトマウスの好中球はLy6Gの発現が低下しているにもかかわらず形態学的には分葉した核をもち成熟した好中球の様相を呈していた.また,ミエロペルオキシダーゼなどの抗菌タンパク質を蓄える好中球からなる顆粒の形成も正常であった.
Jdp2ノックアウトマウスの好中球の数は野生型マウスより2割ほど増加していたため,細胞死に着目して解析を行った.その結果,Jdp2ノックアウトマウスの好中球は自発的なアポトーシスが著明に障害されており,抗アポトーシスタンパク質であるBcl2の発現が上昇していることが明らかになった.また,Jdp2ノックアウトマウスの好中球における各種の自然免疫受容体の発現や炎症性サイトカインの産生は正常であったが,NADPHオキシダーゼのサブユニットのひとつであるNCF1の発現低下により活性酸素種の産生が減弱していた.さらに,好中球が感染にともない放出する高粘度の殺菌活性をもつクロマチンである好中球細胞外トラップ8)(neutrophil extracellular trap,NET)の形成も障害されており,その結果として,in vitroにおいて黄色ブドウ球菌やカンジダ菌の殺傷力が低下していた.以上より,Jdp2ノックアウトマウスの好中球はさまざまな機能に障害をもつことが明らかになった.
Jdp2の好中球における標的遺伝子を明らかにするため,DNA chipによりJdp2ノックアウトマウスの好中球におけるトランスクリプトーム解析を行い,野生型マウスより高い発現を示した遺伝子のプロモーターに存在する転写因子結合部位について調べた.その結果,好中球の一次顆粒に含まれる酵素遺伝子などC/EBP結合部位をもつ遺伝子のmRNAがJdp2ノックアウトマウスの好中球において著しく増加していることが判明した.その一方で,これら酵素遺伝子のタンパク質レベルは正常であった.野生型マウスにおいて顆粒の形成が十分に生じていない未分化な状態の好中球では顆粒に含まれる酵素遺伝子のmRNAがピークを示し,Jdp2ノックアウトマウスと同じく好中球においてその分化マーカーであるLy6Gの発現が低下しているGfi-1ノックアウトマウス9) やIkarosノックアウトマウス10) でも顆粒の形成に障害がある一方で顆粒に含まれる酵素遺伝子のmRNAに増加が認められる.こうしたことから,Jdp2ノックアウトマウスにおける好中球の一次顆粒に含まれる酵素遺伝子のmRNAの増加は,好中球の未分化性を反映しているものと考えられた.
Jdp2ノックアウトマウスの好中球から核タンパク質を抽出し,C/EBP結合部位に対するC/EBPファミリー転写因子の結合能を調べたところ,タンパク質のレベルは正常であるにもかかわらず,C/EBPαのC/EBP結合部位への結合が亢進していることが明らかになった.さらに,Jdp2はC/EBPαと直接に結合することによりC/EBPαの活性を抑制していることも免疫沈降法とレポーターアッセイ法により確認された.実際に,C/EBPαを野生型マウスの好中球に導入すると一次顆粒に含まれる酵素遺伝子のmRNAの増加やBcl2の発現上昇が認められ,アポトーシスの減弱や好中球細胞外トラップの形成障害など,Jdp2ノックアウトマウスの好中球とよく似た形質を示したことから,Jdp2は好中球の最終分化の段階においてC/EBPαと直接に結合し,これを抑制することにより適切な遺伝子の発現状態をつくりだしているものと考えられた.
好中球の分化マーカーであるLy6Gの発現低下の原因はC/EBPαの過剰な活性化では説明がつかなかったため,Jdp2がエピジェネティックな制御タンパク質であることを勘案し,Jdp2ノックアウトマウスの好中球に由来するゲノムのヒストンアセチル化の状態をChIP-seq(クロマチン免疫沈降-シークエンシング)法により網羅的に解析した.その結果,Jdp2と同じくAP-1ファミリーに属する転写因子であるATF3をコードする遺伝子のプロモーター領域におけるヒストンアセチル化が,Jdp2ノックアウトマウスの好中球において著明に亢進していることが判明した.実際に,ATF3の発現はJdp2ノックアウトマウスの好中球において上昇しており,Jdp2はATF3遺伝子のプロモーターに直接に結合することによりそのヒストンアセチル化を阻害していた.また,野生型マウスに由来する骨髄細胞にATF3を導入しin vitroにおいて好中球に分化誘導させるとLy6Gの細胞表面における発現が減弱したことから,ATF3は好中球の新規の分化阻害タンパク質であり,Jdp2がこの発現を直接に抑制することにより好中球の適切な最終分化の状態が実現されているものと考えられた.
好中球は細菌および真菌への感染防御において中心的な役割をはたす自然免疫細胞であることから,Jdp2ノックアウトマウスに黄色ブドウ球菌やカンジダ菌を静脈から感染させてその生存を野生型マウスと比較した.その結果,Jdp2ノックアウトマウスではこれら病原体の全身の臓器における排除能が低下しており,感染ののち早期に死亡してしまうことが明らかになった.さらに,放射線を照射したのちJdp2ノックアウトマウスの骨髄を移植した野生型マウスも,野生型マウスの骨髄を移植した対照と比べ,黄色ブドウ球菌の感染に対する脆弱性を示した.この感受性の差は好中球を除去することにより消失した.ここで用いた感染モデルはT細胞およびB細胞を除去した状態において致死率に変化のないものであったことから,Jdp2ノックアウトマウスの黄色ブドウ球菌への感染における易感染性の原因は好中球の異常に起因するものと考えられた.
今回の筆者らのJdp2ノックアウトマウスを用いた検討は,Jdp2が破骨細胞および好中球の正常な分化に必須であることを解明したのみならず,個体レベルにおいてJdp2が新規の“骨自然免疫系”制御タンパク質であることを明確に示した.Jdp2は破骨細胞および好中球における系譜特異的な遺伝子発現を転写およびエピジェネティックな制御の2つのレベルで複雑に制御しており(図1),その機能についてはさらなる検討が必要と考えられる.今後は,関節リウマチのような破骨細胞と好中球がともに過剰に活性化した疾患の制御という切り口からの研究も重要なテーマとなりうるだろう.
略歴:大阪大学大学院医学研究科 在学中.
研究テーマ:分子免疫生理学,医学史,老年医療.
審良 静男(Shizuo Akira)
大阪大学免疫学フロンティア研究センター 教授.
研究室URL:http://hostdefense.ifrec.osaka-u.ac.jp/ja/index.html
© 2012 丸山健太・審良静男 Licensed under CC 表示 2.1 日本
(大阪大学免疫学フロンティア研究センター 自然免疫学)
email:丸山健太
DOI: 10.7875/first.author.2012.155
The transcription factor Jdp2 controls bone homeostasis and antibacterial immunity by regulating osteoclast and neutrophil differentiation.
Kenta Maruyama, Masahiro Fukasaka, Alexis Vandenbon, Tatsuya Saitoh, Takumi Kawasaki, Takeshi Kondo, Kazunari K. Yokoyama, Hiroyasu Kidoya, Nobuyuki Takakura, Daron Standley, Osamu Takeuchi, Shizuo Akira
Immunity, 37, 1024-1036 (2012)
要 約
Jdp2はAP-1ファミリーに属する転写因子であり,細胞死やヒストンアセチル化の制御に関与することが知られている.しかし,多様な細胞分化におけるその機能や個体レベルでの生理的な意義については謎につつまれていた.今回,筆者らは,Jdp2ノックアウトマウスが大理石骨病を発症すると同時に,黄色ブドウ球菌やカンジダ菌に対し易感染性となることを発見した.この2つの形質はそれぞれ破骨細胞および好中球の分化障害に起因するものと考えられ,DNA chipやChIP-seq法を用いた網羅的なゲノム解析により,Jdp2はこれら2つの細胞系譜に特異的な遺伝子発現を,転写およびエピジェネティックな制御の2つのレベルにおいて複雑に制御していることが明らかになった.
はじめに
多彩な刺激応答性をもつ転写因子AP-1(activator protein 1)は,AP-1ファミリーに属する複数のタンパク質がヘテロ二量体あるいはホモ二量体を形成したものの総称であり,AP-1ファミリータンパク質からなるプールの組合せによりその標的遺伝子の精緻な発現制御がなされている.骨を吸収する破骨細胞は,骨形成を担う骨芽細胞に存在するRANKLにより分化誘導されるが,その際にAP-1が強く活性化される.そのため,AP-1ファミリータンパク質の遺伝子改変マウスの多くで破骨細胞の分化異常が報告されている.筆者らは,これまでに,RANKLやAP-1が破骨細胞の分化のみならず自然免疫系においても重要な役割をはたしていることを報告しており1,2),これらが“骨自然免疫系”制御タンパク質として機能していることが明らかになりつつある.
AP-1ファミリータンパク質のひとつであるJdp2(Jun dimerization protein 2)は,これまでに破骨細胞の分化を促進するタンパク質として3),一方では,紫外線により誘導されるアポトーシスを抑制するタンパク質として報告されていた4).また,Jdp2はほかのAP-1ファミリータンパク質であるc-Jun,JunD,JunB,ATF2と結合し,これらパートナータンパク質の活性を抑制することから転写抑制因子とも考えられていた5).さらに近年,Jdp2はヒストンアセチル化酵素活性を抑制することが見い出され,エピジェネティックな制御タンパク質としての機能にも注目があつまっていた6).しかし,Jdp2の多様な細胞分化における役割や個体レベルでの生理的な機能についてはほとんど明らかにされていなかった.筆者らは,Jdp2ノックアウトマウスを作製し詳細に解析した.その結果,Jdp2は破骨細胞のみならず好中球の最終分化の一端を制御することにより,骨代謝と感染防御の双方を制御していることが判明した.
1.Jdp2ノックアウトマウスは破骨細胞の分化障害により大理石骨病を発症する
Jdp2はミエロイド系細胞においてその発現が高く,なかでも,破骨細胞においてはRANKLによる刺激にともない発現が強く誘導された.さらに,破骨細胞の分化に必須のAP-1ファミリータンパク質であるc-Fosをノックダウンするとこの発現誘導は消失した.Jdp2ノックアウトマウスを作製しin vitroにおいてRANKL誘導性の破骨細胞の分化を観察したところ,驚くべきことに,破骨細胞はまったく形成されなかった.Jdp2ノックアウトマウスに由来する細胞ではRANKLによるc-Fosの活性化は正常に生じている一方で,破骨細胞のマーカーであるCTSKやTRAPの誘導は起こらなかったことから,Jdp2はc-Fosに依存的な発現制御をうけており,同時に,破骨細胞に特異的な遺伝子の発現誘導に必須であることが明らかになった.
Jdp2ノックアウトマウスの骨を解析したところ骨量および骨密度の上昇が認められ,軽度の大理石骨病を呈していることが判明した.組織学的な解析では,骨形成の速度や骨芽細胞に異常は認められなかった一方で,破骨細胞の量と骨吸収活性の低下が確認された.過去に報告のあるTREM2などによるRANKL共刺激シグナル7) ではin vitroにおけるJdp2ノックアウトマウスに由来する細胞におけるRANKL誘導性の破骨細胞の分化をレスキューできなかったことから,in vivoにおいては,破骨細胞の分化障害はRANKL以外の未知のシグナルによりある程度まで代償されていることも明らかになった.
2.Jdp2ノックアウトマウスの好中球は形態学的には正常だが分化マーカーは減弱している
破骨細胞以外の血球を各種の細胞表面マーカーにより精査したところ,Jdp2ノックアウトマウスのリンパ球,樹状細胞,マクロファージの分化には明らかな異常のないことがわかった.分化にともないJdp2の発現の上昇する好中球に着目したところ,Jdp2ノックアウトマウスの好中球においては分化マーカーであるLy6Gの細胞表面における発現が顕著に低下していることが明らかになった.この形質は骨髄のみならず脾臓や腹腔といった末梢の好中球でも認められ,放射線を照射したのちJdp2ノックアウトマウスの骨髄を移植した野生型マウスでも同様の形質が再現された.また,レトロウイルスを用いた遺伝子導入によりJdp2ノックアウトマウスの好中球にJdp2を補うとLy6Gの細胞表面における発現は回復した.Jdp2ノックアウトマウスの骨髄から得たミエロイド系の各種の血球のin vitroにおけるコロニー形成能は正常で,好中球の分化に必須のサイトカインであるG-CSFに対するシグナル伝達も正常に生じていたことから,この形質は好中球に内在するJdp2の欠損に起因した最終分化における異常であると考えられた.興味深いことに,Ly6Gの細胞表面における発現の低い野生型マウスの好中球は未分化であり形態学的に円形の核をもつが,Jdp2ノックアウトマウスの好中球はLy6Gの発現が低下しているにもかかわらず形態学的には分葉した核をもち成熟した好中球の様相を呈していた.また,ミエロペルオキシダーゼなどの抗菌タンパク質を蓄える好中球からなる顆粒の形成も正常であった.
3.Jdp2ノックアウトマウスの好中球はさまざまな機能に障害をもつ
Jdp2ノックアウトマウスの好中球の数は野生型マウスより2割ほど増加していたため,細胞死に着目して解析を行った.その結果,Jdp2ノックアウトマウスの好中球は自発的なアポトーシスが著明に障害されており,抗アポトーシスタンパク質であるBcl2の発現が上昇していることが明らかになった.また,Jdp2ノックアウトマウスの好中球における各種の自然免疫受容体の発現や炎症性サイトカインの産生は正常であったが,NADPHオキシダーゼのサブユニットのひとつであるNCF1の発現低下により活性酸素種の産生が減弱していた.さらに,好中球が感染にともない放出する高粘度の殺菌活性をもつクロマチンである好中球細胞外トラップ8)(neutrophil extracellular trap,NET)の形成も障害されており,その結果として,in vitroにおいて黄色ブドウ球菌やカンジダ菌の殺傷力が低下していた.以上より,Jdp2ノックアウトマウスの好中球はさまざまな機能に障害をもつことが明らかになった.
4.Jdp2ノックアウトマウスの好中球はC/EBPαの過剰な活性化とATF3の発現上昇により異常な分化を呈する
Jdp2の好中球における標的遺伝子を明らかにするため,DNA chipによりJdp2ノックアウトマウスの好中球におけるトランスクリプトーム解析を行い,野生型マウスより高い発現を示した遺伝子のプロモーターに存在する転写因子結合部位について調べた.その結果,好中球の一次顆粒に含まれる酵素遺伝子などC/EBP結合部位をもつ遺伝子のmRNAがJdp2ノックアウトマウスの好中球において著しく増加していることが判明した.その一方で,これら酵素遺伝子のタンパク質レベルは正常であった.野生型マウスにおいて顆粒の形成が十分に生じていない未分化な状態の好中球では顆粒に含まれる酵素遺伝子のmRNAがピークを示し,Jdp2ノックアウトマウスと同じく好中球においてその分化マーカーであるLy6Gの発現が低下しているGfi-1ノックアウトマウス9) やIkarosノックアウトマウス10) でも顆粒の形成に障害がある一方で顆粒に含まれる酵素遺伝子のmRNAに増加が認められる.こうしたことから,Jdp2ノックアウトマウスにおける好中球の一次顆粒に含まれる酵素遺伝子のmRNAの増加は,好中球の未分化性を反映しているものと考えられた.
Jdp2ノックアウトマウスの好中球から核タンパク質を抽出し,C/EBP結合部位に対するC/EBPファミリー転写因子の結合能を調べたところ,タンパク質のレベルは正常であるにもかかわらず,C/EBPαのC/EBP結合部位への結合が亢進していることが明らかになった.さらに,Jdp2はC/EBPαと直接に結合することによりC/EBPαの活性を抑制していることも免疫沈降法とレポーターアッセイ法により確認された.実際に,C/EBPαを野生型マウスの好中球に導入すると一次顆粒に含まれる酵素遺伝子のmRNAの増加やBcl2の発現上昇が認められ,アポトーシスの減弱や好中球細胞外トラップの形成障害など,Jdp2ノックアウトマウスの好中球とよく似た形質を示したことから,Jdp2は好中球の最終分化の段階においてC/EBPαと直接に結合し,これを抑制することにより適切な遺伝子の発現状態をつくりだしているものと考えられた.
好中球の分化マーカーであるLy6Gの発現低下の原因はC/EBPαの過剰な活性化では説明がつかなかったため,Jdp2がエピジェネティックな制御タンパク質であることを勘案し,Jdp2ノックアウトマウスの好中球に由来するゲノムのヒストンアセチル化の状態をChIP-seq(クロマチン免疫沈降-シークエンシング)法により網羅的に解析した.その結果,Jdp2と同じくAP-1ファミリーに属する転写因子であるATF3をコードする遺伝子のプロモーター領域におけるヒストンアセチル化が,Jdp2ノックアウトマウスの好中球において著明に亢進していることが判明した.実際に,ATF3の発現はJdp2ノックアウトマウスの好中球において上昇しており,Jdp2はATF3遺伝子のプロモーターに直接に結合することによりそのヒストンアセチル化を阻害していた.また,野生型マウスに由来する骨髄細胞にATF3を導入しin vitroにおいて好中球に分化誘導させるとLy6Gの細胞表面における発現が減弱したことから,ATF3は好中球の新規の分化阻害タンパク質であり,Jdp2がこの発現を直接に抑制することにより好中球の適切な最終分化の状態が実現されているものと考えられた.
5.Jdp2ノックアウトマウスは細菌および真菌の感染に対し脆弱である
好中球は細菌および真菌への感染防御において中心的な役割をはたす自然免疫細胞であることから,Jdp2ノックアウトマウスに黄色ブドウ球菌やカンジダ菌を静脈から感染させてその生存を野生型マウスと比較した.その結果,Jdp2ノックアウトマウスではこれら病原体の全身の臓器における排除能が低下しており,感染ののち早期に死亡してしまうことが明らかになった.さらに,放射線を照射したのちJdp2ノックアウトマウスの骨髄を移植した野生型マウスも,野生型マウスの骨髄を移植した対照と比べ,黄色ブドウ球菌の感染に対する脆弱性を示した.この感受性の差は好中球を除去することにより消失した.ここで用いた感染モデルはT細胞およびB細胞を除去した状態において致死率に変化のないものであったことから,Jdp2ノックアウトマウスの黄色ブドウ球菌への感染における易感染性の原因は好中球の異常に起因するものと考えられた.
おわりに
今回の筆者らのJdp2ノックアウトマウスを用いた検討は,Jdp2が破骨細胞および好中球の正常な分化に必須であることを解明したのみならず,個体レベルにおいてJdp2が新規の“骨自然免疫系”制御タンパク質であることを明確に示した.Jdp2は破骨細胞および好中球における系譜特異的な遺伝子発現を転写およびエピジェネティックな制御の2つのレベルで複雑に制御しており(図1),その機能についてはさらなる検討が必要と考えられる.今後は,関節リウマチのような破骨細胞と好中球がともに過剰に活性化した疾患の制御という切り口からの研究も重要なテーマとなりうるだろう.
文 献
- Maruyama, K., Takada, Y., Ray, N. et al.: Receptor activator of NF-κB ligand and osteoprotegerin regulate proinflammatory cytokine production in mice. J. Immunol., 177, 3799-3805 (2006)[PubMed]
- Maruyama, K., Sano, G., Ray, N. et al.: c-Fos-deficient mice are susceptible to Salmonella enterica serovar Typhimurium infection. Infect. Immun., 75, 1520-1523 (2007)[PubMed]
- Kawaida, R., Ohtsuka, T., Okutsu, J. et al.: Jun dimerization protein 2 (JDP2), a member of the AP-1 family of transcription factor, mediates osteoclast differentiation induced by RANKL. J. Exp. Med., 197, 1029-1035 (2003)[PubMed]
- Huang, Y. C., Saito, S. & Yokoyama, K. K.: Histone chaperone Jun dimerization protein 2 (JDP2): role in cellular senescence and aging. Kaohsiung J. Med. Sci., 26, 515-531 (2010)[PubMed]
- Jin, C., Ugai, H., Song, J. et al.: Identification of mouse Jun dimerization protein 2 as a novel repressor of ATF-2. FEBS Lett., 489, 34-41 (2001)[PubMed]
- Jin, C., Kato, K., Chimura, T. et al.: Regulation of histone acetylation and nucleosome assembly by transcription factor JDP2. Nat. Struct. Mol. Biol., 13, 331-338 (2006)[PubMed]
- Humphrey, M. B., Daws, M. R., Spusta, S. C. et al.: TREM2, a DAP12-associated receptor, regulates osteoclast differentiation and function. J. Bone Miner. Res., 21, 237-245 (2006)[PubMed]
- Brinkmann, V., Reichard, U., Goosmann, C. et al.: Neutrophil extracellular traps kill bacteria. Science, 303, 1532-1535 (2004)[PubMed]
- Hock, H., Hamblen, M. J., Rooke, H. M. et al.: Intrinsic requirement for zinc finger transcription factor Gfi-1 in neutrophil differentiation. Immunity, 18, 109-120 (2003)[PubMed]
- Dumortier, A., Kirstetter, P., Kastner, P. et al.: Ikaros regulates neutrophil differentiation. Blood, 101, 2219-2226 (2003)[PubMed]
著者プロフィール
略歴:大阪大学大学院医学研究科 在学中.
研究テーマ:分子免疫生理学,医学史,老年医療.
審良 静男(Shizuo Akira)
大阪大学免疫学フロンティア研究センター 教授.
研究室URL:http://hostdefense.ifrec.osaka-u.ac.jp/ja/index.html
© 2012 丸山健太・審良静男 Licensed under CC 表示 2.1 日本