大腸菌のペリプラズム空間でのリポ多糖の輸送は細胞質におけるATP加水分解エネルギーにより駆動される
奥田 傑・Daniel Kahne
(米国Harvard大学Department of Chemistry and Chemical Biology)
email:奥田 傑
DOI: 10.7875/first.author.2012.152
Cytoplasmic ATP hydrolysis powers transport of lipopolysaccharide across the periplasm in E. coli.
Suguru Okuda, Elizaveta Freinkman, Daniel Kahne
Science, 338, 1214-1217 (2012)
グラム陰性細菌の細胞表層はリポ多糖によりおおわれており,細胞は分裂するたびに数百万分子のリポ多糖を細胞表層へと輸送しなければならない.大腸菌においては,リポ多糖が細胞表層へと正しくたどりつくための内膜と外膜とをつなぐ7つのLptタンパク質が同定されている.これらLptタンパク質は内膜の外側からペリプラズム空間をへて細胞表層までリポ多糖を輸送すると考えられているが,これまで,リポ多糖とLptタンパク質との輸送中間体は検出されたことがなく,その輸送機構の解明は困難であった.そこで,筆者らは,リポ多糖とLptタンパク質とが結合した輸送中間体をin vivoにおいて観察する手法を確立した.また,この手法をin vitroにおける実験に応用したところ,Lptタンパク質を介した内膜から外膜へのリポ多糖の輸送には,少なくとも2段階でATP加水分解反応が必要であることが示唆された.この高いATP要求性はリポ多糖を濃度勾配にさからって細胞表層へと輸送するため必要であり,リポ多糖は互いに押し合いながら内膜と外膜とをつなぐLptタンパク質のリポ多糖結合部位のあいだを移動し,内膜から細胞表層へ到達すると推測された.
グラム陰性細菌には,リン脂質の二重層からなる細胞質膜(内膜)の外側に,内側がリン脂質,外側がリポ多糖とよばれる糖脂質からなる非対称な脂質二重層(外膜)が存在する.このリポ多糖層により,グラム陰性細菌は過酷な環境あるいは多くの抗生物質の存在のもとでも生存することが可能になっている.そのため,グラム陰性細菌におけるリポ多糖の生合成機構の解明は,新たな抗生物質の標的を同定するという医学的にも重要な意味をもつ.この複雑な構造をもつリポ多糖が生体においてどのように合成されるのか詳細に研究されてきた一方1),大きな疎水領域をもつリポ多糖がいかにして親水的なペリプラズム空間を経由して内膜から細胞表層へと輸送されるのかは明らかになっていない.
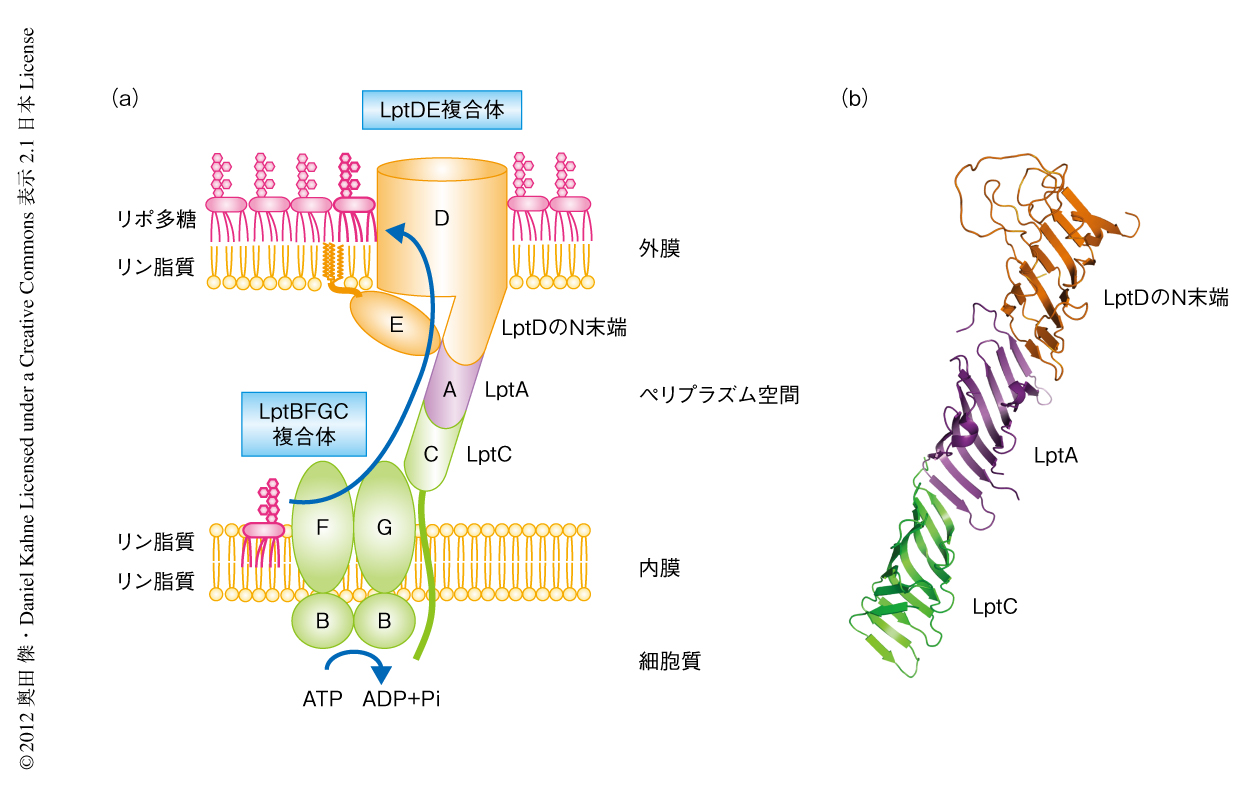
これまでに,大腸菌において生育に必須な7つのLpt(lipopolysaccharide transport)タンパク質が同定されており2)(図1),これらのタンパク質をそれぞれ欠損させた場合にはいずれも,内膜の外側にリポ多糖の蓄積が観察される3,4).このことから,Lptタンパク質は内膜の外側から細胞表層までのリポ多糖の輸送にかかわっていると考えられる5-8).この研究では,Lptタンパク質によるリポ多糖の輸送機構の解明をめざし,まずはこれまで観察されたことのない,in vivoにおけるリポ多糖とLptタンパク質との相互作用の解析からはじめた.
リポ多糖とLptタンパク質との相互作用を検出するためin vivo光架橋法を試みた.この手法は,終止コドンのひとつアンバーコドンに光架橋性をもつ非天然アミノ酸p-ベンゾニルフェニルアラニンを導入することのできるtRNAとアミノアシルtRNA合成酵素の組合せを生体において発現させることにより,任意の部位にこのp-ベンゾニルフェニルアラニンの導入された光架橋性のタンパク質を発現させることが可能である9).これまでこの手法によりさまざまなタンパク質間相互作用が解析されてきたが5,10,11),p-ベンゾニルフェニルアラニンによる架橋の標的は近くに存在するC-H結合とされているため,タンパク質である必要はなくリポ多糖も標的となりうる.
立体構造の明らかになっているLptCおよびLptAについて,それぞれ23種類および14種類のアンバー変異体を作製し,in vivoにおいて紫外線の照射に依存してリポ多糖と架橋される部位を調べた.その結果,LptCでは4種類の変異体,LptAでは5種類の変異体においてリポ多糖との架橋産物が検出された.LptC変異体の結晶構造において構造をとらない領域に変異をもつ1つを除き,リポ多糖との架橋産物が検出されたすべての変異体においてp-ベンゾニルフェニルアラニンの導入された残基の側鎖はβゼリーロール構造の内側をむいていたことから,LptCおよびLptAのゼリーロール構造の内側はリポ多糖の結合部位であり,リポ多糖はこのゼリーロール構造の内側をとおってペリプラズム空間を横断していることが示唆された.
LptCあるいはLptAとリポ多糖との架橋はほかのLptタンパク質に依存しているのか,つまり,検出された架橋産物はLptタンパク質による輸送途中のリポ多糖であるのか? この疑問を明らかにするため,Lptタンパク質の発現量を変化させる実験を行った.リポ多糖と架橋されたLptC変異体あるいはLptA変異体を単独で過剰発現させた場合と,それぞれをLptBFG複合体またはLptBFGC複合体とともに過剰発現させた場合において,リポ多糖との架橋効率を比較した.その結果,LptCについては1つの変異体においてLptBFG複合体と共発現させたとき,LptAについてはすべての変異体においてLptBFGC複合体と共発現させたときに,架橋効率は著しく上昇した.このことから,内膜からLptCへのリポ多糖の輸送にはLptBFG複合体が,LptAへの輸送にはLptBFGC複合体が必要であることが示され,検出された架橋産物はLptタンパク質に依存した輸送中間体であることが示唆された.LptBFG複合体との共発現によりリポ多糖との架橋効率が上昇したLptC変異体は,ペリプラズム領域のN末端側の構造をとらない領域に変異をもち,この領域はLptFまたはLptGと相互作用していると予想されている.複合体を形成した際には構造をとりリポ多糖との強い結合部位を形成しているのかもしれないが,この領域の役割については,複合体の結晶構造解析など今後より詳細な解析が必要である.
この実験により得られたもうひとつの重要な情報は,不完全なLpt複合体が機能することであった.いずれのLpt欠損株においても内膜の外側にリポ多糖の蓄積が観察されることから,あらゆるLptタンパク質の欠陥はリポ多糖の輸送機能を完全に壊してしまう,つまり,不完全なLpt複合体はまったく機能しないという可能性が考えられていた.しかし,外膜にあるLpt複合体とつながっていない不完全なLpt複合体を形成させたとき,リポ多糖は内膜の外側だけではなくLptCまたはLptAにも蓄積したことから,不完全なLpt複合体でもリポ多糖を内膜から引き抜きLptAまで輸送することは可能であると考えられた.このことは,リポ多糖の輸送は数段階に分けて解析することが可能であることを示唆しており,in vitroにおける実験を行うにあたり非常に重要な情報であった.
内膜に存在するLptBFG複合体はABCトランスポーターに属しており,リポ多糖の輸送にATPを必要とすることは想像にかたくない.しかし,リポ多糖はLpt複合体により内膜のペリプラズム側から細胞表層まで輸送されるため,どの段階においてATPの加水分解エネルギーが必要なのかは明らかでなかった.そこで,リポ多糖の内膜からLptCへの輸送にATPが必要なのかどうかを確かめた.in vivoにおいてLptBFG複合体と共発現させた際にリポ多糖との架橋効率が上昇したLptC変異体を過剰発現させ,外膜を壊したのち,浸透圧法によりATPを含む緩衝液を細胞質に導入した.この膜小胞を用いてLptC変異体とリポ多糖との架橋を観察した.その結果,LptC変異体を単独で過剰発現させた膜画分では架橋産物は検出されず,LptBFG複合体と共発現させた場合のみLptC変異体とリポ多糖との架橋産物が検出された.これは,in vivoにおいて観察された結果と同様であった.また,この架橋産物はATPの存在下で経時的に著しく増大したことから,リポ多糖はLptBFG複合体およびATPに依存してLptCへと輸送されると考えられた.
in vivoにおいてリポ多糖と架橋されたLptA変異体を精製し,さきの膜小胞にくわえてLptAへのリポ多糖の輸送を観察した.その結果,LptAへのリポ多糖の輸送にはLptBFGC複合体とATPが必要であることが示された.in vivoにおいてLptCと架橋されることが報告されているLptA変異体を用いて同様の実験を行うと,ATPに依存することなくLptCと架橋されたことから,ATP加水分解エネルギーはこれらタンパク質どうしの相互作用には関与せず,リポ多糖の輸送にのみ使われているようであった.LptBFG複合体またはLptCを単独で過剰発現させた膜画分からはLptAへのリポ多糖の輸送は起こらなかったため,リポ多糖はLptBFG複合体の助けを借りて内膜からLptCへ,そして,LptAへと輸送されると考えられた.
ATPの非存在下で作製された膜小胞においてLptCに少量のリポ多糖の蓄積が観察されたが,その画分にLptAをくわえてもリポ多糖はLptAへと輸送されなかった.このことから,LptCからLptAへのリポ多糖の輸送はATPに依存していると考えられたが,LptCに蓄積していたリポ多糖は微量であったことから明確ではなかった.この可能性を確かめるため,ATPの存在下で膜小胞を作製してまずはLptCにリポ多糖を十分に蓄積させ,そののち,LptAをくわえると同時にATPaseの阻害剤であるバナジン酸をくわえた.その結果,リポ多糖はLptCに蓄積したままLptAには輸送されず,LptCからLptAへのリポ多糖の輸送にはATP加水分解エネルギーを必要とすることが示された.
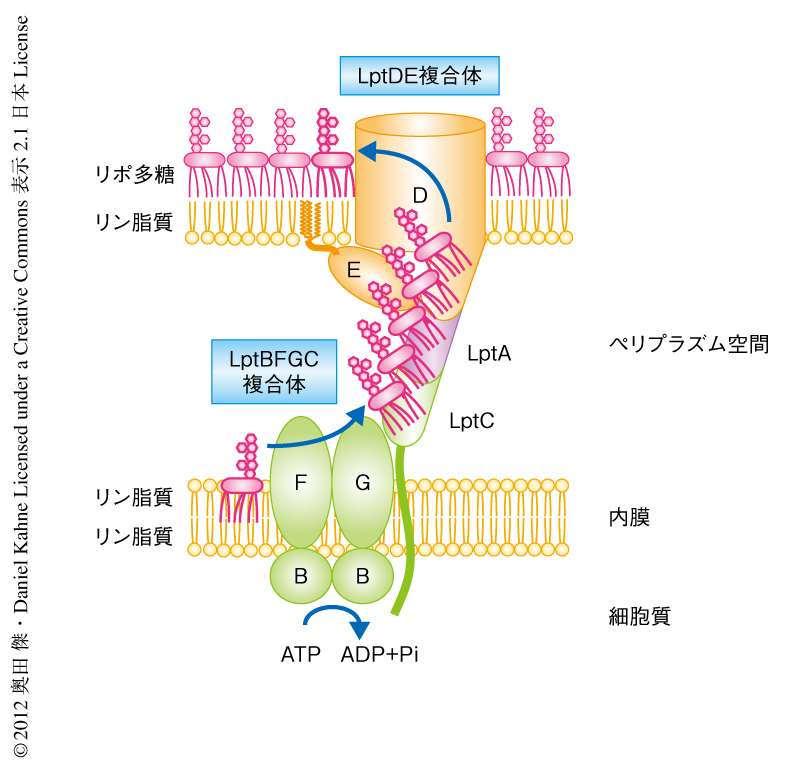
このことから,リポ多糖の内膜から細胞表層への輸送には,1段階目は内膜からLptCのペリプラズム領域,2段階目はLptCからLptAの,少なくとも2段階のATP加水分解が必要であることが明らかになった.また,バナジン酸をくわえない場合はLptCに蓄積されたリポ多糖は減少せず,さらにLptAにもリポ多糖は蓄積されていった.この結果から,Lptタンパク質のもつ基質結合部位はリポ多糖によりつねに満たされていることが示唆された.以上より,細胞質におけるATP加水分解がペリプラズム空間におけるリポ多糖の輸送に必要なエネルギーを供給し,リポ多糖はLptタンパク質で構成されたタンパク質の橋を互いに押し合うようリポ多糖結合部位のあいだをわたってペリプラズム空間を横断するというモデルが示唆された(図2).
輸送機構の詳細がまったくわかっていなかったLptシステムは,発見の当初,グラム陰性細菌におけるリポタンパク質の輸送機構であるLolシステムと似ているのではないかと予想されていた.Lolシステムにおいて,N末端が脂質により修飾されたリポタンパク質は内膜の外側から外膜の内側まで輸送される.ABCトランスポーターに属するLolCDE複合体はATP加水分解エネルギーを利用して内膜の外側からペリプラズムタンパク質LolAへとリポタンパク質を輸送する.そののち,LolAと一対一の水溶性の複合体を形成したリポタンパク質は,外膜にある受容体LolBへと受け渡され外膜の内側へと組み込まれる12).ここでLolAは分子シャペロンとしてはたらいており,リポタンパク質がひとたびLolAへと輸送されると,そのあとはエネルギーを必要とせず親和性の差を利用して目的地までたどり着く.
LptAはLolAのような分子シャペロンではないのか? Lptシステムにおいて内膜と外膜をつなぐタンパク質の複合体が形成される利点は何なのか? そんな疑問をもちながら研究を進めていたが,最後の実験でようやくその答えがみえた気がする.リポ多糖の目的地は外膜の外側,細胞表層であり,そこは数百万分子のリポ多糖でみたされている.リポ多糖はその濃度勾配にさからって輸送されなければならないが,ペリプラズム空間にはATPのようなエネルギー源は存在しない.この問題を解決するため,Lptタンパク質は内膜と外膜とをつなぐ複合体を形成し,内膜の内側に存在するLptBの発生するATP加水分解エネルギーを利用してリポ多糖を細胞表層にいたるまで押しつづける方法を選んだのではないだろうか.また,膜のあいだをつなぐ複合体を形成することは,リポ多糖のまちがった局在を防ぐ役割もはたすと考えられる.
この研究では,内膜からそこにあるLptBFGC複合体を介しペリプラズムにあるLptAに到達するまでのリポ多糖の輸送機構を解析することにより,全体の輸送機構を予想した.しかし,LptAよりあとの輸送機構についてはまだ何も示されていない.LptAからLptDへのリポ多糖の輸送にエネルギーは必要なのか? そののち,リポ多糖は外膜をどのように透過するのか,また,そこでのLptEの役割は? など,さまざまな疑問が残っている.Lptタンパク質がリポ多糖のどの部位とどのように相互作用しているのかを知ることも,Lptタンパク質を標的とした薬剤を探すうえで重要である.この研究はリポ多糖の輸送機構の一端を示したものの,解析はまだはじまったばかりである.今後のさらなる進展を期待したい.
略歴:2008年 東京大学大学院農学生命科学研究科 修了,同年 東京大学分子細胞生物学研究所 特任研究員,2009年 米国Harvard大学Postdoctoral Fellowを経て,2012年より同Research Associate.
研究テーマ:グラム陰性細菌の外膜の形成機構,および,それを標的とした新規の抗生物質の探索.
関心事:生体における反応はつねに理にかなっているのか?
Daniel Kahne
米国Harvard UniversityにてProfessor.
研究室URL:http://www.chem.harvard.edu/groups/kahne/home
© 2012 奥田 傑・Daniel Kahne Licensed under CC 表示 2.1 日本
(米国Harvard大学Department of Chemistry and Chemical Biology)
email:奥田 傑
DOI: 10.7875/first.author.2012.152
Cytoplasmic ATP hydrolysis powers transport of lipopolysaccharide across the periplasm in E. coli.
Suguru Okuda, Elizaveta Freinkman, Daniel Kahne
Science, 338, 1214-1217 (2012)
要 約
グラム陰性細菌の細胞表層はリポ多糖によりおおわれており,細胞は分裂するたびに数百万分子のリポ多糖を細胞表層へと輸送しなければならない.大腸菌においては,リポ多糖が細胞表層へと正しくたどりつくための内膜と外膜とをつなぐ7つのLptタンパク質が同定されている.これらLptタンパク質は内膜の外側からペリプラズム空間をへて細胞表層までリポ多糖を輸送すると考えられているが,これまで,リポ多糖とLptタンパク質との輸送中間体は検出されたことがなく,その輸送機構の解明は困難であった.そこで,筆者らは,リポ多糖とLptタンパク質とが結合した輸送中間体をin vivoにおいて観察する手法を確立した.また,この手法をin vitroにおける実験に応用したところ,Lptタンパク質を介した内膜から外膜へのリポ多糖の輸送には,少なくとも2段階でATP加水分解反応が必要であることが示唆された.この高いATP要求性はリポ多糖を濃度勾配にさからって細胞表層へと輸送するため必要であり,リポ多糖は互いに押し合いながら内膜と外膜とをつなぐLptタンパク質のリポ多糖結合部位のあいだを移動し,内膜から細胞表層へ到達すると推測された.
はじめに
グラム陰性細菌には,リン脂質の二重層からなる細胞質膜(内膜)の外側に,内側がリン脂質,外側がリポ多糖とよばれる糖脂質からなる非対称な脂質二重層(外膜)が存在する.このリポ多糖層により,グラム陰性細菌は過酷な環境あるいは多くの抗生物質の存在のもとでも生存することが可能になっている.そのため,グラム陰性細菌におけるリポ多糖の生合成機構の解明は,新たな抗生物質の標的を同定するという医学的にも重要な意味をもつ.この複雑な構造をもつリポ多糖が生体においてどのように合成されるのか詳細に研究されてきた一方1),大きな疎水領域をもつリポ多糖がいかにして親水的なペリプラズム空間を経由して内膜から細胞表層へと輸送されるのかは明らかになっていない.
これまでに,大腸菌において生育に必須な7つのLpt(lipopolysaccharide transport)タンパク質が同定されており2)(図1),これらのタンパク質をそれぞれ欠損させた場合にはいずれも,内膜の外側にリポ多糖の蓄積が観察される3,4).このことから,Lptタンパク質は内膜の外側から細胞表層までのリポ多糖の輸送にかかわっていると考えられる5-8).この研究では,Lptタンパク質によるリポ多糖の輸送機構の解明をめざし,まずはこれまで観察されたことのない,in vivoにおけるリポ多糖とLptタンパク質との相互作用の解析からはじめた.
1.リポ多糖はin vivoにおいてLptCおよびLptAのもつゼリーロール構造の内側と相互作用する
リポ多糖とLptタンパク質との相互作用を検出するためin vivo光架橋法を試みた.この手法は,終止コドンのひとつアンバーコドンに光架橋性をもつ非天然アミノ酸p-ベンゾニルフェニルアラニンを導入することのできるtRNAとアミノアシルtRNA合成酵素の組合せを生体において発現させることにより,任意の部位にこのp-ベンゾニルフェニルアラニンの導入された光架橋性のタンパク質を発現させることが可能である9).これまでこの手法によりさまざまなタンパク質間相互作用が解析されてきたが5,10,11),p-ベンゾニルフェニルアラニンによる架橋の標的は近くに存在するC-H結合とされているため,タンパク質である必要はなくリポ多糖も標的となりうる.
立体構造の明らかになっているLptCおよびLptAについて,それぞれ23種類および14種類のアンバー変異体を作製し,in vivoにおいて紫外線の照射に依存してリポ多糖と架橋される部位を調べた.その結果,LptCでは4種類の変異体,LptAでは5種類の変異体においてリポ多糖との架橋産物が検出された.LptC変異体の結晶構造において構造をとらない領域に変異をもつ1つを除き,リポ多糖との架橋産物が検出されたすべての変異体においてp-ベンゾニルフェニルアラニンの導入された残基の側鎖はβゼリーロール構造の内側をむいていたことから,LptCおよびLptAのゼリーロール構造の内側はリポ多糖の結合部位であり,リポ多糖はこのゼリーロール構造の内側をとおってペリプラズム空間を横断していることが示唆された.
2.リポ多糖は内膜のLptタンパク質に依存的にLptCおよびLptAに蓄積する
LptCあるいはLptAとリポ多糖との架橋はほかのLptタンパク質に依存しているのか,つまり,検出された架橋産物はLptタンパク質による輸送途中のリポ多糖であるのか? この疑問を明らかにするため,Lptタンパク質の発現量を変化させる実験を行った.リポ多糖と架橋されたLptC変異体あるいはLptA変異体を単独で過剰発現させた場合と,それぞれをLptBFG複合体またはLptBFGC複合体とともに過剰発現させた場合において,リポ多糖との架橋効率を比較した.その結果,LptCについては1つの変異体においてLptBFG複合体と共発現させたとき,LptAについてはすべての変異体においてLptBFGC複合体と共発現させたときに,架橋効率は著しく上昇した.このことから,内膜からLptCへのリポ多糖の輸送にはLptBFG複合体が,LptAへの輸送にはLptBFGC複合体が必要であることが示され,検出された架橋産物はLptタンパク質に依存した輸送中間体であることが示唆された.LptBFG複合体との共発現によりリポ多糖との架橋効率が上昇したLptC変異体は,ペリプラズム領域のN末端側の構造をとらない領域に変異をもち,この領域はLptFまたはLptGと相互作用していると予想されている.複合体を形成した際には構造をとりリポ多糖との強い結合部位を形成しているのかもしれないが,この領域の役割については,複合体の結晶構造解析など今後より詳細な解析が必要である.
この実験により得られたもうひとつの重要な情報は,不完全なLpt複合体が機能することであった.いずれのLpt欠損株においても内膜の外側にリポ多糖の蓄積が観察されることから,あらゆるLptタンパク質の欠陥はリポ多糖の輸送機能を完全に壊してしまう,つまり,不完全なLpt複合体はまったく機能しないという可能性が考えられていた.しかし,外膜にあるLpt複合体とつながっていない不完全なLpt複合体を形成させたとき,リポ多糖は内膜の外側だけではなくLptCまたはLptAにも蓄積したことから,不完全なLpt複合体でもリポ多糖を内膜から引き抜きLptAまで輸送することは可能であると考えられた.このことは,リポ多糖の輸送は数段階に分けて解析することが可能であることを示唆しており,in vitroにおける実験を行うにあたり非常に重要な情報であった.
3.内膜からLptタンパク質へのATPに依存性のリポ多糖の輸送をin vitroにおいて再現した
内膜に存在するLptBFG複合体はABCトランスポーターに属しており,リポ多糖の輸送にATPを必要とすることは想像にかたくない.しかし,リポ多糖はLpt複合体により内膜のペリプラズム側から細胞表層まで輸送されるため,どの段階においてATPの加水分解エネルギーが必要なのかは明らかでなかった.そこで,リポ多糖の内膜からLptCへの輸送にATPが必要なのかどうかを確かめた.in vivoにおいてLptBFG複合体と共発現させた際にリポ多糖との架橋効率が上昇したLptC変異体を過剰発現させ,外膜を壊したのち,浸透圧法によりATPを含む緩衝液を細胞質に導入した.この膜小胞を用いてLptC変異体とリポ多糖との架橋を観察した.その結果,LptC変異体を単独で過剰発現させた膜画分では架橋産物は検出されず,LptBFG複合体と共発現させた場合のみLptC変異体とリポ多糖との架橋産物が検出された.これは,in vivoにおいて観察された結果と同様であった.また,この架橋産物はATPの存在下で経時的に著しく増大したことから,リポ多糖はLptBFG複合体およびATPに依存してLptCへと輸送されると考えられた.
in vivoにおいてリポ多糖と架橋されたLptA変異体を精製し,さきの膜小胞にくわえてLptAへのリポ多糖の輸送を観察した.その結果,LptAへのリポ多糖の輸送にはLptBFGC複合体とATPが必要であることが示された.in vivoにおいてLptCと架橋されることが報告されているLptA変異体を用いて同様の実験を行うと,ATPに依存することなくLptCと架橋されたことから,ATP加水分解エネルギーはこれらタンパク質どうしの相互作用には関与せず,リポ多糖の輸送にのみ使われているようであった.LptBFG複合体またはLptCを単独で過剰発現させた膜画分からはLptAへのリポ多糖の輸送は起こらなかったため,リポ多糖はLptBFG複合体の助けを借りて内膜からLptCへ,そして,LptAへと輸送されると考えられた.
4.内膜から細胞表層へのリポ多糖の輸送には複数回のATP加水分解が必要である
ATPの非存在下で作製された膜小胞においてLptCに少量のリポ多糖の蓄積が観察されたが,その画分にLptAをくわえてもリポ多糖はLptAへと輸送されなかった.このことから,LptCからLptAへのリポ多糖の輸送はATPに依存していると考えられたが,LptCに蓄積していたリポ多糖は微量であったことから明確ではなかった.この可能性を確かめるため,ATPの存在下で膜小胞を作製してまずはLptCにリポ多糖を十分に蓄積させ,そののち,LptAをくわえると同時にATPaseの阻害剤であるバナジン酸をくわえた.その結果,リポ多糖はLptCに蓄積したままLptAには輸送されず,LptCからLptAへのリポ多糖の輸送にはATP加水分解エネルギーを必要とすることが示された.
このことから,リポ多糖の内膜から細胞表層への輸送には,1段階目は内膜からLptCのペリプラズム領域,2段階目はLptCからLptAの,少なくとも2段階のATP加水分解が必要であることが明らかになった.また,バナジン酸をくわえない場合はLptCに蓄積されたリポ多糖は減少せず,さらにLptAにもリポ多糖は蓄積されていった.この結果から,Lptタンパク質のもつ基質結合部位はリポ多糖によりつねに満たされていることが示唆された.以上より,細胞質におけるATP加水分解がペリプラズム空間におけるリポ多糖の輸送に必要なエネルギーを供給し,リポ多糖はLptタンパク質で構成されたタンパク質の橋を互いに押し合うようリポ多糖結合部位のあいだをわたってペリプラズム空間を横断するというモデルが示唆された(図2).
おわりに
輸送機構の詳細がまったくわかっていなかったLptシステムは,発見の当初,グラム陰性細菌におけるリポタンパク質の輸送機構であるLolシステムと似ているのではないかと予想されていた.Lolシステムにおいて,N末端が脂質により修飾されたリポタンパク質は内膜の外側から外膜の内側まで輸送される.ABCトランスポーターに属するLolCDE複合体はATP加水分解エネルギーを利用して内膜の外側からペリプラズムタンパク質LolAへとリポタンパク質を輸送する.そののち,LolAと一対一の水溶性の複合体を形成したリポタンパク質は,外膜にある受容体LolBへと受け渡され外膜の内側へと組み込まれる12).ここでLolAは分子シャペロンとしてはたらいており,リポタンパク質がひとたびLolAへと輸送されると,そのあとはエネルギーを必要とせず親和性の差を利用して目的地までたどり着く.
LptAはLolAのような分子シャペロンではないのか? Lptシステムにおいて内膜と外膜をつなぐタンパク質の複合体が形成される利点は何なのか? そんな疑問をもちながら研究を進めていたが,最後の実験でようやくその答えがみえた気がする.リポ多糖の目的地は外膜の外側,細胞表層であり,そこは数百万分子のリポ多糖でみたされている.リポ多糖はその濃度勾配にさからって輸送されなければならないが,ペリプラズム空間にはATPのようなエネルギー源は存在しない.この問題を解決するため,Lptタンパク質は内膜と外膜とをつなぐ複合体を形成し,内膜の内側に存在するLptBの発生するATP加水分解エネルギーを利用してリポ多糖を細胞表層にいたるまで押しつづける方法を選んだのではないだろうか.また,膜のあいだをつなぐ複合体を形成することは,リポ多糖のまちがった局在を防ぐ役割もはたすと考えられる.
この研究では,内膜からそこにあるLptBFGC複合体を介しペリプラズムにあるLptAに到達するまでのリポ多糖の輸送機構を解析することにより,全体の輸送機構を予想した.しかし,LptAよりあとの輸送機構についてはまだ何も示されていない.LptAからLptDへのリポ多糖の輸送にエネルギーは必要なのか? そののち,リポ多糖は外膜をどのように透過するのか,また,そこでのLptEの役割は? など,さまざまな疑問が残っている.Lptタンパク質がリポ多糖のどの部位とどのように相互作用しているのかを知ることも,Lptタンパク質を標的とした薬剤を探すうえで重要である.この研究はリポ多糖の輸送機構の一端を示したものの,解析はまだはじまったばかりである.今後のさらなる進展を期待したい.
文 献
- Raetz, C. R. & Whitfield, C.: Lipopolysaccharide endotoxins. Annu. Rev. Biochem., 71, 635-700 (2002)[PubMed]
- Ruiz, N., Kahne, D. & Silhavy, T. J.: Transport of lipopolysaccharide across the cell envelope: the long road of discovery. Nat. Rev. Microbiol., 7, 677-683 (2009)[PubMed]
- Ruiz, N., Gronenberg, L. S., Kahne, D. et al.: Identification of two inner-membrane proteins required for the transport of lipopolysaccharide to the outer membrane of Escherichia coli. Proc. Natl. Acad. Sci. USA, 105, 5537-5542 (2008)[PubMed]
- Sperandeo, P., Lau, F. K., Carpentieri, A. et al.: Functional analysis of the protein machinery required for transport of lipopolysaccharide to the outer membrane of Escherichia coli. J. Bacteriol., 190, 4460-4469 (2008)[PubMed]
- Freinkman, E., Okuda, S., Ruiz, N. et al.: Regulated assembly of the transenvelope protein complex required for lipopolysaccharide export. Biochemistry, 51, 4800-4806 (2012)[PubMed]
- Chng, S. S., Gronenberg, L. S. & Kahne, D.: Proteins required for lipopolysaccharide assembly in Escherichia coli form a transenvelope complex. Biochemistry, 49, 4565-4567 (2010)[PubMed]
- Tran, A. X., Dong, C. & Whitfield, C.: Structure and functional analysis of LptC, a conserved membrane protein involved in the lipopolysaccharide export pathway in Escherichia coli. J. Biol. Chem., 285, 33529-33539 (2010)[PubMed]
- Suits, M. D., Sperandeo, P., Deho, G. et al.: Novel structure of the conserved gram-negative lipopolysaccharide transport protein A and mutagenesis analysis. J. Mol. Biol., 380, 476-488 (2008)[PubMed]
- Liu, C. C. & Schultz, P. G.: Adding new chemistries to the genetic code. Annu. Rev. Biochem., 79, 413-444 (2010)[PubMed]
- Okuda, S. & Tokuda, H.: Model of mouth-to-mouth transfer of bacterial lipoproteins through inner membrane LolC, periplasmic LolA, and outer membrane LolB. Proc. Natl. Acad. Sci. USA, 106, 5877-5882 (2009)[PubMed]
- Mori, H. & Ito K.: Different modes of SecY-SecA interactions revealed by site-directed in vivo photo-cross-linking. Proc. Natl. Acad. Sci. USA, 103, 16159-16164 (2006)[PubMed]
- Okuda, S. & Tokuda, H.: Lipoproteins sorting in bacteria. Annu. Rev. Microbiol., 65, 239-259 (2011)[PubMed]
著者プロフィール
略歴:2008年 東京大学大学院農学生命科学研究科 修了,同年 東京大学分子細胞生物学研究所 特任研究員,2009年 米国Harvard大学Postdoctoral Fellowを経て,2012年より同Research Associate.
研究テーマ:グラム陰性細菌の外膜の形成機構,および,それを標的とした新規の抗生物質の探索.
関心事:生体における反応はつねに理にかなっているのか?
Daniel Kahne
米国Harvard UniversityにてProfessor.
研究室URL:http://www.chem.harvard.edu/groups/kahne/home
© 2012 奥田 傑・Daniel Kahne Licensed under CC 表示 2.1 日本