凝集したタンパク質を巻き戻す分子シャペロンClpB/Hsp104による脱凝集の制御機構
小口友樹・Bernd Bukau
(ドイツHeidelberg大学Zentrum fuer Molekulare Biologie)
email:小口友樹
DOI: 10.7875/first.author.2012.146
A tightly regulated molecular toggle controls AAA+ disaggregase.
Yuki Oguchi, Eva Kummer, Fabian Seyffer, Mykhaylo Berynskyy, Benjamin Anstett, Regina Zahn, Rebecca C. Wade, Axel Mogk, Bernd Bukau
Nature Structural & Molecular Biology, 19, 1338-1346 (2012)
生体においてさまざまなストレスにより生じた凝集タンパク質は分子シャペロンClpB/Hsp104とHsp70により活性ある状態へと修復される.ClpB/Hsp104はMドメインとよばれる活性に必須な独自のドメインをもつが,これまでその役割は明らかではなかった.今回,筆者らは,重水素交換反応および生化学的な手法を組み合わせた解析により,長いあいだ明らかにされていなかったClpB/Hsp104六量体構造におけるMドメインの局在を決定し,さらに,MドメインがClpB/Hsp104の脱凝集活性を制御するスイッチとして機能していることを示した.また,Hsp70はClpB/Hsp104を凝集したタンパク質へとリクルートするとともに,ClpB/Hsp104においてMドメインによる抑制を解除し,脱凝集反応を制御していることが示された.これらのことより,ClpB/Hsp104とHsp70からなる脱凝集系に備えられた厳密かつ効率的な制御機構が明らかになった.
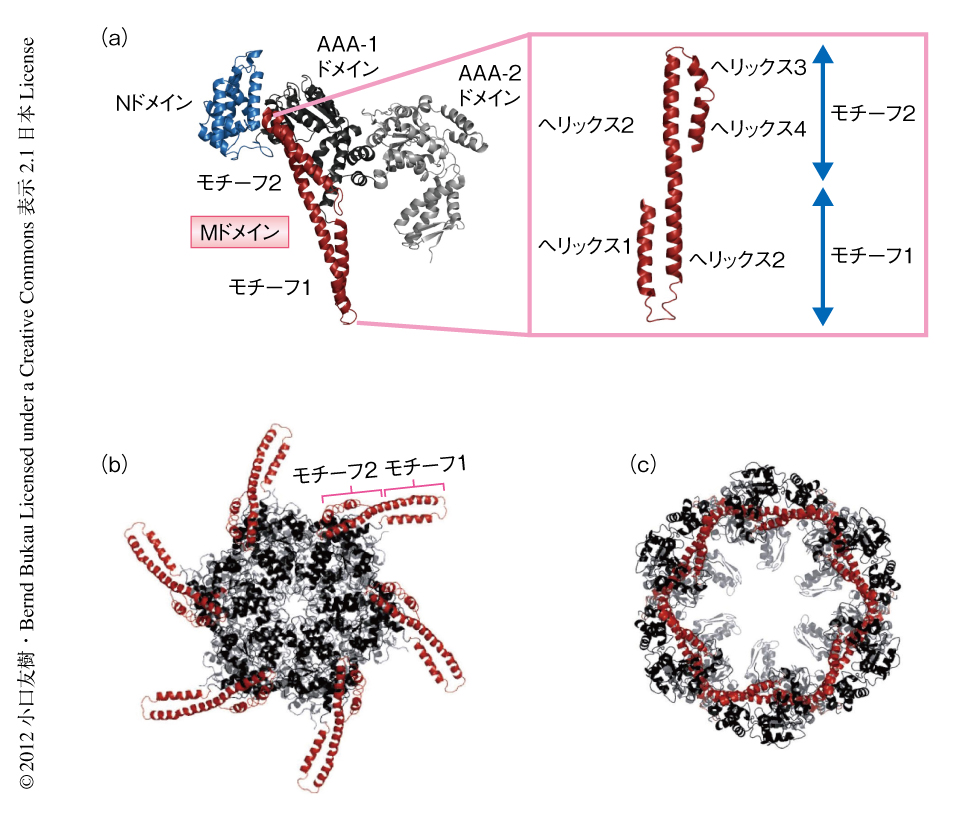
生体においてタンパク質はさまざまなストレスや環境変化によりミスフォールディングし,さらには凝集してしまう.変性したタンパク質が凝集すると正常なタンパク質をも巻き込んで大きな凝集体を形成し,細胞にさまざまな損傷をあたえる.このようなタンパク質の凝集は組換えタンパク質の発現における障害だけでなく,老化現象ひいてはアルツハイマー病など神経変性疾患にも深くかかわっている.ゆで卵を生卵にもどすのがむずかしいように,タンパク質はいったん凝集してしまうと天然のフォールディング状態へともどすことはむずかしい.しかし,原核生物はClpB,出芽酵母はそのホモログであるHsp104をもち,これら分子シャペロンはATPを加水分解したときに生じるエネルギーを利用し,からみあい凝集したタンパク質をHsp70と協力してひも解き天然のフォールディング状態へともどすことができる.このClpB/Hsp104はAAA+タンパク質とよばれるタンパク質ファミリーに属することが知られており,AAA+タンパク質は共通して六量体からなるリングを形成し,さまざまな基質をATP加水分解に依存的に中央の孔に引き込むことにより基質の分解や脱凝集を行う1).これまで,ClpB単量体の結晶構造解析がなされており2),ClpBはAAA-1ドメインとAAA-2ドメインの2つのATPaseドメインをもち,そのあいだにMドメインとよばれる脱凝集活性に必須な独自のドメインをもつことが明らかにされている(図1a).Mドメインはコイルドコイル構造を形成し,さらにモチーフ1とモチーフ2とに分割されるが,それぞれの役割は明らかになっていない.
これまで,ClpB単量体の構造は明らかにされているが,近年まで,実際に脱凝集を行うClpB/Hsp104六量体の構造についての知見は得られていなかった.しかしここ数年,2つの異なるグループが,ClpB/Hsp104六量体の構造についてクライオ電子顕微鏡を用いた構造解析を精力的に進め,それぞれ,まったく異なった六量体モデルを提唱している3-6).片方の六量体モデルではAAA-1ドメインとAAA-2ドメインはコンパクトなリングを形成しておりMドメインはプロペラのように溶媒に突き出ている3,6)(図1b).もう一方の六量体モデルではAAA-1ドメインとAAA-2ドメインは籠のように内部に大きなキャビティを含んだリングを形成しMドメインはそれぞれのサブユニットのあいだに位置していて大部分は内部に埋まっている4,5)(図1c).この2つのモデルのどちらの構造が正しいのか(もしくは,両者とも正しくないのか),また,Mドメインは外に突き出ているのか内部に埋まっているのかについて,これまで5年以上にわたり大きな論争がくり広げられてきたが,両者の見解は平行線をたどっていた.くわえて,両者の知見はClpB/Hsp104の構造に関してのみであり,Mドメインが脱凝集反応においてどのような役割を担うのかについてほとんど知見は得られていなかった.そこで,筆者らは,これらの問題を明らかにするため,重水素交換反応と生化学的な手法とを組み合わせてClpB/Hsp104六量体とMドメインの構造解析を行い,さらに,構造情報をもとにした生化学的な機能解析によりClpB/Hsp104による脱凝集反応の分子機構を明らかにした.
これまで長年にわたりClpB六量体構造の結晶構造解析が試みられてきたが,この六量体はおよそ570 kDaと非常に大きく,また,さまざまなフレキシブルな部位が存在するためか成功にはいたっていない.そこで,重水素交換反応と質量分析とを組み合わせたClpB六量体の構造ダイナミクスの解析を試みた.重水素交換反応を用いた解析では,重水素を用いて調製した緩衝液において目的とするタンパク質をインキュベーションした際に生じる,タンパク質主鎖のもつアミド水素と緩衝液の重水素との交換を観察することができる.重水素緩衝液は通常の緩衝液を純水(H2O)の代わりに重水素水(D2O)を用いて調製しただけのものなので,重水素緩衝液のタンパク質は天然の構造を保っている.一定時間の交換反応を行い,反応を停止させたのち,プロテアーゼによりタンパク質を切断し5~15アミノ酸残基からなるペプチド断片とする.これらのペプチド断片をHPLCにより分離し,それぞれのペプチド断片に組み込まれた重水素の数を質量分析により解析する.それぞれのペプチド断片における重水素への交換率は周囲の構造を反映したものであり,たとえば,相互作用にかかわっていたり内部に埋もれていたりしたようなペプチド断片の重水素交換率は低く,溶媒に露出していたりフレキシブルな部位にあったりしたペプチド断片の重水素交換率は高い.このような原理のもと,すべてのペプチド断片の重水素交換率の情報を集約することにより,目的とするタンパク質の構造ダイナミクスが解析できる.
ClpB単量体,ClpB六量体,ClpB六量体にATPの非加水分解アナログであるATPγSをくわえた条件において,この重水素交換反応を用いた解析を行うことにより,六量体化,そして,さらなるATPとの結合のときに起こる構造変化を解析した.その結果,ClpB六量体はコンパクトなリングを形成しているが,MドメインはAAA-1ドメインからなるリングとタイトに相互作用していることが明らかになった.さらなる生化学的な解析により,Mドメインのもつモチーフ1は六量体においてとなりのサブユニットのAAA-1ドメインと相互作用し,モチーフ2は同一のサブユニットのAAA-1ドメインと相互作用していることが明らかになった.これらの結果は,これまでクライオ電子顕微鏡解析により提唱されていた2つのClpB/Hsp104六量体モデルとは大きく異なっており,新たな六量体モデルが提唱された.これまでに提唱されたClpB/Hsp104六量体モデルのうち,生化学的な手法による詳細な検証が行われたのは今回がはじめてであった.
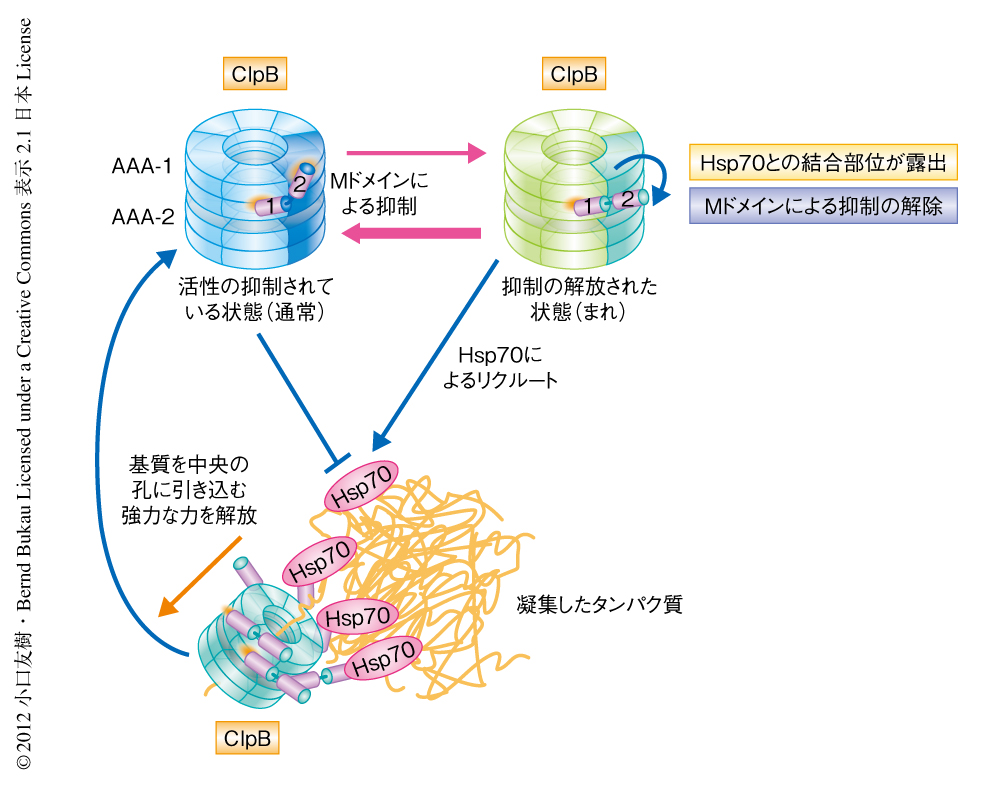
脱凝集反応に必須であるMドメインのClpB六量体における局在は明らかになったが,それでは,Mドメインは実際にどのような機能をもつのだろうか? この問いに答えるため,Mドメインに存在する保存された残基の変異体シリーズを作製した.これらClpB変異体の脱凝集活性を調べたところ,不活性になる変異体と,活性が非常に高くなる変異体とに分類された.生化学的な手法および重水素交換反応により解析したところ,不活性となる変異体は共通して,ATPase活性が低い,基質を中央の孔に引き込む力が弱い,MドメインとAAA-1ドメインとの相互作用がさらに強まっている,ことがわかった.一方,活性の高くなった変異体は,ATPase活性が基質の存在のもと著しく上昇する,基質を中央の孔に引き込む力が非常に高い,MドメインとAAA-1ドメインとの相互作用が失われている,ことがわかった.これらの結果より,MドメインはAAA-1ドメインと相互作用することによりClpB六量体のもつATPase活性と基質を中央の孔に引き込む力を抑制していることが示唆された.興味深いことに,ClpBを不活性にする変異と活性化させる変異とをかけあわせたものは,野生型のClpBとほぼ同等の性質を示した.このことから,ClpBは活性の抑制されている状態と抑制の解放された状態とのあいだで平衡状態にあり,通常はMドメインによりClpBの活性化が抑制されていると考えられた(図2).抑制の解放された状態においてClpBのATPase活性は基質の存在のもと著しく上昇したことから,ClpBの完全な活性化においては,MドメインとAAA-1ドメインとの相互作用の解除と,基質のClpBへの結合の,少なくとも2つの段階があると考えられた.
ここで,脱凝集活性のすぐれるClpBがなぜ進化の過程で選抜されてこなかったのかという疑問が生じた.しかし,脱凝集活性の上昇したClpBは大腸菌に発現させると生育阻害を示した.これより,強すぎる脱凝集活性をもつClpBは細胞においておそらく天然にフォールディングしたタンパク質すらもひも解いてしまい,その結果,そのタンパク質の機能をも喪失させてしまうことが考えられた.通常,凝集したタンパク質をひも解くのは困難だが,それを可能にするためClpBは進化の過程で強大な力をもつ分子シャペロンとしてつくりあげられてきたのだろう.しかし同時に,そのような大きな力は細胞にとり大きな危険を含むため,ClpBにはMドメインのような活性制御装置が備えられたのだと思われた.
ClpBは細胞において通常は活性の抑制されている状態として存在すると考えられたが,ClpBの活性化にはまず第1段階としてMドメインとAAA-1ドメインとの相互作用が解除されなければならない.しかし,むやみにClpBを活性化させることは細胞にとり危険である.それでは,実際に細胞においてMドメインによるClpBの活性はどのように制御されているのであろうか?
筆者らによりこの論文と同時に発表された論文における報告7) ともあわせ,生化学的な解析により,脱凝集反応の補因子としてはたらく分子シャペロンHsp70がClpBのMドメインに直接に結合することでAAA-1ドメインとの相互作用を断ち切り,ClpBを活性化していることが示唆された.Hsp70はClpBにさきんじて凝集タンパク質に結合しClpBをリクルートすることがすでに明らかになっており8,9),Hsp70によるClpBの凝集タンパク質へのターゲティングと活性化は共役した反応であることが考えられた.また,活性化には1つのClpB六量体に対し複数のHsp70が必要であることも示された.これは,凝集体の表面においていくつものHsp70が結合している状態に近いと考えられ,幅広い基質特異性をもつHsp70が凝集体以外の基質と相互作用している場合,ClpBがむやみに活性化されないようにする制御機構のひとつと思われた.このように,ClpBの脱凝集活性はHsp70によりMドメインを介し制御されているため,ClpBの活性化は非常にピンポイントで行われ,ClpBによる脱凝集反応は効率的にかつ安全に遂行されていると考えられた(図2).
ClpB/Hsp104六量体モデルは多くのグループを巻き込み大きな論争をひき起こしてきた.しかし,今回の筆者らによる重水素交換反応と生化学的な手法とを組み合わせた解析により,ClpB六量体のおおよその構造が明らかにされたとともに,議論の中心であったMドメインの局在とその機能についても詳細な解析がなされた.また,ClpBのMドメインによる脱凝集活性の制御機構は非常に精巧なものであることが明らかになり,ClpB/Hsp104とHsp70による脱凝集機構だけでなく,生体においてタンパク質複合体がどのように効率的かつ安全に自らの役割を遂行しているかについても大きな知見がもたらされたともの思われる.また,筆者らは,ClpB六量体とともにHsp104六量体の構造解析も行ったが,得られた結果はClpB六量体とHsp104六量体とで同じであった.これまでに,筆者が所属するグループにより,出芽酵母においてHsp104によるプリオンの分断はHsp70に依存的に行われていることが明らかにされており9),このプリオンを分断する機構もHsp70によるHsp104の活性化を介し同じような機構で行われていることが考えられ,これからのプリオンあるいはアミロイドに関する研究においても有用な知見になると期待している.
略歴:2008年 東京大学大学院農学生命科学研究科 修了,同年よりドイツHeidelberg大学 博士研究員.
研究テーマ:タンパク質の構造および機能とその分子機構.
抱負:生体においてタンパク質のもつさまざまなすぐれた分子機構を明らかにし,その分子機構を人類が応用できるようにしたい.
Bernd Bukau
ドイツHeidelberg大学Zentrum fuer Molekulare BiologieにてDirector.
研究室URL:http://www.zmbh.uni-heidelberg.de/bukau/default.shtml
© 2012 小口友樹・Bernd Bukau Licensed under CC 表示 2.1 日本
(ドイツHeidelberg大学Zentrum fuer Molekulare Biologie)
email:小口友樹
DOI: 10.7875/first.author.2012.146
A tightly regulated molecular toggle controls AAA+ disaggregase.
Yuki Oguchi, Eva Kummer, Fabian Seyffer, Mykhaylo Berynskyy, Benjamin Anstett, Regina Zahn, Rebecca C. Wade, Axel Mogk, Bernd Bukau
Nature Structural & Molecular Biology, 19, 1338-1346 (2012)
要 約
生体においてさまざまなストレスにより生じた凝集タンパク質は分子シャペロンClpB/Hsp104とHsp70により活性ある状態へと修復される.ClpB/Hsp104はMドメインとよばれる活性に必須な独自のドメインをもつが,これまでその役割は明らかではなかった.今回,筆者らは,重水素交換反応および生化学的な手法を組み合わせた解析により,長いあいだ明らかにされていなかったClpB/Hsp104六量体構造におけるMドメインの局在を決定し,さらに,MドメインがClpB/Hsp104の脱凝集活性を制御するスイッチとして機能していることを示した.また,Hsp70はClpB/Hsp104を凝集したタンパク質へとリクルートするとともに,ClpB/Hsp104においてMドメインによる抑制を解除し,脱凝集反応を制御していることが示された.これらのことより,ClpB/Hsp104とHsp70からなる脱凝集系に備えられた厳密かつ効率的な制御機構が明らかになった.
はじめに
生体においてタンパク質はさまざまなストレスや環境変化によりミスフォールディングし,さらには凝集してしまう.変性したタンパク質が凝集すると正常なタンパク質をも巻き込んで大きな凝集体を形成し,細胞にさまざまな損傷をあたえる.このようなタンパク質の凝集は組換えタンパク質の発現における障害だけでなく,老化現象ひいてはアルツハイマー病など神経変性疾患にも深くかかわっている.ゆで卵を生卵にもどすのがむずかしいように,タンパク質はいったん凝集してしまうと天然のフォールディング状態へともどすことはむずかしい.しかし,原核生物はClpB,出芽酵母はそのホモログであるHsp104をもち,これら分子シャペロンはATPを加水分解したときに生じるエネルギーを利用し,からみあい凝集したタンパク質をHsp70と協力してひも解き天然のフォールディング状態へともどすことができる.このClpB/Hsp104はAAA+タンパク質とよばれるタンパク質ファミリーに属することが知られており,AAA+タンパク質は共通して六量体からなるリングを形成し,さまざまな基質をATP加水分解に依存的に中央の孔に引き込むことにより基質の分解や脱凝集を行う1).これまで,ClpB単量体の結晶構造解析がなされており2),ClpBはAAA-1ドメインとAAA-2ドメインの2つのATPaseドメインをもち,そのあいだにMドメインとよばれる脱凝集活性に必須な独自のドメインをもつことが明らかにされている(図1a).Mドメインはコイルドコイル構造を形成し,さらにモチーフ1とモチーフ2とに分割されるが,それぞれの役割は明らかになっていない.
これまで,ClpB単量体の構造は明らかにされているが,近年まで,実際に脱凝集を行うClpB/Hsp104六量体の構造についての知見は得られていなかった.しかしここ数年,2つの異なるグループが,ClpB/Hsp104六量体の構造についてクライオ電子顕微鏡を用いた構造解析を精力的に進め,それぞれ,まったく異なった六量体モデルを提唱している3-6).片方の六量体モデルではAAA-1ドメインとAAA-2ドメインはコンパクトなリングを形成しておりMドメインはプロペラのように溶媒に突き出ている3,6)(図1b).もう一方の六量体モデルではAAA-1ドメインとAAA-2ドメインは籠のように内部に大きなキャビティを含んだリングを形成しMドメインはそれぞれのサブユニットのあいだに位置していて大部分は内部に埋まっている4,5)(図1c).この2つのモデルのどちらの構造が正しいのか(もしくは,両者とも正しくないのか),また,Mドメインは外に突き出ているのか内部に埋まっているのかについて,これまで5年以上にわたり大きな論争がくり広げられてきたが,両者の見解は平行線をたどっていた.くわえて,両者の知見はClpB/Hsp104の構造に関してのみであり,Mドメインが脱凝集反応においてどのような役割を担うのかについてほとんど知見は得られていなかった.そこで,筆者らは,これらの問題を明らかにするため,重水素交換反応と生化学的な手法とを組み合わせてClpB/Hsp104六量体とMドメインの構造解析を行い,さらに,構造情報をもとにした生化学的な機能解析によりClpB/Hsp104による脱凝集反応の分子機構を明らかにした.
1.重水素交換反応を用いた構造ダイナミクスの解析
これまで長年にわたりClpB六量体構造の結晶構造解析が試みられてきたが,この六量体はおよそ570 kDaと非常に大きく,また,さまざまなフレキシブルな部位が存在するためか成功にはいたっていない.そこで,重水素交換反応と質量分析とを組み合わせたClpB六量体の構造ダイナミクスの解析を試みた.重水素交換反応を用いた解析では,重水素を用いて調製した緩衝液において目的とするタンパク質をインキュベーションした際に生じる,タンパク質主鎖のもつアミド水素と緩衝液の重水素との交換を観察することができる.重水素緩衝液は通常の緩衝液を純水(H2O)の代わりに重水素水(D2O)を用いて調製しただけのものなので,重水素緩衝液のタンパク質は天然の構造を保っている.一定時間の交換反応を行い,反応を停止させたのち,プロテアーゼによりタンパク質を切断し5~15アミノ酸残基からなるペプチド断片とする.これらのペプチド断片をHPLCにより分離し,それぞれのペプチド断片に組み込まれた重水素の数を質量分析により解析する.それぞれのペプチド断片における重水素への交換率は周囲の構造を反映したものであり,たとえば,相互作用にかかわっていたり内部に埋もれていたりしたようなペプチド断片の重水素交換率は低く,溶媒に露出していたりフレキシブルな部位にあったりしたペプチド断片の重水素交換率は高い.このような原理のもと,すべてのペプチド断片の重水素交換率の情報を集約することにより,目的とするタンパク質の構造ダイナミクスが解析できる.
2.ClpB六量体の構造ダイナミクス
ClpB単量体,ClpB六量体,ClpB六量体にATPの非加水分解アナログであるATPγSをくわえた条件において,この重水素交換反応を用いた解析を行うことにより,六量体化,そして,さらなるATPとの結合のときに起こる構造変化を解析した.その結果,ClpB六量体はコンパクトなリングを形成しているが,MドメインはAAA-1ドメインからなるリングとタイトに相互作用していることが明らかになった.さらなる生化学的な解析により,Mドメインのもつモチーフ1は六量体においてとなりのサブユニットのAAA-1ドメインと相互作用し,モチーフ2は同一のサブユニットのAAA-1ドメインと相互作用していることが明らかになった.これらの結果は,これまでクライオ電子顕微鏡解析により提唱されていた2つのClpB/Hsp104六量体モデルとは大きく異なっており,新たな六量体モデルが提唱された.これまでに提唱されたClpB/Hsp104六量体モデルのうち,生化学的な手法による詳細な検証が行われたのは今回がはじめてであった.
3.MドメインはClpBの脱凝集活性の制御装置として機能する
脱凝集反応に必須であるMドメインのClpB六量体における局在は明らかになったが,それでは,Mドメインは実際にどのような機能をもつのだろうか? この問いに答えるため,Mドメインに存在する保存された残基の変異体シリーズを作製した.これらClpB変異体の脱凝集活性を調べたところ,不活性になる変異体と,活性が非常に高くなる変異体とに分類された.生化学的な手法および重水素交換反応により解析したところ,不活性となる変異体は共通して,ATPase活性が低い,基質を中央の孔に引き込む力が弱い,MドメインとAAA-1ドメインとの相互作用がさらに強まっている,ことがわかった.一方,活性の高くなった変異体は,ATPase活性が基質の存在のもと著しく上昇する,基質を中央の孔に引き込む力が非常に高い,MドメインとAAA-1ドメインとの相互作用が失われている,ことがわかった.これらの結果より,MドメインはAAA-1ドメインと相互作用することによりClpB六量体のもつATPase活性と基質を中央の孔に引き込む力を抑制していることが示唆された.興味深いことに,ClpBを不活性にする変異と活性化させる変異とをかけあわせたものは,野生型のClpBとほぼ同等の性質を示した.このことから,ClpBは活性の抑制されている状態と抑制の解放された状態とのあいだで平衡状態にあり,通常はMドメインによりClpBの活性化が抑制されていると考えられた(図2).抑制の解放された状態においてClpBのATPase活性は基質の存在のもと著しく上昇したことから,ClpBの完全な活性化においては,MドメインとAAA-1ドメインとの相互作用の解除と,基質のClpBへの結合の,少なくとも2つの段階があると考えられた.
4.Mドメインによる抑制を失ったClpBは細胞に対し毒性となる
ここで,脱凝集活性のすぐれるClpBがなぜ進化の過程で選抜されてこなかったのかという疑問が生じた.しかし,脱凝集活性の上昇したClpBは大腸菌に発現させると生育阻害を示した.これより,強すぎる脱凝集活性をもつClpBは細胞においておそらく天然にフォールディングしたタンパク質すらもひも解いてしまい,その結果,そのタンパク質の機能をも喪失させてしまうことが考えられた.通常,凝集したタンパク質をひも解くのは困難だが,それを可能にするためClpBは進化の過程で強大な力をもつ分子シャペロンとしてつくりあげられてきたのだろう.しかし同時に,そのような大きな力は細胞にとり大きな危険を含むため,ClpBにはMドメインのような活性制御装置が備えられたのだと思われた.
5.ClpBのMドメインを介した活性化は凝集体の存在のもとHsp70によりピンポイントに行われる
ClpBは細胞において通常は活性の抑制されている状態として存在すると考えられたが,ClpBの活性化にはまず第1段階としてMドメインとAAA-1ドメインとの相互作用が解除されなければならない.しかし,むやみにClpBを活性化させることは細胞にとり危険である.それでは,実際に細胞においてMドメインによるClpBの活性はどのように制御されているのであろうか?
筆者らによりこの論文と同時に発表された論文における報告7) ともあわせ,生化学的な解析により,脱凝集反応の補因子としてはたらく分子シャペロンHsp70がClpBのMドメインに直接に結合することでAAA-1ドメインとの相互作用を断ち切り,ClpBを活性化していることが示唆された.Hsp70はClpBにさきんじて凝集タンパク質に結合しClpBをリクルートすることがすでに明らかになっており8,9),Hsp70によるClpBの凝集タンパク質へのターゲティングと活性化は共役した反応であることが考えられた.また,活性化には1つのClpB六量体に対し複数のHsp70が必要であることも示された.これは,凝集体の表面においていくつものHsp70が結合している状態に近いと考えられ,幅広い基質特異性をもつHsp70が凝集体以外の基質と相互作用している場合,ClpBがむやみに活性化されないようにする制御機構のひとつと思われた.このように,ClpBの脱凝集活性はHsp70によりMドメインを介し制御されているため,ClpBの活性化は非常にピンポイントで行われ,ClpBによる脱凝集反応は効率的にかつ安全に遂行されていると考えられた(図2).
おわりに
ClpB/Hsp104六量体モデルは多くのグループを巻き込み大きな論争をひき起こしてきた.しかし,今回の筆者らによる重水素交換反応と生化学的な手法とを組み合わせた解析により,ClpB六量体のおおよその構造が明らかにされたとともに,議論の中心であったMドメインの局在とその機能についても詳細な解析がなされた.また,ClpBのMドメインによる脱凝集活性の制御機構は非常に精巧なものであることが明らかになり,ClpB/Hsp104とHsp70による脱凝集機構だけでなく,生体においてタンパク質複合体がどのように効率的かつ安全に自らの役割を遂行しているかについても大きな知見がもたらされたともの思われる.また,筆者らは,ClpB六量体とともにHsp104六量体の構造解析も行ったが,得られた結果はClpB六量体とHsp104六量体とで同じであった.これまでに,筆者が所属するグループにより,出芽酵母においてHsp104によるプリオンの分断はHsp70に依存的に行われていることが明らかにされており9),このプリオンを分断する機構もHsp70によるHsp104の活性化を介し同じような機構で行われていることが考えられ,これからのプリオンあるいはアミロイドに関する研究においても有用な知見になると期待している.
文 献
- Weibezahn, J., Schlieker, C., Bukau, B. et al.: Characterization of a trap mutant of the AAA+ chaperone ClpB. J. Biol. Chem., 278, 32608-32617 (2003)[PubMed]
- Lee, S., Sowa, M. E., Watanabe, Y. H. et al.: The structure of ClpB: a molecular chaperone that rescues proteins from an aggregated state. Cell, 115, 229-240 (2003)[PubMed]
- Lee, S., Choi, J. M. & Tsai, F. T.: Visualizing the ATPase cycle in a protein disaggregating machine: structural basis for substrate binding by ClpB. Mol. Cell, 25, 261-271 (2007)[PubMed]
- Wendler, P., Shorter, J., Plisson, C. et al.: Atypical AAA+ subunit packing creates an expanded cavity for disaggregation by the protein-remodeling factor Hsp104. Cell, 131, 1366-1377 (2007)[PubMed]
- Wendler, P., Shorter, J., Snead, D. et al.: Motor mechanism for protein threading through Hsp104. Mol. Cell, 34, 81-92 (2009)[PubMed]
- Lee, S., Sielaff, B., Lee, J. et al.: CryoEM structure of Hsp104 and its mechanistic implication for protein disaggregation. Proc. Natl. Acad. Sci. USA, 107, 8135-8140 (2010)[PubMed]
- Seyffer, F., Kummer, E., Oguchi, Y. et al.: Hsp70 proteins bind Hsp100 regulatory M domains to activate AAA+ disaggregase at aggregate surfaces. Nat. Struct. Mol. Biol., 19, 1347-1355 (2012)[PubMed]
- Winkler, J., Seybert, A., Konig, L. et al.: Quantitative and spatio-temporal features of protein aggregation in Escherichia coli and consequences on protein quality control and cellular ageing. EMBO J., 29, 910-923 (2010)[PubMed]
- Winkler, J., Tyedmers, J., Bukau, B. et al.: Hsp70 targets Hsp100 chaperones to substrates for protein disaggregation and prion fragmentation. J. Cell Biol., 198, 387-404 (2012)[PubMed]
著者プロフィール
略歴:2008年 東京大学大学院農学生命科学研究科 修了,同年よりドイツHeidelberg大学 博士研究員.
研究テーマ:タンパク質の構造および機能とその分子機構.
抱負:生体においてタンパク質のもつさまざまなすぐれた分子機構を明らかにし,その分子機構を人類が応用できるようにしたい.
Bernd Bukau
ドイツHeidelberg大学Zentrum fuer Molekulare BiologieにてDirector.
研究室URL:http://www.zmbh.uni-heidelberg.de/bukau/default.shtml
© 2012 小口友樹・Bernd Bukau Licensed under CC 表示 2.1 日本