マイクロRNAは異なる複数の機構を介し遺伝子発現を抑制する
深谷雄志・泊 幸秀
(東京大学分子細胞生物学研究所 RNA機能研究分野)
email:深谷雄志,泊 幸秀
DOI: 10.7875/first.author.2012.144
MicroRNAs mediate gene silencing via multiple different pathways in Drosophila.
Takashi Fukaya, Yukihide Tomari
Molecular Cell, 48, 825-836 (2012)
マイクロRNAは約22塩基の小分子RNAであり,その配列の相補性により標的となるmRNAを認識し,ポリA鎖の分解と翻訳の抑制をひき起こす.マイクロRNAはRISCとよばれるRNA-タンパク質複合体を形成することによりはじめて機能を発揮する.RISCにおいて重要な役割をはたしているのは,マイクロRNAに直接に結合するAgoと,Agoの結合タンパク質であるGW182である.これまで,マイクロRNAが機能を発揮するのにGW182は必須であると考えられてきたが,今回,筆者らは,マイクロRNAがGW182に非依存的に翻訳を抑制する新たな機構を発見した.このGW182に非依存的な翻訳抑制機構は,これまで知られていたGW182に依存的なポリA鎖の分解や翻訳の抑制とは独立してはたらいていた.よって,マイクロRNAはこれら異なる複数の作用機構を介し遺伝子発現を抑制すると考えられた.
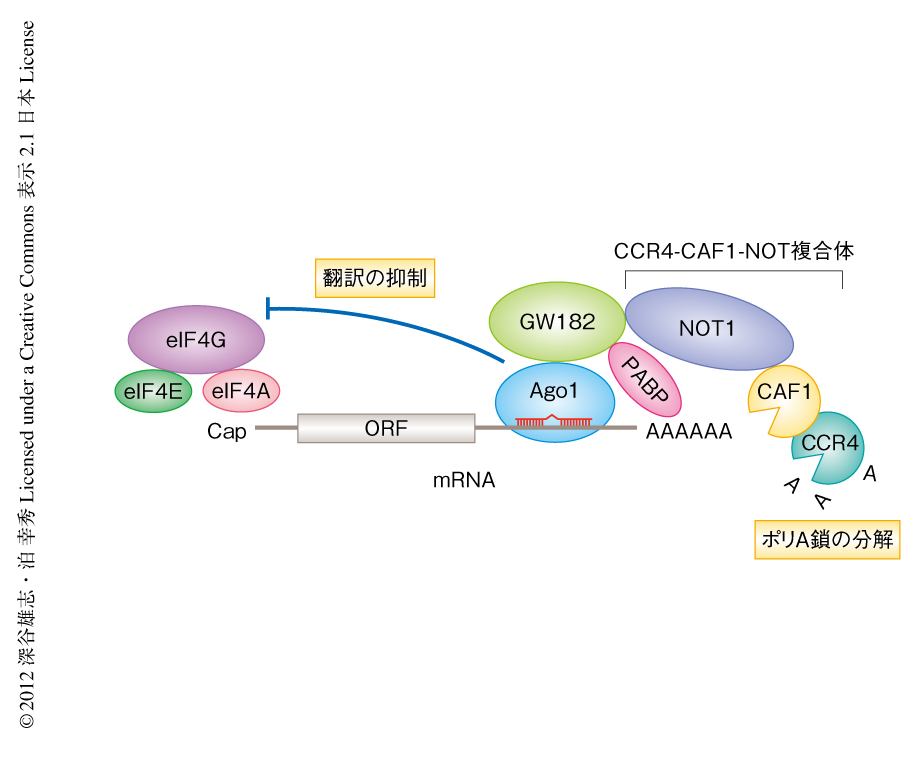
マイクロRNA(miRNA)はゲノムにコードされる約22塩基の小分子RNAであり,それ自体に対し部分相補的な配列をもつ標的mRNAからの翻訳を抑制することにより遺伝子発現を制御している.マイクロRNAは単独ではたらくわけではなく,RISC(RNA-induced silencing complex)とよばれるRNA-タンパク質複合体を形成することによりはじめて機能を発揮する.ショウジョウバエのマイクロRNA経路において中心的な役割を担うのは,RISCの構成タンパク質としてマイクロRNAに直接に結合するArgonauteタンパク質(Ago)のひとつAgo1と,Ago1の結合タンパク質であるGW182である.ショウジョウバエにおいてAgo1を中核として組み立てられたRISC(以下,Ago1-RISCと表記)は,標的mRNAのポリA鎖の分解をひき起こすことによりその不安定化を誘導するとともに,それとは独立して翻訳そのものを抑制することが知られている(図1).これまで,Ago1-RISCがこれらの機能を発揮するにはGW182は必須であると考えられてきた.
近年の研究において,GW182はポリA鎖分解酵素であるCCR4-CAF1-NOT複合体と直接に結合することが示された1-3).つまり,GW182は標的mRNAにポリA鎖分解酵素を積極的に呼び込むことによりポリA鎖の分解を誘導すると考えられる.一方,翻訳抑制経路に関しては,GW182の関与が信じられてきたものの,翻訳のどの段階をどのように阻害するかを含め,その具体的な作用機構に関しては数多くの相反する実験結果が報告されており統一的な見解にはいたっていない.その原因のひとつとして,ポリA鎖の分解されたmRNAは翻訳の効率も必然的に低下し,逆に,翻訳の抑制されたmRNAはポリA鎖の分解が促進される,というように,“ポリA鎖の分解”と“翻訳の抑制”は互いに影響をあたえあっていることがあげられる.従来の実験手法ではマイクロRNAのこれらの作用をひとまとめに観察していたため,実験結果の因果関係を明らかにすることが困難であった.この研究において,筆者らは,ポリA鎖分解経路と翻訳抑制経路とをそれぞれ切り分けて解析することのできる実験系を構築し,これまで解析の困難であった翻訳抑制機構の詳細な分子機構を明らかにすることを目的とした.
ショウジョウバエのAgo1-RISCが機能を発揮する際にGW182のはたす役割を調べるため,GW182の特異的なノックダウンがAgo1-RISCによるポリA鎖の分解,あるいは,翻訳の抑制にあたえる影響をS2細胞において解析した.その結果,従来のモデルと一致して,GW182のノックダウンにより標的mRNAのポリA鎖の分解と不安定化が解除された.
つづいて,Ago1-RISCによる翻訳の抑制に対しGW182のノックダウンのあたえる影響を解析した.ポリA鎖の分解反応の影響を排除した“純粋”な翻訳の抑制を観察するため,自己切断能をもつハンマーヘッドリボザイムを利用し,ポリA鎖のさらに下流に40塩基の保護配列を付加した新たな標的mRNAを設計した.このような標的mRNAはAgo1-RISCによるポリA鎖の分解をうけなかったが,にもかかわらず,Ago1-RISCは標的mRNAの翻訳を抑制した.この結果は,マイクロRNAがポリA鎖の分解とは独立して翻訳の抑制をひき起こすという過去の知見に一致していた4,5).驚くべきことに,GW182が存在しなくてもAgo1-RISCによる翻訳の抑制は効率よく進行した.このことは,ショウジョウバエのAgo1-RISCはGW182に非依存的に翻訳を抑制することを示唆した.さらに,in vivoにおいて観察されたGW182に非依存的な翻訳の抑制を,S2細胞の抽出液を用いたin vitro再構成系により再現することにも成功した.以下,in vitro再構成系を用いることにより詳細な生化学的な解析を行った.
マイクロRNAによりひき起こされるポリA鎖の分解はおもにCCR4-CAF1-NOT複合体により行われる.近年,CCR4-CAF1-NOT複合体をλNペプチドとBoxB配列を介し人工的に直接mRNAに繋留させると翻訳の抑制をひき起こすことが示された6).このことから,CCR4-CAF1-NOT複合体はマイクロRNAによるポリA鎖分解経路だけでなく,翻訳抑制経路にも寄与するというモデルが提唱されている.そこで,CCR4-CAF1-NOT複合体の構成タンパク質をノックダウンしたS2細胞の抽出液を用いて,Ago1-RISCによるポリA鎖の分解と翻訳の抑制について解析した.これまで考えられてきたように,CCR4-CAF1-NOT複合体の活性中心であるCAF1やGW182との結合に必要なNOT1をノックダウンするとポリA鎖の分解は阻害された.対照的に,翻訳の抑制はこれらのノックダウンによる影響をうけなかった.つまり,Ago1-RISCによる翻訳の抑制は,GW182だけでなく,CCR4-CAF1-NOT複合体にも依存しない未知の機構により行われることがわかった.
ショウジョウバエのAgo1-RISCが翻訳のどの段階を阻害するかを調べるため,スクロース密度勾配遠心法により標的mRNAにおけるリボソームの形成状態を解析した.ポリA鎖の分解と切り分けた純粋な翻訳の抑制のみを解析するため,末端に保護配列を付加したポリA鎖をもつ標的mRNAを用いて実験を行った.その結果,Ago1-RISCの標的とするmRNAにおいては80S翻訳開始複合体および48S翻訳開始複合体の形成が阻害されていた.この結果は,Ago1-RISCは翻訳の開始においてmRNAにリボソームを呼び込む初期の段階を阻害することを示唆した.GW182が存在しなくても48S翻訳開始複合体の形成阻害は起こったことから,Ago1-RISCはGW182に非依存的に翻訳開始を阻害すると考えられた.
通常,翻訳開始段階では,mRNAの5’側のキャップ構造が翻訳開始因子であるeIF4Eにより認識される.eIF4Eは足場タンパク質であるeIF4Gと結合し,さらにeIF4GはRNAヘリカーゼであるeIF4Aを5’側非翻訳領域に作用させる.また,eIF4GはeIF3と相互作用することによりリボソームをmRNAへと呼び込む.Ago1-RISCが翻訳開始のどの段階を抑制するのか調べるため,特殊な5’側非翻訳領域の配列をもつことにより翻訳の開始においてある特定の段階をスキップするような標的mRNAを設計し,Ago1-RISCによる翻訳の抑制に対する感受性を調べた.その結果,eIF4GをλNペプチドとBoxB配列を介し直接mRNAに繋留させることにより,eIF4Eによる5’側のキャップ構造の認識およびeIF4EとeIF4Gとの相互作用を必要としない特殊な標的mRNAは翻訳の抑制をうけることがわかった.このことは,mRNAへのeIF4Gの呼び込みより下流の段階をAgo1-RISCが阻害することを示唆した.一方,ショウジョウバエのアポトーシス誘導遺伝子のひとつであるreaper遺伝子のもつ5’側非翻訳領域の配列を介したeIF4Aに非依存的な翻訳は,Ago1-RISCによる翻訳の抑制をほぼ完全にまぬがれた.以上の結果より,Ago1-RISCはeIF4Aに依存的な翻訳開始段階を標的としていることが考えられた.
ここまで,GW182に非依存的な翻訳の抑制に焦点をあて解析を行ってきたが,はたして,GW182は翻訳の抑制にはまったく寄与しないのであろうか.GW182を介した純粋な翻訳の抑制の有無を調べるため,GW182を直接mRNAに繋留する実験を行った.その結果,GW182はポリA鎖の分解だけでなく,それとは独立した翻訳の抑制をひき起こした.内在性のAgo1を除いてもGW182を介した翻訳の抑制は影響をうけなかったことから,GW182はAgo1に依存せずに翻訳の抑制をひき起こす能力をもつことがわかった.スクロース密度勾配遠心法によりGW182を介した翻訳の抑制について解析したところ,GW182により80S翻訳開始複合体および48S翻訳開始複合体の形成が阻害されていた.つまり,Ago1-RISCを介した翻訳の抑制と同様に,GW182を介した翻訳の抑制も翻訳開始の初期段階を阻害することがわかった.
ショウジョウバエの胚抽出液を用いたin vitro再構成系によりマイクロRNAはポリソームと同様の沈降係数をもつ偽ポリソーム(pseudo-polysome)とよばれるmRNA-タンパク質複合体の形成を誘導することが示されている7).しかし,その機能や構成タンパク質は未知であった.スクロース密度勾配遠心法による解析の結果,S2細胞の抽出液を用いた筆者らのin vitro再構成系においても偽ポリソームの形成がみられた.しかし,GW182が存在しないときには偽ポリソームの形成は阻害された.また,GW182はポリA鎖結合タンパク質であるPABPと直接に結合することが示されているが8),PABPのノックダウンによっても偽ポリソームの形成は阻害された.つまり,GW182とPABPは偽ポリソームの構成タンパク質であることが示唆された.しかし重要なことに,GW182あるいはPABPをノックダウンしてもAgo1-RISCによる翻訳の抑制は影響をうけなかった.以上の結果は,偽ポリソームの形成はマイクロRNAによる翻訳抑制機構に寄与していないことを示した.
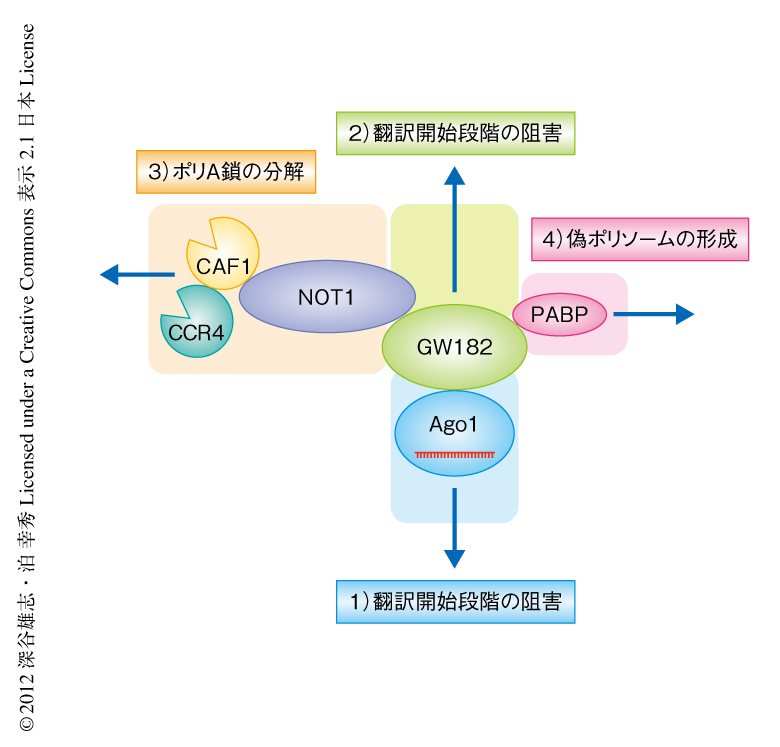
この研究により,これまで知られていなかったGW182に非依存的な翻訳抑制機構の存在が明らかになった.一方で,GW182自体も独立して翻訳の抑制を誘導する活性をもっていたことから,マイクロRNAは複数の機構により翻訳開始段階を阻害することが考えられた.さらに,翻訳の抑制と並行して,マイクロRNAはポリA鎖の分解により標的mRNAを不安定化する(図2).また,スクロース密度勾配遠心法においてポリソームと同様の画分に観察される偽ポリソームの存在は,翻訳の阻害が開始段階で起こっているのか伸長段階で起こっているのか,そのみきわめをむずかしくしていた.従来の研究手法では,これらすべてが総合された最終的なアウトプットを観察していたが,それぞれの機構の寄与の度合いが実験系により異なっていたため,いっけん相矛盾する結論が得られてきたのではないかと推察された.しかしながら,翻訳の抑制において具体的にどのタンパク質がどのようにはたらいているかなど,未解決の問題は数多く存在しており,今後の詳細な解析が期待される.
略歴:東京大学大学院新領域創成科学研究科博士課程 在学中.
研究テーマ:マイクロRNAによる翻訳抑制機構の解析.
抱負:マイクロRNAのはたらくしくみを明らかにしたい.
泊 幸秀(Yukihide Tomari)
東京大学分子細胞生物学研究所 准教授
研究室URL:http://www.iam.u-tokyo.ac.jp/tomari/
© 2012 深谷雄志・泊 幸秀 Licensed under CC 表示 2.1 日本
(東京大学分子細胞生物学研究所 RNA機能研究分野)
email:深谷雄志,泊 幸秀
DOI: 10.7875/first.author.2012.144
MicroRNAs mediate gene silencing via multiple different pathways in Drosophila.
Takashi Fukaya, Yukihide Tomari
Molecular Cell, 48, 825-836 (2012)
要 約
マイクロRNAは約22塩基の小分子RNAであり,その配列の相補性により標的となるmRNAを認識し,ポリA鎖の分解と翻訳の抑制をひき起こす.マイクロRNAはRISCとよばれるRNA-タンパク質複合体を形成することによりはじめて機能を発揮する.RISCにおいて重要な役割をはたしているのは,マイクロRNAに直接に結合するAgoと,Agoの結合タンパク質であるGW182である.これまで,マイクロRNAが機能を発揮するのにGW182は必須であると考えられてきたが,今回,筆者らは,マイクロRNAがGW182に非依存的に翻訳を抑制する新たな機構を発見した.このGW182に非依存的な翻訳抑制機構は,これまで知られていたGW182に依存的なポリA鎖の分解や翻訳の抑制とは独立してはたらいていた.よって,マイクロRNAはこれら異なる複数の作用機構を介し遺伝子発現を抑制すると考えられた.
はじめに
マイクロRNA(miRNA)はゲノムにコードされる約22塩基の小分子RNAであり,それ自体に対し部分相補的な配列をもつ標的mRNAからの翻訳を抑制することにより遺伝子発現を制御している.マイクロRNAは単独ではたらくわけではなく,RISC(RNA-induced silencing complex)とよばれるRNA-タンパク質複合体を形成することによりはじめて機能を発揮する.ショウジョウバエのマイクロRNA経路において中心的な役割を担うのは,RISCの構成タンパク質としてマイクロRNAに直接に結合するArgonauteタンパク質(Ago)のひとつAgo1と,Ago1の結合タンパク質であるGW182である.ショウジョウバエにおいてAgo1を中核として組み立てられたRISC(以下,Ago1-RISCと表記)は,標的mRNAのポリA鎖の分解をひき起こすことによりその不安定化を誘導するとともに,それとは独立して翻訳そのものを抑制することが知られている(図1).これまで,Ago1-RISCがこれらの機能を発揮するにはGW182は必須であると考えられてきた.
近年の研究において,GW182はポリA鎖分解酵素であるCCR4-CAF1-NOT複合体と直接に結合することが示された1-3).つまり,GW182は標的mRNAにポリA鎖分解酵素を積極的に呼び込むことによりポリA鎖の分解を誘導すると考えられる.一方,翻訳抑制経路に関しては,GW182の関与が信じられてきたものの,翻訳のどの段階をどのように阻害するかを含め,その具体的な作用機構に関しては数多くの相反する実験結果が報告されており統一的な見解にはいたっていない.その原因のひとつとして,ポリA鎖の分解されたmRNAは翻訳の効率も必然的に低下し,逆に,翻訳の抑制されたmRNAはポリA鎖の分解が促進される,というように,“ポリA鎖の分解”と“翻訳の抑制”は互いに影響をあたえあっていることがあげられる.従来の実験手法ではマイクロRNAのこれらの作用をひとまとめに観察していたため,実験結果の因果関係を明らかにすることが困難であった.この研究において,筆者らは,ポリA鎖分解経路と翻訳抑制経路とをそれぞれ切り分けて解析することのできる実験系を構築し,これまで解析の困難であった翻訳抑制機構の詳細な分子機構を明らかにすることを目的とした.
1.Ago1-RISCによるGW182に非依存的な翻訳の抑制
ショウジョウバエのAgo1-RISCが機能を発揮する際にGW182のはたす役割を調べるため,GW182の特異的なノックダウンがAgo1-RISCによるポリA鎖の分解,あるいは,翻訳の抑制にあたえる影響をS2細胞において解析した.その結果,従来のモデルと一致して,GW182のノックダウンにより標的mRNAのポリA鎖の分解と不安定化が解除された.
つづいて,Ago1-RISCによる翻訳の抑制に対しGW182のノックダウンのあたえる影響を解析した.ポリA鎖の分解反応の影響を排除した“純粋”な翻訳の抑制を観察するため,自己切断能をもつハンマーヘッドリボザイムを利用し,ポリA鎖のさらに下流に40塩基の保護配列を付加した新たな標的mRNAを設計した.このような標的mRNAはAgo1-RISCによるポリA鎖の分解をうけなかったが,にもかかわらず,Ago1-RISCは標的mRNAの翻訳を抑制した.この結果は,マイクロRNAがポリA鎖の分解とは独立して翻訳の抑制をひき起こすという過去の知見に一致していた4,5).驚くべきことに,GW182が存在しなくてもAgo1-RISCによる翻訳の抑制は効率よく進行した.このことは,ショウジョウバエのAgo1-RISCはGW182に非依存的に翻訳を抑制することを示唆した.さらに,in vivoにおいて観察されたGW182に非依存的な翻訳の抑制を,S2細胞の抽出液を用いたin vitro再構成系により再現することにも成功した.以下,in vitro再構成系を用いることにより詳細な生化学的な解析を行った.
2.Ago1-RISCによる翻訳の抑制はCCR4-CAF1-NOT複合体を必要としない
マイクロRNAによりひき起こされるポリA鎖の分解はおもにCCR4-CAF1-NOT複合体により行われる.近年,CCR4-CAF1-NOT複合体をλNペプチドとBoxB配列を介し人工的に直接mRNAに繋留させると翻訳の抑制をひき起こすことが示された6).このことから,CCR4-CAF1-NOT複合体はマイクロRNAによるポリA鎖分解経路だけでなく,翻訳抑制経路にも寄与するというモデルが提唱されている.そこで,CCR4-CAF1-NOT複合体の構成タンパク質をノックダウンしたS2細胞の抽出液を用いて,Ago1-RISCによるポリA鎖の分解と翻訳の抑制について解析した.これまで考えられてきたように,CCR4-CAF1-NOT複合体の活性中心であるCAF1やGW182との結合に必要なNOT1をノックダウンするとポリA鎖の分解は阻害された.対照的に,翻訳の抑制はこれらのノックダウンによる影響をうけなかった.つまり,Ago1-RISCによる翻訳の抑制は,GW182だけでなく,CCR4-CAF1-NOT複合体にも依存しない未知の機構により行われることがわかった.
3.Ago1-RISCは翻訳開始の初期段階を阻害する
ショウジョウバエのAgo1-RISCが翻訳のどの段階を阻害するかを調べるため,スクロース密度勾配遠心法により標的mRNAにおけるリボソームの形成状態を解析した.ポリA鎖の分解と切り分けた純粋な翻訳の抑制のみを解析するため,末端に保護配列を付加したポリA鎖をもつ標的mRNAを用いて実験を行った.その結果,Ago1-RISCの標的とするmRNAにおいては80S翻訳開始複合体および48S翻訳開始複合体の形成が阻害されていた.この結果は,Ago1-RISCは翻訳の開始においてmRNAにリボソームを呼び込む初期の段階を阻害することを示唆した.GW182が存在しなくても48S翻訳開始複合体の形成阻害は起こったことから,Ago1-RISCはGW182に非依存的に翻訳開始を阻害すると考えられた.
4.Ago1-RISCはeIF4Aに依存的な翻訳開始段階を阻害する
通常,翻訳開始段階では,mRNAの5’側のキャップ構造が翻訳開始因子であるeIF4Eにより認識される.eIF4Eは足場タンパク質であるeIF4Gと結合し,さらにeIF4GはRNAヘリカーゼであるeIF4Aを5’側非翻訳領域に作用させる.また,eIF4GはeIF3と相互作用することによりリボソームをmRNAへと呼び込む.Ago1-RISCが翻訳開始のどの段階を抑制するのか調べるため,特殊な5’側非翻訳領域の配列をもつことにより翻訳の開始においてある特定の段階をスキップするような標的mRNAを設計し,Ago1-RISCによる翻訳の抑制に対する感受性を調べた.その結果,eIF4GをλNペプチドとBoxB配列を介し直接mRNAに繋留させることにより,eIF4Eによる5’側のキャップ構造の認識およびeIF4EとeIF4Gとの相互作用を必要としない特殊な標的mRNAは翻訳の抑制をうけることがわかった.このことは,mRNAへのeIF4Gの呼び込みより下流の段階をAgo1-RISCが阻害することを示唆した.一方,ショウジョウバエのアポトーシス誘導遺伝子のひとつであるreaper遺伝子のもつ5’側非翻訳領域の配列を介したeIF4Aに非依存的な翻訳は,Ago1-RISCによる翻訳の抑制をほぼ完全にまぬがれた.以上の結果より,Ago1-RISCはeIF4Aに依存的な翻訳開始段階を標的としていることが考えられた.
5.GW182を介した翻訳抑制機構
ここまで,GW182に非依存的な翻訳の抑制に焦点をあて解析を行ってきたが,はたして,GW182は翻訳の抑制にはまったく寄与しないのであろうか.GW182を介した純粋な翻訳の抑制の有無を調べるため,GW182を直接mRNAに繋留する実験を行った.その結果,GW182はポリA鎖の分解だけでなく,それとは独立した翻訳の抑制をひき起こした.内在性のAgo1を除いてもGW182を介した翻訳の抑制は影響をうけなかったことから,GW182はAgo1に依存せずに翻訳の抑制をひき起こす能力をもつことがわかった.スクロース密度勾配遠心法によりGW182を介した翻訳の抑制について解析したところ,GW182により80S翻訳開始複合体および48S翻訳開始複合体の形成が阻害されていた.つまり,Ago1-RISCを介した翻訳の抑制と同様に,GW182を介した翻訳の抑制も翻訳開始の初期段階を阻害することがわかった.
6.GW182-PABP複合体を介した偽ポリソームの形成
ショウジョウバエの胚抽出液を用いたin vitro再構成系によりマイクロRNAはポリソームと同様の沈降係数をもつ偽ポリソーム(pseudo-polysome)とよばれるmRNA-タンパク質複合体の形成を誘導することが示されている7).しかし,その機能や構成タンパク質は未知であった.スクロース密度勾配遠心法による解析の結果,S2細胞の抽出液を用いた筆者らのin vitro再構成系においても偽ポリソームの形成がみられた.しかし,GW182が存在しないときには偽ポリソームの形成は阻害された.また,GW182はポリA鎖結合タンパク質であるPABPと直接に結合することが示されているが8),PABPのノックダウンによっても偽ポリソームの形成は阻害された.つまり,GW182とPABPは偽ポリソームの構成タンパク質であることが示唆された.しかし重要なことに,GW182あるいはPABPをノックダウンしてもAgo1-RISCによる翻訳の抑制は影響をうけなかった.以上の結果は,偽ポリソームの形成はマイクロRNAによる翻訳抑制機構に寄与していないことを示した.
おわりに
この研究により,これまで知られていなかったGW182に非依存的な翻訳抑制機構の存在が明らかになった.一方で,GW182自体も独立して翻訳の抑制を誘導する活性をもっていたことから,マイクロRNAは複数の機構により翻訳開始段階を阻害することが考えられた.さらに,翻訳の抑制と並行して,マイクロRNAはポリA鎖の分解により標的mRNAを不安定化する(図2).また,スクロース密度勾配遠心法においてポリソームと同様の画分に観察される偽ポリソームの存在は,翻訳の阻害が開始段階で起こっているのか伸長段階で起こっているのか,そのみきわめをむずかしくしていた.従来の研究手法では,これらすべてが総合された最終的なアウトプットを観察していたが,それぞれの機構の寄与の度合いが実験系により異なっていたため,いっけん相矛盾する結論が得られてきたのではないかと推察された.しかしながら,翻訳の抑制において具体的にどのタンパク質がどのようにはたらいているかなど,未解決の問題は数多く存在しており,今後の詳細な解析が期待される.
文 献
- Braun, J. E., Huntzinger, E., Fauser, M. et al.: GW182 proteins directly recruit cytoplasmic deadenylase complexes to miRNA targets. Mol. Cell, 44, 120-133 (2011)[PubMed]
- Chekulaeva, M., Mathys, H., Zipprich, J. T. et al.: miRNA repression involves GW182-mediated recruitment of CCR4-NOT through conserved W-containing motifs. Nat. Struct. Mol. Biol., 18, 1218-1226 (2011)[PubMed]
- Fabian, M. R., Cieplak, M. K., Frank, F. et al.: miRNA-mediated deadenylation is orchestrated by GW182 through two conserved motifs that interact with CCR4-NOT. Nat. Struct. Mol. Biol., 18, 1211-1217 (2011)[PubMed]
- Fukaya, T. & Tomari, Y.: PABP is not essential for microRNA-mediated translational repression and deadenylation in vitro. EMBO J., 30, 4998-5009 (2011)[PubMed]
- Mishima, Y., Fukao, A., Kishimoto, T. et al.: Translational inhibition by deadenylation-independent mechanisms is central to microRNA-mediated silencing in zebrafish. Proc. Natl. Acad. Sci. USA, 109, 1104-1109 (2012)[PubMed]
- Cooke, A., Prigge, A. & Wickens, M.: Translational repression by deadenylases. J. Biol. Chem., 285, 28506-28513 (2010)[PubMed]
- Thermann, R. & Hentze, M. W.: Drosophila miR2 induces pseudo-polysomes and inhibits translation initiation. Nature, 447, 875-878 (2007)[PubMed]
- Fabian, M. R., Mathonnet, G., Sundermeier, T. et al.: Mammalian miRNA RISC recruits CAF1 and PABP to affect PABP-dependent deadenylation. Mol. Cell, 35, 868-880 (2009)[PubMed]
著者プロフィール
略歴:東京大学大学院新領域創成科学研究科博士課程 在学中.
研究テーマ:マイクロRNAによる翻訳抑制機構の解析.
抱負:マイクロRNAのはたらくしくみを明らかにしたい.
泊 幸秀(Yukihide Tomari)
東京大学分子細胞生物学研究所 准教授
研究室URL:http://www.iam.u-tokyo.ac.jp/tomari/
© 2012 深谷雄志・泊 幸秀 Licensed under CC 表示 2.1 日本