ミトコンドリア遺伝病の生殖系列細胞の遺伝子治療へむけた紡錘体置換法
立花眞仁・Shoukhrat Mitalipov
(米国Oregon Health & Science大学Oregon National Primate Research Center)
email:立花眞仁
DOI: 10.7875/first.author.2012.142
Towards germline gene therapy of inherited mitochondrial diseases.
Masahito Tachibana, Paula Amato, Michelle Sparman, Joy Woodward, Dario Melguizo Sanchis, Hong Ma, Nuria Marti Gutierrez, Rebecca Tippner-Hedges, Eunju Kang, Hyo-Sang Lee, Cathy Ramsey, Keith Masterson, David Battaglia, David Lee, Diana Wu, Jeffrey Jensen, Phillip Patton, Sumita Gokhale, Richard Stouffer, Shoukhrat Mitalipov
Nature, 493, 627-631 (2013)
母系遺伝をするミトコンドリアの遺伝子異常はヒトの重篤な疾患と関連している.筆者らは,ヒトの卵子において紡錘体置換法によるミトコンドリア遺伝子の置換につき,その実現可能性を検討した.紡錘体置換法を施行した卵子と対照となる卵子における受精率は同等であった.しかしながら,紡錘体置換法を施行した卵子においては,約半数に前核の数の異常など受精の異常を認めた.正常に受精した紡錘体置換法を施行した卵子は対照となる卵子と同等の胚盤胞の発生率とES細胞の樹立率を示した.正常に受精した紡錘体置換法を施行した卵子に由来するES細胞は正常な核型を示し,ミトコンドリア遺伝子はほぼ排他的に細胞質ドナーに由来していた.筆者らの検討により,紡錘体置換法によりヒトの卵子においてミトコンドリア遺伝子は効率に置き換えられることが示された.紡錘体置換法を施行した一部の卵子は受精に異常を示したものの,正常に受精した卵子は対照と遜色ない胚発生を示し,正常なES細胞を生み出すことが可能であった.
核遺伝子とは異なり,ミトコンドリア遺伝子は細胞質にあるミトコンドリアに存在し,それぞれの細胞は多コピーのミトコンドリア遺伝子をもつ.そして,ミトコンドリア病の患者においてミトコンドリア遺伝子の変異は,すべてが同一の変異体(ホモプラスミー),あるいは,正常と変異体の混合(ヘテロプラスミー)として存在しうる.ミトコンドリア病の臨床症状は多様であり,さまざまな臓器の障害と関連するが,しばしばエネルギーの需要の高い器官あるいは組織に対し影響を及ぼす1).疾患の発症,重症度,症状は変異ミトコンドリア遺伝子の種類と変異体の割合に依存する1).
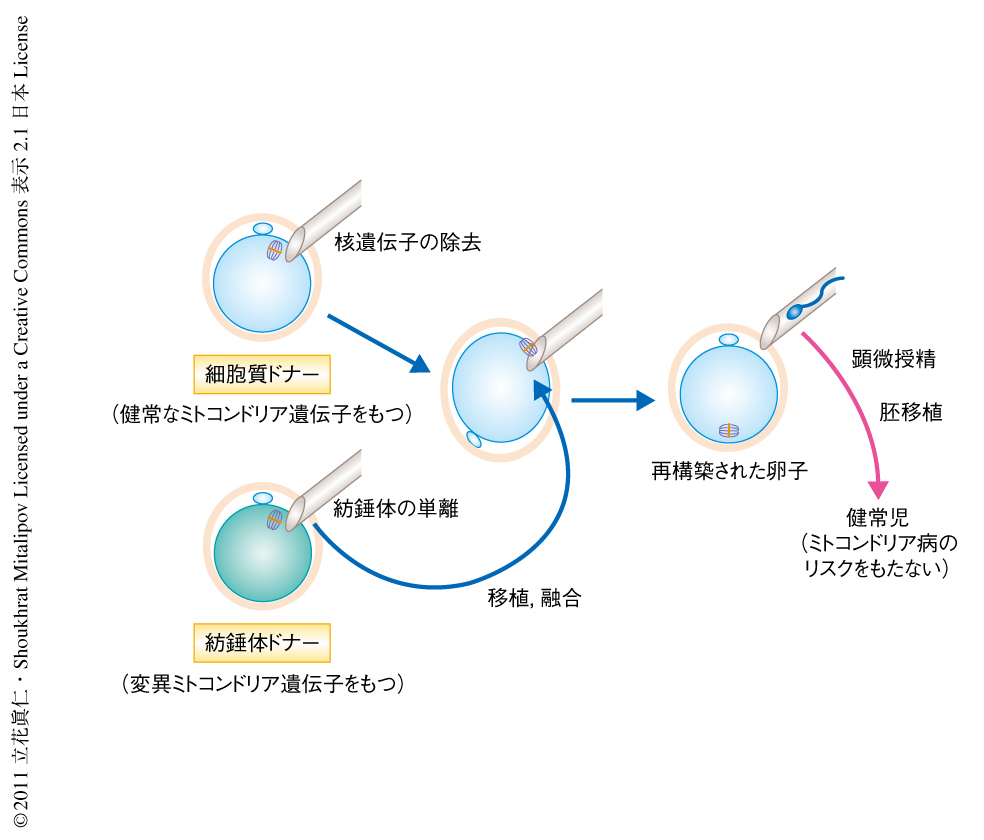
ミトコンドリア遺伝病の罹患者は約5000~10,000人に1人と推定される2,3).現時点でミトコンドリア病の治癒は望めず,治療は対処療法と進行の遅延を目的とした投薬のみである.それゆえ,母から子への変異ミトコンドリア遺伝子の伝達を防ぐいくつかの生殖補助技術が提唱されてきた.そのひとつが紡錘体置換法である4).この技術は,染色体(核遺伝子)を患者の未受精卵から単離し,健常なミトコンドリアを含む除核されたドナーの卵子の細胞質へ導入する.これにより,子は患者の核遺伝子を継承し,ドナーから健常なミトコンドリア遺伝子を継承する(図1).
さきに筆者らは,紡錘体置換法の霊長類モデルについて報告し,実現可能性のみでなく,効率的で正常な受精および健康な産仔を得ることが可能なことを証明した4).今回,健康なドナーにより供与されたヒトの卵子を用いて,紡錘体置換法の実現可能性と胚発生について検討した.また,付加的な検討として,霊長類モデルにおいて,凍結融解した卵子における紡錘体置換法の実現可能性,および,生後の発育について検討した.
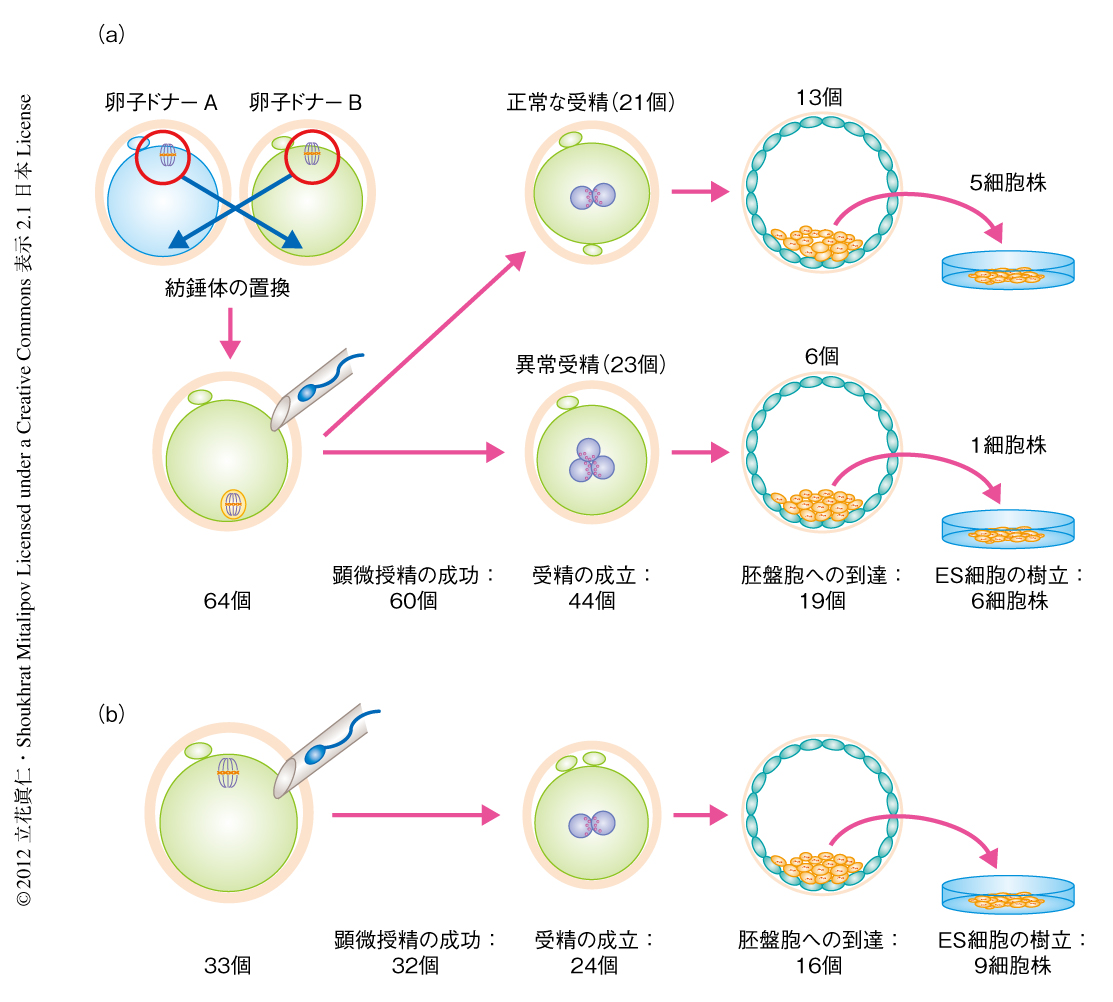
7人の卵子のドナー(21~32歳)に対し排卵誘発を施行し,計106個の成熟卵を採取した(ドナー1人あたり7~28個,平均15個).65個の卵子に対し紡錘体置換法を施行した.そのうち64個の卵子において,紡錘体を最小の細胞質(カリオプラスト)とともに単離し置換することに成功した.60個の卵子は顕微授精ののちにも生存し,うち44個が受精した.この結果は,対照として顕微授精のみを施行した33個の卵子における,顕微授精ののちの生存32個,および,受精24個と同等であった.紡錘体置換法を施行した受精胚を詳細に検討したところ,約半数は正常な2前核2極体を示していたが,残りの受精胚は異常な受精を示し異常な数の前核または極体をもっていた.異常な受精は対照となる卵子においても認められたが低頻度であった.正常に受精した紡錘体置換法を施行した卵子の胚盤胞の発生率は,対照となる卵子と統計学的に同等であった(図2).
卵子のさらなる発育能力の評価や,細胞遺伝学的および分子生物学的な検討のため,胚盤胞へ発育した紡錘体置換法を施行した卵子からES細胞(embryonic stem cell,胚性幹細胞)を樹立した.対照となる卵子から発生した16個の胚盤胞(すべて正常受精)から9株のES細胞が樹立された.このES細胞の樹立率は,これまでに報告された体外受精の治療より寄与された卵子を用いたものよりも高い率であった5).同様に,紡錘体置換法を施行した卵子から発生した胚盤胞のうち正常受精の13個から5株のES細胞が樹立された.さらに,紡錘体置換法を施行した卵子から発生した胚盤胞のうち異常受精の6個からもES細胞の樹立を試みたところ,3前核1極体を示す胚盤胞から1株のES細胞を得た(図2).
紡錘体置換法を施行した卵子から樹立されたES細胞は,対照となる卵子から樹立されたES細胞と類似しており,すべての多能性マーカーの発現を認め,さらに,SCIDマウスへの移植により三胚葉すべての組織への分化を認めた.遺伝学的な検討により,すべてのES細胞において,核遺伝子およびミトコンドリア遺伝子は,それぞれ,紡錘体ドナーと細胞質ドナーに由来していることが示された.紡錘体ドナーからの持ち込まれたミトコンドリア遺伝子の量は平均して1%以下であり,ミトコンドリア遺伝子は細胞質ドナーに由来するものにほぼ置換されていた.
紡錘体置換法を施行した卵子が正常に受精し発生した胚盤胞から樹立された5株のES細胞は,すべて正常な核型を示した.興味深いことに,対照となる卵子が正常に受精し発生した胚盤胞から樹立されたES細胞において,9株のうち2株に異数性の染色体異常が認められた.しかるに,この種の異数性は紡錘体置換法と直接に関連するものではないと考えられた.また,紡錘体置換法を施行した卵子が異常受精し発生した3前核1極体を示す胚盤胞から樹立された1株のES細胞において,余剰な染色体セットを認められ,過剰な紡錘体ドナーに由来するアリルの存在が明らかになった.これは,第2極体の放出障害によるものと考えられ,過剰な前核と第2極体の欠損による3前核1極体の所見と一致した.
ヒトにおいて紡錘体置換法を施行した卵子の半数に受精の異常を認めたが,これは霊長類モデル4) では認められなかった予期せぬ結果であった.紡錘体置換法を施行した卵子のうち受精に異常を示したものの大半が第2極体の放出障害に起因する3前核1極体を示したことから,紡錘体置換法において用いられるサイトカラシンB,および,導入された紡錘体の極性や卵子の早期の活性化に焦点をあてて異常の原因を検討した.しかし,サイトカラシンBの濃度の変化や紡錘体の極性による受精異常の割合に変化は認められず,これらは原因として除外された.しかし,再構築された卵子を固定染色したところ,霊長類モデルでは認められなかった減数分裂の再開をいくつかにおいて認めた.それゆえ,ヒトに対する紡錘体置換法における受精の異常は,この卵子の早期の活性化に起因していると推察された.ヒトの卵子はサルの卵子と比較して紡錘体置換法の操作に敏感であり,一部の卵子は早期の活性化を生じていたものと考えられた.
現在の紡錘体置換法のプロトコールでは患者とドナーから施行日に卵子を得る必要があり,排卵誘発の同期が必須である.しかし,ホルモンに対する反応性は個々で異なっており臨床において問題となりうる.そこで,凍結融解した卵子を用いることはこうした問題を解決する有用な手段と考えられる.そこで,凍結融解を行ったアカゲザルの卵子を用いて紡錘体置換法の実現可能性と発育能力を検討した.その結果,紡錘体置換法により,凍結融解した卵子を用いてもES細胞の樹立と健康な産仔を得ることが可能であることが示された.この成功の鍵は新鮮な細胞質を使用することであり,凍結融解操作を行った紡錘体(染色体)でも,新鮮な細胞質へ導入することにより胚発生を示した.
また,2009年に紡錘体置換法により誕生したサル4) の追跡調査においては,4匹(Mito,Tracker,Spindler,Spindy)すべてが正常な成長を示しており,健康状態にも問題はなく,紡錘体ドナーに由来するミトコンドリア遺伝子の増加(ヘテロプラスミーの変化)は認められなかった.
今回,筆者らは,紡錘体置換法によりヒトの卵子においても効率的にミトコンドリア遺伝子の置換が可能であることを示した.紡錘体置換法を施行した卵子の約半数に受精の異常を認めたものの,正常に受精した卵子は対照となる卵子と遜色のない胚発生とES細胞の樹立率を示した.しかるに,臨床の現場においては,通常の体外受精と同様に,前核の注意深い観察により正常な胚を選択することができると考えられる.また,霊長類モデルにおける検討は,凍結融解した卵子を用いても紡錘体置換法は効率的に行えることを示した.臨床への応用を考慮した際,紡錘体置換法の施行に先行して患者の卵子を凍結保存することが可能であることが示唆された.これは,臨床のうえで問題になるであろう排卵誘発の同期の問題が克服される可能性を示す.また,2009年に紡錘体置換法により誕生したサルは,健康で正常な成長をみせている.筆者らは,今後も生殖能力を含めこのサルの追跡調査を継続していく予定である.
紡錘体置換法は,現在,臨床的に重篤なミトコンドリア病を回避する手法として考慮されている6).倫理面に関しても,最近,英国Nuffield Council on Bioethicsはこの治療に対しサポートするコメントを発表している.しかし,臨床試験の開始にさきだち,ヒトの卵子を用いた検討において安全性に関するさらなるエビデンスが求められており,筆者らのデータはそうしたニーズに応えるものである.今後,さらなるエビデンスの蓄積により,近い将来,政府の管轄のもとで臨床試験が認証され,患者およびその家族にこの技術が早期に安全に提供されることが望まれる.
略歴:2006年 東北大学大学院医学系研究科 修了,同年 同 助教,2008年 米国Oregon Health & Science大学 ポストドクトラルフェロー,2009年 同 シニアリサーチアソシエイトを経て,2011年より同 スタッフサイエンティスト.
研究テーマ:初期胚発生,リプログラミング,核移植,ES細胞.
Shoukhrat Mitalipov
米国Oregon Health & Science大学 アソシエイトサイエンティスト.
研究室URL:http://www.ohsu.edu/xd/research/centers-institutes/stem-cell-center/labs/mitalipov-lab/index.cfm
© 2012 立花眞仁・Shoukhrat Mitalipov Licensed under CC 表示 2.1 日本
(米国Oregon Health & Science大学Oregon National Primate Research Center)
email:立花眞仁
DOI: 10.7875/first.author.2012.142
Towards germline gene therapy of inherited mitochondrial diseases.
Masahito Tachibana, Paula Amato, Michelle Sparman, Joy Woodward, Dario Melguizo Sanchis, Hong Ma, Nuria Marti Gutierrez, Rebecca Tippner-Hedges, Eunju Kang, Hyo-Sang Lee, Cathy Ramsey, Keith Masterson, David Battaglia, David Lee, Diana Wu, Jeffrey Jensen, Phillip Patton, Sumita Gokhale, Richard Stouffer, Shoukhrat Mitalipov
Nature, 493, 627-631 (2013)
要 約
母系遺伝をするミトコンドリアの遺伝子異常はヒトの重篤な疾患と関連している.筆者らは,ヒトの卵子において紡錘体置換法によるミトコンドリア遺伝子の置換につき,その実現可能性を検討した.紡錘体置換法を施行した卵子と対照となる卵子における受精率は同等であった.しかしながら,紡錘体置換法を施行した卵子においては,約半数に前核の数の異常など受精の異常を認めた.正常に受精した紡錘体置換法を施行した卵子は対照となる卵子と同等の胚盤胞の発生率とES細胞の樹立率を示した.正常に受精した紡錘体置換法を施行した卵子に由来するES細胞は正常な核型を示し,ミトコンドリア遺伝子はほぼ排他的に細胞質ドナーに由来していた.筆者らの検討により,紡錘体置換法によりヒトの卵子においてミトコンドリア遺伝子は効率に置き換えられることが示された.紡錘体置換法を施行した一部の卵子は受精に異常を示したものの,正常に受精した卵子は対照と遜色ない胚発生を示し,正常なES細胞を生み出すことが可能であった.
はじめに
核遺伝子とは異なり,ミトコンドリア遺伝子は細胞質にあるミトコンドリアに存在し,それぞれの細胞は多コピーのミトコンドリア遺伝子をもつ.そして,ミトコンドリア病の患者においてミトコンドリア遺伝子の変異は,すべてが同一の変異体(ホモプラスミー),あるいは,正常と変異体の混合(ヘテロプラスミー)として存在しうる.ミトコンドリア病の臨床症状は多様であり,さまざまな臓器の障害と関連するが,しばしばエネルギーの需要の高い器官あるいは組織に対し影響を及ぼす1).疾患の発症,重症度,症状は変異ミトコンドリア遺伝子の種類と変異体の割合に依存する1).
ミトコンドリア遺伝病の罹患者は約5000~10,000人に1人と推定される2,3).現時点でミトコンドリア病の治癒は望めず,治療は対処療法と進行の遅延を目的とした投薬のみである.それゆえ,母から子への変異ミトコンドリア遺伝子の伝達を防ぐいくつかの生殖補助技術が提唱されてきた.そのひとつが紡錘体置換法である4).この技術は,染色体(核遺伝子)を患者の未受精卵から単離し,健常なミトコンドリアを含む除核されたドナーの卵子の細胞質へ導入する.これにより,子は患者の核遺伝子を継承し,ドナーから健常なミトコンドリア遺伝子を継承する(図1).
さきに筆者らは,紡錘体置換法の霊長類モデルについて報告し,実現可能性のみでなく,効率的で正常な受精および健康な産仔を得ることが可能なことを証明した4).今回,健康なドナーにより供与されたヒトの卵子を用いて,紡錘体置換法の実現可能性と胚発生について検討した.また,付加的な検討として,霊長類モデルにおいて,凍結融解した卵子における紡錘体置換法の実現可能性,および,生後の発育について検討した.
1.ヒトの卵子におけるミトコンドリア遺伝子の置換
7人の卵子のドナー(21~32歳)に対し排卵誘発を施行し,計106個の成熟卵を採取した(ドナー1人あたり7~28個,平均15個).65個の卵子に対し紡錘体置換法を施行した.そのうち64個の卵子において,紡錘体を最小の細胞質(カリオプラスト)とともに単離し置換することに成功した.60個の卵子は顕微授精ののちにも生存し,うち44個が受精した.この結果は,対照として顕微授精のみを施行した33個の卵子における,顕微授精ののちの生存32個,および,受精24個と同等であった.紡錘体置換法を施行した受精胚を詳細に検討したところ,約半数は正常な2前核2極体を示していたが,残りの受精胚は異常な受精を示し異常な数の前核または極体をもっていた.異常な受精は対照となる卵子においても認められたが低頻度であった.正常に受精した紡錘体置換法を施行した卵子の胚盤胞の発生率は,対照となる卵子と統計学的に同等であった(図2).
2.ES細胞の樹立と遺伝学的な検討
卵子のさらなる発育能力の評価や,細胞遺伝学的および分子生物学的な検討のため,胚盤胞へ発育した紡錘体置換法を施行した卵子からES細胞(embryonic stem cell,胚性幹細胞)を樹立した.対照となる卵子から発生した16個の胚盤胞(すべて正常受精)から9株のES細胞が樹立された.このES細胞の樹立率は,これまでに報告された体外受精の治療より寄与された卵子を用いたものよりも高い率であった5).同様に,紡錘体置換法を施行した卵子から発生した胚盤胞のうち正常受精の13個から5株のES細胞が樹立された.さらに,紡錘体置換法を施行した卵子から発生した胚盤胞のうち異常受精の6個からもES細胞の樹立を試みたところ,3前核1極体を示す胚盤胞から1株のES細胞を得た(図2).
紡錘体置換法を施行した卵子から樹立されたES細胞は,対照となる卵子から樹立されたES細胞と類似しており,すべての多能性マーカーの発現を認め,さらに,SCIDマウスへの移植により三胚葉すべての組織への分化を認めた.遺伝学的な検討により,すべてのES細胞において,核遺伝子およびミトコンドリア遺伝子は,それぞれ,紡錘体ドナーと細胞質ドナーに由来していることが示された.紡錘体ドナーからの持ち込まれたミトコンドリア遺伝子の量は平均して1%以下であり,ミトコンドリア遺伝子は細胞質ドナーに由来するものにほぼ置換されていた.
紡錘体置換法を施行した卵子が正常に受精し発生した胚盤胞から樹立された5株のES細胞は,すべて正常な核型を示した.興味深いことに,対照となる卵子が正常に受精し発生した胚盤胞から樹立されたES細胞において,9株のうち2株に異数性の染色体異常が認められた.しかるに,この種の異数性は紡錘体置換法と直接に関連するものではないと考えられた.また,紡錘体置換法を施行した卵子が異常受精し発生した3前核1極体を示す胚盤胞から樹立された1株のES細胞において,余剰な染色体セットを認められ,過剰な紡錘体ドナーに由来するアリルの存在が明らかになった.これは,第2極体の放出障害によるものと考えられ,過剰な前核と第2極体の欠損による3前核1極体の所見と一致した.
3.ヒトに対する紡錘体置換法における受精の異常の原因
ヒトにおいて紡錘体置換法を施行した卵子の半数に受精の異常を認めたが,これは霊長類モデル4) では認められなかった予期せぬ結果であった.紡錘体置換法を施行した卵子のうち受精に異常を示したものの大半が第2極体の放出障害に起因する3前核1極体を示したことから,紡錘体置換法において用いられるサイトカラシンB,および,導入された紡錘体の極性や卵子の早期の活性化に焦点をあてて異常の原因を検討した.しかし,サイトカラシンBの濃度の変化や紡錘体の極性による受精異常の割合に変化は認められず,これらは原因として除外された.しかし,再構築された卵子を固定染色したところ,霊長類モデルでは認められなかった減数分裂の再開をいくつかにおいて認めた.それゆえ,ヒトに対する紡錘体置換法における受精の異常は,この卵子の早期の活性化に起因していると推察された.ヒトの卵子はサルの卵子と比較して紡錘体置換法の操作に敏感であり,一部の卵子は早期の活性化を生じていたものと考えられた.
4.霊長類モデルにおける追加の検討
現在の紡錘体置換法のプロトコールでは患者とドナーから施行日に卵子を得る必要があり,排卵誘発の同期が必須である.しかし,ホルモンに対する反応性は個々で異なっており臨床において問題となりうる.そこで,凍結融解した卵子を用いることはこうした問題を解決する有用な手段と考えられる.そこで,凍結融解を行ったアカゲザルの卵子を用いて紡錘体置換法の実現可能性と発育能力を検討した.その結果,紡錘体置換法により,凍結融解した卵子を用いてもES細胞の樹立と健康な産仔を得ることが可能であることが示された.この成功の鍵は新鮮な細胞質を使用することであり,凍結融解操作を行った紡錘体(染色体)でも,新鮮な細胞質へ導入することにより胚発生を示した.
また,2009年に紡錘体置換法により誕生したサル4) の追跡調査においては,4匹(Mito,Tracker,Spindler,Spindy)すべてが正常な成長を示しており,健康状態にも問題はなく,紡錘体ドナーに由来するミトコンドリア遺伝子の増加(ヘテロプラスミーの変化)は認められなかった.
おわりに
今回,筆者らは,紡錘体置換法によりヒトの卵子においても効率的にミトコンドリア遺伝子の置換が可能であることを示した.紡錘体置換法を施行した卵子の約半数に受精の異常を認めたものの,正常に受精した卵子は対照となる卵子と遜色のない胚発生とES細胞の樹立率を示した.しかるに,臨床の現場においては,通常の体外受精と同様に,前核の注意深い観察により正常な胚を選択することができると考えられる.また,霊長類モデルにおける検討は,凍結融解した卵子を用いても紡錘体置換法は効率的に行えることを示した.臨床への応用を考慮した際,紡錘体置換法の施行に先行して患者の卵子を凍結保存することが可能であることが示唆された.これは,臨床のうえで問題になるであろう排卵誘発の同期の問題が克服される可能性を示す.また,2009年に紡錘体置換法により誕生したサルは,健康で正常な成長をみせている.筆者らは,今後も生殖能力を含めこのサルの追跡調査を継続していく予定である.
紡錘体置換法は,現在,臨床的に重篤なミトコンドリア病を回避する手法として考慮されている6).倫理面に関しても,最近,英国Nuffield Council on Bioethicsはこの治療に対しサポートするコメントを発表している.しかし,臨床試験の開始にさきだち,ヒトの卵子を用いた検討において安全性に関するさらなるエビデンスが求められており,筆者らのデータはそうしたニーズに応えるものである.今後,さらなるエビデンスの蓄積により,近い将来,政府の管轄のもとで臨床試験が認証され,患者およびその家族にこの技術が早期に安全に提供されることが望まれる.
文 献
- Gropman, A. L.: Diagnosis and treatment of childhood mitochondrial diseases. Curr. Neurol. Neurosci. Rep., 1, 185-194 (2001)[PubMed]
- Haas, R. H., Parikh, S., Falk, M. J. et al.: Mitochondrial disease: a practical approach for primary care physicians. Pediatrics, 120, 1326-1333 (2007)[PubMed]
- Schaefer, A. M., McFarland, R., Blakely, E. L. et al.: Prevalence of mitochondrial DNA disease in adults. Ann. Neurol., 63, 35-39 (2008)[PubMed]
- Tachibana, M., Sparman, M, Sritanaudomchai, H. et al.: Mitochondrial gene replacement in primate offspring and embryonic stem cells. Nature, 461, 367-372 (2009)[PubMed]
- Cowan, C. A., Klimanskaya, I., McMahon, J. et al.: Derivation of embryonic stem-cell lines from human blastocysts. N. Engl. J. Med., 350, 1353-1356 (2004)[PubMed]
- Callaway, E.: UK sets sights on gene therapy in eggs. Nature, 481, 419 (2012)[PubMed]
著者プロフィール
略歴:2006年 東北大学大学院医学系研究科 修了,同年 同 助教,2008年 米国Oregon Health & Science大学 ポストドクトラルフェロー,2009年 同 シニアリサーチアソシエイトを経て,2011年より同 スタッフサイエンティスト.
研究テーマ:初期胚発生,リプログラミング,核移植,ES細胞.
Shoukhrat Mitalipov
米国Oregon Health & Science大学 アソシエイトサイエンティスト.
研究室URL:http://www.ohsu.edu/xd/research/centers-institutes/stem-cell-center/labs/mitalipov-lab/index.cfm
© 2012 立花眞仁・Shoukhrat Mitalipov Licensed under CC 表示 2.1 日本