血友病Aの動物モデルにおいて第VIII因子の止血作用を代替する遺伝子組換えヒト化バイスペシフィック抗体の創製
北沢剛久1・井川智之1・嶋 緑倫2・服部有宏1
(1中外製薬富士御殿場研究所,2奈良県立医科大学 小児科学)
email:北沢剛久
DOI: 10.7875/first.author.2012.134
A bispecific antibody to factors IXa and X restores factor VIII hemostatic activity in a hemophilia A model.
Takehisa Kitazawa, Tomoyuki Igawa, Zenjiro Sampei, Atsushi Muto, Tetsuo Kojima, Tetsuhiro Soeda, Kazutaka Yoshihashi, Yukiko Okuyama-Nishida, Hiroyuki Saito, Hiroyuki Tsunoda, Tsukasa Suzuki, Hideki Adachi, Taro Miyazaki, Shinya Ishii, Mika Kamata-Sakurai, Takeo Iida, Aya Harada, Keiko Esaki, Miho Funaki, Chifumi Moriyama, Eriko Tanaka, Yasufumi Kikuchi, Tetsuya Wakabayashi, Manabu Wada, Masaaki Goto, Takeshi Toyoda, Atsunori Ueyama, Sachiyo Suzuki, Kenta Haraya, Tatsuhiko Tachibana, Yoshiki Kawabe, Midori Shima, Akira Yoshioka, Kunihiro Hattori
Nature Medicine, 18, 1570-1574 (2012)
血友病Aは第VIII因子の先天性の欠乏に起因する出血性の疾患であり,第VIII因子の活性が正常の1%未満である重症例では小児期より重篤な出血をくり返す.出血を止めるために第VIII因子が投与されるが,近年では,出血を予防する目的で第VIII因子を定期補充する治療も実施されている.ところが,第VIII因子の外来性ゆえ,重症例の約30%においては第VIII因子を阻害する抗体が誘導され,その場合,治療効果はなくなってしまう.さらに,第VIII因子の皮下からの生物学的な利用率は低く,また,半減期は0.5日と短いため,第VIII因子の定期補充には頻回にわたる静脈注射が必要となる.筆者らは,これら課題を克服すべく,第VIII因子の機能を代替する第IXa因子と第X因子に対するヒト化バイスペシフィック抗体を創製した.この抗体は第VIII因子を欠乏した血漿において第VIII因子を阻害する抗体の存在の有無にかかわらず凝固促進活性を発揮し,血友病Aの動物モデルにおいて止血作用を示した.さらに,この抗体は皮下からの生物学的な利用率が高く,また,約2週間の半減期をもつことが動物において示された.このバイスペシフィック抗体は第VIII因子を阻害する抗体の影響をうけず,皮下投与が可能で持続性の高い薬剤であり,血友病Aにおける治療の負担を大きく軽減しうると考えられた.
血友病AはX染色体への連鎖遺伝により発症する出血性の疾患であり,その罹患率は男性1万人に約1人と報告されている.血友病Aにおいて,残存する第VIII因子の活性と出血症状の重篤度とは相関し,第VIII因子の活性が正常の1%未満の場合は重症に分類される.血友病Aの約半数は重症であり,のちにのべる出血予防をしないかぎり,おおむね毎月1回以上の出血を経験する.そのなかでも関節に生じる出血は激しい疼痛をともなうのみならず,反復すると関節症をきたして不可逆的な関節障害につながるため大きな問題となっている.
血友病Aの治療には血漿に由来するまたは遺伝子組換えの第VIII因子製剤が使用される.近年では,出血を止める目的だけではなく,出血を予防するための定期補充も実施されている.定期補充は第VIII因子の活性をつねに正常の1%以上に保つ,すなわち,中等症(第VIII因子の活性が1~5%)の状態にすることを目標に実施される.これにより,出血回数のみならず乳幼児期から定期補充をつづければ関節障害のリスクも大きく減らすことができる1,2).しかしながら,第VIII因子の活性をつねに1%以上に保つには,通常,週に3回の第VIII因子製剤の投与が必要になる.また,第VIII因子は皮下からの生物学的な利用率が低いため静脈注射により投与される.血友病においては多くの国で自己注射(家庭療法)が認められており患者やその家族の生活の向上に寄与しているが,一方で,とくに血管の確保のむずかしい小児期には家庭での静脈注射が大きな負担となっている3).
さらに,血友病Aでは遺伝的に第VIII因子が欠乏しており投与された第VIII因子は外来性の異物となるため,第VIII因子を阻害する抗体が誘導されることがある.この抗体は“インヒビター”とよばれ,重症例の約30%に生じる.インヒビターを保有している場合,投与する第VIII因子製剤の治療効果はなくなるか大きく低減する.したがって,第VIII因子製剤の代わりに別の作用機序をもつバイパス止血製剤が用いられるが,第VIII因子製剤に比べバイパス止血製剤の止血効果は不確実であり,半減期が短く,非常に高価である.そのため,インヒビターを保有する患者の止血管理はいっそうむずかしくなる1).このように,第VIII因子製剤は血友病Aの治療において大きな効果を発揮している一方,頻回の静脈注射の問題,および,インヒビターの問題をともなっている.そのため,これらの問題を解決する新しい薬剤が求められていた.
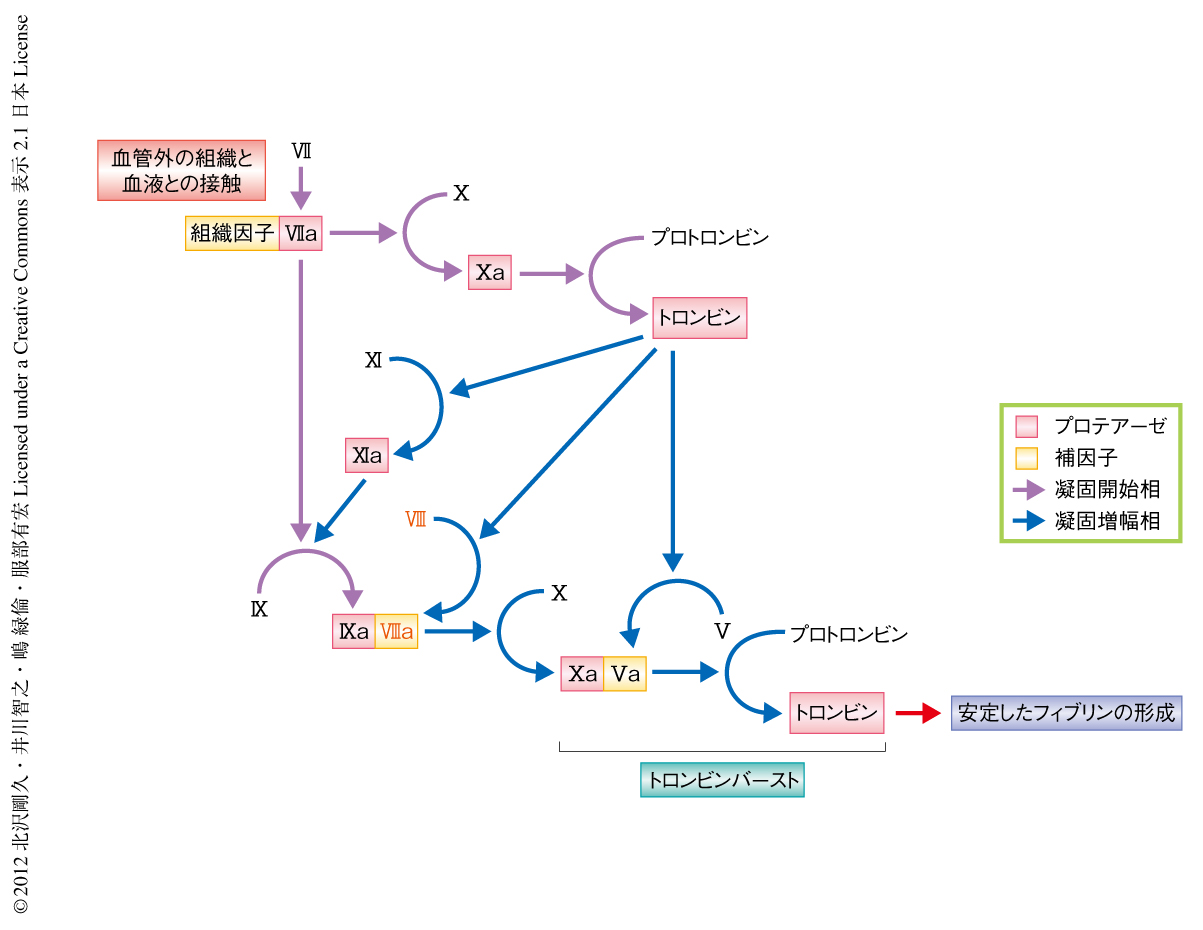
血管が破綻し血液が血管の外に流出すると,血管外に豊富に存在する組織因子と血液中の第VII因子とが接触し,凝固反応が開始される(図1).第VII因子は組織因子と複合体を形成することによりその活性化が促進され,生じた第VIIa因子-組織因子複合体はプロテアーゼ前駆体である第X因子を活性化する.その活性化体である第Xa因子はプロトロンビンを活性化し,少量のトロンビンが形成される.生じたトロンビンは補因子の前駆体である第VIII因子を活性化させる.活性化された第VIIIa因子は第IXa因子と複合体を形成し,第IXa因子による第X因子の活性化反応を飛躍的に促進する.その結果,つぎつぎに生み出される第Xa因子はその補因子である第Va因子と複合体を形成し,プロトロンビンをトロンビンへと爆発的に変換する.この現象はトロンビンバーストとよばれる.大量のトロンビンはフィブリノゲンをフィブリンに変換し,その結果,血液は固まる.これが血液凝固のしくみである.血友病Aでは補因子である第VIII因子が欠乏しているため,第IXa因子による第X因子の活性化反応が進まず,その結果,トロンビンの爆発的な形成が生じず止血栓の形成が不十分になる.そのため,出血が重篤化してしまうのである.
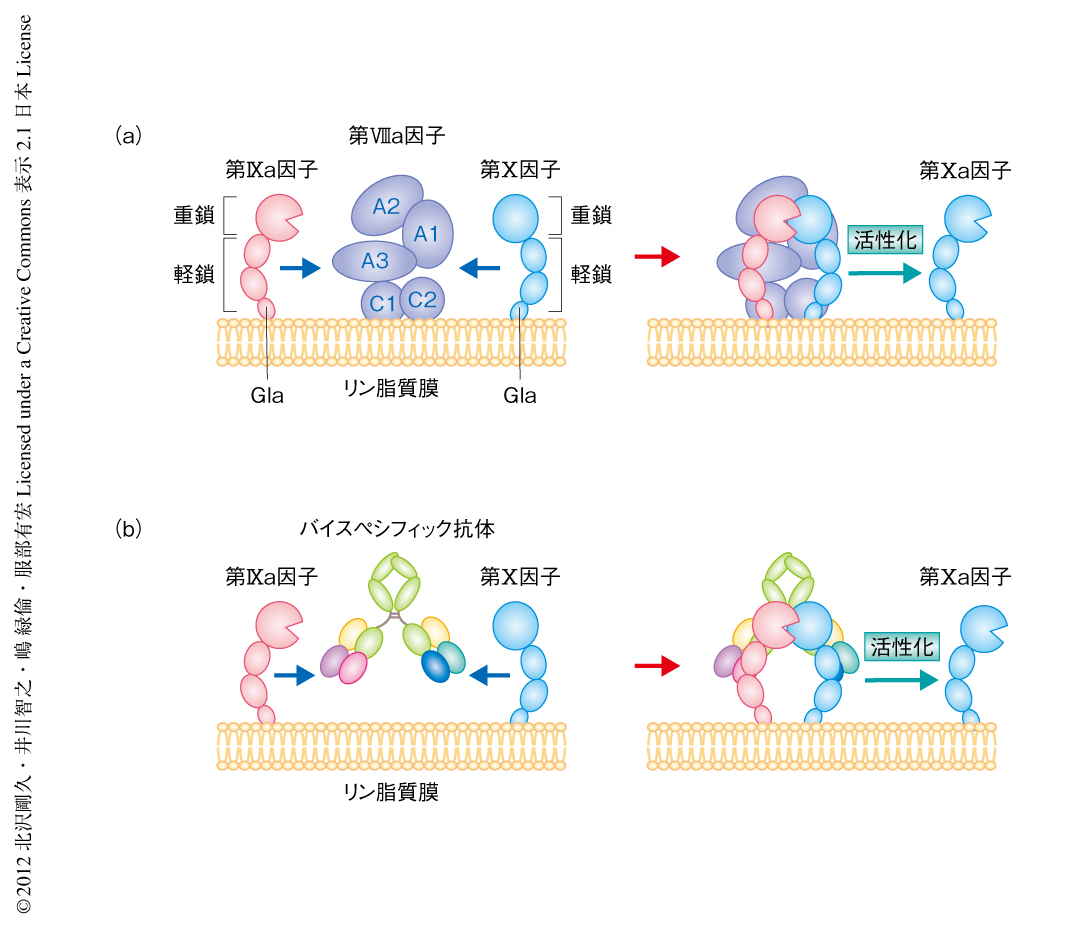
第VIIIa因子はA1領域,A2領域,軽鎖(A3領域-C1領域-C2領域)からなる.C1領域およびC2領域は,活性化した血小板膜など細胞膜の表面に存在する負に荷電したリン脂質に結合する.この第VIIIa因子は,同様に負に荷電したリン脂質に結合する第IXa因子および第X因子と結合し,第IXa因子と第X因子との相互作用を促進するとともに,第IXa因子のプロテアーゼ活性部位と第X因子のプロテアーゼ切断部位を空間的に適切な位置に配置し,くわえて,第IXa因子のもつプロテアーゼ活性をアロステリック効果により高めることで,第IXa因子による第X因子の活性化反応を飛躍的に促進する(図2a).このような第VIII因子の作用機構は,1990年代後半に明らかになった4).
筆者らは,第VIII因子の補因子機能を,第IXa因子および第X因子の適切なエピトープを認識するバイスペシフィック抗体(二重特異性抗体)により代替できる可能性を提唱し(図2b),そのような抗体を創製できれば非常に有用な薬剤になりうると考えた.一般に,抗体医薬品は血漿における作用時間が長く,皮下投与が可能である.くわえて,第VIII因子とはまったく異なる分子構造をもつため第VIII因子に対するインヒビターの影響はうけず,また,それを惹起することもない.すなわち,第VIII因子の補充療法にともなう課題を解決できる.構造解析のデータからは,第VIIIa因子における第IXa因子結合部位と第X因子結合部位とのあいだの距離と,免疫グロブリンGのもつ2つの抗原結合部位のあいだの距離は同じ程度であり,この仮説は十分に実現可能であると考えた.
抗体の多様性を得るため複数の動物種(マウス,ラット,ウサギ)に第IXa因子または第X因子を免疫し,それぞれに対する抗体を100以上ずつ作製した.ついで,これら抗体の可変領域の配列をもとに,遺伝子工学的な手法を用い,約4万もの抗第IXa因子-抗第X因子バイスペシフィック抗体を発現させた.おのおののバイスペシフィック抗体につき,精製された凝固因子を用いた酵素アッセイを実施し,第IXa因子による第X因子の活性化を促進する補因子活性を測定した.この結果,補因子活性の強さと,製造を効率化するための分子改良のしやすさを勘案して,プロトタイプのバイスペシフィック抗体を選択した.このプロトタイプ抗体をヒト化し,さらに,さまざまな分子エンジニアリングをくわえ改良することにより,この研究において薬理作用の検討の対象としたバイスペシフィック抗体hBS23を創製した.
バイスペシフィック抗体hBS23は酵素アッセイにおいて,第IXa因子の存在したときのみ第X因子の活性化を促進すること,すなわち,それ自体は酵素活性をもたない補因子であることが示された.また,hBS23の第IXa因子結合部位のみからなる抗体,第X因子結合部位のみからなる抗体,あるいは,それらの混合物には補因子活性がないこと,すなわち,1分子の抗体が第IXa因子と第X因子の両方に結合することがhBS23の補因子活性に必須であることも示された.くわえて,hBS23が補因子活性を発揮するためには負に荷電したリン脂質の存在が必要であること,すなわち,活性化した血小板膜など反応の場の存在する場合にのみ凝固反応を促進することが示された.
第IXa因子による第X因子の活性化反応を促進するhBS23の補因子活性を反応速度論的に解析した.第VIIIa因子は第IXa因子(酵素)と第X因子(基質)との相互作用を促進し(ミカエリス定数Kmを低下させ),かつ,第IXa因子の酵素反応速度を高め(酵素反応速度定数kcatを上昇させ),その結果,酵素反応効率kcat/Kmを補因子がない状態に比べ飛躍的に(272,000倍)高めることが示された.一方,hBS23も酵素反応効率kcat/Kmを補因子がない状態に比べ飛躍的に(19,800倍)高めることが示された.両者を比較すると,hBS23による酵素反応効率の上昇は第VIIIa因子と比べ1/14であった.しかしながら,さきに述べたとおり,血友病Aにおいては1%の第VIII因子のレベルを維持できれば出血回数を低減し関節症の発症や進展を抑制できることから,十分な薬効を期待できる結果と考えた.
hBS23が血友病Aの患者に由来する第VIII因子を欠乏した血漿において凝固時間を短縮させることができるかどうかを,活性化部分トロンボブラスチン時間により評価した.その結果,hBS23はインヒビターを保有した血漿および保有しない血漿のいずれにおいても,活性化部分トロンボブラスチン時間を用量依存的に短縮した.一方,第VIII因子を添加したときには,インヒビターを保有しない血漿において活性化部分トロンボブラスチン時間は短縮したが,インヒビターを保有した血漿においてはまったく短縮しなかった.さらに,hBS23が第VIII因子を欠乏した血漿においてトロンビンバーストをともなう凝固機能の改善を示すことができるどうかを,トロンビン生成アッセイ5) により評価した.第VIII因子を欠乏した血漿に対しトロンビン生成アッセイを行ってもトロンビンの生成は検出されないが,そこに第VIII因子を添加するとトロンビンバーストの指標のひとつである遊離のトロンビン濃度のピーク値が用量依存的に増加する.第VIII因子を欠乏した血漿にhBS23を添加した場合も,同様に遊離のトロンビン濃度のピーク値は用量依存的に増加し,30 nMのhBS23を添加したときには1%の第VIII因子を添加したときと同じ程度のピーク値,300 nMのhBS23を添加したときには10%の第VIII因子を添加したときに近いピーク値を示した.また,インヒビターを保有した血漿に第VIII因子を添加してもトロンビンの生成はまったく観察されなかったのに対し,hBS23を添加するとインヒビターを保有しない血漿と同様にトロンビンが生成されることが確認された.
hBS23が実際にin vivoにおいて止血効果をもつかどうかを検討した.そのためには,hBS23のもつ動物種交差性の問題から,非ヒト霊長類モデルを構築する必要があった.先天性血友病Aの非ヒト霊長類モデルは入手できなかったため,カニクイザルを用いて後天性血友病Aモデルを構築することにした.カニクイザルに第VIII因子を中和する抗体を投与することにより血友病Aの状態をひき起こすことができた.ここで用いた抗第VIII因子中和抗体は,ブタの第VIII因子の活性を中和しないという特性をもち,この抗体を用いた実験においてブタの第VIII因子を陽性対照として用いることができる.hBS23の止血効果は,カニクイザルにこの抗第VIII因子中和抗体を投与して血友病Aの状態としたのち,人工的に四肢に出血を惹起するモデルを用いて検討した.このモデルにおいて,3日間の観察期間のあいだ,失血にともないヘモグロビンは経時的に低下し,出血にともない表皮における紫変部の面積は経時的に拡大した.さきに述べたトロンビン生成アッセイによる検討においてhBS23は30 nMの血漿濃度で1%の第VIII因子と同等の補因子活性をもっていたので,血漿濃度30 nM前後に維持することを目的にhBS23の用量を設定した.
その結果,hBS23は血友病Aカニクイザルモデルにおけるヘモグロビンの低下を有意に抑制し,表皮における紫変部の面積の拡大を抑制する傾向を示した.また,このときの出血症状の抑制効果は,ブタの第VIII因子を1%以上に維持することを目的に投与した陽性対照における抑制効果とおおむね同等であった.これらの結果から,hBS23の血漿濃度を30 nM前後あるいはそれ以上に保つことにより,臨床における出血予防の効果を期待できると考えられた.
カニクイザルを用いてhBS23の薬物動態的な特性を検討した.その結果,hBS23の血漿における半減期は約2週間と第VIII因子の半減期0.5日に比べ格段に長く,皮下からの生物学的な利用率は84%と高い値を示すことが確認された.このカニクイザルの実験において得られたhBS23の薬物動態パラメーターを用いて計算すると,たとえば,1 mg/kgの週1回の皮下投与により,さきに述べた止血実験におけるhBS23の最大濃度である40 nM(投与直後の濃度)をつねに大きくうわまわる状態を維持できることが示唆された.ほかの抗体医薬品に関する報告において,カニクイザルにおける抗体医薬品の薬物動態についてヒトへの外挿性は高く,また,カニクイザルに比べヒトでは薬物動態特性が少し向上する傾向のあることが示されている6).これらから,バイスペシフィック抗体hBS23は臨床においても週1回の皮下投与により出血予防の効果を発揮すると推測された.
筆者らは,これまで述べてきたとおり,バイスペシフィック抗体により第VIII因子の機能を代替するという仮説を,創製したバイスペシフィック抗体hBS23により証明した.ただし,臨床応用のためには,以下のような側面からさらなる分子改良が必要と考えている.
・生産効率を高めるための分子改良:バイスペシフィック抗体は複雑な分子構造をもつため高品質での製造がむずかしく,それを克服するためさらなる分子エンジニアリングが必要である7,8).
・免疫原性を低減させるための分子改良:一般的にヒト化抗体に対する同種抗体の発生率は低いが,そのリスクをさらに減らすための分子エンジニアリング手法が提唱されており8,9),それをこのバイスペシフィック抗体にも適用することができる.
・患者における投与の負担を低減させるための分子改良:バイスペシフィック抗体の物理化学的な安定性を高めることで製剤をより高濃度化し投与容量を低減させる分子エンジニアリング,および,このバイスペシフィック抗体の半減期をより延長する分子エンジニアリングを行うことが可能である8,10).
・補因子活性をさらに向上させる分子改良:プロトタイプのバイスペシフィック抗体の抗原結合決定部位にアミノ酸変異をくわえることにより補因子活性を高めることに成功しhBS23を創製した.同様の手法を用いて,このバイスペシフィック抗体のさらなる補因子活性の向上を期待できる.
これらの課題は残っているが,バイスペシフィック抗体hBS23は新しい血友病Aの治療薬として非常に有用な特性をもっている.これらの課題を達成した遺伝子組換えヒト化抗第IXa因子-抗第X因子バイスペシフィック抗体には,現行の血友病Aの治療薬の課題を克服し,患者,その家族,および,医療関係者の治療に関する負担を大きく減らすことが期待される.
略歴:1993年より中外製薬 研究員.
研究テーマ:バイオロジクス医薬品の創製.
抱負:患者さんへの想いを大切に,いままでにない医薬品を仲間といっしょに創りたい.
井川 智之(Tomoyuki Igawa)
中外製薬 研究員.
嶋 緑倫(Midori Shima)
奈良県立医科大学 教授.
服部 有宏(Kunihiro Hattori)
中外製薬 部長.
© 2012 北沢剛久・井川智之・嶋 緑倫・服部有宏 Licensed under CC 表示 2.1 日本
(1中外製薬富士御殿場研究所,2奈良県立医科大学 小児科学)
email:北沢剛久
DOI: 10.7875/first.author.2012.134
A bispecific antibody to factors IXa and X restores factor VIII hemostatic activity in a hemophilia A model.
Takehisa Kitazawa, Tomoyuki Igawa, Zenjiro Sampei, Atsushi Muto, Tetsuo Kojima, Tetsuhiro Soeda, Kazutaka Yoshihashi, Yukiko Okuyama-Nishida, Hiroyuki Saito, Hiroyuki Tsunoda, Tsukasa Suzuki, Hideki Adachi, Taro Miyazaki, Shinya Ishii, Mika Kamata-Sakurai, Takeo Iida, Aya Harada, Keiko Esaki, Miho Funaki, Chifumi Moriyama, Eriko Tanaka, Yasufumi Kikuchi, Tetsuya Wakabayashi, Manabu Wada, Masaaki Goto, Takeshi Toyoda, Atsunori Ueyama, Sachiyo Suzuki, Kenta Haraya, Tatsuhiko Tachibana, Yoshiki Kawabe, Midori Shima, Akira Yoshioka, Kunihiro Hattori
Nature Medicine, 18, 1570-1574 (2012)
要 約
血友病Aは第VIII因子の先天性の欠乏に起因する出血性の疾患であり,第VIII因子の活性が正常の1%未満である重症例では小児期より重篤な出血をくり返す.出血を止めるために第VIII因子が投与されるが,近年では,出血を予防する目的で第VIII因子を定期補充する治療も実施されている.ところが,第VIII因子の外来性ゆえ,重症例の約30%においては第VIII因子を阻害する抗体が誘導され,その場合,治療効果はなくなってしまう.さらに,第VIII因子の皮下からの生物学的な利用率は低く,また,半減期は0.5日と短いため,第VIII因子の定期補充には頻回にわたる静脈注射が必要となる.筆者らは,これら課題を克服すべく,第VIII因子の機能を代替する第IXa因子と第X因子に対するヒト化バイスペシフィック抗体を創製した.この抗体は第VIII因子を欠乏した血漿において第VIII因子を阻害する抗体の存在の有無にかかわらず凝固促進活性を発揮し,血友病Aの動物モデルにおいて止血作用を示した.さらに,この抗体は皮下からの生物学的な利用率が高く,また,約2週間の半減期をもつことが動物において示された.このバイスペシフィック抗体は第VIII因子を阻害する抗体の影響をうけず,皮下投与が可能で持続性の高い薬剤であり,血友病Aにおける治療の負担を大きく軽減しうると考えられた.
はじめに
血友病AはX染色体への連鎖遺伝により発症する出血性の疾患であり,その罹患率は男性1万人に約1人と報告されている.血友病Aにおいて,残存する第VIII因子の活性と出血症状の重篤度とは相関し,第VIII因子の活性が正常の1%未満の場合は重症に分類される.血友病Aの約半数は重症であり,のちにのべる出血予防をしないかぎり,おおむね毎月1回以上の出血を経験する.そのなかでも関節に生じる出血は激しい疼痛をともなうのみならず,反復すると関節症をきたして不可逆的な関節障害につながるため大きな問題となっている.
血友病Aの治療には血漿に由来するまたは遺伝子組換えの第VIII因子製剤が使用される.近年では,出血を止める目的だけではなく,出血を予防するための定期補充も実施されている.定期補充は第VIII因子の活性をつねに正常の1%以上に保つ,すなわち,中等症(第VIII因子の活性が1~5%)の状態にすることを目標に実施される.これにより,出血回数のみならず乳幼児期から定期補充をつづければ関節障害のリスクも大きく減らすことができる1,2).しかしながら,第VIII因子の活性をつねに1%以上に保つには,通常,週に3回の第VIII因子製剤の投与が必要になる.また,第VIII因子は皮下からの生物学的な利用率が低いため静脈注射により投与される.血友病においては多くの国で自己注射(家庭療法)が認められており患者やその家族の生活の向上に寄与しているが,一方で,とくに血管の確保のむずかしい小児期には家庭での静脈注射が大きな負担となっている3).
さらに,血友病Aでは遺伝的に第VIII因子が欠乏しており投与された第VIII因子は外来性の異物となるため,第VIII因子を阻害する抗体が誘導されることがある.この抗体は“インヒビター”とよばれ,重症例の約30%に生じる.インヒビターを保有している場合,投与する第VIII因子製剤の治療効果はなくなるか大きく低減する.したがって,第VIII因子製剤の代わりに別の作用機序をもつバイパス止血製剤が用いられるが,第VIII因子製剤に比べバイパス止血製剤の止血効果は不確実であり,半減期が短く,非常に高価である.そのため,インヒビターを保有する患者の止血管理はいっそうむずかしくなる1).このように,第VIII因子製剤は血友病Aの治療において大きな効果を発揮している一方,頻回の静脈注射の問題,および,インヒビターの問題をともなっている.そのため,これらの問題を解決する新しい薬剤が求められていた.
血管が破綻し血液が血管の外に流出すると,血管外に豊富に存在する組織因子と血液中の第VII因子とが接触し,凝固反応が開始される(図1).第VII因子は組織因子と複合体を形成することによりその活性化が促進され,生じた第VIIa因子-組織因子複合体はプロテアーゼ前駆体である第X因子を活性化する.その活性化体である第Xa因子はプロトロンビンを活性化し,少量のトロンビンが形成される.生じたトロンビンは補因子の前駆体である第VIII因子を活性化させる.活性化された第VIIIa因子は第IXa因子と複合体を形成し,第IXa因子による第X因子の活性化反応を飛躍的に促進する.その結果,つぎつぎに生み出される第Xa因子はその補因子である第Va因子と複合体を形成し,プロトロンビンをトロンビンへと爆発的に変換する.この現象はトロンビンバーストとよばれる.大量のトロンビンはフィブリノゲンをフィブリンに変換し,その結果,血液は固まる.これが血液凝固のしくみである.血友病Aでは補因子である第VIII因子が欠乏しているため,第IXa因子による第X因子の活性化反応が進まず,その結果,トロンビンの爆発的な形成が生じず止血栓の形成が不十分になる.そのため,出血が重篤化してしまうのである.
第VIIIa因子はA1領域,A2領域,軽鎖(A3領域-C1領域-C2領域)からなる.C1領域およびC2領域は,活性化した血小板膜など細胞膜の表面に存在する負に荷電したリン脂質に結合する.この第VIIIa因子は,同様に負に荷電したリン脂質に結合する第IXa因子および第X因子と結合し,第IXa因子と第X因子との相互作用を促進するとともに,第IXa因子のプロテアーゼ活性部位と第X因子のプロテアーゼ切断部位を空間的に適切な位置に配置し,くわえて,第IXa因子のもつプロテアーゼ活性をアロステリック効果により高めることで,第IXa因子による第X因子の活性化反応を飛躍的に促進する(図2a).このような第VIII因子の作用機構は,1990年代後半に明らかになった4).
1.第VIII因子の機能を代替するバイスペシフィック抗体の創製
筆者らは,第VIII因子の補因子機能を,第IXa因子および第X因子の適切なエピトープを認識するバイスペシフィック抗体(二重特異性抗体)により代替できる可能性を提唱し(図2b),そのような抗体を創製できれば非常に有用な薬剤になりうると考えた.一般に,抗体医薬品は血漿における作用時間が長く,皮下投与が可能である.くわえて,第VIII因子とはまったく異なる分子構造をもつため第VIII因子に対するインヒビターの影響はうけず,また,それを惹起することもない.すなわち,第VIII因子の補充療法にともなう課題を解決できる.構造解析のデータからは,第VIIIa因子における第IXa因子結合部位と第X因子結合部位とのあいだの距離と,免疫グロブリンGのもつ2つの抗原結合部位のあいだの距離は同じ程度であり,この仮説は十分に実現可能であると考えた.
抗体の多様性を得るため複数の動物種(マウス,ラット,ウサギ)に第IXa因子または第X因子を免疫し,それぞれに対する抗体を100以上ずつ作製した.ついで,これら抗体の可変領域の配列をもとに,遺伝子工学的な手法を用い,約4万もの抗第IXa因子-抗第X因子バイスペシフィック抗体を発現させた.おのおののバイスペシフィック抗体につき,精製された凝固因子を用いた酵素アッセイを実施し,第IXa因子による第X因子の活性化を促進する補因子活性を測定した.この結果,補因子活性の強さと,製造を効率化するための分子改良のしやすさを勘案して,プロトタイプのバイスペシフィック抗体を選択した.このプロトタイプ抗体をヒト化し,さらに,さまざまな分子エンジニアリングをくわえ改良することにより,この研究において薬理作用の検討の対象としたバイスペシフィック抗体hBS23を創製した.
2.バイスペシフィック抗体hBS23のもつ補因子活性
バイスペシフィック抗体hBS23は酵素アッセイにおいて,第IXa因子の存在したときのみ第X因子の活性化を促進すること,すなわち,それ自体は酵素活性をもたない補因子であることが示された.また,hBS23の第IXa因子結合部位のみからなる抗体,第X因子結合部位のみからなる抗体,あるいは,それらの混合物には補因子活性がないこと,すなわち,1分子の抗体が第IXa因子と第X因子の両方に結合することがhBS23の補因子活性に必須であることも示された.くわえて,hBS23が補因子活性を発揮するためには負に荷電したリン脂質の存在が必要であること,すなわち,活性化した血小板膜など反応の場の存在する場合にのみ凝固反応を促進することが示された.
第IXa因子による第X因子の活性化反応を促進するhBS23の補因子活性を反応速度論的に解析した.第VIIIa因子は第IXa因子(酵素)と第X因子(基質)との相互作用を促進し(ミカエリス定数Kmを低下させ),かつ,第IXa因子の酵素反応速度を高め(酵素反応速度定数kcatを上昇させ),その結果,酵素反応効率kcat/Kmを補因子がない状態に比べ飛躍的に(272,000倍)高めることが示された.一方,hBS23も酵素反応効率kcat/Kmを補因子がない状態に比べ飛躍的に(19,800倍)高めることが示された.両者を比較すると,hBS23による酵素反応効率の上昇は第VIIIa因子と比べ1/14であった.しかしながら,さきに述べたとおり,血友病Aにおいては1%の第VIII因子のレベルを維持できれば出血回数を低減し関節症の発症や進展を抑制できることから,十分な薬効を期待できる結果と考えた.
hBS23が血友病Aの患者に由来する第VIII因子を欠乏した血漿において凝固時間を短縮させることができるかどうかを,活性化部分トロンボブラスチン時間により評価した.その結果,hBS23はインヒビターを保有した血漿および保有しない血漿のいずれにおいても,活性化部分トロンボブラスチン時間を用量依存的に短縮した.一方,第VIII因子を添加したときには,インヒビターを保有しない血漿において活性化部分トロンボブラスチン時間は短縮したが,インヒビターを保有した血漿においてはまったく短縮しなかった.さらに,hBS23が第VIII因子を欠乏した血漿においてトロンビンバーストをともなう凝固機能の改善を示すことができるどうかを,トロンビン生成アッセイ5) により評価した.第VIII因子を欠乏した血漿に対しトロンビン生成アッセイを行ってもトロンビンの生成は検出されないが,そこに第VIII因子を添加するとトロンビンバーストの指標のひとつである遊離のトロンビン濃度のピーク値が用量依存的に増加する.第VIII因子を欠乏した血漿にhBS23を添加した場合も,同様に遊離のトロンビン濃度のピーク値は用量依存的に増加し,30 nMのhBS23を添加したときには1%の第VIII因子を添加したときと同じ程度のピーク値,300 nMのhBS23を添加したときには10%の第VIII因子を添加したときに近いピーク値を示した.また,インヒビターを保有した血漿に第VIII因子を添加してもトロンビンの生成はまったく観察されなかったのに対し,hBS23を添加するとインヒビターを保有しない血漿と同様にトロンビンが生成されることが確認された.
3.バイスペシフィック抗体hBS23の血友病Aの動物モデルにおける止血効果
hBS23が実際にin vivoにおいて止血効果をもつかどうかを検討した.そのためには,hBS23のもつ動物種交差性の問題から,非ヒト霊長類モデルを構築する必要があった.先天性血友病Aの非ヒト霊長類モデルは入手できなかったため,カニクイザルを用いて後天性血友病Aモデルを構築することにした.カニクイザルに第VIII因子を中和する抗体を投与することにより血友病Aの状態をひき起こすことができた.ここで用いた抗第VIII因子中和抗体は,ブタの第VIII因子の活性を中和しないという特性をもち,この抗体を用いた実験においてブタの第VIII因子を陽性対照として用いることができる.hBS23の止血効果は,カニクイザルにこの抗第VIII因子中和抗体を投与して血友病Aの状態としたのち,人工的に四肢に出血を惹起するモデルを用いて検討した.このモデルにおいて,3日間の観察期間のあいだ,失血にともないヘモグロビンは経時的に低下し,出血にともない表皮における紫変部の面積は経時的に拡大した.さきに述べたトロンビン生成アッセイによる検討においてhBS23は30 nMの血漿濃度で1%の第VIII因子と同等の補因子活性をもっていたので,血漿濃度30 nM前後に維持することを目的にhBS23の用量を設定した.
その結果,hBS23は血友病Aカニクイザルモデルにおけるヘモグロビンの低下を有意に抑制し,表皮における紫変部の面積の拡大を抑制する傾向を示した.また,このときの出血症状の抑制効果は,ブタの第VIII因子を1%以上に維持することを目的に投与した陽性対照における抑制効果とおおむね同等であった.これらの結果から,hBS23の血漿濃度を30 nM前後あるいはそれ以上に保つことにより,臨床における出血予防の効果を期待できると考えられた.
カニクイザルを用いてhBS23の薬物動態的な特性を検討した.その結果,hBS23の血漿における半減期は約2週間と第VIII因子の半減期0.5日に比べ格段に長く,皮下からの生物学的な利用率は84%と高い値を示すことが確認された.このカニクイザルの実験において得られたhBS23の薬物動態パラメーターを用いて計算すると,たとえば,1 mg/kgの週1回の皮下投与により,さきに述べた止血実験におけるhBS23の最大濃度である40 nM(投与直後の濃度)をつねに大きくうわまわる状態を維持できることが示唆された.ほかの抗体医薬品に関する報告において,カニクイザルにおける抗体医薬品の薬物動態についてヒトへの外挿性は高く,また,カニクイザルに比べヒトでは薬物動態特性が少し向上する傾向のあることが示されている6).これらから,バイスペシフィック抗体hBS23は臨床においても週1回の皮下投与により出血予防の効果を発揮すると推測された.
おわりに
筆者らは,これまで述べてきたとおり,バイスペシフィック抗体により第VIII因子の機能を代替するという仮説を,創製したバイスペシフィック抗体hBS23により証明した.ただし,臨床応用のためには,以下のような側面からさらなる分子改良が必要と考えている.
・生産効率を高めるための分子改良:バイスペシフィック抗体は複雑な分子構造をもつため高品質での製造がむずかしく,それを克服するためさらなる分子エンジニアリングが必要である7,8).
・免疫原性を低減させるための分子改良:一般的にヒト化抗体に対する同種抗体の発生率は低いが,そのリスクをさらに減らすための分子エンジニアリング手法が提唱されており8,9),それをこのバイスペシフィック抗体にも適用することができる.
・患者における投与の負担を低減させるための分子改良:バイスペシフィック抗体の物理化学的な安定性を高めることで製剤をより高濃度化し投与容量を低減させる分子エンジニアリング,および,このバイスペシフィック抗体の半減期をより延長する分子エンジニアリングを行うことが可能である8,10).
・補因子活性をさらに向上させる分子改良:プロトタイプのバイスペシフィック抗体の抗原結合決定部位にアミノ酸変異をくわえることにより補因子活性を高めることに成功しhBS23を創製した.同様の手法を用いて,このバイスペシフィック抗体のさらなる補因子活性の向上を期待できる.
これらの課題は残っているが,バイスペシフィック抗体hBS23は新しい血友病Aの治療薬として非常に有用な特性をもっている.これらの課題を達成した遺伝子組換えヒト化抗第IXa因子-抗第X因子バイスペシフィック抗体には,現行の血友病Aの治療薬の課題を克服し,患者,その家族,および,医療関係者の治療に関する負担を大きく減らすことが期待される.
文 献
- 嶋 緑倫: 血友病の治療:最近の進歩. 日本医事新報, 4413, 59-66 (2008)
- Berntorp, E. & Shapiro, A. D.: Modern haemophilia care. Lancet, 379, 1447-1456 (2012)[PubMed]
- Hacker, M. R., Geraghty, S. & Manco-Johnson, M.: Barriers to compliance with prophylaxis therapy in haemophilia. Haemophilia, 7, 392-396 (2001)[PubMed]
- Fay, P. J.: Activation of factor VIII and mechanisms of cofactor action. Blood Rev., 18, 1-15 (2004)[PubMed]
- 嶋 緑倫, 松本智子: トロンビン生成試験の実際と応用. 日本血栓止血学会誌, 18, 217-225 (2007)
- Deng, R., Iyer, S., Theil, F. P. et al.: Projecting human pharmacokinetics of therapeutic antibodies from nonclinical data: what have we learned? MAbs, 3, 61-66 (2011)[PubMed]
- Merchant, A. M., Zhu, Z., Yuan, J. Q. et al.: An efficient route to human bispecific IgG. Nat. Biotechnol., 16, 677-681 (1998)[PubMed]
- Igawa, T., Tsunoda, H., Kumamochi, T. et al.: Engineering the variable region of therapeutic IgG antibodies. MAbs, 3, 243-252 (2011)[PubMed]
- Baker, M. P., Reynolds H. M., Lumicisi, B. et al.: Immunogenicity of protein therapeutics: the key causes, consequences and challenges. Self Nonself, 1, 314-322 (2010)[PubMed]
- Igawa, T., Tsunoda, H., Tachibana, T. et al.: Reduced elimination of IgG antibodies by engineering the variable region. Protein Eng. Des. Sel., 23, 385-392 (2010)[PubMed]
著者プロフィール
略歴:1993年より中外製薬 研究員.
研究テーマ:バイオロジクス医薬品の創製.
抱負:患者さんへの想いを大切に,いままでにない医薬品を仲間といっしょに創りたい.
井川 智之(Tomoyuki Igawa)
中外製薬 研究員.
嶋 緑倫(Midori Shima)
奈良県立医科大学 教授.
服部 有宏(Kunihiro Hattori)
中外製薬 部長.
© 2012 北沢剛久・井川智之・嶋 緑倫・服部有宏 Licensed under CC 表示 2.1 日本