哺乳動物における小胞体膜への尾部アンカー型膜タンパク質の挿入機構
山本泰憲・匂坂敏朗
(神戸大学大学院医学研究科 膜動態学分野)
email:山本泰憲
DOI: 10.7875/first.author.2012.130
Molecular machinery for insertion of tail-anchored membrane proteins into the endoplasmic reticulum membrane in mammalian cells.
Yasunori Yamamoto, Toshiaki Sakisaka
Molecular Cell, 48, 387-397 (2012)
尾部アンカー型膜タンパク質は翻訳終結ののち小胞体膜へと挿入され,分泌経路により輸送される.しかしながら,哺乳動物において,小胞体への尾部アンカー型膜タンパク質の翻訳終結後の膜挿入の分子機構は不明であった.今回,筆者らは,哺乳動物において尾部アンカー型膜タンパク質の膜挿入装置の分子実態を明らかにした.翻訳終結の直後の新生した尾部アンカー型膜タンパク質を認識するATPaseであるTRC40に着目し,TRC40に結合する哺乳類に特異的な受容体型タンパク質としてCAMLを同定した.CAMLは進化的に保存されたTRC40の受容体であるWRBと膜貫通領域を介して結合し,WRBと協調して尾部アンカー型膜タンパク質の膜挿入を行っていた.CAMLの変異導入解析により,CAMLとWRBによる協調した膜挿入には,CAMLとTRC40との結合が必須であることがわかった.以上の結果から,2種類のTRC40の受容体,CAMLとWRBにより構成される複合体が哺乳動物の小胞体における尾部アンカー型膜タンパク質の膜挿入装置であることが明らかになった.
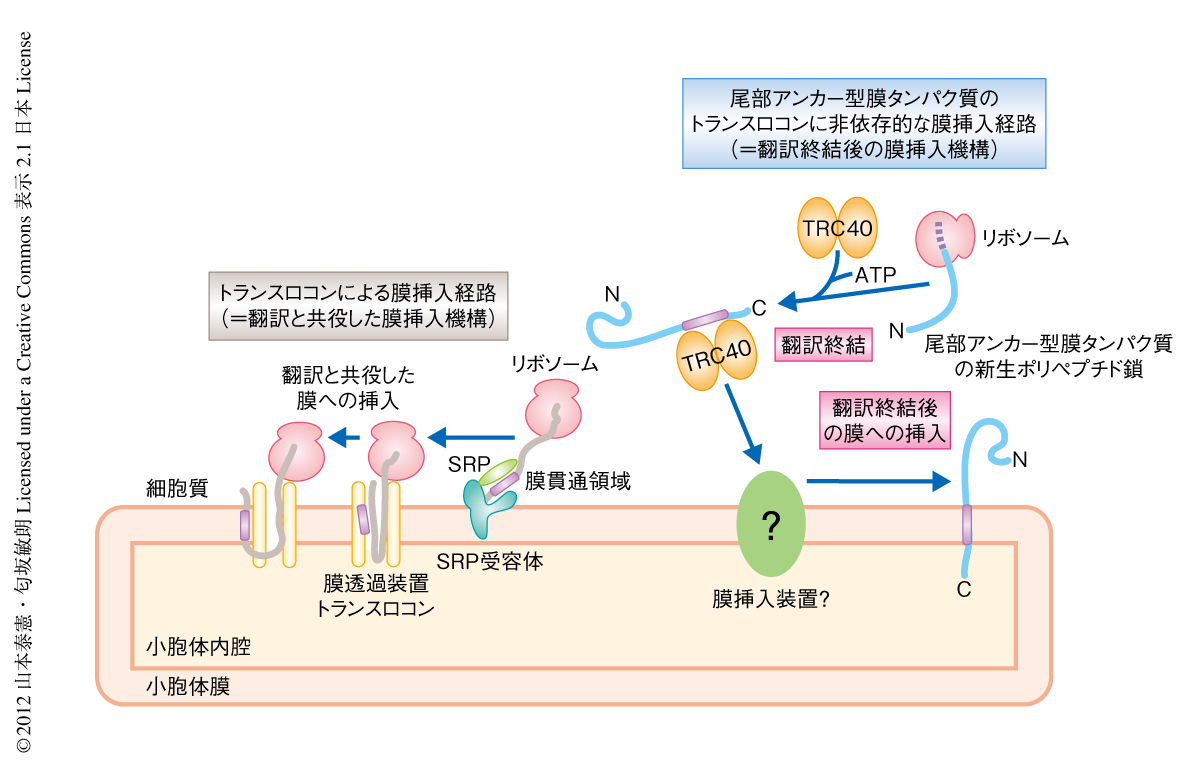
真核生物は多種多様な膜タンパク質を小胞体膜に挿入し,分泌経路により輸送し適切に配置することで生命活動を行っている.もっとも主要な膜タンパク質の小胞体への膜挿入系として,SRP(signal recognition particle,シグナル認識粒子),SRP受容体,膜透過装置トランスロコン(Sec61複合体)による翻訳と共役した膜挿入機構がある1)(図1).しかしながら,すべての膜タンパク質がトランスロコンを利用できるわけではない.尾部アンカー型膜タンパク質はC末端側に1つの膜貫通領域をもち,N末端が細胞質にある一群の膜タンパク質であり,膜輸送,脂質合成,オルガネラ生合成,タンパク質の品質管理など,さまざまな重要な機能を担っている2).尾部アンカー型膜タンパク質はシグナル配列がリボソームの外にでてくるまえに翻訳が終結するため,トランスロコンによる小胞体膜への挿入は物理的に不可能であり,必然的に,翻訳ののち膜挿入される3)(図1).
哺乳動物では,細胞質に局在するATPaseであるTRC40が翻訳終結の直後の新生した尾部アンカー型膜タンパク質の膜貫通領域を認識し小胞体へとリクルートする4)(図1).しかしながら,そののちの膜挿入の過程については不明な点がきわめて多い.他方,遺伝学的な解析の容易な下等真核生物である出芽酵母ではGET経路が同定されている5).GET経路の構成タンパク質におけるアミノ酸配列の相同性から,TRC40の小胞体膜における受容体としてWRBが同定されている6).しかしながら,GET経路を構成するすべてのタンパク質が哺乳動物において完全に保存されているわけではないこと,および,哺乳動物に特異的な制御タンパク質も存在する7) ことから,哺乳動物における尾部アンカー型膜タンパク質の翻訳終結後の膜挿入機構,とりわけ,膜挿入装置は長いあいだ不明であった.この研究では,哺乳動物の小胞体における尾部アンカー型膜タンパク質の膜挿入装置の分子実態を明らかにした.
哺乳動物の小胞体における尾部アンカー型膜タンパク質の翻訳終結後の膜挿入機構を明らかにするため,TRC40に結合する小胞体膜タンパク質の同定をアフィニティークロマトグラフィー法により試みた.GSTとTRC40との融合タンパク質を固相化したカラムにブタの脳から得たTriton X-100抽出液をアプライし,精製されたタンパク質を質量分析により同定した.その結果,TRC40に結合する分子量38,000のタンパク質としてCAML(calcium-modulating cyclophilin ligand)を同定した.CAMLはもともとT細胞受容体のシグナル伝達を制御する小胞体膜タンパク質として単離され8),のちに,免疫系のみならず,胚発生9),神経伝達10),血管収縮11) におけるさまざまなシグナル伝達を制御していることが報告されている.他方,CAMLは脊椎動物のあいだで高度に保存されたタンパク質であり,臓器に普遍的に発現しているが,普遍的な小胞体膜タンパク質としてのCAMLの生理機能については不明であった.そこで,このCAMLに着目し,その尾部アンカー型膜タンパク質の翻訳終結後の膜挿入における役割について検討を行った.
CAMLとTRC40との結合をHEK293細胞を用いた共免疫沈降法により検討したところ,CAMLはN末端の細胞質領域においてTRC40と結合していた.HeLa細胞にTRC40を過剰発現して免疫染色したところ,TRC40は細胞の全体に拡散していたが,TRC40とCAMLとを同時に過剰発現するとTRC40はCAMLの局在する小胞体膜にリクルートされていた.以上の結果から,CAMLはN末端の細胞質領域においてTRC40と結合し,小胞体膜においてTRC40の受容体として機能することが明らかになった.
CAMLとTRC40との結合が尾部アンカー型膜タンパク質の小胞体膜への翻訳終結後の膜挿入にあたえる影響について調べた.尾部アンカー型膜タンパク質であるSec61βのN末端にFLAGタグ,C末端にopsinタグ(糖鎖付加配列)を導入したものをウサギ網状赤血球抽出液を用いin vitroにおいて翻訳し,シクロヘキシミドにより翻訳反応を停止したのち,イヌの膵臓に由来するミクロソームとインキュベーションしたところ,小胞体膜に挿入され糖鎖が付加された.この反応をCAMLの細胞質領域のみからなる断片の存在のもと行うと糖鎖の付加は顕著に低下したことから,CAMLとTRC40との結合は尾部アンカー型膜タンパク質の小胞体膜への翻訳終結後の膜挿入に重要なはたらきをしていることが明らかになった.CAMLが膜挿入に対し促進的にはたらくのか抑制的にはたらくのかを調べるため,CAMLをsiRNAによりノックダウンしたHEK293細胞に由来する小胞体膜を用いて,さきと同様にタグを付加したSec61βの翻訳終結後の膜挿入を検討した.対照のHEK293細胞と比べ,CAMLをノックダウンしたHEK293細胞では糖鎖の付加は顕著に低下した.他方,TRC40に非依存的な尾部アンカー型膜タンパク質であるシトクロムb5の膜挿入に影響はなかった.以上のことから,CAMLはTRC40による尾部アンカー型膜タンパク質の翻訳終結後の膜挿入を正に制御するタンパク質であることが明らかになった.
CAMLによる尾部アンカー型膜タンパク質の膜挿入における制御機構をさらにくわしく理解するため,CAMLタンパク質複合体の単離および同定を行った.FLAGタグを付加したCAMLを安定に発現するHEK293細胞株を樹立し,その細胞抽出液よりFLAG抗体固相化カラムを用いてCAMLタンパク質複合体を精製し,質量分析により解析したところ,TRC40にくわえ,新たにTRC40の小胞体膜における受容体としてすでに報告のあるWRBが同定された.CAMLとWRBとの結合をHEK293細胞を用いた共免疫沈降法により検討したところ,CAMLはC末端の膜貫通領域においてWRBと結合していた.
尾部アンカー型膜タンパク質の膜挿入におけるCAMLとWRBとの結合の役割を調べた.CAMLあるいはWRBを単独で過剰発現させたHEK293細胞においては,内在性のTRC40の作用は阻害され,タグを付加したSec61βの小胞体への膜挿入は低下した.これらの抑制効果はCAMLとWRBの両方を過剰発現させることにより完全に消失した.以上のことから,CAMLとWRBは小胞体膜においてTRC40受容体複合体を形成し,協調的に尾部アンカー型膜タンパク質の翻訳終結後の膜挿入を行っていることが明らかになった.
CAMLもWRBも細胞質領域においてTRC40と結合することから,これら三者の結合について検討した.HeLa細胞にWRBとTRC40を過剰発現すると,TRC40はWRBの局在する小胞体膜にリクルートされた.ここにCAMLの細胞質領域のみのフラグメントを過剰発現すると,TRC40の小胞体へのリクルートは阻害された.また,CAMLの細胞質領域のみ,WRBの細胞質のコイルドコイルドメイン,および,TRC40をそれぞれ大腸菌で発現させて精製し,これら三者の結合をin vitroにおいて生化学的に検討したところ,WRBの細胞質領域はCAMLの細胞質領域とTRC40との結合を用量依存的に阻害し,代わって,WRBの細胞質領域とTRC40とが結合していた.以上の結果から,CAMLとWRBは競合的にTRC40と結合することが明らかになった.
さまざまな脊椎動物のゲノムにコードされているCAMLのアミノ酸配列を比較したところ,CAMLは細胞質領域のN末端の付近に高度に保存された塩基性アミノ酸残基のクラスターをもつことがわかった.この塩基性アミノ酸クラスターを酸性アミノ酸残基であるグルタミン酸残基に置換した変異体はTRC40との結合能を完全に消失したことから,CAMLのもつ保存された塩基性アミノ酸クラスター領域はTRC40との結合に重要なはたらきをしていることが明らかになった.CAMLの酸性アミノ酸クラスター置換変異体の性状をさらに解析したところ,小胞体への局在およびWRBとの結合能にまったく影響のないことがわかった.そこで,この置換変異体を用いて,尾部アンカー型膜タンパク質の翻訳終結後の膜挿入におけるCAMLとWRBのTRC40への競合的な結合の役割を調べた.さきに述べたように,WRBを単独で過剰発現させたHEK293細胞では内在性のTRC40の作用が阻害されタグを付加したSec61βの小胞体への膜挿入が低下した一方,この膜挿入の低下はCAMLとWRBの両方を過剰発現させることにより完全に回復した.ところが,CAMLの酸性アミノ酸クラスター置換変異体とWRBの両方を過剰発現させたHEK293細胞では,WRBを単独で過剰発現させたときの膜挿入の低下を回復させたものの,その回復は野生型のCAMLとWRBの両方を過剰発現させたときに比べ著しく低かった.したがって,尾部アンカー型膜タンパク質の翻訳終結後の膜挿入においてはTRC40のWRBへの結合だけでは不十分であり,TRC40のCAML-WRB複合体への競合的な結合が必須であることが明らかになった.
以上の結果を総合し,長年にわたり不明であった哺乳動物の小胞体における尾部アンカー型膜タンパク質の翻訳終結後の膜挿入を担う膜挿入装置の分子実態は,CAMLとWRBという2種類のTRC40受容体からなる複合体であることが明らかになった.
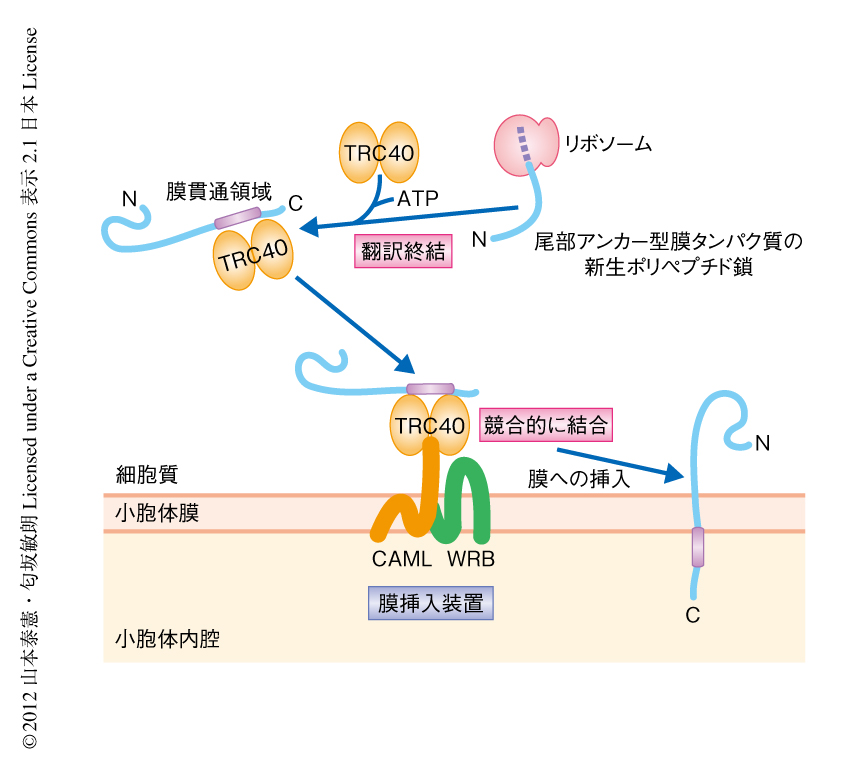
今回,筆者らは,哺乳動物の小胞体における尾部アンカー型膜タンパク質の膜挿入装置の実態がCAML-WRB複合体であることを明らかにした(図2).生化学的な解析により,CAMLとWRBとの競合的なTRC40への結合が膜挿入に必須であることを明らかにしたが,分子機械としてのCAML-WRB複合体が,実際にどのような機序によりTRC40を受け取り,脂質膜の構造を制御して尾部アンカー型膜タンパク質を翻訳終結ののちに膜挿入するのかについて,その駆動機構はいまのところ不明である.出芽酵母にはCAMLのホモログは存在しない一方,GET経路における膜挿入装置であるGET1-GET2複合体のうちのGET1はWRBの相同タンパク質である6).GET2とCAMLにはアミノ酸配列の相同性はまったくないが,膜挿入に関して一部に重複した機能をもつ可能性も考えられる.これを明らかにするためには,今後,TRC40-CAML-WRB複合体の立体構造解析と人工膜再構成系による解析が必要であると思われる.
CAMLは哺乳動物のみならず鳥類,両生類,魚類などにおいて高度に保存されている.したがって,CAML-WRB複合体による尾部アンカー型膜タンパク質の膜挿入機構は脊椎動物のあいだで広く保存されている可能性が高い.一方,CAMLはもともとヒトの免疫細胞の活性化を制御するシグナル伝達タンパク質として同定されたものであり,そののち,免疫系のみならず,胚発生,神経伝達,血管収縮においてさまざまなシグナル伝達を制御していることが報告されている.CAMLに結合してシグナル伝達を制御するタンパク質として,EGF受容体,p56LCK,TACI,ATRAP,GABAA受容体などが報告されているが,これらのシグナル伝達タンパク質が尾部アンカー型膜タンパク質の膜挿入機構に関与しているのかどうかは,今後,検討すべき課題である.今回の膜挿入装置としてのCAMLの発見をきっかけに,膜挿入の制御とシグナル伝達の制御とのあいだの未知の関係あるいはクロストークの存在が明らかになる可能性があり,きわめて興味深い.
略歴:2003年 大阪大学大学院医学系研究科博士課程 修了,米国Pittsburgh大学 ポスドクなどを経て,2007年より神戸大学大学院医学研究科 助教.
研究テーマ:小胞体における膜タンパク質の生合成の機構と小胞輸送.
抱負:生体分子(タンパク質および脂質)のあいだの弱い化学結合と自己組織化,相転移の視点から小胞体の機能と構造をとらえ,生命における散逸構造構築の化学原理にせまっていきたい.
匂坂 敏朗(Toshiaki Sakisaka)
神戸大学大学院医学研究科 教授
研究室URL:http://www.med.kobe-u.ac.jp/membrd/
© 2012 山本泰憲・匂坂敏朗 Licensed under CC 表示 2.1 日本
(神戸大学大学院医学研究科 膜動態学分野)
email:山本泰憲
DOI: 10.7875/first.author.2012.130
Molecular machinery for insertion of tail-anchored membrane proteins into the endoplasmic reticulum membrane in mammalian cells.
Yasunori Yamamoto, Toshiaki Sakisaka
Molecular Cell, 48, 387-397 (2012)
要 約
尾部アンカー型膜タンパク質は翻訳終結ののち小胞体膜へと挿入され,分泌経路により輸送される.しかしながら,哺乳動物において,小胞体への尾部アンカー型膜タンパク質の翻訳終結後の膜挿入の分子機構は不明であった.今回,筆者らは,哺乳動物において尾部アンカー型膜タンパク質の膜挿入装置の分子実態を明らかにした.翻訳終結の直後の新生した尾部アンカー型膜タンパク質を認識するATPaseであるTRC40に着目し,TRC40に結合する哺乳類に特異的な受容体型タンパク質としてCAMLを同定した.CAMLは進化的に保存されたTRC40の受容体であるWRBと膜貫通領域を介して結合し,WRBと協調して尾部アンカー型膜タンパク質の膜挿入を行っていた.CAMLの変異導入解析により,CAMLとWRBによる協調した膜挿入には,CAMLとTRC40との結合が必須であることがわかった.以上の結果から,2種類のTRC40の受容体,CAMLとWRBにより構成される複合体が哺乳動物の小胞体における尾部アンカー型膜タンパク質の膜挿入装置であることが明らかになった.
はじめに
真核生物は多種多様な膜タンパク質を小胞体膜に挿入し,分泌経路により輸送し適切に配置することで生命活動を行っている.もっとも主要な膜タンパク質の小胞体への膜挿入系として,SRP(signal recognition particle,シグナル認識粒子),SRP受容体,膜透過装置トランスロコン(Sec61複合体)による翻訳と共役した膜挿入機構がある1)(図1).しかしながら,すべての膜タンパク質がトランスロコンを利用できるわけではない.尾部アンカー型膜タンパク質はC末端側に1つの膜貫通領域をもち,N末端が細胞質にある一群の膜タンパク質であり,膜輸送,脂質合成,オルガネラ生合成,タンパク質の品質管理など,さまざまな重要な機能を担っている2).尾部アンカー型膜タンパク質はシグナル配列がリボソームの外にでてくるまえに翻訳が終結するため,トランスロコンによる小胞体膜への挿入は物理的に不可能であり,必然的に,翻訳ののち膜挿入される3)(図1).
哺乳動物では,細胞質に局在するATPaseであるTRC40が翻訳終結の直後の新生した尾部アンカー型膜タンパク質の膜貫通領域を認識し小胞体へとリクルートする4)(図1).しかしながら,そののちの膜挿入の過程については不明な点がきわめて多い.他方,遺伝学的な解析の容易な下等真核生物である出芽酵母ではGET経路が同定されている5).GET経路の構成タンパク質におけるアミノ酸配列の相同性から,TRC40の小胞体膜における受容体としてWRBが同定されている6).しかしながら,GET経路を構成するすべてのタンパク質が哺乳動物において完全に保存されているわけではないこと,および,哺乳動物に特異的な制御タンパク質も存在する7) ことから,哺乳動物における尾部アンカー型膜タンパク質の翻訳終結後の膜挿入機構,とりわけ,膜挿入装置は長いあいだ不明であった.この研究では,哺乳動物の小胞体における尾部アンカー型膜タンパク質の膜挿入装置の分子実態を明らかにした.
1.CAMLはN末端の細胞質領域においてTRC40と結合する小胞体膜タンパク質である
哺乳動物の小胞体における尾部アンカー型膜タンパク質の翻訳終結後の膜挿入機構を明らかにするため,TRC40に結合する小胞体膜タンパク質の同定をアフィニティークロマトグラフィー法により試みた.GSTとTRC40との融合タンパク質を固相化したカラムにブタの脳から得たTriton X-100抽出液をアプライし,精製されたタンパク質を質量分析により同定した.その結果,TRC40に結合する分子量38,000のタンパク質としてCAML(calcium-modulating cyclophilin ligand)を同定した.CAMLはもともとT細胞受容体のシグナル伝達を制御する小胞体膜タンパク質として単離され8),のちに,免疫系のみならず,胚発生9),神経伝達10),血管収縮11) におけるさまざまなシグナル伝達を制御していることが報告されている.他方,CAMLは脊椎動物のあいだで高度に保存されたタンパク質であり,臓器に普遍的に発現しているが,普遍的な小胞体膜タンパク質としてのCAMLの生理機能については不明であった.そこで,このCAMLに着目し,その尾部アンカー型膜タンパク質の翻訳終結後の膜挿入における役割について検討を行った.
CAMLとTRC40との結合をHEK293細胞を用いた共免疫沈降法により検討したところ,CAMLはN末端の細胞質領域においてTRC40と結合していた.HeLa細胞にTRC40を過剰発現して免疫染色したところ,TRC40は細胞の全体に拡散していたが,TRC40とCAMLとを同時に過剰発現するとTRC40はCAMLの局在する小胞体膜にリクルートされていた.以上の結果から,CAMLはN末端の細胞質領域においてTRC40と結合し,小胞体膜においてTRC40の受容体として機能することが明らかになった.
2.CAMLはTRC40を介した尾部アンカー型膜タンパク質の翻訳終結後の膜挿入に必須である
CAMLとTRC40との結合が尾部アンカー型膜タンパク質の小胞体膜への翻訳終結後の膜挿入にあたえる影響について調べた.尾部アンカー型膜タンパク質であるSec61βのN末端にFLAGタグ,C末端にopsinタグ(糖鎖付加配列)を導入したものをウサギ網状赤血球抽出液を用いin vitroにおいて翻訳し,シクロヘキシミドにより翻訳反応を停止したのち,イヌの膵臓に由来するミクロソームとインキュベーションしたところ,小胞体膜に挿入され糖鎖が付加された.この反応をCAMLの細胞質領域のみからなる断片の存在のもと行うと糖鎖の付加は顕著に低下したことから,CAMLとTRC40との結合は尾部アンカー型膜タンパク質の小胞体膜への翻訳終結後の膜挿入に重要なはたらきをしていることが明らかになった.CAMLが膜挿入に対し促進的にはたらくのか抑制的にはたらくのかを調べるため,CAMLをsiRNAによりノックダウンしたHEK293細胞に由来する小胞体膜を用いて,さきと同様にタグを付加したSec61βの翻訳終結後の膜挿入を検討した.対照のHEK293細胞と比べ,CAMLをノックダウンしたHEK293細胞では糖鎖の付加は顕著に低下した.他方,TRC40に非依存的な尾部アンカー型膜タンパク質であるシトクロムb5の膜挿入に影響はなかった.以上のことから,CAMLはTRC40による尾部アンカー型膜タンパク質の翻訳終結後の膜挿入を正に制御するタンパク質であることが明らかになった.
3.CAMLはWRBとTRC40受容体複合体を形成し協調的に尾部アンカー型膜タンパク質の翻訳終結後の膜挿入を行う
CAMLによる尾部アンカー型膜タンパク質の膜挿入における制御機構をさらにくわしく理解するため,CAMLタンパク質複合体の単離および同定を行った.FLAGタグを付加したCAMLを安定に発現するHEK293細胞株を樹立し,その細胞抽出液よりFLAG抗体固相化カラムを用いてCAMLタンパク質複合体を精製し,質量分析により解析したところ,TRC40にくわえ,新たにTRC40の小胞体膜における受容体としてすでに報告のあるWRBが同定された.CAMLとWRBとの結合をHEK293細胞を用いた共免疫沈降法により検討したところ,CAMLはC末端の膜貫通領域においてWRBと結合していた.
尾部アンカー型膜タンパク質の膜挿入におけるCAMLとWRBとの結合の役割を調べた.CAMLあるいはWRBを単独で過剰発現させたHEK293細胞においては,内在性のTRC40の作用は阻害され,タグを付加したSec61βの小胞体への膜挿入は低下した.これらの抑制効果はCAMLとWRBの両方を過剰発現させることにより完全に消失した.以上のことから,CAMLとWRBは小胞体膜においてTRC40受容体複合体を形成し,協調的に尾部アンカー型膜タンパク質の翻訳終結後の膜挿入を行っていることが明らかになった.
4.CAMLとWRBはTRC40と競合的に結合する
CAMLもWRBも細胞質領域においてTRC40と結合することから,これら三者の結合について検討した.HeLa細胞にWRBとTRC40を過剰発現すると,TRC40はWRBの局在する小胞体膜にリクルートされた.ここにCAMLの細胞質領域のみのフラグメントを過剰発現すると,TRC40の小胞体へのリクルートは阻害された.また,CAMLの細胞質領域のみ,WRBの細胞質のコイルドコイルドメイン,および,TRC40をそれぞれ大腸菌で発現させて精製し,これら三者の結合をin vitroにおいて生化学的に検討したところ,WRBの細胞質領域はCAMLの細胞質領域とTRC40との結合を用量依存的に阻害し,代わって,WRBの細胞質領域とTRC40とが結合していた.以上の結果から,CAMLとWRBは競合的にTRC40と結合することが明らかになった.
5.TRC40のCAML-WRB複合体への競合的な結合は尾部アンカー型膜タンパク質の翻訳終結後の膜挿入に必須である
さまざまな脊椎動物のゲノムにコードされているCAMLのアミノ酸配列を比較したところ,CAMLは細胞質領域のN末端の付近に高度に保存された塩基性アミノ酸残基のクラスターをもつことがわかった.この塩基性アミノ酸クラスターを酸性アミノ酸残基であるグルタミン酸残基に置換した変異体はTRC40との結合能を完全に消失したことから,CAMLのもつ保存された塩基性アミノ酸クラスター領域はTRC40との結合に重要なはたらきをしていることが明らかになった.CAMLの酸性アミノ酸クラスター置換変異体の性状をさらに解析したところ,小胞体への局在およびWRBとの結合能にまったく影響のないことがわかった.そこで,この置換変異体を用いて,尾部アンカー型膜タンパク質の翻訳終結後の膜挿入におけるCAMLとWRBのTRC40への競合的な結合の役割を調べた.さきに述べたように,WRBを単独で過剰発現させたHEK293細胞では内在性のTRC40の作用が阻害されタグを付加したSec61βの小胞体への膜挿入が低下した一方,この膜挿入の低下はCAMLとWRBの両方を過剰発現させることにより完全に回復した.ところが,CAMLの酸性アミノ酸クラスター置換変異体とWRBの両方を過剰発現させたHEK293細胞では,WRBを単独で過剰発現させたときの膜挿入の低下を回復させたものの,その回復は野生型のCAMLとWRBの両方を過剰発現させたときに比べ著しく低かった.したがって,尾部アンカー型膜タンパク質の翻訳終結後の膜挿入においてはTRC40のWRBへの結合だけでは不十分であり,TRC40のCAML-WRB複合体への競合的な結合が必須であることが明らかになった.
以上の結果を総合し,長年にわたり不明であった哺乳動物の小胞体における尾部アンカー型膜タンパク質の翻訳終結後の膜挿入を担う膜挿入装置の分子実態は,CAMLとWRBという2種類のTRC40受容体からなる複合体であることが明らかになった.
おわりに
今回,筆者らは,哺乳動物の小胞体における尾部アンカー型膜タンパク質の膜挿入装置の実態がCAML-WRB複合体であることを明らかにした(図2).生化学的な解析により,CAMLとWRBとの競合的なTRC40への結合が膜挿入に必須であることを明らかにしたが,分子機械としてのCAML-WRB複合体が,実際にどのような機序によりTRC40を受け取り,脂質膜の構造を制御して尾部アンカー型膜タンパク質を翻訳終結ののちに膜挿入するのかについて,その駆動機構はいまのところ不明である.出芽酵母にはCAMLのホモログは存在しない一方,GET経路における膜挿入装置であるGET1-GET2複合体のうちのGET1はWRBの相同タンパク質である6).GET2とCAMLにはアミノ酸配列の相同性はまったくないが,膜挿入に関して一部に重複した機能をもつ可能性も考えられる.これを明らかにするためには,今後,TRC40-CAML-WRB複合体の立体構造解析と人工膜再構成系による解析が必要であると思われる.
CAMLは哺乳動物のみならず鳥類,両生類,魚類などにおいて高度に保存されている.したがって,CAML-WRB複合体による尾部アンカー型膜タンパク質の膜挿入機構は脊椎動物のあいだで広く保存されている可能性が高い.一方,CAMLはもともとヒトの免疫細胞の活性化を制御するシグナル伝達タンパク質として同定されたものであり,そののち,免疫系のみならず,胚発生,神経伝達,血管収縮においてさまざまなシグナル伝達を制御していることが報告されている.CAMLに結合してシグナル伝達を制御するタンパク質として,EGF受容体,p56LCK,TACI,ATRAP,GABAA受容体などが報告されているが,これらのシグナル伝達タンパク質が尾部アンカー型膜タンパク質の膜挿入機構に関与しているのかどうかは,今後,検討すべき課題である.今回の膜挿入装置としてのCAMLの発見をきっかけに,膜挿入の制御とシグナル伝達の制御とのあいだの未知の関係あるいはクロストークの存在が明らかになる可能性があり,きわめて興味深い.
文 献
- Osborne, A. R., Rapoport, T. A., & van den Berg, B.: Protein translocation by the Sec61/SecY channel. Annu. Rev. Cell Dev. Biol., 21, 529-550 (2005)[PubMed]
- Borgese, N., Colombo, S. & Pedrazzini, E.: The tale of tail-anchored proteins: coming from the cytosol and looking for a membrane. J. Cell Biol., 161, 1013-1019 (2003)[PubMed]
- Shao, S., and Hegde, R. S.: Membrane protein insertion at the endoplasmic reticulum. Annu. Rev. Cell Dev. Biol. 27, 25-56 (2011)[PubMed]
- Stefanovic, S., & Hegde, R. S.: Identification of a targeting factor for posttranslational membrane protein insertion into the ER. Cell, 128, 1147-159 (2007)[PubMed]
- Schuldiner, M., Metz. J., Schmid, V. et al.: The GET complex mediates insertion of tail-anchored proteins into the ER membrane. Cell, 134, 634-645 (2008)[PubMed]
- Vilardi, F., Lorenz, H. & Dobberstein, B.: WRB is the receptor for TRC40/Asna1-mediated insertion of tail-anchored proteins into the ER membrane. J. Cell Sci., 124, 1301-1307 (2011)[PubMed]
- Mariappan, M., Li, X., Stefanovic, S. et al.: A ribosome-associating factor chaperones tail-anchored membrane proteins. Nature, 466, 1120-1124 (2010)[PubMed]
- Bram, R. J. & Crabtree, G. R.: Calcium signalling in T cells stimulated by a cyclophilin B-binding protein. Nature, 371, 355-358 (1994)[PubMed]
- Tran, D. D., Russell, H. R., Sutor, S. L. et al.: CAML is required for efficient EGF receptor recycling. Dev. Cell, 5, 245-256 (2003)[PubMed]
- Yuan, X., Yao, J., Norris, D. et al.: Calcium-modulating cyclophilin ligand regulates membrane trafficking of postsynaptic GABAA receptors. Mol. Cell. Neurosci., 38, 277-289 (2008)[PubMed]
- Guo, S., Lopez-Ilasaca, M. & Dzau, V. J.: Identification of calcium-modulating cyclophilin ligand (CAML) as transducer of angiotensin II-mediated nuclear factor of activated T cells (NFAT) activation. J. Biol. Chem., 280, 12536-12541 (2005)[PubMed]
著者プロフィール
略歴:2003年 大阪大学大学院医学系研究科博士課程 修了,米国Pittsburgh大学 ポスドクなどを経て,2007年より神戸大学大学院医学研究科 助教.
研究テーマ:小胞体における膜タンパク質の生合成の機構と小胞輸送.
抱負:生体分子(タンパク質および脂質)のあいだの弱い化学結合と自己組織化,相転移の視点から小胞体の機能と構造をとらえ,生命における散逸構造構築の化学原理にせまっていきたい.
匂坂 敏朗(Toshiaki Sakisaka)
神戸大学大学院医学研究科 教授
研究室URL:http://www.med.kobe-u.ac.jp/membrd/
© 2012 山本泰憲・匂坂敏朗 Licensed under CC 表示 2.1 日本