新生した血管から放出されるプロスタサイクリンは神経回路の再生を促進する
村松里衣子・山下俊英
(大阪大学大学院医学系研究科 分子神経科学)
email:村松里衣子,山下俊英
DOI: 10.7875/first.author.2012.129
Angiogenesis induced by CNS inflammation promotes neuronal remodeling through vessel-derived prostacyclin.
Rieko Muramatsu, Chisato Takahashi, Shuzo Miyake, Harutoshi Fujimura, Hideki Mochizuki, Toshihide Yamashita
Nature Medicine, 16, 1658-1664 (2012)
血管の新生は傷害をうけた中枢神経組織の主要な特徴であり,病変において炎症を悪化させたり組織の修復をもたらしたりすることが知られている.筆者らは,脳脊髄炎において形成される新生血管は傷ついた中枢神経回路の修復を促進することを見い出した.マウスの胸髄において脳脊髄炎を誘導すると,四肢の運動機能を制御する皮質脊髄路が脱落する.時間がたつにつれ病巣の周囲では血管の新生が起こり,ついで,残存した皮質脊髄路から軸索枝が発芽した.この軸索枝は,新しい神経回路を構築することで脳脊髄炎により失われた運動機能を代償するものであった.さらに,マウスの脳の血管内皮細胞と大脳皮質のニューロンとの共培養実験により,血管内皮細胞から分泌されるプロスタサイクリンがニューロンのもつIP受容体に作用することが軸索の伸長に重要であることを発見した.IP受容体の発現をノックダウンした脳脊髄炎マウスでは,皮質脊髄路における側枝の形成と四肢の麻痺症状の自然回復が抑制された.これらの結果から,新生した血管には神経回路の修復を高める作用のあることが明らかになった.今回の研究成果は,プロスタサイクリンが中枢神経疾患の治療薬として有望であることを示したものであった.
脳や脊髄において炎症が生じると,神経回路が脱落し,運動機能の不全,感覚の障害,認知機能の障害など重篤な症状が生じる.この症状は時間がたつにつれ,わずかではあるが自然に回復する.これは,損傷により失われた神経の機能を代償する新しい神経回路が,残存する神経回路から形成されたためと考えられている1).多発性硬化症は中枢神経系における自己免疫疾患であり,脳脊髄の神経軸索2),とくに,大脳皮質第5層を発し脊髄へと投射する皮質脊髄路の軸索が炎症性の細胞により傷害をうける.皮質脊髄路は手足の運動機能を制御する神経回路であり,その傷害は手足の運動機能の障害や麻痺を導く.この症状は時間がたつにつれ自然に回復するが,これは皮質脊髄路が修復された結果であることが多発性硬化症に類似する脳脊髄炎を発症する動物モデルから指摘されていた3).しかし,傷ついた神経回路がなぜ自然に修復されるのか,その生体における機構は明らかにされていなかった.
炎症に関連するタンパク質には血管の新生を高めるはたらきがあり,多発性硬化症をはじめ多くの中枢神経疾患の病変において顕著な血管の新生が観察されている4).古くから,新生した血管は組織を修復させるものと考えられているが,神経回路の修復との関連は不明だった.筆者らは,新生した血管が神経回路を修復させると考え研究を行った.
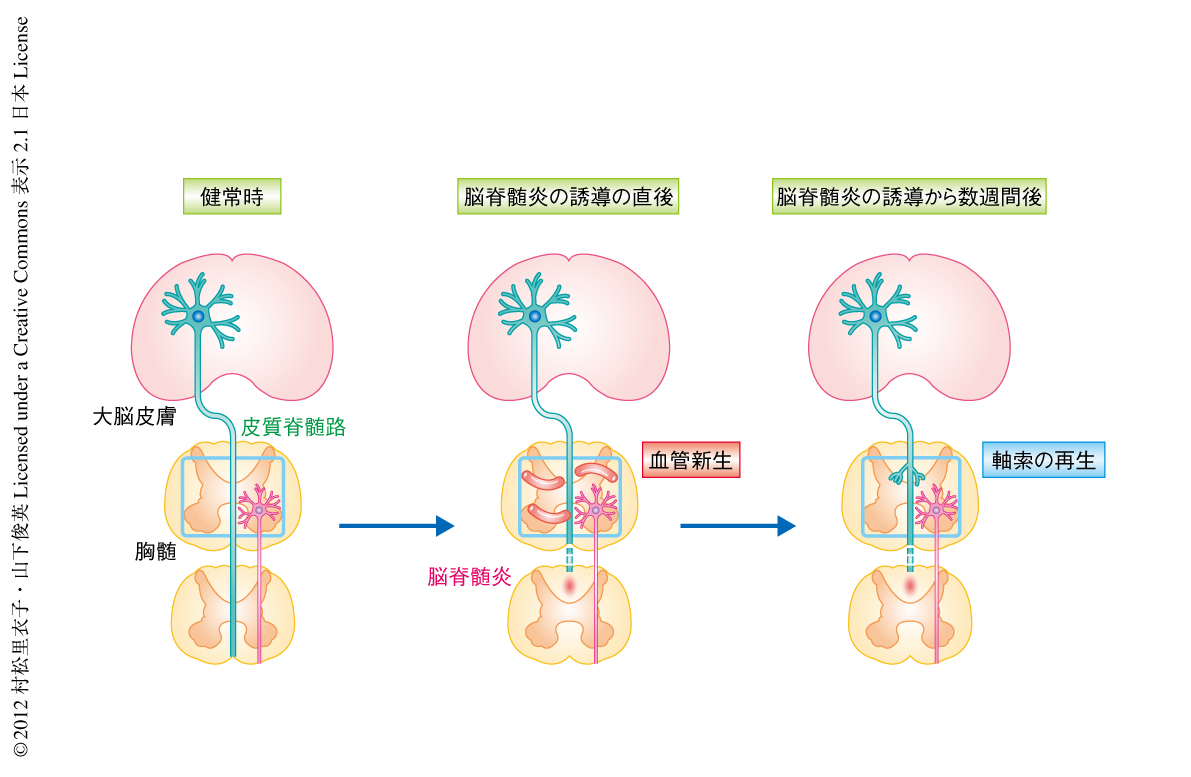
胸髄背側に限局して脳脊髄炎を誘導するマウスを作製した.このマウスでは後肢の運動機能が障害されていたが,時間がたつにつれ症状は自然に回復した.脳脊髄炎を誘導すると炎症の部位より下位の皮質脊髄路の軸索が脱落し,症状の回復した時期においても脱落した軸索の再生は認められなかった.このことから,運動機能の障害の改善は残存する皮質脊髄路が代償的な神経回路を形成したためと考え,つづいて,皮質脊髄路にトレーサーを注入することでこれを可視化し,脳脊髄炎の誘導ののちの軸索の走行を詳細に解析した.すると,脳脊髄炎の誘導から2週間のち,炎症の周囲に残存する皮質脊髄路から軸索枝が発芽していた.この軸索枝は,胸髄の介在性ニューロンを介し腰髄へとむかう神経回路を形成するものであった.この結果から,脳脊髄炎ののち,残存する皮質脊髄路から発芽した軸索枝により運動機能の障害が改善されることが示唆された.
神経系の発達においては周囲に備わる因子による軸索の誘導が重要である5).脳脊髄炎ののちに修復された皮質脊髄路は発生期の運動神経回路とは異なるため,病態のもとでの神経回路の形成は発生期とは異なる因子の関与が予想された.一方,さまざまな疾患において炎症は血管の新生を促すことが示唆されており,多発性硬化症の患者の剖検組織においても旺盛な血管の新生が観察されている6).脳脊髄炎の誘導ののち病巣の周囲における血管の新生を経時的に観察したところ,脳脊髄炎の誘導から1週間のちに,増殖している血管のマーカーであるCD105に陽性を示す血管の数が増大しており,この増大は,脳脊髄炎の誘導から2週間のちには対照のレベルにまで低下した.血管のマーカーであるCD31の陽性を示す血管の長さを計測したところ,脳脊髄炎の誘導ののち1週間から4週間まで対照より高い状態が持続した.このことから,脳脊髄炎により病巣において血管内皮細胞の増殖により血管の数が増え,それは皮質脊髄路の修復にさきだち生じるものであることがわかった(図1).
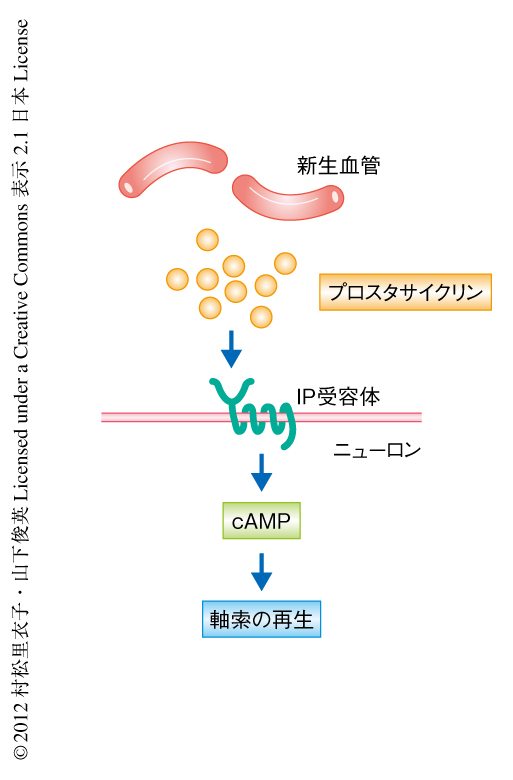
in vivoにおける結果から,新生した血管から放出される因子が軸索の伸長を促していると考え,in vitroにおいて血管内皮細胞による軸索伸長の効果を検討する実験を行った.脳の血管内皮細胞と大脳皮質のニューロンを採取し,トランスウェルを用いて共培養したとき皮質脊髄路を構成する神経突起の長さを計測した.すると,ニューロンの単独培養に比べ,血管内皮細胞との共培養により神経突起の伸長が観察された.このことは,血管内皮細胞は皮質脊髄路の神経突起の伸長を促す活性をもつことを意味した.血管内皮細胞に由来する軸索伸長因子の候補として,血管の収縮にかかわる因子の関与を検証した.その結果,血管の弛緩作用の報告されているプロスタサイクリンがcAMPの合成を高めることにより軸索の伸長を促していることを発見した.
脳脊髄炎を起こしたマウスの大脳皮質第5層のニューロンにおいて,プロスタサイクリンの受容体であるIP受容体の発現量に変化は認められなかった.一方,脳脊髄炎の誘導から1週間のちの脊髄において,プロスタサイクリン合成酵素のタンパク質量が増大していた.正常な状態の脊髄ではオリゴデンドロサイト前駆細胞と血管内皮細胞においてプロスタサイクリン合成酵素の発現が観察され,脳脊髄炎の誘導ののち,この2つの細胞におけるプロスタサイクリン合成酵素の発現量に変化はなかった.このことから,脳脊髄炎が誘導されて血管が増加することにより,脊髄組織におけるプロスタサイクリンの発現量が増大するものと考えられた.
脳脊髄炎の誘導ののちのプロスタサイクリンの量の増加が皮質脊髄路における側枝の形成に関与しているのかどうかを検討するため,大脳皮質第5層にIP受容体のsiRNAを投与したマウスを観察した.IP受容体の発現をノックダウンすると皮質脊髄路における側枝の形成は阻害され,運動機能の自然回復も遅延した.このことから,皮質脊髄路におけるIP受容体の発現が脳脊髄炎ののちの神経回路の修復に関与していることがわかった.
血管に由来するプロスタサイクリンは皮質脊髄路における側枝の形成に関与しているのかどうか,プロスタサイクリン合成酵素のsiRNAを血管内皮細胞に導入したマウスを用いて検討した.血管内皮細胞においてプロスタサイクリン合成酵素の発現をノックダウンすると,脳脊髄炎の誘導ののちの皮質脊髄路における側枝の形成と運動機能の自然回復が抑制された.このマウスの炎症の部位にIP受容体の作動薬を持続的に投与すると,側枝の形成や運動機能の回復に対する抑制効果はレスキューされた.これらの結果から,血管内皮細胞に由来するプロスタサイクリンが皮質脊髄路の修復と機能の回復に重要であることが示された(図2).
IP受容体の作動薬は脳脊髄炎の症状に対し治療効果を発揮するだろうか? 脳脊髄炎を誘導した部位にIP受容体の作動薬を処置すると,皮質脊髄路における軸索枝の数が増え,また,運動機能の回復も加速した.IP受容体の作動薬あるいは阻害薬を脳脊髄炎の部位に施したマウスから調製した培養脾細胞の上清や脊髄組織において,炎症性サイトカインの発現量に差は認められなかった.また,脳脊髄炎を誘導すると脊髄においてCD4陽性T細胞およびCD11b陽性ミクログリア/マクロファージの集積が観察されるが,それらの細胞の数にも薬剤の処置による影響はみられなかった.これらの結果は,プロスタサイクリンによる神経症状の回復に免疫系は関与していないことを示唆するものであった.
末梢組織において血管と神経はしばしば並走している.一方,成体の脳において神経と血管の回路の密接な関連は見い出されておらず,血管に由来する因子による軸索の誘導制御は発生期の末梢神経系に特異的な現象と信じられていた.この研究により,成体の中枢神経系において病態のもと形成される新生した血管の新しい役割が明らかになった.
脳脊髄炎の発症に対しプロスタサイクリンは影響しないことが示唆されている7).今回の研究成果は,病態の慢性期において観察される神経組織の自発的な修復の分子機構を明らかにしたものであり,今後,脳脊髄におけるさまざまな疾患に対する応用が期待される.
略歴:2008年 東京大学大学院薬学系研究科 修了,同年より大阪大学大学院医学系研究科 特任助教(現 助教).
研究テーマ:中枢神経疾患における神経組織の修復機構.
関心事:中枢神経疾患の治療につながる研究をつづけていきたいと考えています.ニューロン以外の細胞がニューロンにあたえる役割に興味があります.
山下 俊英(Toshihide Yamashita)
大阪大学大学院医学系研究科 教授.
研究室URL:http://www.med.osaka-u.ac.jp/pub/molneu/
© 2012 村松里衣子・山下俊英 Licensed under CC 表示 2.1 日本
(大阪大学大学院医学系研究科 分子神経科学)
email:村松里衣子,山下俊英
DOI: 10.7875/first.author.2012.129
Angiogenesis induced by CNS inflammation promotes neuronal remodeling through vessel-derived prostacyclin.
Rieko Muramatsu, Chisato Takahashi, Shuzo Miyake, Harutoshi Fujimura, Hideki Mochizuki, Toshihide Yamashita
Nature Medicine, 16, 1658-1664 (2012)
要 約
血管の新生は傷害をうけた中枢神経組織の主要な特徴であり,病変において炎症を悪化させたり組織の修復をもたらしたりすることが知られている.筆者らは,脳脊髄炎において形成される新生血管は傷ついた中枢神経回路の修復を促進することを見い出した.マウスの胸髄において脳脊髄炎を誘導すると,四肢の運動機能を制御する皮質脊髄路が脱落する.時間がたつにつれ病巣の周囲では血管の新生が起こり,ついで,残存した皮質脊髄路から軸索枝が発芽した.この軸索枝は,新しい神経回路を構築することで脳脊髄炎により失われた運動機能を代償するものであった.さらに,マウスの脳の血管内皮細胞と大脳皮質のニューロンとの共培養実験により,血管内皮細胞から分泌されるプロスタサイクリンがニューロンのもつIP受容体に作用することが軸索の伸長に重要であることを発見した.IP受容体の発現をノックダウンした脳脊髄炎マウスでは,皮質脊髄路における側枝の形成と四肢の麻痺症状の自然回復が抑制された.これらの結果から,新生した血管には神経回路の修復を高める作用のあることが明らかになった.今回の研究成果は,プロスタサイクリンが中枢神経疾患の治療薬として有望であることを示したものであった.
はじめに
脳や脊髄において炎症が生じると,神経回路が脱落し,運動機能の不全,感覚の障害,認知機能の障害など重篤な症状が生じる.この症状は時間がたつにつれ,わずかではあるが自然に回復する.これは,損傷により失われた神経の機能を代償する新しい神経回路が,残存する神経回路から形成されたためと考えられている1).多発性硬化症は中枢神経系における自己免疫疾患であり,脳脊髄の神経軸索2),とくに,大脳皮質第5層を発し脊髄へと投射する皮質脊髄路の軸索が炎症性の細胞により傷害をうける.皮質脊髄路は手足の運動機能を制御する神経回路であり,その傷害は手足の運動機能の障害や麻痺を導く.この症状は時間がたつにつれ自然に回復するが,これは皮質脊髄路が修復された結果であることが多発性硬化症に類似する脳脊髄炎を発症する動物モデルから指摘されていた3).しかし,傷ついた神経回路がなぜ自然に修復されるのか,その生体における機構は明らかにされていなかった.
炎症に関連するタンパク質には血管の新生を高めるはたらきがあり,多発性硬化症をはじめ多くの中枢神経疾患の病変において顕著な血管の新生が観察されている4).古くから,新生した血管は組織を修復させるものと考えられているが,神経回路の修復との関連は不明だった.筆者らは,新生した血管が神経回路を修復させると考え研究を行った.
1.脳脊髄炎ののち神経回路は自発的に修復する
胸髄背側に限局して脳脊髄炎を誘導するマウスを作製した.このマウスでは後肢の運動機能が障害されていたが,時間がたつにつれ症状は自然に回復した.脳脊髄炎を誘導すると炎症の部位より下位の皮質脊髄路の軸索が脱落し,症状の回復した時期においても脱落した軸索の再生は認められなかった.このことから,運動機能の障害の改善は残存する皮質脊髄路が代償的な神経回路を形成したためと考え,つづいて,皮質脊髄路にトレーサーを注入することでこれを可視化し,脳脊髄炎の誘導ののちの軸索の走行を詳細に解析した.すると,脳脊髄炎の誘導から2週間のち,炎症の周囲に残存する皮質脊髄路から軸索枝が発芽していた.この軸索枝は,胸髄の介在性ニューロンを介し腰髄へとむかう神経回路を形成するものであった.この結果から,脳脊髄炎ののち,残存する皮質脊髄路から発芽した軸索枝により運動機能の障害が改善されることが示唆された.
2.皮質脊髄路の修復にさきだち血管の新生が生じる
神経系の発達においては周囲に備わる因子による軸索の誘導が重要である5).脳脊髄炎ののちに修復された皮質脊髄路は発生期の運動神経回路とは異なるため,病態のもとでの神経回路の形成は発生期とは異なる因子の関与が予想された.一方,さまざまな疾患において炎症は血管の新生を促すことが示唆されており,多発性硬化症の患者の剖検組織においても旺盛な血管の新生が観察されている6).脳脊髄炎の誘導ののち病巣の周囲における血管の新生を経時的に観察したところ,脳脊髄炎の誘導から1週間のちに,増殖している血管のマーカーであるCD105に陽性を示す血管の数が増大しており,この増大は,脳脊髄炎の誘導から2週間のちには対照のレベルにまで低下した.血管のマーカーであるCD31の陽性を示す血管の長さを計測したところ,脳脊髄炎の誘導ののち1週間から4週間まで対照より高い状態が持続した.このことから,脳脊髄炎により病巣において血管内皮細胞の増殖により血管の数が増え,それは皮質脊髄路の修復にさきだち生じるものであることがわかった(図1).
3.プロスタサイクリンは軸索の伸長を促進する
in vivoにおける結果から,新生した血管から放出される因子が軸索の伸長を促していると考え,in vitroにおいて血管内皮細胞による軸索伸長の効果を検討する実験を行った.脳の血管内皮細胞と大脳皮質のニューロンを採取し,トランスウェルを用いて共培養したとき皮質脊髄路を構成する神経突起の長さを計測した.すると,ニューロンの単独培養に比べ,血管内皮細胞との共培養により神経突起の伸長が観察された.このことは,血管内皮細胞は皮質脊髄路の神経突起の伸長を促す活性をもつことを意味した.血管内皮細胞に由来する軸索伸長因子の候補として,血管の収縮にかかわる因子の関与を検証した.その結果,血管の弛緩作用の報告されているプロスタサイクリンがcAMPの合成を高めることにより軸索の伸長を促していることを発見した.
4.IP受容体は脳脊髄炎ののちの運動機能の回復に重要である
脳脊髄炎を起こしたマウスの大脳皮質第5層のニューロンにおいて,プロスタサイクリンの受容体であるIP受容体の発現量に変化は認められなかった.一方,脳脊髄炎の誘導から1週間のちの脊髄において,プロスタサイクリン合成酵素のタンパク質量が増大していた.正常な状態の脊髄ではオリゴデンドロサイト前駆細胞と血管内皮細胞においてプロスタサイクリン合成酵素の発現が観察され,脳脊髄炎の誘導ののち,この2つの細胞におけるプロスタサイクリン合成酵素の発現量に変化はなかった.このことから,脳脊髄炎が誘導されて血管が増加することにより,脊髄組織におけるプロスタサイクリンの発現量が増大するものと考えられた.
脳脊髄炎の誘導ののちのプロスタサイクリンの量の増加が皮質脊髄路における側枝の形成に関与しているのかどうかを検討するため,大脳皮質第5層にIP受容体のsiRNAを投与したマウスを観察した.IP受容体の発現をノックダウンすると皮質脊髄路における側枝の形成は阻害され,運動機能の自然回復も遅延した.このことから,皮質脊髄路におけるIP受容体の発現が脳脊髄炎ののちの神経回路の修復に関与していることがわかった.
5.プロスタサイクリンは脳脊髄炎ののちの神経回路の修復を促進する
血管に由来するプロスタサイクリンは皮質脊髄路における側枝の形成に関与しているのかどうか,プロスタサイクリン合成酵素のsiRNAを血管内皮細胞に導入したマウスを用いて検討した.血管内皮細胞においてプロスタサイクリン合成酵素の発現をノックダウンすると,脳脊髄炎の誘導ののちの皮質脊髄路における側枝の形成と運動機能の自然回復が抑制された.このマウスの炎症の部位にIP受容体の作動薬を持続的に投与すると,側枝の形成や運動機能の回復に対する抑制効果はレスキューされた.これらの結果から,血管内皮細胞に由来するプロスタサイクリンが皮質脊髄路の修復と機能の回復に重要であることが示された(図2).
6.IP受容体の作動薬は脳脊髄炎の症状の自然回復を加速させる
IP受容体の作動薬は脳脊髄炎の症状に対し治療効果を発揮するだろうか? 脳脊髄炎を誘導した部位にIP受容体の作動薬を処置すると,皮質脊髄路における軸索枝の数が増え,また,運動機能の回復も加速した.IP受容体の作動薬あるいは阻害薬を脳脊髄炎の部位に施したマウスから調製した培養脾細胞の上清や脊髄組織において,炎症性サイトカインの発現量に差は認められなかった.また,脳脊髄炎を誘導すると脊髄においてCD4陽性T細胞およびCD11b陽性ミクログリア/マクロファージの集積が観察されるが,それらの細胞の数にも薬剤の処置による影響はみられなかった.これらの結果は,プロスタサイクリンによる神経症状の回復に免疫系は関与していないことを示唆するものであった.
おわりに
末梢組織において血管と神経はしばしば並走している.一方,成体の脳において神経と血管の回路の密接な関連は見い出されておらず,血管に由来する因子による軸索の誘導制御は発生期の末梢神経系に特異的な現象と信じられていた.この研究により,成体の中枢神経系において病態のもと形成される新生した血管の新しい役割が明らかになった.
脳脊髄炎の発症に対しプロスタサイクリンは影響しないことが示唆されている7).今回の研究成果は,病態の慢性期において観察される神経組織の自発的な修復の分子機構を明らかにしたものであり,今後,脳脊髄におけるさまざまな疾患に対する応用が期待される.
文 献
- Harel, N. Y. & Strittmatter, S. M.: Can regenerating axons recapitulate developmental guidance during recovery from spinal cord injury? Nat. Rev. Neurosci., 7, 603-616 (2006)[PubMed]
- Nikic, I., Merkler, D., Sorbara, C. et al.: A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat. Med., 17, 495-499 (2011)[PubMed]
- Kerschensteiner, M., Bareyre, F. M., Buddeberg, B. S. et al.: Remodeling of axonal connections contributes to recovery in an animal model of multiple sclerosis. J. Exp. Med., 200, 1027-1038 (2004)[PubMed]
- Fokman, J. & Brem, H.: Angiogenesis and inflammation. in Inflammation: Basic Principles and Clinical Correlates, 2nd Ed. (Gallin, J. I., Goldstein, I. M. & Snyderman, R. ed.), pp.821-839, Raven Press, New York (1992)
- Tessier-Lavigne, M. & Goodman, C. S.: The molecular biology of axon guidance. Science, 274, 1123-1133 (1996)[PubMed]
- Holley, J. E., Newcombe, J., Whatmore, J. L. et al.: Increased blood vessel density and endothelial cell proliferation in multiple sclerosis cerebral white matter. Neurosci. Lett., 470, 65-70 (2010)[PubMed]
- Jung, S., Donhauser, T., Toyka, K. V. et al.: Propentofylline and iloprost suppress the production of TNF-α by macrophages but fail to ameliorate experimental autoimmune encephalomyelitis in Lewis rats. J. Autoimmun., 10, 519-529 (1997)[PubMed]
著者プロフィール
略歴:2008年 東京大学大学院薬学系研究科 修了,同年より大阪大学大学院医学系研究科 特任助教(現 助教).
研究テーマ:中枢神経疾患における神経組織の修復機構.
関心事:中枢神経疾患の治療につながる研究をつづけていきたいと考えています.ニューロン以外の細胞がニューロンにあたえる役割に興味があります.
山下 俊英(Toshihide Yamashita)
大阪大学大学院医学系研究科 教授.
研究室URL:http://www.med.osaka-u.ac.jp/pub/molneu/
© 2012 村松里衣子・山下俊英 Licensed under CC 表示 2.1 日本