TGFαの切断を用いた正確かつ汎用性の高いGタンパク質共役受容体の活性化の測定法
井上飛鳥・青木淳賢
(東北大学大学院薬学研究科 分子細胞生化学分野)
email:井上飛鳥,青木淳賢
DOI: 10.7875/first.author.2012.125
TGFα shedding assay: an accurate and versatile method for detecting GPCR activation.
Asuka Inoue, Jun Ishiguro, Hajime Kitamura, Naoaki Arima, Michiyo Okutani, Akira Shuto, Shigeki Higashiyama, Tomohiko Ohwada, Hiroyuki Arai, Kumiko Makide, Junken Aoki
Nature Methods, 9, 1021-1029 (2012)
Gタンパク質共役受容体は創薬において重要な標的タンパク質であり,その活性化の測定は機能解析に必須である.しかし,Gタンパク質共役受容体の活性化を網羅的に検出する手法は確立されていない.この研究において,筆者らは,TGFαの膜結合型前駆体からのエクトドメインの切断を指標に,Gタンパク質共役受容体の活性化を高感度かつ高精度に検出する手法を確立した.TGFα切断アッセイと命名されたこの手法は,Gα12/13シグナルおよびGαqシグナルの両方を検出することが可能であった.Gαキメラサブユニットの共発現を利用することによりGαs共役受容体とGαi共役受容体の活性化の検出も可能となり,これにより約90%のGタンパク質共役受容体の活性化の検出が可能となった.さらにこの手法は,オーファンGタンパク質共役受容体のリガンドの同定においても有用であった.以上から,TGFα切断アッセイはGタンパク質共役受容体の研究において有用なツールとなることが実証された.
Gタンパク質共役受容体(G protein-coupled receptor:GPCR)は7回膜貫通型の特徴的な構造をもつ膜型受容体であり,ヒトのゲノムにおいて約800種類からなる最大の遺伝子ファミリーを形成している.このうち,ロドプシンファミリーに分類される約280種類のGタンパク質共役受容体は,おもに水溶性のリガンドを介して体内において多様な生理機能および病理機能に関与する.Gタンパク質共役受容体は創薬開発においてもっとも重要な標的タンパク質であり,現在,市販されている薬剤の40~50%がGタンパク質共役受容体に作用すると推定されている.近年も,Gタンパク質共役受容体を標的として新たな作用機序をもつ薬剤が開発されており,そのなかには,多発性硬化症治療薬(標的となる受容体は,S1P1),睡眠導入剤(標的となる受容体は,MT1およびMT2),抗肥満薬(標的となる受容体は,5-HT2C)などが含まれる.したがって,Gタンパク質共役受容体の機能を理解することは創薬開発の近道である.
Gタンパク質共役受容体によるシグナル伝達は,おもに三量体Gタンパク質のもつGαサブユニットにより担われる.Gタンパク質共役受容体はリガンド(アゴニスト,作動薬)との結合により活性化型に構造変化する.活性化型のGタンパク質共役受容体はGαサブユニットに結合してその構造変化を誘導し,これを非活性化型(GDP結合型)から活性化型(GTP結合型)へと変化させる.活性化型のGαサブユニットはGβγサブユニットから解離し,エフェクタータンパク質を介しシグナル伝達を行う.伝達されるシグナルの種類はGαs,Gαi,Gαq,Gα12/13に分類されるGαサブユニットのサブファミリーごとに異なる.たとえば,Gαsサブユニットはアデニル酸シクラーゼの活性化を介したcAMPの増加,Gαiサブユニットはアデニル酸シクラーゼの抑制を介したcAMPの減少,GαqサブユニットはホスホリパーゼCを介した細胞へのCa2+の流入,Gα12/13は低分子量Gタンパク質であるRhoの活性化タンパク質RhoGEFを介したアクチンストレスファイバーの形成をひき起こす.これら細胞におけるイベントを観察することによりGタンパク質共役受容体の活性化を評価することが可能であるが,Gタンパク質共役受容体は通常は1種類か2種類のGαサブファミリーとしか共役しないことから,特定のイベントを測定するだけでは全体のGタンパク質共役受容体の活性化を検出することはできない(Gタンパク質共役受容体のデータベースについては,International Union of Basic and Clinical Pharmacology,http://www.iuphar-db.org/ を参照されたい).実際に,ひとつの測定法により検出可能なGタンパク質共役受容体の割合は多くても60%程度である.とくに,Gα12/13シグナルの検出法の開発は遅れており,Gα12/13共役受容体の機能を解明するうえで大きな障害であった.
筆者らは,以前の研究により,毛髪の形成において生理活性脂質であるリゾホスファチジン酸が必須の役割をはたしていることを明らかにした1).その過程において,リゾホスファチジン酸の受容体のひとつであるLPA6(別名P2Y5)がGα12/13サブユニットを介しTGFα(transforming growth factor α)の膜結合型前駆体からのエクトドメインの切断をひき起こしていることを見い出した.TGFαの切断機構として,膜型プロテアーゼであるTACE(tumor necrosis factor α-converting enzyme,別名ADAM17)のGα12/13シグナルによる活性化が関与していることを明らかにした.この成果から,TACEによるTGFαの切断という現象を培養細胞において再現することにより,Gタンパク質共役受容体の活性化を測定することができるのではないかと想定した.
この研究において,筆者らは,アルカリホスファターゼとTGFαの融合タンパク質を用いて,TGFαの膜結合型前駆体からのエクトドメインの切断を簡便に評価する手法を開発した.TGFα切断アッセイ(TGFα shedding assey)と命名されたこの手法は,Gα12/13シグナルにくわえGαqシグナルを精度よく検出すること,各種のGαサブユニットとの共発現によりGαs共役受容体やGαi共役受容体を含むGタンパク質共役受容体の活性化を網羅的に検出可能なこと,Gタンパク質共役受容体のリガンドの薬理学的な評価にも応用できることを明らかにした.TGFα切断アッセイはGタンパク質共役受容体の研究における強力なツールとなることが期待される.
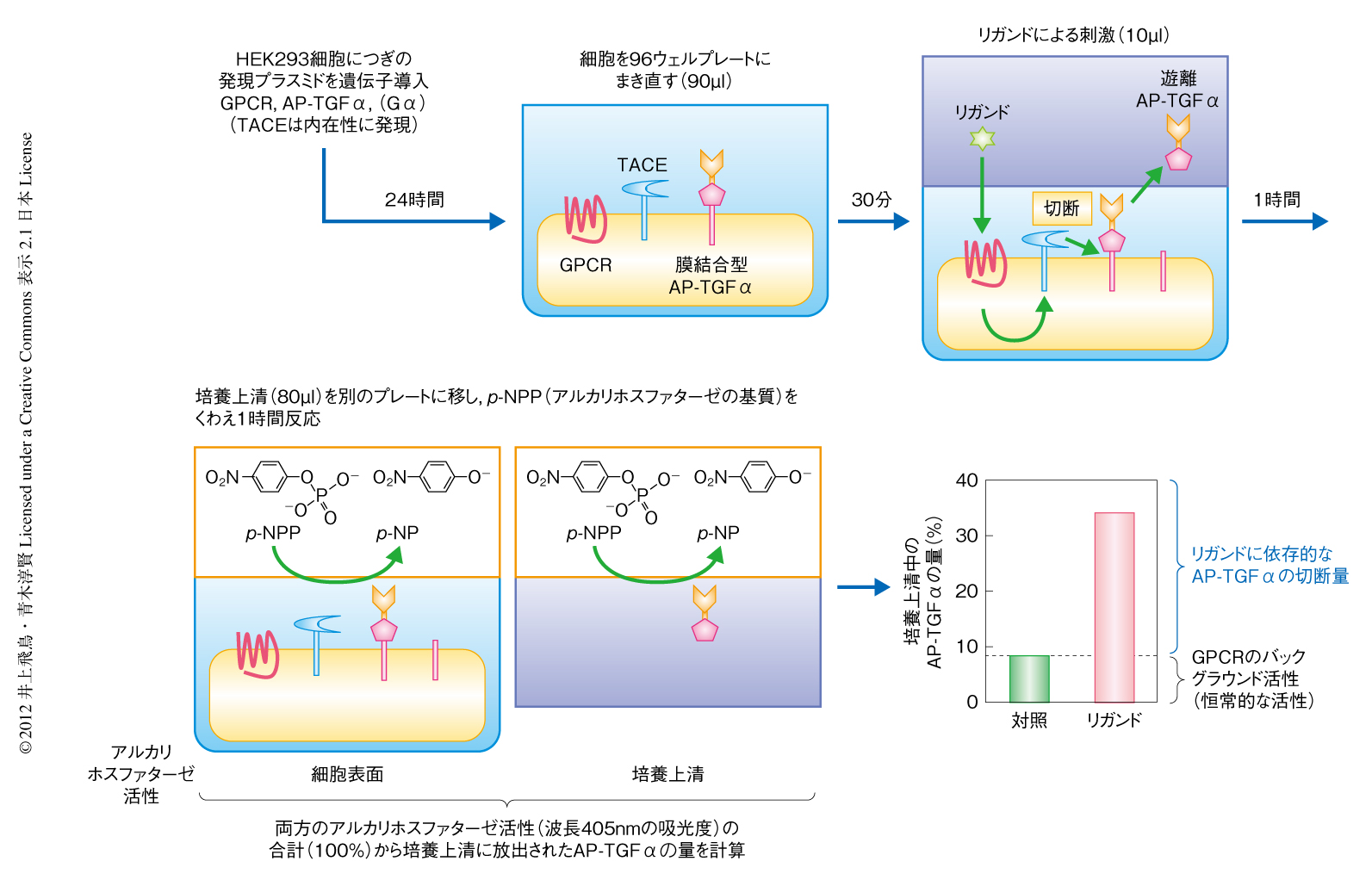
HEK293細胞にGタンパク質共役受容体の発現プラスミドベクターと,アルカリホスファターゼ-TGFα融合タンパク質の発現プラスミドベクター2) を,リポフェクション法により遺伝子導入した.また,必要に応じて(後述),Gαサブユニットの発現プラスミドベクターも同時に遺伝子導入した.24時間後,細胞をはがして血清不含培地(5 mM HEPES(pH 7.4)含有Hank’s Balanced Salt Solution)に懸濁し,ウェルあたり90μlずつ96ウェルプレートに播種した(細胞プレート).30分後,リガンドをウェルあたり10μlずつ添加した.1時間の培養ののち,培養上清をウェルあたり80μlずつ,別の96ウェルプレートに移した(培養上清プレート).細胞プレートと培養上清プレートにアルカリホスファターゼの基質であるp-ニトロフェニルリン酸(p-NPP)溶液をくわえた.p-NPPの添加直後,および,1時間の反応ののち,プレート対応吸光度計により波長405 nmにおける吸光度(OD405)を測定した(図1).
アルカリホスファターゼ-TGFα融合タンパク質(AP-TGFα)の切断量は,つぎのように計算した.
ΔOD405 =反応1時間後のOD405 - p-NPP添加直後のOD405
培養上清中のAP-TGFαの量(%)=培養上清プレートでのΔOD405/(培養上清プレートでのΔOD405 +細胞プレートでのΔOD405)
AP-TGFαの切断量(%)=リガンド刺激したときの培養上清中のAP-TGFαの量-無刺激のときの培養上清中のAP-TGFαの量
おのおののリガンド濃度に対しAP-TGFαの切断量をプロットし,4パラメーターシグモイド曲線にフィッティングさせることで各種のパラメーター(EC50値およびEmax値)を得た.なお,無刺激のときの培養上清中のAP-TGFαの量は,発現させたGタンパク質共役受容体により8%から20%であった.この値は,のちに述べるように,発現させたGタンパク質共役受容体のバックグラウンドレベルの活性(恒常的な活性)を反映していた.
ヒスタミンH1受容体を用いて,TGFα切断アッセイの精度,再現性,堅牢性を検証した.その指標としてZ’因子を用いた.Z’因子は,1 - 3×(陽性対照における標準偏差+陰性対照における標準偏差)/(陽性対照における平均値-陰性対照における平均値) により算出され,一般に0.5以上,望ましくは0.8以上とされる.TGFα切断アッセイにおいて,Z’因子は96ウェルプレートを使った際に0.84を示し,すぐれたアッセイ系であることが確認された.この値は同一の条件において,ヒスタミンH1受容体の発現細胞を用いた細胞内Ca2+測定法よりすぐれていた.さらに,384ウェルプレートを使った際にもZ’因子は0.76を示し,ハイスループットアッセイへの適用が可能であることがわかった.日間での測定誤差を検証したところ,細胞内Ca2+測定法より測定誤差は少なく,この点でもすぐれたアッセイ法であることが検証された.
精度のほかTGFα切断アッセイの利点として,1)コストの安さ(p-NPPは安価な試薬),2)検出機器の手軽さ(吸光プレートリーダーを用いたエンドポイント測定),3)一過性発現で測定が可能,4)スループット性の高さ(96ウェルプレートまたは384ウェルプレート)があった.一方,不利な点として,1)TGFαの切断はGタンパク質共役受容体の活性化の直下のイベントではないこと(種々のタンパク質が介在している),2)リガンドによる刺激時間が長いこと,3)シグナル/ノイズ比が悪いこと,があった.
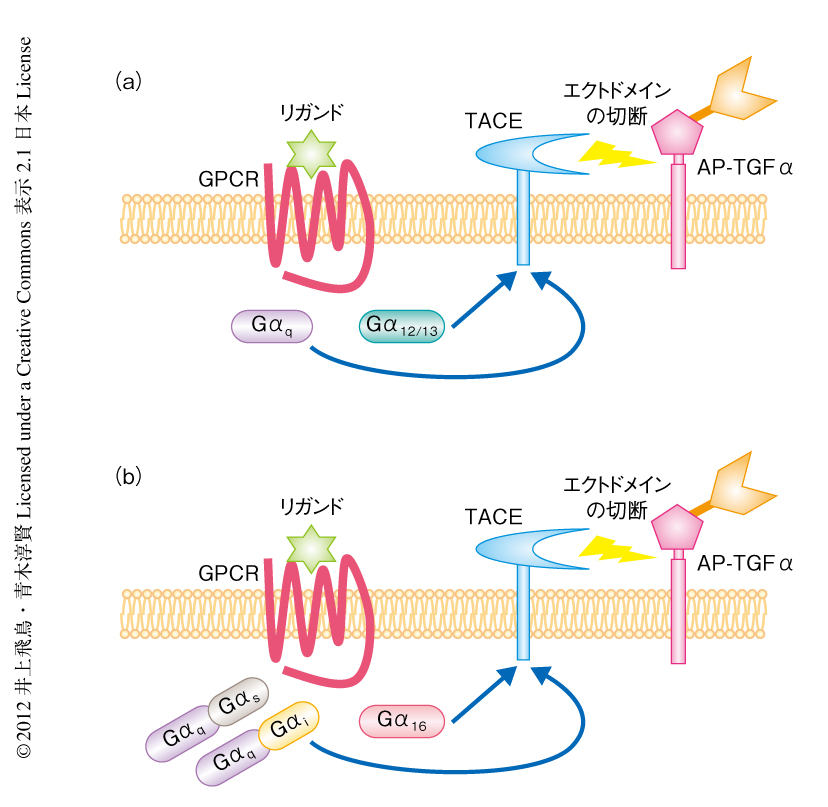
おのおののGαサブユニットに共役するGタンパク質共役受容体を用いて,TGFαの膜結合型前駆体からのエクトドメインの切断におけるシグナル経路を解析した.その結果,Gαqサブユニットに共役することが知られているGタンパク質共役受容体およびGα12/13サブユニットに共役することが知られているGタンパク質共役受容体の活性化により,TGFαの膜結合型前駆体からのエクトドメインの切断がひき起こされた(図2a).一方,GαsサブユニットあるいはGαiサブユニットのみに共役するGタンパク質共役受容体ではTGFαの膜結合型前駆体からの切断は起こらなかった.したがって,GαqシグナルとGα12/13シグナルが選択的にTGFαの切断に関与することが強く示唆された.
Gαキメラサブユニットを用いてこの結果を検証した.アセチルコリンM2受容体はGαi共役型の受容体であり,GαiサブユニットのC末端のアミノ酸残基(おもに3番目と4番目)が重要であることが示されている3).たとえば,GαqサブユニットのC末端の6アミノ酸残基をGαi1サブユニットのアミノ酸残基に置換したGαq/i1キメラサブユニットをアセチルコリンM2受容体と共発現し,アセチルコリンにより刺激するとGαqシグナルを誘導することができる.各種のGαキメラサブユニットをそれぞれアセチルコリンM2受容体と共発現してTGFαの切断量を測定したところ,GαqシグナルやGα12/13シグナルを誘導した際に反応性は増加し(Gαq > Gα13 > Gα12の順),GαsシグナルやGαiシグナルを誘導した際には反応性は変化しなかった.以上から,GαqシグナルとGα12/13シグナルがTGFαの膜結合型前駆体からのエクトドメインの切断に関与することが明らかになった.
TGFα切断アッセイがどのくらいの割合のGタンパク質共役受容体の活性化を検出できるのか,リガンドが既知の116種類のヒトGタンパク質共役受容体を用いて検討した.AP-TGFαの切断量を表すEmax値として3%以上を示すものを“検出可能”とした場合,75種類(65%)のGタンパク質共役受容体の活性化がTGFα切断アッセイにより検出可能であった.一方,“検出可能”ではなかったGタンパク質共役受容体や,“検出可能”ではあったがEmax値の低い(10%以下)Gタンパク質共役受容体には,GαsサブユニットやGαiサブユニットに共役する受容体が多かったことから,Gαキメラサブユニットを用いることにより反応性の向上がみこめるのではないかと想定した.
GαsサブファミリーとGαiサブファミリーのすべてのC末端アミノ酸残基を網羅するよう,5種類のGαキメラサブユニット,Gαq/s,Gαq/i1,Gαq/i3,Gαq/o,Gαq/zを作製した.Gαqサブファミリーに属し非特異的にGタンパク質共役受容体と共役することの知られているGα16(別名Gα15)も利用した.この6種類のGαサブユニットを116種類のヒトGタンパク質共役受容体と共発現させ,再度,TGFαの膜結合型前駆体からのエクトドメインの切断における反応性を検討した.その結果,ほとんどのGαsサブユニットやGαiサブユニットに共役する受容体において反応性は向上した.すなわち,Gαs共役型受容体およびGαi共役型受容体については,Gαqサブユニットの共発現により,TGFαの膜結合型前駆体からのエクトドメインの切断がひき起こされた(図2b).AP-TGFαの切断量を表すEmax値が3%以上を示すGタンパク質共役受容体は101種類(87%)であった.Gαサブユニットを共発現することでEmax値が3%以下になった3種類のGタンパク質共役受容体とあわせて,104種類(90%)のGタンパク質共役受容体がTGFα切断アッセイにより検出可能であった.なお,多くの場合,6種類のGαサブユニットを同時に共発現させるより,いずれか1種類の共発現(あるいは,Gαサブユニットの共発現なし)のほうが高い反応性を示した.したがって,TGFα切断アッセイの初期条件は6種類のGαサブユニットの共発現でよいが,最大の反応を得たい場合には1種類ずつのGαサブユニットの共発現(あるいは,Gαサブユニットの共発現なし)について検討することが推奨される.
Gタンパク質共役受容体はリガンドが結合していないときにも活性型と非活性型の平衡状態にあることが知られている.この平衡状態を変化させるかどうかにより,リガンドは薬理学的に,平衡状態を活性型に傾けるアゴニスト(作動薬),平衡状態を非活性化型に傾けるインバースアゴニスト(逆作動薬),平衡状態を変化させないニュートラルアンタゴニスト(拮抗薬),に分類される.一方,遮断薬はアゴニストやアンタゴニストによる平衡状態を阻害する活性をもつもので,アゴニストとニュートラルアンタゴニストの両方が含まれる.これまでに開発された多くのGタンパク質共役受容体の遮断薬はインバースアゴニストであることが知られている4).したがって,逆作動活性と拮抗活性とを区別することが重要であるが,既存の多くのGタンパク質共役受容体の検出系はCa2+の流入,ERKのリン酸化など一過性のシグナルを測定しているため,Gタンパク質共役受容体の恒常な活性の検出には適さない.
さきに述べたように,TGFα切断アッセイにおいてGタンパク質共役受容体を発現させるとリガンド無刺激の条件においてもTGFαの切断量が8%から20%ほど上昇することが観察された.そこで,TGFα切断アッセイによりGタンパク質共役受容体の恒常的な活性を検出できるかどうか,ヒスタミンH2受容体およびヒスタミンH4受容体に対する逆作動薬および拮抗薬を用いて検討した.その結果,逆作動薬はヒスタミン無刺激の条件においても受容体の発現によるTGFαの切断を抑制(逆作動活性)したのに対し,拮抗薬はその活性を抑制しなかった.一方,逆作動薬と拮抗薬はともにヒスタミン刺激による受容体の活性化を抑制した(遮断活性).したがって,TGFα切断アッセイにより逆作動薬と拮抗薬を容易に区別して評価することが可能であることがわかった.
TGFα切断アッセイはこれまで検出の困難であったGα12/13シグナルを高感度かつ高精度で検出することができたことから,Gα12/13サブユニットに共役する新たなGタンパク質共役受容体の探索を行った.さきに述べたリガンドが既知の116種類のヒトGタンパク質共役受容体のうち,AP-TGFαの切断量を表すEmax値が10%以上と高い値を示した44種類のGタンパク質共役受容体について,Gα12/13シグナル経路の阻害(Gα12 siRNA,Gα13 siRNA,RhoA siRNA,または,ROCK阻害剤Y-27632による処理)による抑制効果を検討した.その結果,25種類のGタンパク質共役受容体において,いずれかのGα12/13シグナル経路の阻害によりTGFαの切断量の減少(相対Emax値が0.67以下)が観察された.したがって,この25種類のGタンパク質共役受容体はリガンド刺激によりGα12/13シグナルを誘導できることがわかった.このうち14種類のGタンパク質共役受容体についてはGα12/13シグナル経路との関連はまったく報告されてなく,この研究がはじめての知見であった.
最後に,リガンドが未知のオーファンGタンパク質共役受容体におけるリガンド探索への有用性について検証した.これまで,多くの研究者がオーファンGタンパク質共役受容体のリガンド探索を行ってきているが,そのなかで,Gα12/13サブユニットに選択的に共役するGタンパク質共役受容体は適切な検出系が存在しないことから見過ごされてきた可能性が高いと想定された.種々のリガンドとオーファンGタンパク質共役受容体を組み合わせてスクリーニングした結果,3つのGタンパク質共役受容体,P2Y10,GPR174,A630033H20が生理活性脂質リゾリン脂質として知られるリゾホスファチジルセリンに特異的に応答することを見い出した.これらのGタンパク質共役受容体はGα12/13共役型であった.リゾホスファチジルセリンはマスト細胞への脱顆粒の促進作用をはじめ,in vitroにおいて複数の薬理作用が報告されているが,生体における機能はほとんど明らかになっていない5).今後,この研究により同定された3つのGタンパク質共役受容体を解析することにより,リゾホスファチジルセリンの生理的および病理的な機能が明らかになるものと期待される.
この研究により開発されたTGFα切断アッセイは,Gタンパク質共役受容体の活性化の解析において有用なツールであった.とくに,これまで検出の困難であったGα12/13共役型のGタンパク質共役受容体の解析に役立つことが実証された.
今回,多くのGタンパク質共役受容体はTACEの活性制御に関与していることを明らかにした点も興味深い.TACEは多様な生理現象や病態に関与することが知られているが,その活性がどのように制御されているか不明な点も多い6).今後,TACEの活性制御タンパク質としてのGタンパク質共役受容体の意義の解明が期待される.
略歴:2008年 東京大学大学院薬学研究科博士課程 中退,同年より東北大学大学院薬学研究科 助手.
研究テーマ:産生酵素と受容体の両面からの生理活性脂質の機能解明.
関心事:脂質と毛髪という(ニッチ)研究から,今回のGタンパク質共役受容体の検出系にたどりついた.研究しつくされていると思っていたGタンパク質共役受容体の分野も,未開拓な領域が多く残されていてやりがいを感じている.現在は,生体におけるGタンパク質共役受容体の活性化の時空間的な制御に興味をもっている.
青木 淳賢(Junken Aoki)
東北大学大学院薬学研究科 教授.
研究室URL:http://www.pharm.tohoku.ac.jp/~seika/H24/index.html
© 2012 井上飛鳥・青木淳賢 Licensed under CC 表示 2.1 日本
(東北大学大学院薬学研究科 分子細胞生化学分野)
email:井上飛鳥,青木淳賢
DOI: 10.7875/first.author.2012.125
TGFα shedding assay: an accurate and versatile method for detecting GPCR activation.
Asuka Inoue, Jun Ishiguro, Hajime Kitamura, Naoaki Arima, Michiyo Okutani, Akira Shuto, Shigeki Higashiyama, Tomohiko Ohwada, Hiroyuki Arai, Kumiko Makide, Junken Aoki
Nature Methods, 9, 1021-1029 (2012)
要 約
Gタンパク質共役受容体は創薬において重要な標的タンパク質であり,その活性化の測定は機能解析に必須である.しかし,Gタンパク質共役受容体の活性化を網羅的に検出する手法は確立されていない.この研究において,筆者らは,TGFαの膜結合型前駆体からのエクトドメインの切断を指標に,Gタンパク質共役受容体の活性化を高感度かつ高精度に検出する手法を確立した.TGFα切断アッセイと命名されたこの手法は,Gα12/13シグナルおよびGαqシグナルの両方を検出することが可能であった.Gαキメラサブユニットの共発現を利用することによりGαs共役受容体とGαi共役受容体の活性化の検出も可能となり,これにより約90%のGタンパク質共役受容体の活性化の検出が可能となった.さらにこの手法は,オーファンGタンパク質共役受容体のリガンドの同定においても有用であった.以上から,TGFα切断アッセイはGタンパク質共役受容体の研究において有用なツールとなることが実証された.
はじめに
Gタンパク質共役受容体(G protein-coupled receptor:GPCR)は7回膜貫通型の特徴的な構造をもつ膜型受容体であり,ヒトのゲノムにおいて約800種類からなる最大の遺伝子ファミリーを形成している.このうち,ロドプシンファミリーに分類される約280種類のGタンパク質共役受容体は,おもに水溶性のリガンドを介して体内において多様な生理機能および病理機能に関与する.Gタンパク質共役受容体は創薬開発においてもっとも重要な標的タンパク質であり,現在,市販されている薬剤の40~50%がGタンパク質共役受容体に作用すると推定されている.近年も,Gタンパク質共役受容体を標的として新たな作用機序をもつ薬剤が開発されており,そのなかには,多発性硬化症治療薬(標的となる受容体は,S1P1),睡眠導入剤(標的となる受容体は,MT1およびMT2),抗肥満薬(標的となる受容体は,5-HT2C)などが含まれる.したがって,Gタンパク質共役受容体の機能を理解することは創薬開発の近道である.
Gタンパク質共役受容体によるシグナル伝達は,おもに三量体Gタンパク質のもつGαサブユニットにより担われる.Gタンパク質共役受容体はリガンド(アゴニスト,作動薬)との結合により活性化型に構造変化する.活性化型のGタンパク質共役受容体はGαサブユニットに結合してその構造変化を誘導し,これを非活性化型(GDP結合型)から活性化型(GTP結合型)へと変化させる.活性化型のGαサブユニットはGβγサブユニットから解離し,エフェクタータンパク質を介しシグナル伝達を行う.伝達されるシグナルの種類はGαs,Gαi,Gαq,Gα12/13に分類されるGαサブユニットのサブファミリーごとに異なる.たとえば,Gαsサブユニットはアデニル酸シクラーゼの活性化を介したcAMPの増加,Gαiサブユニットはアデニル酸シクラーゼの抑制を介したcAMPの減少,GαqサブユニットはホスホリパーゼCを介した細胞へのCa2+の流入,Gα12/13は低分子量Gタンパク質であるRhoの活性化タンパク質RhoGEFを介したアクチンストレスファイバーの形成をひき起こす.これら細胞におけるイベントを観察することによりGタンパク質共役受容体の活性化を評価することが可能であるが,Gタンパク質共役受容体は通常は1種類か2種類のGαサブファミリーとしか共役しないことから,特定のイベントを測定するだけでは全体のGタンパク質共役受容体の活性化を検出することはできない(Gタンパク質共役受容体のデータベースについては,International Union of Basic and Clinical Pharmacology,http://www.iuphar-db.org/ を参照されたい).実際に,ひとつの測定法により検出可能なGタンパク質共役受容体の割合は多くても60%程度である.とくに,Gα12/13シグナルの検出法の開発は遅れており,Gα12/13共役受容体の機能を解明するうえで大きな障害であった.
筆者らは,以前の研究により,毛髪の形成において生理活性脂質であるリゾホスファチジン酸が必須の役割をはたしていることを明らかにした1).その過程において,リゾホスファチジン酸の受容体のひとつであるLPA6(別名P2Y5)がGα12/13サブユニットを介しTGFα(transforming growth factor α)の膜結合型前駆体からのエクトドメインの切断をひき起こしていることを見い出した.TGFαの切断機構として,膜型プロテアーゼであるTACE(tumor necrosis factor α-converting enzyme,別名ADAM17)のGα12/13シグナルによる活性化が関与していることを明らかにした.この成果から,TACEによるTGFαの切断という現象を培養細胞において再現することにより,Gタンパク質共役受容体の活性化を測定することができるのではないかと想定した.
この研究において,筆者らは,アルカリホスファターゼとTGFαの融合タンパク質を用いて,TGFαの膜結合型前駆体からのエクトドメインの切断を簡便に評価する手法を開発した.TGFα切断アッセイ(TGFα shedding assey)と命名されたこの手法は,Gα12/13シグナルにくわえGαqシグナルを精度よく検出すること,各種のGαサブユニットとの共発現によりGαs共役受容体やGαi共役受容体を含むGタンパク質共役受容体の活性化を網羅的に検出可能なこと,Gタンパク質共役受容体のリガンドの薬理学的な評価にも応用できることを明らかにした.TGFα切断アッセイはGタンパク質共役受容体の研究における強力なツールとなることが期待される.
1.TGFα切断アッセイの手法
HEK293細胞にGタンパク質共役受容体の発現プラスミドベクターと,アルカリホスファターゼ-TGFα融合タンパク質の発現プラスミドベクター2) を,リポフェクション法により遺伝子導入した.また,必要に応じて(後述),Gαサブユニットの発現プラスミドベクターも同時に遺伝子導入した.24時間後,細胞をはがして血清不含培地(5 mM HEPES(pH 7.4)含有Hank’s Balanced Salt Solution)に懸濁し,ウェルあたり90μlずつ96ウェルプレートに播種した(細胞プレート).30分後,リガンドをウェルあたり10μlずつ添加した.1時間の培養ののち,培養上清をウェルあたり80μlずつ,別の96ウェルプレートに移した(培養上清プレート).細胞プレートと培養上清プレートにアルカリホスファターゼの基質であるp-ニトロフェニルリン酸(p-NPP)溶液をくわえた.p-NPPの添加直後,および,1時間の反応ののち,プレート対応吸光度計により波長405 nmにおける吸光度(OD405)を測定した(図1).
アルカリホスファターゼ-TGFα融合タンパク質(AP-TGFα)の切断量は,つぎのように計算した.
ΔOD405 =反応1時間後のOD405 - p-NPP添加直後のOD405
培養上清中のAP-TGFαの量(%)=培養上清プレートでのΔOD405/(培養上清プレートでのΔOD405 +細胞プレートでのΔOD405)
AP-TGFαの切断量(%)=リガンド刺激したときの培養上清中のAP-TGFαの量-無刺激のときの培養上清中のAP-TGFαの量
おのおののリガンド濃度に対しAP-TGFαの切断量をプロットし,4パラメーターシグモイド曲線にフィッティングさせることで各種のパラメーター(EC50値およびEmax値)を得た.なお,無刺激のときの培養上清中のAP-TGFαの量は,発現させたGタンパク質共役受容体により8%から20%であった.この値は,のちに述べるように,発現させたGタンパク質共役受容体のバックグラウンドレベルの活性(恒常的な活性)を反映していた.
2.TGFα切断アッセイの精度および再現性
ヒスタミンH1受容体を用いて,TGFα切断アッセイの精度,再現性,堅牢性を検証した.その指標としてZ’因子を用いた.Z’因子は,1 - 3×(陽性対照における標準偏差+陰性対照における標準偏差)/(陽性対照における平均値-陰性対照における平均値) により算出され,一般に0.5以上,望ましくは0.8以上とされる.TGFα切断アッセイにおいて,Z’因子は96ウェルプレートを使った際に0.84を示し,すぐれたアッセイ系であることが確認された.この値は同一の条件において,ヒスタミンH1受容体の発現細胞を用いた細胞内Ca2+測定法よりすぐれていた.さらに,384ウェルプレートを使った際にもZ’因子は0.76を示し,ハイスループットアッセイへの適用が可能であることがわかった.日間での測定誤差を検証したところ,細胞内Ca2+測定法より測定誤差は少なく,この点でもすぐれたアッセイ法であることが検証された.
精度のほかTGFα切断アッセイの利点として,1)コストの安さ(p-NPPは安価な試薬),2)検出機器の手軽さ(吸光プレートリーダーを用いたエンドポイント測定),3)一過性発現で測定が可能,4)スループット性の高さ(96ウェルプレートまたは384ウェルプレート)があった.一方,不利な点として,1)TGFαの切断はGタンパク質共役受容体の活性化の直下のイベントではないこと(種々のタンパク質が介在している),2)リガンドによる刺激時間が長いこと,3)シグナル/ノイズ比が悪いこと,があった.
3.Gα12/13シグナルおよびGαqシグナルによりTGFαの切断がひき起こされる
おのおののGαサブユニットに共役するGタンパク質共役受容体を用いて,TGFαの膜結合型前駆体からのエクトドメインの切断におけるシグナル経路を解析した.その結果,Gαqサブユニットに共役することが知られているGタンパク質共役受容体およびGα12/13サブユニットに共役することが知られているGタンパク質共役受容体の活性化により,TGFαの膜結合型前駆体からのエクトドメインの切断がひき起こされた(図2a).一方,GαsサブユニットあるいはGαiサブユニットのみに共役するGタンパク質共役受容体ではTGFαの膜結合型前駆体からの切断は起こらなかった.したがって,GαqシグナルとGα12/13シグナルが選択的にTGFαの切断に関与することが強く示唆された.
Gαキメラサブユニットを用いてこの結果を検証した.アセチルコリンM2受容体はGαi共役型の受容体であり,GαiサブユニットのC末端のアミノ酸残基(おもに3番目と4番目)が重要であることが示されている3).たとえば,GαqサブユニットのC末端の6アミノ酸残基をGαi1サブユニットのアミノ酸残基に置換したGαq/i1キメラサブユニットをアセチルコリンM2受容体と共発現し,アセチルコリンにより刺激するとGαqシグナルを誘導することができる.各種のGαキメラサブユニットをそれぞれアセチルコリンM2受容体と共発現してTGFαの切断量を測定したところ,GαqシグナルやGα12/13シグナルを誘導した際に反応性は増加し(Gαq > Gα13 > Gα12の順),GαsシグナルやGαiシグナルを誘導した際には反応性は変化しなかった.以上から,GαqシグナルとGα12/13シグナルがTGFαの膜結合型前駆体からのエクトドメインの切断に関与することが明らかになった.
4.Gαサブユニットの共発現による検出系の拡張
TGFα切断アッセイがどのくらいの割合のGタンパク質共役受容体の活性化を検出できるのか,リガンドが既知の116種類のヒトGタンパク質共役受容体を用いて検討した.AP-TGFαの切断量を表すEmax値として3%以上を示すものを“検出可能”とした場合,75種類(65%)のGタンパク質共役受容体の活性化がTGFα切断アッセイにより検出可能であった.一方,“検出可能”ではなかったGタンパク質共役受容体や,“検出可能”ではあったがEmax値の低い(10%以下)Gタンパク質共役受容体には,GαsサブユニットやGαiサブユニットに共役する受容体が多かったことから,Gαキメラサブユニットを用いることにより反応性の向上がみこめるのではないかと想定した.
GαsサブファミリーとGαiサブファミリーのすべてのC末端アミノ酸残基を網羅するよう,5種類のGαキメラサブユニット,Gαq/s,Gαq/i1,Gαq/i3,Gαq/o,Gαq/zを作製した.Gαqサブファミリーに属し非特異的にGタンパク質共役受容体と共役することの知られているGα16(別名Gα15)も利用した.この6種類のGαサブユニットを116種類のヒトGタンパク質共役受容体と共発現させ,再度,TGFαの膜結合型前駆体からのエクトドメインの切断における反応性を検討した.その結果,ほとんどのGαsサブユニットやGαiサブユニットに共役する受容体において反応性は向上した.すなわち,Gαs共役型受容体およびGαi共役型受容体については,Gαqサブユニットの共発現により,TGFαの膜結合型前駆体からのエクトドメインの切断がひき起こされた(図2b).AP-TGFαの切断量を表すEmax値が3%以上を示すGタンパク質共役受容体は101種類(87%)であった.Gαサブユニットを共発現することでEmax値が3%以下になった3種類のGタンパク質共役受容体とあわせて,104種類(90%)のGタンパク質共役受容体がTGFα切断アッセイにより検出可能であった.なお,多くの場合,6種類のGαサブユニットを同時に共発現させるより,いずれか1種類の共発現(あるいは,Gαサブユニットの共発現なし)のほうが高い反応性を示した.したがって,TGFα切断アッセイの初期条件は6種類のGαサブユニットの共発現でよいが,最大の反応を得たい場合には1種類ずつのGαサブユニットの共発現(あるいは,Gαサブユニットの共発現なし)について検討することが推奨される.
5.Gタンパク質共役受容体の恒常的な活性の検出
Gタンパク質共役受容体はリガンドが結合していないときにも活性型と非活性型の平衡状態にあることが知られている.この平衡状態を変化させるかどうかにより,リガンドは薬理学的に,平衡状態を活性型に傾けるアゴニスト(作動薬),平衡状態を非活性化型に傾けるインバースアゴニスト(逆作動薬),平衡状態を変化させないニュートラルアンタゴニスト(拮抗薬),に分類される.一方,遮断薬はアゴニストやアンタゴニストによる平衡状態を阻害する活性をもつもので,アゴニストとニュートラルアンタゴニストの両方が含まれる.これまでに開発された多くのGタンパク質共役受容体の遮断薬はインバースアゴニストであることが知られている4).したがって,逆作動活性と拮抗活性とを区別することが重要であるが,既存の多くのGタンパク質共役受容体の検出系はCa2+の流入,ERKのリン酸化など一過性のシグナルを測定しているため,Gタンパク質共役受容体の恒常な活性の検出には適さない.
さきに述べたように,TGFα切断アッセイにおいてGタンパク質共役受容体を発現させるとリガンド無刺激の条件においてもTGFαの切断量が8%から20%ほど上昇することが観察された.そこで,TGFα切断アッセイによりGタンパク質共役受容体の恒常的な活性を検出できるかどうか,ヒスタミンH2受容体およびヒスタミンH4受容体に対する逆作動薬および拮抗薬を用いて検討した.その結果,逆作動薬はヒスタミン無刺激の条件においても受容体の発現によるTGFαの切断を抑制(逆作動活性)したのに対し,拮抗薬はその活性を抑制しなかった.一方,逆作動薬と拮抗薬はともにヒスタミン刺激による受容体の活性化を抑制した(遮断活性).したがって,TGFα切断アッセイにより逆作動薬と拮抗薬を容易に区別して評価することが可能であることがわかった.
6.Gα12/13共役型のGタンパク質共役受容体の解析
TGFα切断アッセイはこれまで検出の困難であったGα12/13シグナルを高感度かつ高精度で検出することができたことから,Gα12/13サブユニットに共役する新たなGタンパク質共役受容体の探索を行った.さきに述べたリガンドが既知の116種類のヒトGタンパク質共役受容体のうち,AP-TGFαの切断量を表すEmax値が10%以上と高い値を示した44種類のGタンパク質共役受容体について,Gα12/13シグナル経路の阻害(Gα12 siRNA,Gα13 siRNA,RhoA siRNA,または,ROCK阻害剤Y-27632による処理)による抑制効果を検討した.その結果,25種類のGタンパク質共役受容体において,いずれかのGα12/13シグナル経路の阻害によりTGFαの切断量の減少(相対Emax値が0.67以下)が観察された.したがって,この25種類のGタンパク質共役受容体はリガンド刺激によりGα12/13シグナルを誘導できることがわかった.このうち14種類のGタンパク質共役受容体についてはGα12/13シグナル経路との関連はまったく報告されてなく,この研究がはじめての知見であった.
最後に,リガンドが未知のオーファンGタンパク質共役受容体におけるリガンド探索への有用性について検証した.これまで,多くの研究者がオーファンGタンパク質共役受容体のリガンド探索を行ってきているが,そのなかで,Gα12/13サブユニットに選択的に共役するGタンパク質共役受容体は適切な検出系が存在しないことから見過ごされてきた可能性が高いと想定された.種々のリガンドとオーファンGタンパク質共役受容体を組み合わせてスクリーニングした結果,3つのGタンパク質共役受容体,P2Y10,GPR174,A630033H20が生理活性脂質リゾリン脂質として知られるリゾホスファチジルセリンに特異的に応答することを見い出した.これらのGタンパク質共役受容体はGα12/13共役型であった.リゾホスファチジルセリンはマスト細胞への脱顆粒の促進作用をはじめ,in vitroにおいて複数の薬理作用が報告されているが,生体における機能はほとんど明らかになっていない5).今後,この研究により同定された3つのGタンパク質共役受容体を解析することにより,リゾホスファチジルセリンの生理的および病理的な機能が明らかになるものと期待される.
おわりに
この研究により開発されたTGFα切断アッセイは,Gタンパク質共役受容体の活性化の解析において有用なツールであった.とくに,これまで検出の困難であったGα12/13共役型のGタンパク質共役受容体の解析に役立つことが実証された.
今回,多くのGタンパク質共役受容体はTACEの活性制御に関与していることを明らかにした点も興味深い.TACEは多様な生理現象や病態に関与することが知られているが,その活性がどのように制御されているか不明な点も多い6).今後,TACEの活性制御タンパク質としてのGタンパク質共役受容体の意義の解明が期待される.
文 献
- Inoue, A., Arima, N., Ishiguro, J. et al.: LPA-producing enzyme PA-PLA1α regulates hair follicle development by modulating EGFR signaling. EMBO J., 30, 4248-4260 (2011)[PubMed]
- Tokumaru, S., Higashiyama, S., Endo, T. et al.: Ectodomain shedding of epidermal growth factor receptor ligands is required for keratinocyte migration in cutaneous wound healing. J. Cell Biol., 151, 209-220 (2000)[PubMed]
- Liu, J., Conklin, B. R., Blin, N. et al.: Identification of a receptor/G-protein contact site critical for signaling specificity and G-protein activation. Proc. Natl. Acad. Sci. USA, 92, 11642-11646 (1995)[PubMed]
- Bond, R. A. & Ijzerman, A. P.: Recent developments in constitutive receptor activity and inverse agonism, and their potential for GPCR drug discovery. Trends Pharmacol. Sci., 27, 92-96 (2006)[PubMed]
- Makide, K., Kitamura, H., Sato, Y. et al.: Emerging lysophospholipid mediators, lysophosphatidylserine, lysophosphatidylthreonine, lysophosphatidylethanolamine and lysophosphatidylglycerol. Prostaglandins Other Lipid Mediat., 89, 135-139 (2009)[PubMed]
- Edwards, D. R., Handsley, M. M. & Pennington, C. J.: The ADAM metalloproteinases. Mol. Aspects Med., 29, 258-289 (2008)[PubMed]
著者プロフィール
略歴:2008年 東京大学大学院薬学研究科博士課程 中退,同年より東北大学大学院薬学研究科 助手.
研究テーマ:産生酵素と受容体の両面からの生理活性脂質の機能解明.
関心事:脂質と毛髪という(ニッチ)研究から,今回のGタンパク質共役受容体の検出系にたどりついた.研究しつくされていると思っていたGタンパク質共役受容体の分野も,未開拓な領域が多く残されていてやりがいを感じている.現在は,生体におけるGタンパク質共役受容体の活性化の時空間的な制御に興味をもっている.
青木 淳賢(Junken Aoki)
東北大学大学院薬学研究科 教授.
研究室URL:http://www.pharm.tohoku.ac.jp/~seika/H24/index.html
© 2012 井上飛鳥・青木淳賢 Licensed under CC 表示 2.1 日本