Wnt5aはTGFβ経路の活性化を介し大腸の損傷の修復において陰窩の再生を促進する
三好弘之・Thaddeus S. Stappenbeck
(米国Washington大学School of Medicine,Department of Pathology and Immunology)
email:三好弘之
DOI: 10.7875/first.author.2012.117
Wnt5a potentiates TGF-β signaling to promote colonic crypt regeneration after tissue injury.
Hiroyuki Miyoshi, Rieko Ajima, Christine T. Luo, Terry P. Yamaguchi, Thaddeus S. Stappenbeck
Science, 338, 108-113 (2012)
損傷により失われた上皮組織が再生するためには,幹細胞が正しい位置に再配置され,正常に分化した細胞により損傷のまえの構造が再構築されなければならない.哺乳類の大腸上皮は規則正しく配列した無数のポケット構造である陰窩をもち,それぞれの陰窩は大腸幹細胞と数種類の分化した細胞から構成される.今回,筆者らは,マウスの大腸の損傷モデルを用い,失われた陰窩の再生に非古典的WntのひとつであるWnt5aが必要であることを明らかにした.Wnt5aを欠損したマウスの大腸における損傷の修復過程では,対照となるマウスと同様に幹細胞の増殖は観察されたが,陰窩は正しく再生されなかった.そこで,上皮細胞に対するWnt5aの作用をくわしく解明するため,in vitroにて大腸幹細胞を高密度に培養する方法を開発した.in vitroにおいてWnt5aは大腸幹細胞の増殖を抑制し,この作用はTGFβ経路に依存的であった.これらの結果から,Wnt5aは幹細胞の増殖を制限することにより大腸上皮の恒常性を回復することが示唆された.
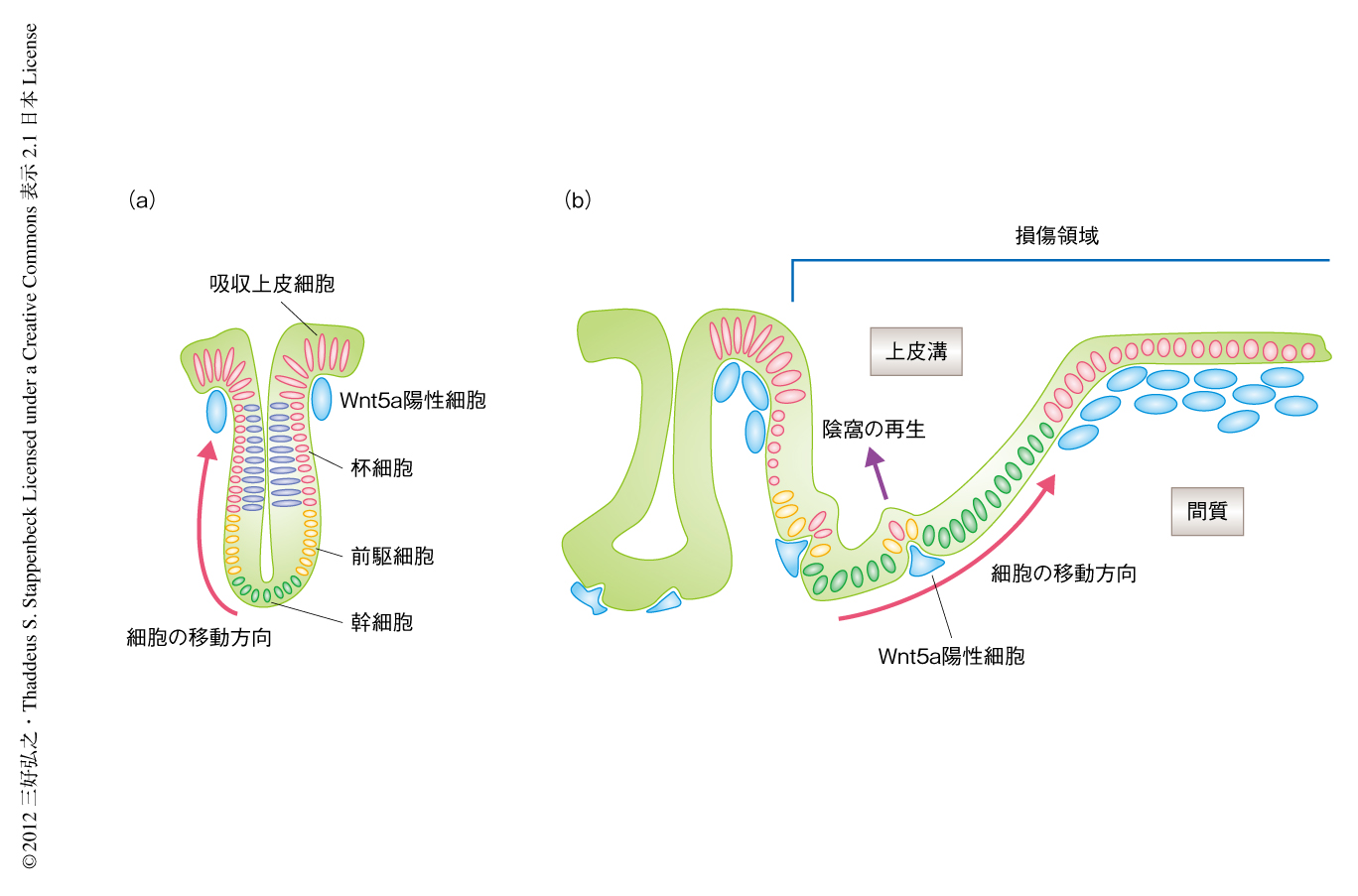
哺乳類の大腸上皮は陰窩(あるいは,クリプト)とよばれる試験管のような構造により構成されており,マウスの大腸には約30万もの陰窩が含まれている.すべての大腸上皮の供給源となる大腸幹細胞はそれぞれの陰窩の最深部に位置しており,大腸幹細胞の活発な分裂により生みだされた娘細胞は最終的に,粘液を産生する杯細胞,栄養分や水分を吸収する吸収上皮細胞,消化管ホルモンを分泌する内分泌細胞といった特定の役割をもつ細胞に分化する(図1a).
腸の管腔はつねに食物が通過し,それを栄養源とする無数の細菌が常在している.互いに強く接着した上皮細胞は微生物や毒素の侵入を防ぐもっとも重要な物理的な防壁である.腸の上皮細胞は入れ替わりが早いため,軽度の損傷は幹細胞から供給される新しい細胞によりすみやかに修復される.しかし,炎症性腸疾患や病原菌の感染などにより損傷が腸の深部に及んだ場合,幹細胞を含む陰窩の全体が失われてしまうことがある.幹細胞が失われればもはや新しい上皮をつくりだすことはできず,広範囲で上皮が失われた状態がつづけば炎症や感染は致命的となる.
それでは,いったん失われた陰窩は再生されるのだろうか? 再生されるとしたら,新たな幹細胞はどこからやってくるのだろうか? 腸管上皮における損傷修復の分子機構は,これまでも化学物質や放射線を用いたさまざまな動物モデルにおいて解析されてきた.しかしながら,これら多くのモデルでは広範囲の傷害とそれに起因する激しい炎症をともなうため,秩序だった上皮の再生を観察するのは困難であった.そこで,今回の研究では,陰窩を含む大腸の粘膜をバイオプシー(生検)ピンセットにより局所的に除去し,失われた陰窩が再生される過程を経時的に解析した.
筆者らのグループは,内視鏡による観察のもとマウスの大腸の粘膜の一部をバイオプシーピンセットにより除去し,欠損した部位の修復過程を観察する系を開発している1).この系を用いて20から30の陰窩を欠損させると,損傷ののち2日以内に傷の表面は1層の上皮によりおおわれる.この特殊な上皮(wound associated epithelium,損傷関連上皮)はすみやかに傷の表面をおおうが,幹細胞を含んでおらず修復がおわると脱落する.つづいて,損傷ののち6日以内に周辺の正常な陰窩が分裂し欠損した部位を補完する1).今回は,250から300の陰窩(約1 mm2)を欠損させ,より広い領域の損傷がどのように修復されるかを観察した.小規模な損傷と同様に,損傷ののち4日以内に傷の表面は損傷関連上皮によりおおわれた.損傷ののち4日目から6日目にかけて,隣接する陰窩は拡張して溝のような構造に変化し傷の中心にむかい伸長した(図1b).この独特な構造体(wound channel,上皮溝)は活発に増殖する未分化な細胞で構成され,杯細胞などの分化した細胞はほとんど認められなかった.上皮溝は損傷ののち6日目から8日目にかけて小さな区画に分割され,正常な陰窩と同様の構造が再生された.これらの結果から,大腸における損傷の修復過程では,隣接する無傷の陰窩が上皮溝を形成することにより大腸幹細胞が損傷領域の全体に供給されることが明らかになった.また,上皮溝が分割され陰窩が再生する過程から,幹細胞の再配置が時間的かつ空間的に厳密に制御されていることが示唆された.
陰窩の再生の際に起こる分子変化を明らかにするため,上皮溝および正常な陰窩におけるRNA発現プロファイルをマイクロアレイ解析により比較した.上皮溝では細胞増殖にかかわる遺伝子とともにWnt経路にかかわる遺伝子の発現が上昇していた.Wnt経路は古典的経路と非古典的経路に分けられ,そのどちらも個体の発生における形態形成において重要なはたらきを担っている2).上皮細胞におけるWnt関連遺伝子の発現上昇は隣接する間質細胞から分泌されるWntリガンドの影響をうけていると考えられたことから,損傷部位の間質細胞からRNAを抽出しRT-PCR法により19種のWntと4種のR-spondinの発現を調べた.その結果,非古典的WntのひとつであるWnt5aがとくに強く発現していることがわかった.
βカテニンを介する古典的Wnt経路の活性化は大腸幹細胞の維持と増殖に必須であるが,非古典的Wnt経路の損傷修復における役割はいまだ不明である.Wnt5a陽性細胞の組織における分布を調べるためin situハイブリダイゼーションを行った.正常な大腸粘膜においてWnt5a陽性細胞は管腔側の間質に局在しており,大腸幹細胞の存在する陰窩の底部の周辺にはほとんど認められなかった.一方,損傷の修復過程では,増殖している上皮溝の細胞に隣接してWnt5a陽性の間質細胞が分布していた(図1b).とくに分割のはじまった上皮溝の分岐点にWnt5a陽性細胞が局在していたことから,これらの細胞から分泌されたWnt5aが隣接する上皮細胞に作用し,局所的に上皮溝の形態変化を促しているものと考えられた.この仮説を証明するため,Wnt5aの時期特異的なノックアウトマウスを作製し,腸管の損傷ののちの修復過程を観察した.Wnt5aノックアウトマウスでは損傷ののち6日目に分岐に乏しい上皮溝が形成され,損傷ののち8日目においても未分割の上皮溝が残存していたことから,Wnt5aが上皮溝からの陰窩の再生に必要であることが示された.
Wnt5aが大腸幹細胞においてどのようなシグナル伝達経路を活性化するのか解析した.上皮溝でみられた大腸幹細胞の活発な増殖をin vitroにおいて再現するため,近年になり見い出された胃腸管幹細胞の維持に必要な3つのタンパク質3,4),古典的Wnt,R-spondin,Nogginを発現する細胞株を作製し,これらのタンパク質を培地に分泌させたコンディション培地を回収した.このコンディション培地を用いて大腸陰窩を培養したところ,代表的な腸幹細胞マーカーであるLgr5 5) を高発現する細胞組織体(オルガノイド)が得られた.これらのオルガノイドに含まれるほぼすべての細胞は増殖しており,分化した細胞はごく少数であったことから,上皮溝に類似した細胞集団であると考えられた.球形のオルガノイドにWnt5aを吸着させたアガロースビーズを隣接させたところ,隣接した部位における細胞増殖は抑制され,上皮溝の分裂に似たくぼみが高頻度で形成された.また,Wnt5aを培地にくわえるとオルガノイドの全体の細胞増殖が濃度に依存的に抑制された.これらの結果から,Wnt5aは細胞増殖を局所的に抑制することにより上皮溝において大腸幹細胞の集団を小さな区画に分断し,陰窩の再生を促しているものと考えられた.
非古典的WntはJNK経路やCa2+経路など複数のシグナル伝達経路を活性化することが知られているが,Wnt5aの大腸幹細胞に対する増殖抑制の効果は既知のシグナル伝達経路では説明できなかった.そこで,Wnt5aを作用させたオルガノイドにおいてサイクリンキナーゼ阻害タンパク質のひとつであるp15の発現が上昇していることに注目した.p15はTGFβ経路の下流において発現の誘導されるタンパク質のひとつであり,TGFβは上皮細胞の増殖を抑制する代表的な分泌タンパク質である6).そこで,TGFβ経路の下流において発現の誘導されるもっとも代表的な遺伝子であるPAI-1遺伝子の発現を調べたところ,Wnt5aにより濃度に依存的に上昇した.また,Wnt5aを作用させたオルガノイドではSmad3のリン酸化と核への移行が観察されたことから,Wnt5aがTGFβ経路の活性化を増強していることが示された.これと一致して,Wnt5aノックアウトマウスでは上皮溝の底部の大腸幹細胞におけるSmad3のリン酸化が抑制されていた.TGFβI型受容体の阻害剤であるSB431542はWnt5aの作用を打ち消したことから,Wnt5aによるTGFβ経路の活性化はTGFβ受容体のもつキナーゼ活性に依存していることがわかった.非古典的Wntの特異的な受容体であるRor2の発現をshRNAによりノックダウンしたオルガノイドでは,Wnt5aおよびTGFβによるPAI-1の発現誘導は弱まったが,細胞増殖の抑制効果は阻害されなかった.これらの結果から,Wnt5aはTGFβ経路の活性化を介し細胞増殖を抑制することが示された.今後は,大腸のオルガノイドを用いて,非古典的Wnt経路とTGFβ経路との相互作用を受容体のレベルで解析していく予定である.
上皮と間質との相互作用は,損傷の修復のみならず,形態形成,腫瘍の形成といったさまざまな場面で鍵となる現象である.今回の研究結果から,大腸陰窩の再生が間質のWnt5a陽性細胞により制御されていることが示された.損傷の修復過程における間質細胞の配置は,再生ののちの組織の形態を決定する重要な要素である.筆者らの用いた大腸バイオプシー損傷モデルでは,上皮と間質が同時に失われるが,上皮溝の形成にさきだち未分化な間質細胞の増殖が観察され,血管や平滑筋などの支持組織が再生される.この過程は魚類や両生類などのより単純なモデル動物の再生機構に類似していた7).たとえば,両生類の肢の一部を切除すると切断面において骨,筋肉,血管といった支持組織の前駆細胞が急速に増殖し芽体(blastema)とよばれる細胞塊を形成する.芽体はいっけん無秩序な細胞の集合にみえるが,神経から分泌される位置情報によりおのおのの前駆細胞の配置は整頓され,上皮を含む失われた構造が再生される8).哺乳類の再生能力は限られているが,皮膚の毛根9) や大腸の陰窩など,組織における特異的な構造を新たに再生することが可能である.このとき,間質は芽体と同様に位置情報を内包しており,上皮を含めた組織の再生の方向性を決定しているものと考えられる.Wnt5a陽性細胞をはじめとするさまざまな間質細胞がどのように位置情報を獲得するのか,今後は,間質細胞どうしの相互作用にも着目して詳細な解析を進めていきたい.
略歴:2002年 京都大学大学院医学研究科 助手,2008年より米国Washington大学School of Medicine博士研究員.
研究テーマ:腸管上皮と間質との相互作用.
Thaddeus S. Stappenbeck
米国Washington大学School of Medicine准教授.
研究室URL: http://pathology.wustl.edu/faculty/index.php?user=826&pageload=indi
© 2012 三好弘之・Thaddeus S. Stappenbeck Licensed under CC 表示 2.1 日本
(米国Washington大学School of Medicine,Department of Pathology and Immunology)
email:三好弘之
DOI: 10.7875/first.author.2012.117
Wnt5a potentiates TGF-β signaling to promote colonic crypt regeneration after tissue injury.
Hiroyuki Miyoshi, Rieko Ajima, Christine T. Luo, Terry P. Yamaguchi, Thaddeus S. Stappenbeck
Science, 338, 108-113 (2012)
要 約
損傷により失われた上皮組織が再生するためには,幹細胞が正しい位置に再配置され,正常に分化した細胞により損傷のまえの構造が再構築されなければならない.哺乳類の大腸上皮は規則正しく配列した無数のポケット構造である陰窩をもち,それぞれの陰窩は大腸幹細胞と数種類の分化した細胞から構成される.今回,筆者らは,マウスの大腸の損傷モデルを用い,失われた陰窩の再生に非古典的WntのひとつであるWnt5aが必要であることを明らかにした.Wnt5aを欠損したマウスの大腸における損傷の修復過程では,対照となるマウスと同様に幹細胞の増殖は観察されたが,陰窩は正しく再生されなかった.そこで,上皮細胞に対するWnt5aの作用をくわしく解明するため,in vitroにて大腸幹細胞を高密度に培養する方法を開発した.in vitroにおいてWnt5aは大腸幹細胞の増殖を抑制し,この作用はTGFβ経路に依存的であった.これらの結果から,Wnt5aは幹細胞の増殖を制限することにより大腸上皮の恒常性を回復することが示唆された.
はじめに
哺乳類の大腸上皮は陰窩(あるいは,クリプト)とよばれる試験管のような構造により構成されており,マウスの大腸には約30万もの陰窩が含まれている.すべての大腸上皮の供給源となる大腸幹細胞はそれぞれの陰窩の最深部に位置しており,大腸幹細胞の活発な分裂により生みだされた娘細胞は最終的に,粘液を産生する杯細胞,栄養分や水分を吸収する吸収上皮細胞,消化管ホルモンを分泌する内分泌細胞といった特定の役割をもつ細胞に分化する(図1a).
腸の管腔はつねに食物が通過し,それを栄養源とする無数の細菌が常在している.互いに強く接着した上皮細胞は微生物や毒素の侵入を防ぐもっとも重要な物理的な防壁である.腸の上皮細胞は入れ替わりが早いため,軽度の損傷は幹細胞から供給される新しい細胞によりすみやかに修復される.しかし,炎症性腸疾患や病原菌の感染などにより損傷が腸の深部に及んだ場合,幹細胞を含む陰窩の全体が失われてしまうことがある.幹細胞が失われればもはや新しい上皮をつくりだすことはできず,広範囲で上皮が失われた状態がつづけば炎症や感染は致命的となる.
それでは,いったん失われた陰窩は再生されるのだろうか? 再生されるとしたら,新たな幹細胞はどこからやってくるのだろうか? 腸管上皮における損傷修復の分子機構は,これまでも化学物質や放射線を用いたさまざまな動物モデルにおいて解析されてきた.しかしながら,これら多くのモデルでは広範囲の傷害とそれに起因する激しい炎症をともなうため,秩序だった上皮の再生を観察するのは困難であった.そこで,今回の研究では,陰窩を含む大腸の粘膜をバイオプシー(生検)ピンセットにより局所的に除去し,失われた陰窩が再生される過程を経時的に解析した.
1.マウスの大腸に生じた陰窩の欠損は周辺の陰窩から供給される大腸幹細胞により修復される
筆者らのグループは,内視鏡による観察のもとマウスの大腸の粘膜の一部をバイオプシーピンセットにより除去し,欠損した部位の修復過程を観察する系を開発している1).この系を用いて20から30の陰窩を欠損させると,損傷ののち2日以内に傷の表面は1層の上皮によりおおわれる.この特殊な上皮(wound associated epithelium,損傷関連上皮)はすみやかに傷の表面をおおうが,幹細胞を含んでおらず修復がおわると脱落する.つづいて,損傷ののち6日以内に周辺の正常な陰窩が分裂し欠損した部位を補完する1).今回は,250から300の陰窩(約1 mm2)を欠損させ,より広い領域の損傷がどのように修復されるかを観察した.小規模な損傷と同様に,損傷ののち4日以内に傷の表面は損傷関連上皮によりおおわれた.損傷ののち4日目から6日目にかけて,隣接する陰窩は拡張して溝のような構造に変化し傷の中心にむかい伸長した(図1b).この独特な構造体(wound channel,上皮溝)は活発に増殖する未分化な細胞で構成され,杯細胞などの分化した細胞はほとんど認められなかった.上皮溝は損傷ののち6日目から8日目にかけて小さな区画に分割され,正常な陰窩と同様の構造が再生された.これらの結果から,大腸における損傷の修復過程では,隣接する無傷の陰窩が上皮溝を形成することにより大腸幹細胞が損傷領域の全体に供給されることが明らかになった.また,上皮溝が分割され陰窩が再生する過程から,幹細胞の再配置が時間的かつ空間的に厳密に制御されていることが示唆された.
2.Wnt5aは損傷の修復過程において陰窩の再生に必要である
陰窩の再生の際に起こる分子変化を明らかにするため,上皮溝および正常な陰窩におけるRNA発現プロファイルをマイクロアレイ解析により比較した.上皮溝では細胞増殖にかかわる遺伝子とともにWnt経路にかかわる遺伝子の発現が上昇していた.Wnt経路は古典的経路と非古典的経路に分けられ,そのどちらも個体の発生における形態形成において重要なはたらきを担っている2).上皮細胞におけるWnt関連遺伝子の発現上昇は隣接する間質細胞から分泌されるWntリガンドの影響をうけていると考えられたことから,損傷部位の間質細胞からRNAを抽出しRT-PCR法により19種のWntと4種のR-spondinの発現を調べた.その結果,非古典的WntのひとつであるWnt5aがとくに強く発現していることがわかった.
βカテニンを介する古典的Wnt経路の活性化は大腸幹細胞の維持と増殖に必須であるが,非古典的Wnt経路の損傷修復における役割はいまだ不明である.Wnt5a陽性細胞の組織における分布を調べるためin situハイブリダイゼーションを行った.正常な大腸粘膜においてWnt5a陽性細胞は管腔側の間質に局在しており,大腸幹細胞の存在する陰窩の底部の周辺にはほとんど認められなかった.一方,損傷の修復過程では,増殖している上皮溝の細胞に隣接してWnt5a陽性の間質細胞が分布していた(図1b).とくに分割のはじまった上皮溝の分岐点にWnt5a陽性細胞が局在していたことから,これらの細胞から分泌されたWnt5aが隣接する上皮細胞に作用し,局所的に上皮溝の形態変化を促しているものと考えられた.この仮説を証明するため,Wnt5aの時期特異的なノックアウトマウスを作製し,腸管の損傷ののちの修復過程を観察した.Wnt5aノックアウトマウスでは損傷ののち6日目に分岐に乏しい上皮溝が形成され,損傷ののち8日目においても未分割の上皮溝が残存していたことから,Wnt5aが上皮溝からの陰窩の再生に必要であることが示された.
3.Wnt5aは大腸幹細胞の増殖を抑制する
Wnt5aが大腸幹細胞においてどのようなシグナル伝達経路を活性化するのか解析した.上皮溝でみられた大腸幹細胞の活発な増殖をin vitroにおいて再現するため,近年になり見い出された胃腸管幹細胞の維持に必要な3つのタンパク質3,4),古典的Wnt,R-spondin,Nogginを発現する細胞株を作製し,これらのタンパク質を培地に分泌させたコンディション培地を回収した.このコンディション培地を用いて大腸陰窩を培養したところ,代表的な腸幹細胞マーカーであるLgr5 5) を高発現する細胞組織体(オルガノイド)が得られた.これらのオルガノイドに含まれるほぼすべての細胞は増殖しており,分化した細胞はごく少数であったことから,上皮溝に類似した細胞集団であると考えられた.球形のオルガノイドにWnt5aを吸着させたアガロースビーズを隣接させたところ,隣接した部位における細胞増殖は抑制され,上皮溝の分裂に似たくぼみが高頻度で形成された.また,Wnt5aを培地にくわえるとオルガノイドの全体の細胞増殖が濃度に依存的に抑制された.これらの結果から,Wnt5aは細胞増殖を局所的に抑制することにより上皮溝において大腸幹細胞の集団を小さな区画に分断し,陰窩の再生を促しているものと考えられた.
4.Wnt5aはTGFβ経路の活性化を増強する
非古典的WntはJNK経路やCa2+経路など複数のシグナル伝達経路を活性化することが知られているが,Wnt5aの大腸幹細胞に対する増殖抑制の効果は既知のシグナル伝達経路では説明できなかった.そこで,Wnt5aを作用させたオルガノイドにおいてサイクリンキナーゼ阻害タンパク質のひとつであるp15の発現が上昇していることに注目した.p15はTGFβ経路の下流において発現の誘導されるタンパク質のひとつであり,TGFβは上皮細胞の増殖を抑制する代表的な分泌タンパク質である6).そこで,TGFβ経路の下流において発現の誘導されるもっとも代表的な遺伝子であるPAI-1遺伝子の発現を調べたところ,Wnt5aにより濃度に依存的に上昇した.また,Wnt5aを作用させたオルガノイドではSmad3のリン酸化と核への移行が観察されたことから,Wnt5aがTGFβ経路の活性化を増強していることが示された.これと一致して,Wnt5aノックアウトマウスでは上皮溝の底部の大腸幹細胞におけるSmad3のリン酸化が抑制されていた.TGFβI型受容体の阻害剤であるSB431542はWnt5aの作用を打ち消したことから,Wnt5aによるTGFβ経路の活性化はTGFβ受容体のもつキナーゼ活性に依存していることがわかった.非古典的Wntの特異的な受容体であるRor2の発現をshRNAによりノックダウンしたオルガノイドでは,Wnt5aおよびTGFβによるPAI-1の発現誘導は弱まったが,細胞増殖の抑制効果は阻害されなかった.これらの結果から,Wnt5aはTGFβ経路の活性化を介し細胞増殖を抑制することが示された.今後は,大腸のオルガノイドを用いて,非古典的Wnt経路とTGFβ経路との相互作用を受容体のレベルで解析していく予定である.
おわりに
上皮と間質との相互作用は,損傷の修復のみならず,形態形成,腫瘍の形成といったさまざまな場面で鍵となる現象である.今回の研究結果から,大腸陰窩の再生が間質のWnt5a陽性細胞により制御されていることが示された.損傷の修復過程における間質細胞の配置は,再生ののちの組織の形態を決定する重要な要素である.筆者らの用いた大腸バイオプシー損傷モデルでは,上皮と間質が同時に失われるが,上皮溝の形成にさきだち未分化な間質細胞の増殖が観察され,血管や平滑筋などの支持組織が再生される.この過程は魚類や両生類などのより単純なモデル動物の再生機構に類似していた7).たとえば,両生類の肢の一部を切除すると切断面において骨,筋肉,血管といった支持組織の前駆細胞が急速に増殖し芽体(blastema)とよばれる細胞塊を形成する.芽体はいっけん無秩序な細胞の集合にみえるが,神経から分泌される位置情報によりおのおのの前駆細胞の配置は整頓され,上皮を含む失われた構造が再生される8).哺乳類の再生能力は限られているが,皮膚の毛根9) や大腸の陰窩など,組織における特異的な構造を新たに再生することが可能である.このとき,間質は芽体と同様に位置情報を内包しており,上皮を含めた組織の再生の方向性を決定しているものと考えられる.Wnt5a陽性細胞をはじめとするさまざまな間質細胞がどのように位置情報を獲得するのか,今後は,間質細胞どうしの相互作用にも着目して詳細な解析を進めていきたい.
文 献
- Seno, H., Miyoshi, H., Brown, S. L. et al.: Efficient colonic mucosal wound repair requires Trem2 signaling. Proc. Natl. Acad. Sci. USA, 106, 256-261 (2009)[PubMed]
- Angers, S. & Moon, R. T.: Proximal events in Wnt signal transduction. Nat. Rev. Mol. Cell Biol., 10, 468-477 (2009)[PubMed]
- Sato, T., Vries, R. G., Snippert, H. J. et al.: Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature, 459, 263-265 (2009)[PubMed]
- Barker, N., Huch, M., Kujala, P. et al.: Lgr5+ve stem cells drive self-renewal in the stomach and build long-lived gastric units in vitro. Cell Stem Cell, 6, 25-36 (2010)[PubMed]
- Barker, N., van Es, J. H., Kuipers, J. et al.: Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature, 449, 1003-1007 (2007)[PubMed]
- Moses, H. L., Yang, E. Y., Pietenpol, J. A.: TGF-β stimulation and inhibition of cell proliferation: New mechanistic insights. Cell, 63, 245-247 (1990)[PubMed]
- Stappenbeck, T. S. & Miyoshi, H.: The role of stromal stem cells in tissue regeneration and wound repair. Science, 324, 1666-1669 (2009)[PubMed]
- Kragl, M., Knapp, D., Nacu, E. et al.: Cells keep a memory of their tissue origin during axolotl limb regeneration. Nature, 460, 60-65 (2009)[PubMed]
- Ito, M., Yang, Z., Andl, T. et al.: Wnt-dependent de novo hair follicle regeneration in adult mouse skin after wounding. Nature, 447, 316-320 (2007)[PubMed]
著者プロフィール
略歴:2002年 京都大学大学院医学研究科 助手,2008年より米国Washington大学School of Medicine博士研究員.
研究テーマ:腸管上皮と間質との相互作用.
Thaddeus S. Stappenbeck
米国Washington大学School of Medicine准教授.
研究室URL: http://pathology.wustl.edu/faculty/index.php?user=826&pageload=indi
© 2012 三好弘之・Thaddeus S. Stappenbeck Licensed under CC 表示 2.1 日本