T細胞性急性リンパ性白血病におけるコア転写制御回路
三田 貴臣
(米国Harvard Medical School,Dana-Farber Cancer Institute)
email:三田貴臣
DOI: 10.7875/first.author.2012.113
Core transcriptional regulatory circuit controlled by the TAL1 complex in human T cell acute lymphoblastic leukemia.
Takaomi Sanda, Lee N. Lawton, M. Inmaculada Barrasa, Zi Peng Fan, Holger Kohlhammer, Alejandro Gutierrez, Wenxue Ma, Jessica Tatarek, Yebin Ahn, Michelle A. Kelliher, Catriona H.M. Jamieson, Louis M. Staudt, Richard A. Young, A. Thomas Look
Cancer Cell, 22, 209-221 (2012)
がん原性の転写因子TAL1は染色体の転座などを介しT細胞性急性リンパ性白血病の症例の約40%に異常に発現しており,その分子病態において重要な役割をはたしている.今回,筆者らは,TAL1およびTAL1複合体の構成タンパク質により形成されるコア転写制御回路の存在を明らかにした.TAL1はGATA3,RUNX1とともに“相互に接続した”正の自己制御ループを形成するとともに,がん遺伝子であるMYB遺伝子の発現を誘導し正のフィードフォワードループを形成した.さらに,TAL1は一部の標的遺伝子の転写制御に関しヘテロ二量体化のパートナーであるEタンパク質の機能を抑制した.これらの結果は,TAL1は正常のT細胞には認められない異常な転写制御プログラムをひき起こすことにより,T細胞の腫瘍化および生存の維持にはたらくことを示すものであった.
T細胞性急性リンパ性白血病(T-cell acute lymphoblastic leukemia:T-ALL)は胸腺のT細胞に由来する悪性の腫瘍であり,小児にも成人にも共通して認められる.T細胞性急性リンパ性白血病ではT細胞受容体をコードする遺伝子領域における染色体の転座が20~35%の症例において認められ,その相手となる遺伝子は,TAL1/SCL,TLX1/HOX11,TLX3/HOX11L2,LYL1,LMO1,LMO2などの転写因子をコードする遺伝子が90%以上をしめる1,2).これらの遺伝子は,それぞれT細胞受容体遺伝子のもつエンハンサー活性のもと異常な発現を起こし,胸腺T細胞の白血病化の過程にがん遺伝子として密接にかかわっている.このうち,TAL1遺伝子は染色体転座のほかにも染色体内組換えなどにより異常な発現を起こし,あわせて約40%のT細胞性急性リンパ性白血病の症例において高発現が認められ,この疾患におけるもっとも高頻度な遺伝子異常のひとつとなっている.
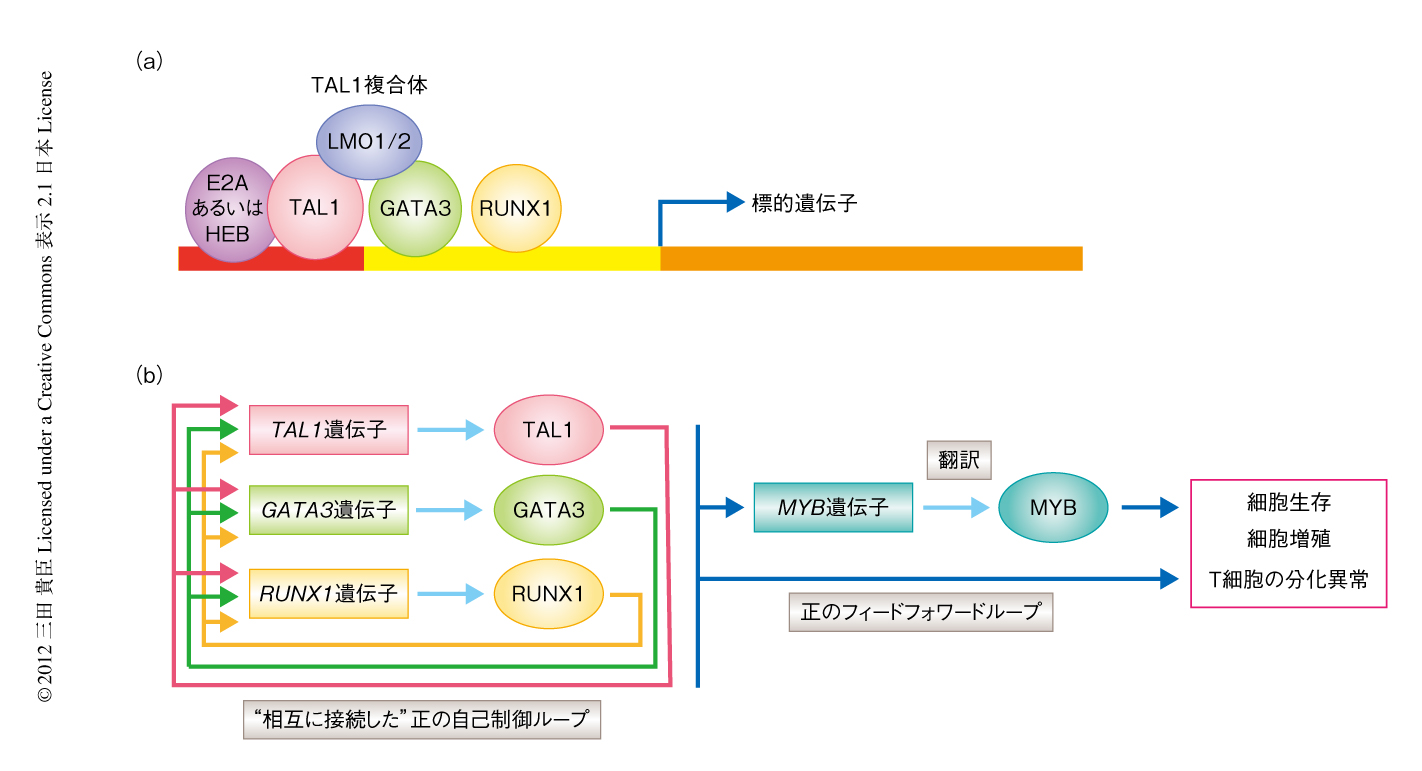
TAL1は塩基性ヘリックス-ループ-ヘリックス型の転写因子であり,別の塩基性ヘリックス-ループ-ヘリックス型転写因子であるEタンパク質(HEBあるいはE2A)とヘテロ二量体を形成し,さらに,LMO1あるいはLMO2との結合を介しGATA3と巨大な転写因子複合体を形成する(図1a).最近では,正常な造血細胞においてRUNX1もTAL1と相互作用することが報告されている.しかしながら,胸腺T細胞の腫瘍化の過程におけるTAL1複合体の詳細な役割についてはこれまで明らかでなかった.
今回,筆者らは,T細胞性急性リンパ性白血病細胞を用いた網羅的な標的遺伝子の解析および遺伝子発現解析により,TAL1およびTAL1複合体の構成タンパク質により制御される“コア転写制御回路”の存在を明らかにした.同様の回路はこれまでES細胞や造血幹細胞において報告されており,今回の報告は,このような回路が白血病細胞あるいはがん細胞にも認められることを明らかにしたはじめての例であった.
TAL1に対する特異的な抗体を用いてクロマチン免疫沈降-シークエンス(chromatin immunoprecipitation coupled to massively parallel DNA sequencing:ChIP-seq)解析を行い,T細胞性急性リンパ性白血病細胞におけるTAL1の標的遺伝子を網羅的に同定した.検体としては,TAL1を発現しているT細胞性急性リンパ性白血病の患者に由来する細胞2種類と,T細胞性急性リンパ性白血病の細胞株2種類を用いた.その結果,これら4つの検体のあいだでTAL1の結合プロファイルに高い一致が認められ,TAL1がT細胞性急性リンパ性白血病細胞において固有の標的遺伝子をもつことが示された.DNA結合モチーフ解析の結果,TAL1の結合部位から200 bp以内にEボックス,GATA結合配列,RUNX結合配列,ETS結合配列の4つのモチーフが有意に認められ,それぞれEタンパク質,GATA,RUNX,ETSが転写因子としてTAL1と同じ部位あるいはその近くで結合していることが示唆された.
つぎに,TAL1複合体の構成タンパク質であるHEB,E2A,GATA3,LMO1,LMO2,RUNX1それぞれに対してもChIP-seq解析を行いそのプロファイルを比較した.その結果,実際にT細胞性急性リンパ性白血病細胞において,TAL1とTAL1複合体の構成タンパク質が標的遺伝子を高い頻度で共有していることが確認された.それらの標的遺伝子には細胞の増殖あるいは生存やがん化にかかわる遺伝子が多く含まれるとともに,T細胞の分化や活性化に関与する遺伝子も多く含まれていた.これらの結果から,TAL1複合体はT細胞性急性リンパ性白血病細胞においても正常の造血幹細胞と同様に転写因子複合体としてはたらいており,一方で,T細胞のホメオスタシスにかかわる遺伝子の発現を制御していることが示された.
TAL1複合体によりその標的遺伝子がどのように制御されているのかを検討するため,TAL1複合体の構成タンパク質それぞれに対しshRNAを用いたノックダウンを行い,そののちの遺伝子発現プロファイルをマイクロアレイ法により解析した.その結果,T細胞性急性リンパ性白血病細胞においてはTAL1のノックダウンにより多くの遺伝子の発現低下が認められ,TAL1はおもに転写の活性化にはたらいていることが示唆された.重要なことに,TAL1,GATA3,RUNX1の3つの転写因子は,その遺伝子自体をも含むそれぞれ3つの遺伝子のエンハンサー領域に結合しており,いずれか1つの転写因子をノックダウンすることにより3つの転写因子の遺伝子すべてに発現低下が認められた.この結果は,TAL1,GATA3,RUNX1が“positive interconnected auto-regulatory loop”(“相互に接続した”正の自己制御ループ)とよばれる転写制御構造を形成し,互いに遺伝子発現を正に制御していることを示すものであった(図1b).このような構造はこれまでES細胞などで観察されており,下流の遺伝子発現制御の安定化および細胞状態の維持に必要と考えられている3).実際に,T細胞性急性リンパ性白血病においてTAL1,GATA3,RUNX1をそれぞれノックダウンするとアポトーシスの誘導が認められ,これらの3つの転写因子がT細胞性急性リンパ性白血病細胞の生存に対し促進的にはたらいていることが考えられた.
TAL1の標的遺伝子がGATA3やRUNX1によりどのように制御されているのかを検討した.この解析にあたり,ChIP-seq解析およびマイクロアレイ解析の結果にもとづき約300の代表的なTAL1の標的遺伝子を選定し,GATA3とRUNX1をそれぞれノックダウンした際にこれらの遺伝子の発現がどのように変動するのかを検討した.その結果,TAL1のノックダウンにより発現の低下する遺伝子の多くがGATA3およびRUNX1のノックダウンによっても発現低下し,逆に,TAL1のノックダウンにより発現の上昇する遺伝子はGATA3およびRUNX1のノックダウンによっても発現上昇した.この結果は,TAL1,GATA3,RUNX1が単に互いを正に制御しているだけでなく,その下流の遺伝子についても協調的に制御していることを示していた.なお,GATA3とRUNX1は正常なT細胞の分化過程においてそれぞれCD4陽性T細胞あるいはCD8陽性T細胞へのコミットメントに関与しており,互いに排他的にはたらくことが知られている.しかし今回の結果は,TAL1が異常に発現している状況ではGATA3とRUNX1とが協調的にはたらく可能性を示していた.さらには,RUNX1遺伝子は急性骨髄性白血病や骨髄異型性症候群,最近では,初期胸腺前駆細胞型のT細胞性急性リンパ性白血病においてがん抑制遺伝子としてはたらくことが報告されているが,TAL1複合体の構成タンパク質という文脈においてはRUNX1が腫瘍化に対し促進的にはたらくことが示唆された.
興味深いことに,TAL1複合体により発現の制御される標的遺伝子には多数の転写因子をコードする遺伝子が含まれていた.そのうち,MYB遺伝子はがん遺伝子として知られており,T細胞性急性リンパ性白血病においても遺伝子の増幅が高頻度に認められる4).そこで,TAL1を発現しているT細胞性急性リンパ性白血病細胞におけるMYBの役割を検討するため,MYBに対しshRNAを用いたノックダウンおよびマイクロアレイ法による遺伝子発現解析を行い,TAL1の標的遺伝子への影響について検討した.その結果,TAL1により発現の制御される遺伝子の多くはMYBによっても同様に制御されることが明らかになった.すなわち,TAL1複合体は直接の標的としてMYBの発現を誘導するとともに,MYBも転写因子として共通の標的遺伝子を制御していた.いわば,第1階層に位置するTAL1とその下の第2階層に位置するMYBとが正のフィードフォワードループを形成しており,そのほか多くの第2階層の標的遺伝子を協調的に制御していた(図1b).このような転写制御構造もこれまで幹細胞において報告されており5),このような構造は下流の転写制御プログラムを強化しその安定性を増加させると考えられている6).
Eタンパク質(HEBあるいはE2A)はTAL1のヘテロ二量体のパートナーとしてその転写制御において不可欠である(図1a).しかし,正常な胸腺T細胞の分化過程ではこれらは異なる発現パターンを示す7).具体的には,TAL1はリンパ球共通前駆細胞の段階では発現しているが分化にともない発現は抑制されDN4段階あるいはDP段階で発現は認められなくなる.一方,HEBあるいはE2Aは分化にともない発現が亢進しDN4段階あるいはDP段階で発現量は最大となる.興味深いことに,HEBあるいはE2Aを遺伝的に欠損したマウスをTAL1トランスジェニックマウスと交配させると,T細胞性急性リンパ性白血病におけるTAL1による腫瘍化がさらに促進されることが報告されており,HEB遺伝子およびE2A遺伝子はTAL1に対しがん抑制遺伝子としてはたらくことが示唆されている8).しかし,これまでその分子機構については明らかではなかった.そこで,HEBあるいはE2Aに対しshRNAを用いたノックダウンおよびマクロアレイ法による遺伝子発現解析を行ったところ,TAL1の標的遺伝子の約40%についてはTAL1とHEBあるいはE2Aは協調的に遺伝子発現を制御するが,約30%については逆向きに遺伝子発現を制御することが明らかになった.その場合,TAL1により遺伝子発現は活性化され,HEBあるいはE2Aにより遺伝子発現は抑制されていた.これら逆向きの制御をうける遺伝子には,ケラチンの遺伝子など通常はT細胞において発現しない遺伝子が含まれていた.このような遺伝子はおそらくDN4段階やDP段階のT細胞においてEタンパク質二量体により転写が抑制されているが,染色体転座などによりTAL1が異所性に発現するとTAL1-Eタンパク質ヘテロ二量体が形成され,Eタンパク質ホモ二量体のはたらきを質的および量的に抑制することにより,その標的遺伝子の発現が亢進に転じているのではないかと予想された.
今回,筆者らは,白血病細胞においてもES細胞と同様のコア転写制御回路が存在することを明らかにした.通常,分化の途中の胸腺T細胞ではTAL1は発現していないためこのような回路は形成されていないと考えられるが,染色体転座などでTAL1が異常に発現することにより幹細胞に類似した回路がT細胞において形成される.さらに,TAL1はEタンパク質の本来もつ機能を阻害することでもT細胞における転写制御プログラムに異常をもたらす.TAL1はいわば転写制御ヒエラルキーの最上部に位置しており,筆者らの報告は,一遺伝子の異常により正常な細胞における転写制御プログラムが書き換えられ,それが白血病につながることを示すものであった.
略歴:2006年 名古屋市立大学大学院医学研究科博士課程 修了,同年 米国Harvard Medical SchoolにてPostdoctoral research fellowを経て,2010年より同Instructor.
研究テーマ:リンパ球系腫瘍における転写因子の異常あるいはチロシンキナーゼの異常の解析,および,それらを標的とした分子標的療法の開発.
抱負:リンパ球系腫瘍に対する新たな分子標的療法の確立をめざし日々研究に励んでいます.
© 2012 三田 貴臣 Licensed under CC 表示 2.1 日本
(米国Harvard Medical School,Dana-Farber Cancer Institute)
email:三田貴臣
DOI: 10.7875/first.author.2012.113
Core transcriptional regulatory circuit controlled by the TAL1 complex in human T cell acute lymphoblastic leukemia.
Takaomi Sanda, Lee N. Lawton, M. Inmaculada Barrasa, Zi Peng Fan, Holger Kohlhammer, Alejandro Gutierrez, Wenxue Ma, Jessica Tatarek, Yebin Ahn, Michelle A. Kelliher, Catriona H.M. Jamieson, Louis M. Staudt, Richard A. Young, A. Thomas Look
Cancer Cell, 22, 209-221 (2012)
要 約
がん原性の転写因子TAL1は染色体の転座などを介しT細胞性急性リンパ性白血病の症例の約40%に異常に発現しており,その分子病態において重要な役割をはたしている.今回,筆者らは,TAL1およびTAL1複合体の構成タンパク質により形成されるコア転写制御回路の存在を明らかにした.TAL1はGATA3,RUNX1とともに“相互に接続した”正の自己制御ループを形成するとともに,がん遺伝子であるMYB遺伝子の発現を誘導し正のフィードフォワードループを形成した.さらに,TAL1は一部の標的遺伝子の転写制御に関しヘテロ二量体化のパートナーであるEタンパク質の機能を抑制した.これらの結果は,TAL1は正常のT細胞には認められない異常な転写制御プログラムをひき起こすことにより,T細胞の腫瘍化および生存の維持にはたらくことを示すものであった.
はじめに
T細胞性急性リンパ性白血病(T-cell acute lymphoblastic leukemia:T-ALL)は胸腺のT細胞に由来する悪性の腫瘍であり,小児にも成人にも共通して認められる.T細胞性急性リンパ性白血病ではT細胞受容体をコードする遺伝子領域における染色体の転座が20~35%の症例において認められ,その相手となる遺伝子は,TAL1/SCL,TLX1/HOX11,TLX3/HOX11L2,LYL1,LMO1,LMO2などの転写因子をコードする遺伝子が90%以上をしめる1,2).これらの遺伝子は,それぞれT細胞受容体遺伝子のもつエンハンサー活性のもと異常な発現を起こし,胸腺T細胞の白血病化の過程にがん遺伝子として密接にかかわっている.このうち,TAL1遺伝子は染色体転座のほかにも染色体内組換えなどにより異常な発現を起こし,あわせて約40%のT細胞性急性リンパ性白血病の症例において高発現が認められ,この疾患におけるもっとも高頻度な遺伝子異常のひとつとなっている.
TAL1は塩基性ヘリックス-ループ-ヘリックス型の転写因子であり,別の塩基性ヘリックス-ループ-ヘリックス型転写因子であるEタンパク質(HEBあるいはE2A)とヘテロ二量体を形成し,さらに,LMO1あるいはLMO2との結合を介しGATA3と巨大な転写因子複合体を形成する(図1a).最近では,正常な造血細胞においてRUNX1もTAL1と相互作用することが報告されている.しかしながら,胸腺T細胞の腫瘍化の過程におけるTAL1複合体の詳細な役割についてはこれまで明らかでなかった.
今回,筆者らは,T細胞性急性リンパ性白血病細胞を用いた網羅的な標的遺伝子の解析および遺伝子発現解析により,TAL1およびTAL1複合体の構成タンパク質により制御される“コア転写制御回路”の存在を明らかにした.同様の回路はこれまでES細胞や造血幹細胞において報告されており,今回の報告は,このような回路が白血病細胞あるいはがん細胞にも認められることを明らかにしたはじめての例であった.
1.TAL1複合体はT細胞のホメオスタシスにかかわる遺伝子の発現を制御する
TAL1に対する特異的な抗体を用いてクロマチン免疫沈降-シークエンス(chromatin immunoprecipitation coupled to massively parallel DNA sequencing:ChIP-seq)解析を行い,T細胞性急性リンパ性白血病細胞におけるTAL1の標的遺伝子を網羅的に同定した.検体としては,TAL1を発現しているT細胞性急性リンパ性白血病の患者に由来する細胞2種類と,T細胞性急性リンパ性白血病の細胞株2種類を用いた.その結果,これら4つの検体のあいだでTAL1の結合プロファイルに高い一致が認められ,TAL1がT細胞性急性リンパ性白血病細胞において固有の標的遺伝子をもつことが示された.DNA結合モチーフ解析の結果,TAL1の結合部位から200 bp以内にEボックス,GATA結合配列,RUNX結合配列,ETS結合配列の4つのモチーフが有意に認められ,それぞれEタンパク質,GATA,RUNX,ETSが転写因子としてTAL1と同じ部位あるいはその近くで結合していることが示唆された.
つぎに,TAL1複合体の構成タンパク質であるHEB,E2A,GATA3,LMO1,LMO2,RUNX1それぞれに対してもChIP-seq解析を行いそのプロファイルを比較した.その結果,実際にT細胞性急性リンパ性白血病細胞において,TAL1とTAL1複合体の構成タンパク質が標的遺伝子を高い頻度で共有していることが確認された.それらの標的遺伝子には細胞の増殖あるいは生存やがん化にかかわる遺伝子が多く含まれるとともに,T細胞の分化や活性化に関与する遺伝子も多く含まれていた.これらの結果から,TAL1複合体はT細胞性急性リンパ性白血病細胞においても正常の造血幹細胞と同様に転写因子複合体としてはたらいており,一方で,T細胞のホメオスタシスにかかわる遺伝子の発現を制御していることが示された.
2.TAL1,GATA3,RUNX1は“相互に接続した”正の自己制御ループを形成する
TAL1複合体によりその標的遺伝子がどのように制御されているのかを検討するため,TAL1複合体の構成タンパク質それぞれに対しshRNAを用いたノックダウンを行い,そののちの遺伝子発現プロファイルをマイクロアレイ法により解析した.その結果,T細胞性急性リンパ性白血病細胞においてはTAL1のノックダウンにより多くの遺伝子の発現低下が認められ,TAL1はおもに転写の活性化にはたらいていることが示唆された.重要なことに,TAL1,GATA3,RUNX1の3つの転写因子は,その遺伝子自体をも含むそれぞれ3つの遺伝子のエンハンサー領域に結合しており,いずれか1つの転写因子をノックダウンすることにより3つの転写因子の遺伝子すべてに発現低下が認められた.この結果は,TAL1,GATA3,RUNX1が“positive interconnected auto-regulatory loop”(“相互に接続した”正の自己制御ループ)とよばれる転写制御構造を形成し,互いに遺伝子発現を正に制御していることを示すものであった(図1b).このような構造はこれまでES細胞などで観察されており,下流の遺伝子発現制御の安定化および細胞状態の維持に必要と考えられている3).実際に,T細胞性急性リンパ性白血病においてTAL1,GATA3,RUNX1をそれぞれノックダウンするとアポトーシスの誘導が認められ,これらの3つの転写因子がT細胞性急性リンパ性白血病細胞の生存に対し促進的にはたらいていることが考えられた.
3.TAL1,GATA3,RUNX1は下流の遺伝子の発現制御に対しても協調的にはたらく
TAL1の標的遺伝子がGATA3やRUNX1によりどのように制御されているのかを検討した.この解析にあたり,ChIP-seq解析およびマイクロアレイ解析の結果にもとづき約300の代表的なTAL1の標的遺伝子を選定し,GATA3とRUNX1をそれぞれノックダウンした際にこれらの遺伝子の発現がどのように変動するのかを検討した.その結果,TAL1のノックダウンにより発現の低下する遺伝子の多くがGATA3およびRUNX1のノックダウンによっても発現低下し,逆に,TAL1のノックダウンにより発現の上昇する遺伝子はGATA3およびRUNX1のノックダウンによっても発現上昇した.この結果は,TAL1,GATA3,RUNX1が単に互いを正に制御しているだけでなく,その下流の遺伝子についても協調的に制御していることを示していた.なお,GATA3とRUNX1は正常なT細胞の分化過程においてそれぞれCD4陽性T細胞あるいはCD8陽性T細胞へのコミットメントに関与しており,互いに排他的にはたらくことが知られている.しかし今回の結果は,TAL1が異常に発現している状況ではGATA3とRUNX1とが協調的にはたらく可能性を示していた.さらには,RUNX1遺伝子は急性骨髄性白血病や骨髄異型性症候群,最近では,初期胸腺前駆細胞型のT細胞性急性リンパ性白血病においてがん抑制遺伝子としてはたらくことが報告されているが,TAL1複合体の構成タンパク質という文脈においてはRUNX1が腫瘍化に対し促進的にはたらくことが示唆された.
4.TAL1複合体はがん遺伝子MYBの発現を誘導し正のフィードフォワードループを形成する
興味深いことに,TAL1複合体により発現の制御される標的遺伝子には多数の転写因子をコードする遺伝子が含まれていた.そのうち,MYB遺伝子はがん遺伝子として知られており,T細胞性急性リンパ性白血病においても遺伝子の増幅が高頻度に認められる4).そこで,TAL1を発現しているT細胞性急性リンパ性白血病細胞におけるMYBの役割を検討するため,MYBに対しshRNAを用いたノックダウンおよびマイクロアレイ法による遺伝子発現解析を行い,TAL1の標的遺伝子への影響について検討した.その結果,TAL1により発現の制御される遺伝子の多くはMYBによっても同様に制御されることが明らかになった.すなわち,TAL1複合体は直接の標的としてMYBの発現を誘導するとともに,MYBも転写因子として共通の標的遺伝子を制御していた.いわば,第1階層に位置するTAL1とその下の第2階層に位置するMYBとが正のフィードフォワードループを形成しており,そのほか多くの第2階層の標的遺伝子を協調的に制御していた(図1b).このような転写制御構造もこれまで幹細胞において報告されており5),このような構造は下流の転写制御プログラムを強化しその安定性を増加させると考えられている6).
5.TAL1とHEB,E2Aは一部の標的遺伝子の発現を逆方向に制御する
Eタンパク質(HEBあるいはE2A)はTAL1のヘテロ二量体のパートナーとしてその転写制御において不可欠である(図1a).しかし,正常な胸腺T細胞の分化過程ではこれらは異なる発現パターンを示す7).具体的には,TAL1はリンパ球共通前駆細胞の段階では発現しているが分化にともない発現は抑制されDN4段階あるいはDP段階で発現は認められなくなる.一方,HEBあるいはE2Aは分化にともない発現が亢進しDN4段階あるいはDP段階で発現量は最大となる.興味深いことに,HEBあるいはE2Aを遺伝的に欠損したマウスをTAL1トランスジェニックマウスと交配させると,T細胞性急性リンパ性白血病におけるTAL1による腫瘍化がさらに促進されることが報告されており,HEB遺伝子およびE2A遺伝子はTAL1に対しがん抑制遺伝子としてはたらくことが示唆されている8).しかし,これまでその分子機構については明らかではなかった.そこで,HEBあるいはE2Aに対しshRNAを用いたノックダウンおよびマクロアレイ法による遺伝子発現解析を行ったところ,TAL1の標的遺伝子の約40%についてはTAL1とHEBあるいはE2Aは協調的に遺伝子発現を制御するが,約30%については逆向きに遺伝子発現を制御することが明らかになった.その場合,TAL1により遺伝子発現は活性化され,HEBあるいはE2Aにより遺伝子発現は抑制されていた.これら逆向きの制御をうける遺伝子には,ケラチンの遺伝子など通常はT細胞において発現しない遺伝子が含まれていた.このような遺伝子はおそらくDN4段階やDP段階のT細胞においてEタンパク質二量体により転写が抑制されているが,染色体転座などによりTAL1が異所性に発現するとTAL1-Eタンパク質ヘテロ二量体が形成され,Eタンパク質ホモ二量体のはたらきを質的および量的に抑制することにより,その標的遺伝子の発現が亢進に転じているのではないかと予想された.
おわりに
今回,筆者らは,白血病細胞においてもES細胞と同様のコア転写制御回路が存在することを明らかにした.通常,分化の途中の胸腺T細胞ではTAL1は発現していないためこのような回路は形成されていないと考えられるが,染色体転座などでTAL1が異常に発現することにより幹細胞に類似した回路がT細胞において形成される.さらに,TAL1はEタンパク質の本来もつ機能を阻害することでもT細胞における転写制御プログラムに異常をもたらす.TAL1はいわば転写制御ヒエラルキーの最上部に位置しており,筆者らの報告は,一遺伝子の異常により正常な細胞における転写制御プログラムが書き換えられ,それが白血病につながることを示すものであった.
文 献
- Look, A. T.: Oncogenic transcription factors in the human acute leukemias. Science, 278, 1059-1064 (1997)[PubMed]
- Aifantis, I., Raetz, E. & Buonamici, S.: Molecular pathogenesis of T-cell leukaemia and lymphoma. Nat. Rev. Immunol., 8, 380-390 (2008)[PubMed]
- Young, R. A.: Control of the embryonic stem cell state. Cell, 144, 940-954 (2011)[PubMed]
- O'Neil, J., Tchinda, J., Gutierrez, A. et al.: Alu elements mediate MYB gene tandem duplication in human T-ALL. J. Exp. Med., 204, 3059-3066 (2007)[PubMed]
- Novershtern, N., Subramanian, A., Lawton, L. N. et al.: Densely interconnected transcriptional circuits control cell states in human hematopoiesis. Cell, 144, 296-309 (2011)[PubMed]
- Alon, U.: Network motifs: theory and experimental approaches. Nat. Rev. Genet., 8, 450-461 (2007)[PubMed]
- Herblot, S., Steff, A. M., Hugo, P. et al.: SCL and LMO1 alter thymocyte differentiation: inhibition of E2A-HEB function and pre-Tα chain expression. Nat. Immunol., 1, 138-144 (2000)[PubMed]
- O'Neil, J., Shank, J., Cusson, N. et al.: TAL1/SCL induces leukemia by inhibiting the transcriptional activity of E47/HEB. Cancer Cell, 5, 587-596 (2004)[PubMed]
著者プロフィール
略歴:2006年 名古屋市立大学大学院医学研究科博士課程 修了,同年 米国Harvard Medical SchoolにてPostdoctoral research fellowを経て,2010年より同Instructor.
研究テーマ:リンパ球系腫瘍における転写因子の異常あるいはチロシンキナーゼの異常の解析,および,それらを標的とした分子標的療法の開発.
抱負:リンパ球系腫瘍に対する新たな分子標的療法の確立をめざし日々研究に励んでいます.
© 2012 三田 貴臣 Licensed under CC 表示 2.1 日本