Lrp4は神経筋接合部において運動神経終末の分化を誘導する逆行性シグナルタンパク質である
湯本 法弘
(米国New York大学Medical School,Departments of Molecular Neurobiology)
email:湯本法弘
DOI: 10.7875/first.author.2012.111
Lrp4 is a retrograde signal for presynaptic differentiation at neuromuscular synapses.
Norihiro Yumoto, Natalie Kim, Steven J. Burden
Nature, 489, 438-442 (2012)
運動神経の軸索はその神経終末の分化や安定化に必須である逆行性シグナルを骨格筋から受容する.この逆行性シグナルの同定はいまだなされていないが,そのシグナルの産生は受容体型チロシンキナーゼであるMuSK,および,MuSKと複合体を形成しAgrinとの結合によりMuSKを活性化させるLDL受容体ファミリーのメンバーLrp4に依存している.筆者らは,Lrp4がMuSKの活性化とは独立に,運動神経終末の分化において必須であることをin vivoにおいて示し,Lrp4が運動神経軸索に結合してシナプス小胞や活性帯の構成タンパク質の集積を誘導することを示すことにより,Lrp4が運動神経終末の分化の初期段階において骨格筋に由来する直接的な逆行性シグナルタンパク質であることを証明した.したがって,Lrp4は,Agrinに結合しMuSKを活性化させることにより後シナプスの分化を促進し,逆に,骨格筋に由来する必要十分な逆行性シグナルタンパク質として前シナプス(運動神経終末)の分化を誘導することにより,両方向性に機能して神経筋接合部におけるシナプスの形成を統合していることが明らかになった.
神経筋接合部(neuromuscular junctions:NMJ)は運動神経終末と骨格筋とのあいだに,胚発生期において厳密な制御のもと形成される高度に特殊化した化学シナプスである.脊椎動物においてはアセチルコリンが運動神経終末から神経伝達物質として放出され,骨格筋に発現しているアセチルコリン受容体に結合することで骨格筋を収縮させる.神経筋接合部のもつ興味深い形態学的な特徴として,1本の筋線維(筋細胞)に必ず1つのシナプスがほぼその中央に形成されること,そして,そのシナプスの骨格筋の側(後シナプス)にはアセチルコリン受容体やシナプス形成タンパク質が非常に高密度に集積していること,などがあり,これらの特徴が堅実で信頼性の高い神経伝達に不可欠である.
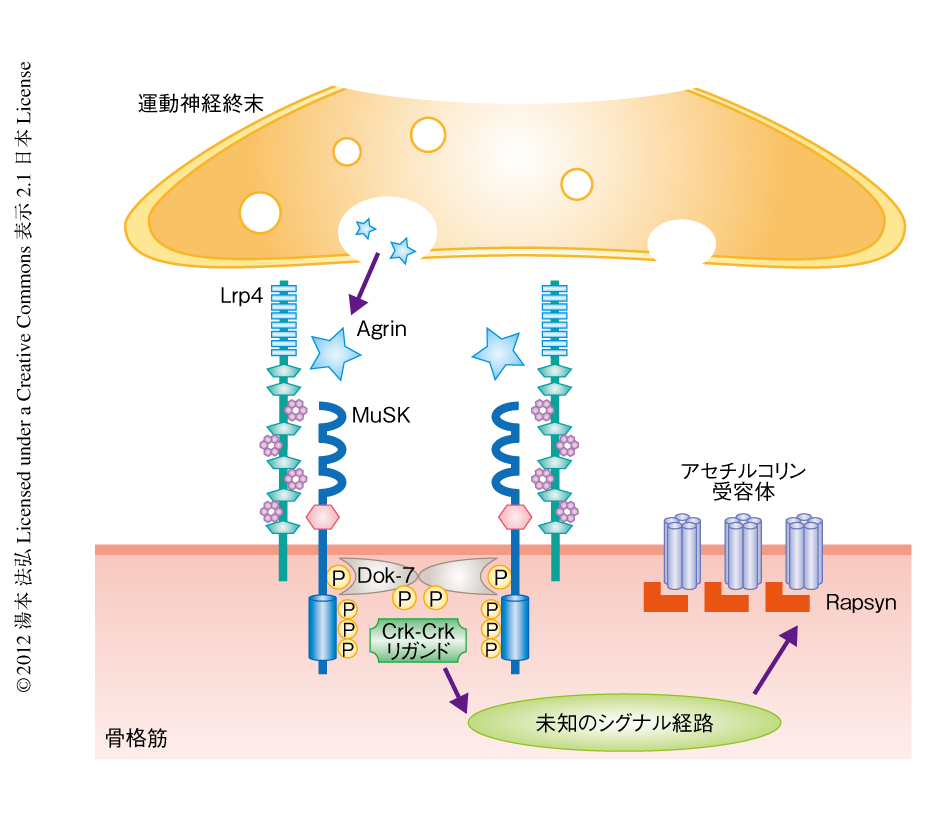
過去,数年から十数年にかけ,神経筋接合部の形成に重要な遺伝子が発見されてきた(図1).運動神経終末が骨格筋に到達すると,神経終末から分泌されているAgrinが,MuSK(muscle specific kinase)と複合体を形成しているLrp4(low-density lipoprotein receptor-related protein 4)と直接に結合する.このAgrinのLrp4への結合はLrp4とMuSKとの相互作用を増強し,MuSKの細胞内領域におけるリン酸化を亢進する1-3).そののち,このリン酸化部位にアダプタータンパク質であるDok-7が結合し,Crk-Crkリガンドを介し細胞内へとつぎつぎにシグナルが伝達され,最終的にRapsynに依存的なアセチルコリン受容体の集積という後シナプスの分化における主要な表現型のひとつが完成する4,5).近年,骨格筋は運動神経の支配をうける以前から,すなわち,Agrinに依存的なシグナルを受容する以前から,すでにアセチルコリン受容体を含む後シナプスタンパク質が集積し高度に分化していることが明らかになった6,7)(これを,muscle prepatterningとよぶ).このmuscle prepatterningはMuSKとLrp4に依存的に形成される1,2,8).したがって,Agrinはすでに形成された後シナプス組織をLrp4とMuSKを介しその調整や安定化を図るのである.このように,運動神経終末が骨格筋に到達したのち,どのようなタンパク質を介し,また,骨格筋においてどのようにシグナルが伝達されるかなどについては相対的に理解が進んでいる.
しかしながら,どのような分子機構が運動神経終末の分化(前シナプスの分化)を誘導しシナプスの形成を促進するのかという疑問は現在まで未解決のままであり,神経筋接合部の形成の分子機構を総合的に理解することにおいて大きなギャップとなっていた.しかしこれもまた,MuSKとLrp4に依存的であることが後述する理由から認識されていた.それは,MuSKノックアウトマウスおよびLrp4ノックアウトマウスにおいて,これらの遺伝子の発現は骨格筋に限定的であるにもかかわらず,運動神経終末はmuscle prepatterningの領域をはるかにこえて伸長し分化しないことである1,6,7)(最近,運動神経においてもLrp4が発現しシナプスの形成に寄与しているという論文が発表されたが,筆者らは,これについては否定的である).これは,骨格筋からのシグナルを運動神経が受容し,それが前シナプスの分化の引き金となっていることを示唆する強い証拠である.この論文では,in vitroおよびin vivoの両方のアプローチを用い,Lrp4こそが長いあいだ追求されてきた逆行性シグナルタンパク質であり,Lrp4が運動神経に結合することにより,後シナプスの分化を促進するシグナル経路とは独立に,運動神経終末への直接の分化誘導シグナルとなることを証明した.
Lrp4はMuSKに結合しAgrinに非依存的にMuSKのリン酸化を促進する1,2).運動神経終末の前シナプス分化はMuSKとLrp4に依存的であるため,その分子機構については,骨格筋においてリン酸化MuSKを介したシグナル経路が新規の逆行性シグナルを産生する可能性と,Lrp4あるいはMuSK,または,その両者が直接的な逆行性シグナルとなる可能性の2つがおもに考えられた.後者の可能性を検討するため,マウスの運動神経と非骨格筋細胞である線維芽細胞とのin vitro共培養系を確立した.この共培養系において,線維芽細胞の代わりに骨格筋細胞を用いると運動神経の軸索は骨格筋細胞と接触し,その接触領域の骨格筋においてアセチルコリン受容体が集積し,それと並列して運動神経の側にはシナプス小胞のマーカータンパク質が集積した(シナプス小胞の集積は,その場に前シナプスの分化が起こっていることを示すマーカーとして用いられる).このことから,この共培養系は実用的であることが示唆された.この運動神経を通常の線維芽細胞と共培養すると,運動神経は線維芽細胞と接触していたものの前シナプスの分化は観察されなかった.一方,運動神経とLrp4を発現させた線維芽細胞との接触領域では,シナプス小胞が集積し前シナプスの分化が誘導されていた.また,この実験系を用いた検証から,約220~240 kDaのLrp4のなかでも,LDLaドメインというN末端に存在する約40~45 kDaの機能ドメインが運動神経の前シナプスの分化誘導において十分であることがわかった.これらのことから,Lrp4は運動神経の前シナプスの分化を誘導するに十分であることが示唆された.
Lrp4の運動神経に対する活性が直接的なのか間接的なのかを検討するため,同様の運動神経の培養系を用い,培養細胞の代わりとして,精製したLrp4でおおわれたマイクロビーズを用いた.陰性対照となるタンパク質でおおわれたマイクロビーズと運動神経軸索との接触面では前シナプスの分化誘導は起こらなかった.一方,Lrp4のLDLaドメインでおおわれたマイクロビーズと運動神経軸索との接触面にはシナプス小胞が集積し,さらに,活性帯(active zone)の構成タンパク質も同時に集積した.同じくLDL受容体ファミリーのメンバーであるLrp1のもつLDLaドメインを用いた同様の実験では前シナプスの分化は誘導されなかったことから,この誘導活性はLrp4に特異的であることも明らかになった.さらには,MuSKでおおわれたマイクロビーズやMuSKを発現した線維芽細胞との共培養の結果から,MuSKはin vivoにおいて前シナプスの分化に必要であるが十分ではないことも示唆された.そのうえ,ビーズに結合していないLrp4を培養した運動神経にくわえても,それがビーズに結合させた実験の場合の10倍以上の量であっても前シナプスの分化は誘導されなかったことから,Lrp4は重合体として前シナプスの分化を誘導することが支持された.また,Agrinを欠損した運動神経は,野生型と同様に,LDLaドメインでおおわれたマイクロビーズにより前シナプスの分化が誘導されたため,Lrp4による前シナプスの分化誘導はAgrinには依存しないことも示された.
さて,つぎの疑問は,Lrp4により誘導された前シナプス組織がはたして機能的なのかどうかということであった.この疑問へのアプローチとして,神経を刺激することによるシナプス小胞の放出ののちの再取り込みを可視化する実験を採用した.すると,運動神経への刺激に依存的に,シナプス小胞の放出と再取り込みを示すシグナルがLrp4により分化の誘導された前シナプスに観察された.したがって,Lrp4は刺激に応じてシナプス小胞を放出,再取り込みする機能的な前シナプス組織の分化を誘導することが証明された.
ここまでの実験結果は,運動神経軸索がLrp4に応答して前シナプスの分化を開始していることを意味していた.すなわち,運動神経軸索にはLrp4に結合する受容体が存在する可能性を示していた.この仮説を検証するため,培養した運動神経にアルカリホスファターゼとLrp4の細胞外領域との融合タンパク質を添加し,アルカリホスファターゼの酵素反応を利用した色素染色を行った.その結果,陰性対照であるアルカリホスファターゼのみを添加した場合には運動神経軸索は染色されず,アルカリホスファターゼとLrp4の細胞外領域との融合タンパク質をくわえたときのみ運動神経軸索は強く染色された.興味深いことに,軸索が細胞体から遠位であればあるほどこの染色の強度は大きくなっており,もっとも遠位の領域では細胞体の付近に比べおよそ30倍も染色強度の大きいことが示された.この現象は,アルカリホスファターゼとLrp4のもつLDLaドメインとの融合タンパク質を用いた実験でも同様であった.すなわち,運動神経軸索の遠位部により多くのLrp4が結合していることを示していた.Lrp4が運動神経軸索の近位と遠位に結合する比率は添加するLrp4の量を変化させても同じであったことから,Lrp4が運動神経軸索の遠位においてより大きな親和性を示すというより,Lrp4結合タンパク質の量自体が運動神経軸索の遠位において多く存在していることが示唆された.また,Agrinを欠損した運動神経軸索も同様にLrp4と結合したため,運動神経軸索にはAgrinではない別のタンパク質がLrp4受容体として存在していることがわかった.
これまでのin vitroの実験から示されたように,Lrp4が神経筋接合部の形成の際の運動神経終末の分化誘導に不可欠かどうかを,in vivoの実験においても検討することにした.しかしながら,これには少しくふうが必要であった.Lrp4ノックアウトマウスでは前シナプスの分化ばかりではなく後シナプスの分化も障害されるためである.Lrp4の前シナプスの分化誘導における特異的な機能を検証するためには,前シナプスと後シナプスそれぞれにおけるLrp4の役割を区別する必要があった.つまり,Lrp4に非依存的に後シナプスの分化を誘導している状態において,前シナプスの分化の状態をLrp4の存在下および非存在下で検討できる状況をつくりだすことが求められた.
近年,Agrinノックアウトマウスにおいて,Musk遺伝子の発現を3倍ほど過剰にすると,Agrinの欠損による後シナプス組織の重度の不安定化,そして,それにともなう呼吸筋の収縮障害による出生時の致死という表現型が回復することが発見された.過剰に発現したMuSKはAgrinシグナル経路を迂回し後シナプスの分化を保つことができるのである.Lrp4はAgrinの受容体であり,Agrinによる後シナプス組織の安定化シグナルはLrp4を介さなければならないが,過剰に発現したMuSKがAgrinの非存在下でも後シナプス組織を維持できることは,過剰に発現したMuSKはまた,Lrp4の非存在下でも後シナプスの分化を誘導できる可能性を強く示唆した.そこで,Lrp4を欠損し同時にMuSKを過剰に発現するマウスを作製して,Lrp4の前シナプスの分化に特異的な役割を検討することにした.
予想どおり,Lrp4を欠損した場合でも過剰に発現したMuSKによりAgrin-Lrp4シグナル経路は迂回され,後シナプス組織が形成され維持されていた.Agrinを欠損した場合,過剰に発現したMuSKにより誘導された後シナプス組織は運動神経の支配をうけてシナプスを形成してこれを維持し,これが出生時の致死の回復につながった.一方,驚くべきことに,Lrp4を欠損した場合,誘導された後シナプス組織は運動神経に支配されることはなく,運動神経終末の側からみると,前シナプスの分化の誘導することはなく神経筋接合部は形成されなかった.そして,やはりこのマウスは出生時に致死であった.この結果は,in vivoにおいてLrp4が骨格筋に由来する運動神経終末に対する,必須の逆行性シグナル本体であることをまさに示す強い証拠であった.
現在までのところ,神経筋接合部の形成の分子機構については,その関連タンパク質の発見や,それらがどのようなシグナル経路を介して形成に寄与するのかなど,多くの場合,後シナプスを対象に研究が行われてきたため,そちらの分子機構の理解は相対的に進んでいる.しかしながら,前シナプスを対象とした研究は非常にチャレンジングな課題であり,神経筋接合部の形成の分子機構を総合的に理解するうえでの大きなギャップとなっていた.
今回の論文では,骨格筋に発現するLrp4がAgrinの受容体としてMuSKを介し後シナプスの分化を制御するばかりでなく,前シナプスの分化の初期段階に決定的な骨格筋に由来する逆行性シグナルタンパク質として機能することで,シナプスの形成を両方向性に厳密に制御していることが示された.このLrp4の前シナプスと後シナプスの両者における多様で決定的な機能は,Lrp4がシナプスの形成において3段階のクリティカルチェックポイントとして機能していることを示唆する(図2).すなわち,1)Lrp4は運動神経の到達にさきだちMuSKに結合してそのリン酸化を促しmuscle prepatterningを形成する,2)MuSKはいちど活性化されるとその正のフィードバック機構によりシグナルが増強し,より多くのタンパク質が集積するなかLrp4も重合体となり,到達した運動神経に対し逆行性シグナルタンパク質として運動神経終末の分化を誘導する,3)Lrp4により前シナプスの分化を誘導された運動神経終末からはAgrinが分泌されており,これをLrp4が受容してその場でより安定したシナプスを確立する.
これまで,in vitroの実験系により,FGF7,FGF10,FGF22,ラミニンB2,IV型コラーゲン,SIRPαなど,培養した運動神経に前シナプスの分化を促す骨格筋に由来するタンパク質がみつかっている.しかし,そのいずれのノックアウトマウスにおいても運動神経はいちど骨格筋とのあいだに神経筋接合部を形成するため,これらのタンパク質の前シナプスの分化における機能は,より後期の安定化や成熟の過程において重要であると考えられる9).したがって,前シナプスの分化の過程でより初期に機能する,別のタンパク質の存在が推定されていた.Lrp4の欠損により運動神経終末は骨格筋との神経筋接合部そのものを形成できなくなったため,Lrp4こそが,この前シナプスの分化の初期段階に機能するタンパク質であると考えられた.
このLrp4のもつ新たな機能の発見は,疾患との関連において新たな視点を生み出すかもしれない.筋萎縮性側索硬化症は患者のうち10~15%だけが家族性であり,大半は原因も理解されていない.しかし,どのような場合にも,初期の病理所見は運動神経末端の骨格筋からの離脱であり10),つまり,神経終末と骨格筋とのあいだの相互作用の脆弱性が原因になっていることも考えられる.そこから,Lrp4あるいは神経終末に存在するであろうLrp4受容体の遺伝子変異や機能不全が病因となっている可能性なども考えられる.
今後は,これまで未開の地であった,神経筋接合部の形成の際の運動神経終末における分子イベントがLrp4を起点として詳細に研究され,神経筋接合部の形成の分子機構の理解が前シナプス組織と後シナプス組織の両方の観点から進むことが期待される.
略歴:2008年 京都大学大学院医学研究科にて博士号取得,2009年より米国New York大学Medical Schoolポスドク研究員.
研究テーマ:前シナプスの分化からみた神経筋接合部の形成の分子機構.
関心事:今後は,Lrp4の受容体の同定とともに,これまで未開の地であった運動神経終末の分化における分子イベントを,単純な興味からだけでなく,ヒトへの還元がみえる位置から研究し理解を深めたい.
© 2012 湯本 法弘 Licensed under CC 表示 2.1 日本
(米国New York大学Medical School,Departments of Molecular Neurobiology)
email:湯本法弘
DOI: 10.7875/first.author.2012.111
Lrp4 is a retrograde signal for presynaptic differentiation at neuromuscular synapses.
Norihiro Yumoto, Natalie Kim, Steven J. Burden
Nature, 489, 438-442 (2012)
この論文に出現する遺伝子・タンパク質のUniprot ID
Lrp4(Q8VI56), 受容体型チロシンキナーゼ, MuSK(Q61006), Agrin(A2ASQ1), LDL受容体, アセチルコリン, アセチルコリン受容体, muscle specific kinase(Q61006), low-density lipoprotein receptor-related protein 4(Q8VI56), Dok-7(Q18PE0), Rapsyn(P12672), Lrp1(Q91ZX7), アルカリホスファターゼ, Lrp4受容体, Musk(Q61006), FGF7(P36363), FGF10(O35565), FGF22(Q9ESS2), ラミニンB2(P02468), IV型コラーゲン, SIRPα(P97797)
要 約
運動神経の軸索はその神経終末の分化や安定化に必須である逆行性シグナルを骨格筋から受容する.この逆行性シグナルの同定はいまだなされていないが,そのシグナルの産生は受容体型チロシンキナーゼであるMuSK,および,MuSKと複合体を形成しAgrinとの結合によりMuSKを活性化させるLDL受容体ファミリーのメンバーLrp4に依存している.筆者らは,Lrp4がMuSKの活性化とは独立に,運動神経終末の分化において必須であることをin vivoにおいて示し,Lrp4が運動神経軸索に結合してシナプス小胞や活性帯の構成タンパク質の集積を誘導することを示すことにより,Lrp4が運動神経終末の分化の初期段階において骨格筋に由来する直接的な逆行性シグナルタンパク質であることを証明した.したがって,Lrp4は,Agrinに結合しMuSKを活性化させることにより後シナプスの分化を促進し,逆に,骨格筋に由来する必要十分な逆行性シグナルタンパク質として前シナプス(運動神経終末)の分化を誘導することにより,両方向性に機能して神経筋接合部におけるシナプスの形成を統合していることが明らかになった.
はじめに
神経筋接合部(neuromuscular junctions:NMJ)は運動神経終末と骨格筋とのあいだに,胚発生期において厳密な制御のもと形成される高度に特殊化した化学シナプスである.脊椎動物においてはアセチルコリンが運動神経終末から神経伝達物質として放出され,骨格筋に発現しているアセチルコリン受容体に結合することで骨格筋を収縮させる.神経筋接合部のもつ興味深い形態学的な特徴として,1本の筋線維(筋細胞)に必ず1つのシナプスがほぼその中央に形成されること,そして,そのシナプスの骨格筋の側(後シナプス)にはアセチルコリン受容体やシナプス形成タンパク質が非常に高密度に集積していること,などがあり,これらの特徴が堅実で信頼性の高い神経伝達に不可欠である.
過去,数年から十数年にかけ,神経筋接合部の形成に重要な遺伝子が発見されてきた(図1).運動神経終末が骨格筋に到達すると,神経終末から分泌されているAgrinが,MuSK(muscle specific kinase)と複合体を形成しているLrp4(low-density lipoprotein receptor-related protein 4)と直接に結合する.このAgrinのLrp4への結合はLrp4とMuSKとの相互作用を増強し,MuSKの細胞内領域におけるリン酸化を亢進する1-3).そののち,このリン酸化部位にアダプタータンパク質であるDok-7が結合し,Crk-Crkリガンドを介し細胞内へとつぎつぎにシグナルが伝達され,最終的にRapsynに依存的なアセチルコリン受容体の集積という後シナプスの分化における主要な表現型のひとつが完成する4,5).近年,骨格筋は運動神経の支配をうける以前から,すなわち,Agrinに依存的なシグナルを受容する以前から,すでにアセチルコリン受容体を含む後シナプスタンパク質が集積し高度に分化していることが明らかになった6,7)(これを,muscle prepatterningとよぶ).このmuscle prepatterningはMuSKとLrp4に依存的に形成される1,2,8).したがって,Agrinはすでに形成された後シナプス組織をLrp4とMuSKを介しその調整や安定化を図るのである.このように,運動神経終末が骨格筋に到達したのち,どのようなタンパク質を介し,また,骨格筋においてどのようにシグナルが伝達されるかなどについては相対的に理解が進んでいる.
しかしながら,どのような分子機構が運動神経終末の分化(前シナプスの分化)を誘導しシナプスの形成を促進するのかという疑問は現在まで未解決のままであり,神経筋接合部の形成の分子機構を総合的に理解することにおいて大きなギャップとなっていた.しかしこれもまた,MuSKとLrp4に依存的であることが後述する理由から認識されていた.それは,MuSKノックアウトマウスおよびLrp4ノックアウトマウスにおいて,これらの遺伝子の発現は骨格筋に限定的であるにもかかわらず,運動神経終末はmuscle prepatterningの領域をはるかにこえて伸長し分化しないことである1,6,7)(最近,運動神経においてもLrp4が発現しシナプスの形成に寄与しているという論文が発表されたが,筆者らは,これについては否定的である).これは,骨格筋からのシグナルを運動神経が受容し,それが前シナプスの分化の引き金となっていることを示唆する強い証拠である.この論文では,in vitroおよびin vivoの両方のアプローチを用い,Lrp4こそが長いあいだ追求されてきた逆行性シグナルタンパク質であり,Lrp4が運動神経に結合することにより,後シナプスの分化を促進するシグナル経路とは独立に,運動神経終末への直接の分化誘導シグナルとなることを証明した.
1.Lrp4は運動神経において前シナプスの分化を誘導する
Lrp4はMuSKに結合しAgrinに非依存的にMuSKのリン酸化を促進する1,2).運動神経終末の前シナプス分化はMuSKとLrp4に依存的であるため,その分子機構については,骨格筋においてリン酸化MuSKを介したシグナル経路が新規の逆行性シグナルを産生する可能性と,Lrp4あるいはMuSK,または,その両者が直接的な逆行性シグナルとなる可能性の2つがおもに考えられた.後者の可能性を検討するため,マウスの運動神経と非骨格筋細胞である線維芽細胞とのin vitro共培養系を確立した.この共培養系において,線維芽細胞の代わりに骨格筋細胞を用いると運動神経の軸索は骨格筋細胞と接触し,その接触領域の骨格筋においてアセチルコリン受容体が集積し,それと並列して運動神経の側にはシナプス小胞のマーカータンパク質が集積した(シナプス小胞の集積は,その場に前シナプスの分化が起こっていることを示すマーカーとして用いられる).このことから,この共培養系は実用的であることが示唆された.この運動神経を通常の線維芽細胞と共培養すると,運動神経は線維芽細胞と接触していたものの前シナプスの分化は観察されなかった.一方,運動神経とLrp4を発現させた線維芽細胞との接触領域では,シナプス小胞が集積し前シナプスの分化が誘導されていた.また,この実験系を用いた検証から,約220~240 kDaのLrp4のなかでも,LDLaドメインというN末端に存在する約40~45 kDaの機能ドメインが運動神経の前シナプスの分化誘導において十分であることがわかった.これらのことから,Lrp4は運動神経の前シナプスの分化を誘導するに十分であることが示唆された.
2.Lrp4は運動神経に直接的に作用し機能的な前シナプスの分化を誘導する
Lrp4の運動神経に対する活性が直接的なのか間接的なのかを検討するため,同様の運動神経の培養系を用い,培養細胞の代わりとして,精製したLrp4でおおわれたマイクロビーズを用いた.陰性対照となるタンパク質でおおわれたマイクロビーズと運動神経軸索との接触面では前シナプスの分化誘導は起こらなかった.一方,Lrp4のLDLaドメインでおおわれたマイクロビーズと運動神経軸索との接触面にはシナプス小胞が集積し,さらに,活性帯(active zone)の構成タンパク質も同時に集積した.同じくLDL受容体ファミリーのメンバーであるLrp1のもつLDLaドメインを用いた同様の実験では前シナプスの分化は誘導されなかったことから,この誘導活性はLrp4に特異的であることも明らかになった.さらには,MuSKでおおわれたマイクロビーズやMuSKを発現した線維芽細胞との共培養の結果から,MuSKはin vivoにおいて前シナプスの分化に必要であるが十分ではないことも示唆された.そのうえ,ビーズに結合していないLrp4を培養した運動神経にくわえても,それがビーズに結合させた実験の場合の10倍以上の量であっても前シナプスの分化は誘導されなかったことから,Lrp4は重合体として前シナプスの分化を誘導することが支持された.また,Agrinを欠損した運動神経は,野生型と同様に,LDLaドメインでおおわれたマイクロビーズにより前シナプスの分化が誘導されたため,Lrp4による前シナプスの分化誘導はAgrinには依存しないことも示された.
さて,つぎの疑問は,Lrp4により誘導された前シナプス組織がはたして機能的なのかどうかということであった.この疑問へのアプローチとして,神経を刺激することによるシナプス小胞の放出ののちの再取り込みを可視化する実験を採用した.すると,運動神経への刺激に依存的に,シナプス小胞の放出と再取り込みを示すシグナルがLrp4により分化の誘導された前シナプスに観察された.したがって,Lrp4は刺激に応じてシナプス小胞を放出,再取り込みする機能的な前シナプス組織の分化を誘導することが証明された.
3.運動神経軸索にはLrp4結合タンパク質が発現している
ここまでの実験結果は,運動神経軸索がLrp4に応答して前シナプスの分化を開始していることを意味していた.すなわち,運動神経軸索にはLrp4に結合する受容体が存在する可能性を示していた.この仮説を検証するため,培養した運動神経にアルカリホスファターゼとLrp4の細胞外領域との融合タンパク質を添加し,アルカリホスファターゼの酵素反応を利用した色素染色を行った.その結果,陰性対照であるアルカリホスファターゼのみを添加した場合には運動神経軸索は染色されず,アルカリホスファターゼとLrp4の細胞外領域との融合タンパク質をくわえたときのみ運動神経軸索は強く染色された.興味深いことに,軸索が細胞体から遠位であればあるほどこの染色の強度は大きくなっており,もっとも遠位の領域では細胞体の付近に比べおよそ30倍も染色強度の大きいことが示された.この現象は,アルカリホスファターゼとLrp4のもつLDLaドメインとの融合タンパク質を用いた実験でも同様であった.すなわち,運動神経軸索の遠位部により多くのLrp4が結合していることを示していた.Lrp4が運動神経軸索の近位と遠位に結合する比率は添加するLrp4の量を変化させても同じであったことから,Lrp4が運動神経軸索の遠位においてより大きな親和性を示すというより,Lrp4結合タンパク質の量自体が運動神経軸索の遠位において多く存在していることが示唆された.また,Agrinを欠損した運動神経軸索も同様にLrp4と結合したため,運動神経軸索にはAgrinではない別のタンパク質がLrp4受容体として存在していることがわかった.
4.Lrp4はin vivoにおいて運動神経終末の分化を誘導する逆行性シグナルタンパク質である
これまでのin vitroの実験から示されたように,Lrp4が神経筋接合部の形成の際の運動神経終末の分化誘導に不可欠かどうかを,in vivoの実験においても検討することにした.しかしながら,これには少しくふうが必要であった.Lrp4ノックアウトマウスでは前シナプスの分化ばかりではなく後シナプスの分化も障害されるためである.Lrp4の前シナプスの分化誘導における特異的な機能を検証するためには,前シナプスと後シナプスそれぞれにおけるLrp4の役割を区別する必要があった.つまり,Lrp4に非依存的に後シナプスの分化を誘導している状態において,前シナプスの分化の状態をLrp4の存在下および非存在下で検討できる状況をつくりだすことが求められた.
近年,Agrinノックアウトマウスにおいて,Musk遺伝子の発現を3倍ほど過剰にすると,Agrinの欠損による後シナプス組織の重度の不安定化,そして,それにともなう呼吸筋の収縮障害による出生時の致死という表現型が回復することが発見された.過剰に発現したMuSKはAgrinシグナル経路を迂回し後シナプスの分化を保つことができるのである.Lrp4はAgrinの受容体であり,Agrinによる後シナプス組織の安定化シグナルはLrp4を介さなければならないが,過剰に発現したMuSKがAgrinの非存在下でも後シナプス組織を維持できることは,過剰に発現したMuSKはまた,Lrp4の非存在下でも後シナプスの分化を誘導できる可能性を強く示唆した.そこで,Lrp4を欠損し同時にMuSKを過剰に発現するマウスを作製して,Lrp4の前シナプスの分化に特異的な役割を検討することにした.
予想どおり,Lrp4を欠損した場合でも過剰に発現したMuSKによりAgrin-Lrp4シグナル経路は迂回され,後シナプス組織が形成され維持されていた.Agrinを欠損した場合,過剰に発現したMuSKにより誘導された後シナプス組織は運動神経の支配をうけてシナプスを形成してこれを維持し,これが出生時の致死の回復につながった.一方,驚くべきことに,Lrp4を欠損した場合,誘導された後シナプス組織は運動神経に支配されることはなく,運動神経終末の側からみると,前シナプスの分化の誘導することはなく神経筋接合部は形成されなかった.そして,やはりこのマウスは出生時に致死であった.この結果は,in vivoにおいてLrp4が骨格筋に由来する運動神経終末に対する,必須の逆行性シグナル本体であることをまさに示す強い証拠であった.
おわりに
現在までのところ,神経筋接合部の形成の分子機構については,その関連タンパク質の発見や,それらがどのようなシグナル経路を介して形成に寄与するのかなど,多くの場合,後シナプスを対象に研究が行われてきたため,そちらの分子機構の理解は相対的に進んでいる.しかしながら,前シナプスを対象とした研究は非常にチャレンジングな課題であり,神経筋接合部の形成の分子機構を総合的に理解するうえでの大きなギャップとなっていた.
今回の論文では,骨格筋に発現するLrp4がAgrinの受容体としてMuSKを介し後シナプスの分化を制御するばかりでなく,前シナプスの分化の初期段階に決定的な骨格筋に由来する逆行性シグナルタンパク質として機能することで,シナプスの形成を両方向性に厳密に制御していることが示された.このLrp4の前シナプスと後シナプスの両者における多様で決定的な機能は,Lrp4がシナプスの形成において3段階のクリティカルチェックポイントとして機能していることを示唆する(図2).すなわち,1)Lrp4は運動神経の到達にさきだちMuSKに結合してそのリン酸化を促しmuscle prepatterningを形成する,2)MuSKはいちど活性化されるとその正のフィードバック機構によりシグナルが増強し,より多くのタンパク質が集積するなかLrp4も重合体となり,到達した運動神経に対し逆行性シグナルタンパク質として運動神経終末の分化を誘導する,3)Lrp4により前シナプスの分化を誘導された運動神経終末からはAgrinが分泌されており,これをLrp4が受容してその場でより安定したシナプスを確立する.
これまで,in vitroの実験系により,FGF7,FGF10,FGF22,ラミニンB2,IV型コラーゲン,SIRPαなど,培養した運動神経に前シナプスの分化を促す骨格筋に由来するタンパク質がみつかっている.しかし,そのいずれのノックアウトマウスにおいても運動神経はいちど骨格筋とのあいだに神経筋接合部を形成するため,これらのタンパク質の前シナプスの分化における機能は,より後期の安定化や成熟の過程において重要であると考えられる9).したがって,前シナプスの分化の過程でより初期に機能する,別のタンパク質の存在が推定されていた.Lrp4の欠損により運動神経終末は骨格筋との神経筋接合部そのものを形成できなくなったため,Lrp4こそが,この前シナプスの分化の初期段階に機能するタンパク質であると考えられた.
このLrp4のもつ新たな機能の発見は,疾患との関連において新たな視点を生み出すかもしれない.筋萎縮性側索硬化症は患者のうち10~15%だけが家族性であり,大半は原因も理解されていない.しかし,どのような場合にも,初期の病理所見は運動神経末端の骨格筋からの離脱であり10),つまり,神経終末と骨格筋とのあいだの相互作用の脆弱性が原因になっていることも考えられる.そこから,Lrp4あるいは神経終末に存在するであろうLrp4受容体の遺伝子変異や機能不全が病因となっている可能性なども考えられる.
今後は,これまで未開の地であった,神経筋接合部の形成の際の運動神経終末における分子イベントがLrp4を起点として詳細に研究され,神経筋接合部の形成の分子機構の理解が前シナプス組織と後シナプス組織の両方の観点から進むことが期待される.
文 献
- Kim, N., Stiegler, A. L., Cameron, T. O. et al.: Lrp4 is a receptor for Agrin and forms a complex with MuSK. Cell, 135, 334-342 (2008)[PubMed]
- Zhang, B., Luo, S., Wang, Q. et al.: LRP4 serves as a coreceptor of agrin. Neuron, 60, 285-97 (2008)[PubMed]
- Zhang, W., Coldefy, A. S., Hubbard, S. R. et al.: Agrin binds to the N-terminal region of Lrp4 protein and stimulates association between Lrp4 and the first immunoglobulin-like domain in muscle-specific kinase (MuSK). J. Biol. Chem., 286, 40624-40630 (2011)[PubMed]
- Bergamin, E., Hallock, P. T., Burden, S. J. et al.: The cytoplasmic adaptor protein Dok7 activates the receptor tyrosine kinase MuSK via dimerization. Mol. Cell, 39, 100-109 (2010)[PubMed]
- Hallock, P. T., Xu, C. F., Park, T. J. et al.: Dok-7 regulates neuromuscular synapse formation by recruiting Crk and Crk-L. Genes Dev., 24, 2451-2461 (2010)[PubMed]
- Yang, X., Arber, S., William, C. et al.: Patterning of muscle acetylcholine receptor gene expression in the absence of motor innervation. Neuron, 30, 399-410 (2001)[PubMed]
- Lin, W., Burgess, R. W., Dominguez, B. et al.: Distinct roles of nerve and muscle in postsynaptic differentiation of the neuromuscular synapse. Nature, 410, 1057-1064 (2001)[PubMed]
- Weatherbee, S. D., Anderson, K. V. & Niswander, L. A.: LDL-receptor-related protein 4 is crucial for formation of the neuromuscular junction. Development, 133, 4993-5000 (2006)[PubMed]
- Fox, M. A., Sanes, J. R., Borza, D. B. et al.: Distinct target-derived signals organize formation, maturation, and maintenance of motor nerve terminals. Cell, 129, 179-193 (2007)[PubMed]
- Pun, S., Santos, A. F., Saxena, S. et al.: Selective vulnerability and pruning of phasic motoneuron axons in motoneuron disease alleviated by CNTF. Nat. Neurosci., 9, 408-419 (2006)[PubMed]
著者プロフィール
略歴:2008年 京都大学大学院医学研究科にて博士号取得,2009年より米国New York大学Medical Schoolポスドク研究員.
研究テーマ:前シナプスの分化からみた神経筋接合部の形成の分子機構.
関心事:今後は,Lrp4の受容体の同定とともに,これまで未開の地であった運動神経終末の分化における分子イベントを,単純な興味からだけでなく,ヒトへの還元がみえる位置から研究し理解を深めたい.
© 2012 湯本 法弘 Licensed under CC 表示 2.1 日本