枯草菌MifMの解析から明らかにされた翻訳の途上にあるポリペプチド鎖によるユニークな翻訳伸長の停止
千葉志信・伊藤維昭
(京都産業大学総合生命科学部 生命システム学科)
email:千葉志信,伊藤維昭
DOI: 10.7875/first.author.2012.109
Multisite ribosomal stalling: a unique mode of regulatory nascent chain action revealed for MifM.
Shinobu Chiba, Koreaki Ito
Molecular Cell, 47, 863-872 (2012)
枯草菌MifMの翻訳の途上にあるポリペプチド鎖にはタンパク質膜組込み装置の活性をモニターする役割がある.膜組込み活性が低下している場合には,MifMの合成されつつあるポリペプチド鎖はリボソームと相互作用することにより自らの翻訳伸長を停止する(翻訳アレスト).このとき,停止したリボソームがmRNAの二次構造を変化させることにより,タンパク質膜組込み装置の構成タンパク質のひとつであるYidC2の翻訳誘導を起こす.これまで,翻訳の途上にあるポリペプチド鎖に依存する翻訳アレストはいずれも特定のコドンにおいて1回だけ起こることが示されてきたが,今回,筆者らは,in vitro翻訳系を利用した解析により,MifMの翻訳アレストは複数の連続したコドンにおいて順番に起こっていることを見い出した.このマルチサイト翻訳アレストには,リボソームのトンネルの中ほどに位置したMifMのポリペプチド鎖に存在する必須のアミノ酸配列と,ペプチジル転移活性中心に近接した酸性アミノ酸残基クラスターの両方が重要であった.酸性アミノ酸残基クラスターの重要性はアミノ酸配列そのものではなく負電荷をもつことにあり,そのアミノ酸配列に対する非依存性がマルチサイト翻訳アレストを可能にしているものと考えられた.伸長を停止したポリペプチド鎖はピューロマイシンへのペプチジル転移反応を起こさなかったことから,翻訳の途上にあるMifMのポリペプチド鎖はペプチジル転移活性を阻害していることが示唆された.MifMはマルチサイト翻訳アレストにより複数回の翻訳アレストを足し合わせることで,全体として遺伝子発現の制御に十分なリボソームの停止時間を確保するというユニークな戦略をとっているものと考えられた.
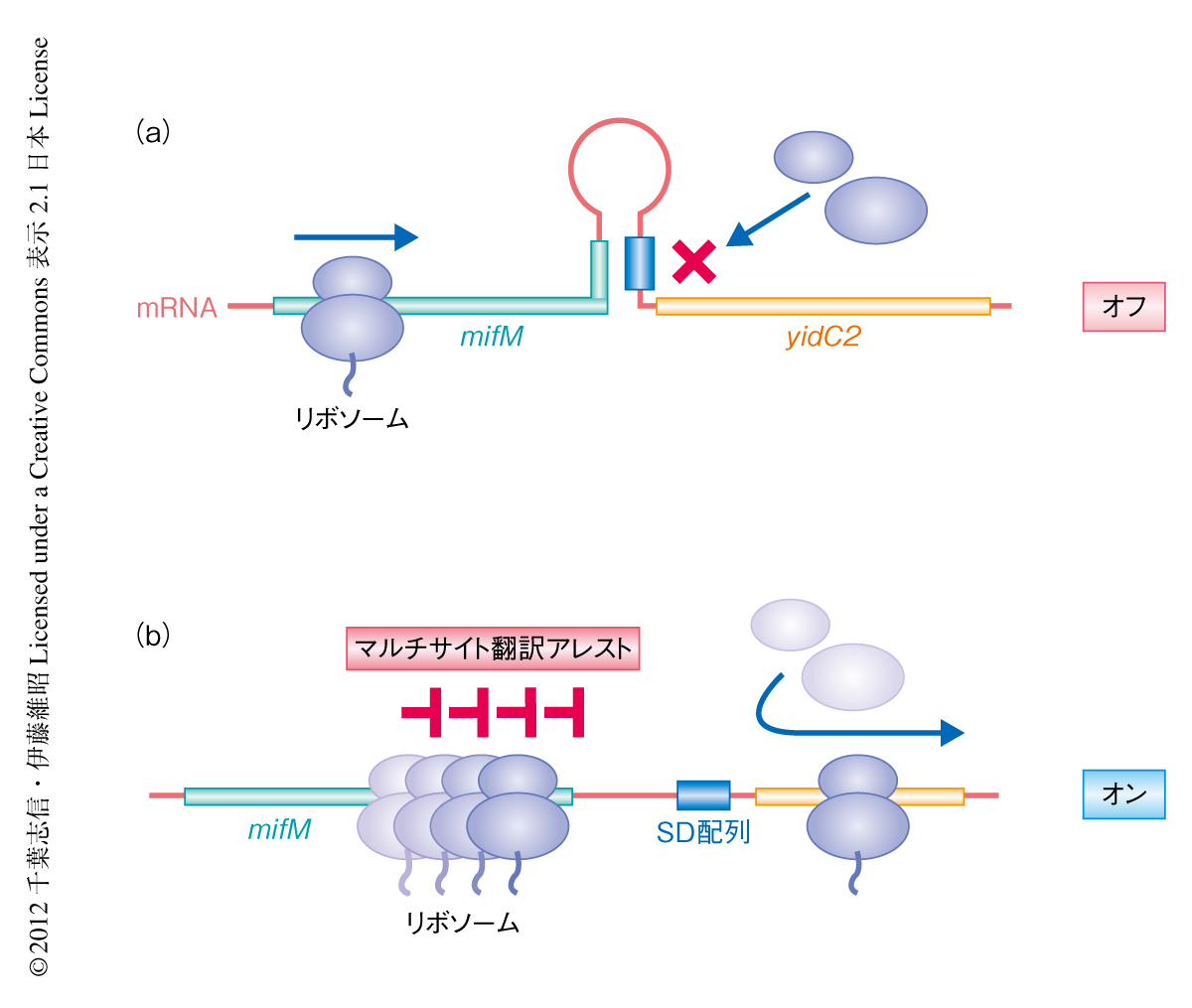
合成されつつあるポリペプチド鎖がリボソームのトンネルと相互作用することにより翻訳を一時停止(翻訳アレスト)させ,それを介し遺伝子発現のフィードバック制御を行う例が,最近になりいくつも報告されている1,2).たとえば,大腸菌SecMは分泌活性の低下を感知すると,分泌にはたらくモーターATPaseであるSecAの発現を誘導する3,4).枯草菌で見い出されたMifMは,膜タンパク質の細胞膜への組込みが正常に起こっているかどうかをモニターし,膜組込み装置の構成タンパク質のひとつであるYidC2の発現を制御する5).これらのタンパク質はいずれも,翻訳アレストを起こすアミノ酸配列(アレスト配列)が“シス”にはたらいてそれ自体の翻訳を停止させる能力をもつが,モニターすべき細胞の因子の活性が正常なら翻訳アレストは解除され,活性が低下したときには翻訳アレストは継続する.この細胞の状態に呼応してオンとオフが切り替わる翻訳アレストを利用することで,ターゲットとなる遺伝子の発現を制御している.
枯草菌はタンパク質の膜組込みチャネルとしてはたらくYidCファミリーに属する2つのホモログ,SpoIIIJとYidC2をもつ6,7).通常はSpoIIIJが多く発現しておりYidC2はほとんど発現していないが,SpoIIIJの活性が低下し細胞における膜組込み活性が低下すると,それを補うかたちでYidC2が合成される8).MifMは95アミノ酸残基からなる膜タンパク質で,YidC2と同一の1本のmRNAから翻訳される.N末端側に膜貫通領域,C末端側に翻訳アレストに必須のアミノ酸配列をもつ.MifMが3’末端の近傍において翻訳アレストを起こすと,停止したリボソームがmRNAの二次構造を変化させ,かくされていたyidC2遺伝子のSD配列を露出させることでその翻訳を促進する(図1).MifMの翻訳アレストはMifMがSpoIIIJにより膜に組み込まれると解除される.そのため,SpoIIIJのはたらきが十分なときにはMifMは翻訳アレストを起こさずYidC2の翻訳スイッチはオフになり,一方,SpoIIIJのはたらきが不十分なときにはMifMが翻訳アレストを起こしてYidC2の翻訳スイッチをオンにする5).
翻訳の途上にあるポリペプチド鎖のひき起こす翻訳アレストは,リボソームのトンネルの内部と翻訳の途上にあるポリペプチド鎖のもつアレスト配列との特異的な相互作用に依存する.翻訳途中のポリペプチド鎖はリボソームのトンネルのなかを一方向に動いていくので,アレスト配列がリボソームの活性中心部位やトンネル内の特定の相互作用部位と結合できる機会は,1本のポリペプチド鎖の合成過程において1回しかおとずれないものと考えられる.実際に,これまで解析されている翻訳アレストを起こすタンパク質は,いずれも翻訳アレストを特定のコドン1箇所においてのみ起こす2).ところが今回,筆者らは,MifMの翻訳アレストが翻訳の途上にあるポリペプチド鎖の連続する複数のコドンにおいて順番に起こることを見い出した.このMifMの“マルチサイト翻訳アレスト”は,複数回にわたる翻訳アレストの継続時間を足し合わせることにより,全体として遺伝子の発現制御に十分なだけの翻訳アレストの継続時間を確保するユニークな戦略であると考えられた(図1).
以前に筆者らは,大腸菌に由来する精製翻訳因子と枯草菌に由来する精製リボソームとを組み合わせたin vitro精製再構成翻訳系であるBs PURE systemを構築し,この系を用いてMifMの翻訳アレストをin vitroにおいて再現した9).今回,このBs PURE systemを用いて,翻訳アレストを起こしたMifM,リボソーム,mifM mRNAからなる複合体を調製し,プライマー伸長阻害アッセイ(primer extension inhibition assay)を行うことで,mRNAのどの位置でリボソームが停止しているかを解析した.具体的には,mifM mRNAの3’末端付近にアニーリングするDNAプライマーを用いて逆転写反応を行い,停止したリボソームにより逆転写反応の阻害された相補鎖DNAを電気泳動により解析した.その結果,4つの主要な逆転写反応産物が検出され,そのサイズから,mifM mRNAの89番目,90番目,91番目,92番目のコドンにP部位が位置した状態でリボソームが停止していることが示唆された(図2a).また,そのほか4箇所のコドンの前後においても弱い翻訳アレストが起こっている可能性を示唆するマイナーな逆転写反応産物も検出された.1箇所のコドンにおいて翻訳アレストを起こすことが知られているErmCL 10) や,人工のアレスト配列をもつポリペプチドWPPP 11) は,Bs PURE systemを用いた同様の実験により,いずれも過去の報告どおり単一の逆転写反応産物を産生したことから,MifMの解析において観察された複数の逆転写反応産物は,この反応系の性質によるアーティファクトではないことも確認された.
以上の結果から,MifMはほかの翻訳アレストを起こすタンパク質にみられる“シングルサイト翻訳アレスト”とは異なる,“マルチサイト翻訳アレスト”を起こしていることが明らかになった.また,フレームシフト変異などを用いた解析から,このマルチサイト翻訳アレストを起こす原因はmifM mRNAの側ではなく,翻訳の途上にあるMifMのポリペプチド鎖のアミノ酸配列に存在することが確かめられた.
翻訳アレストを起こした複合体を翻訳反応の初期から経時的にサンプリングしてプライマー伸長阻害アッセイを行ったところ,時間の経過にしたがって,停止したリボソームの集団が5’側のアレスト部位から3’側のアレスト部位へと移行していくようすが観察された.このことから,MifMの翻訳において,リボソームは複数の潜在的なアレスト部位のうちのどれか1箇所だけでランダムに停止するのではなく,あたかも“各駅停車”のように,5’側から3’側へと順次移動しつつ停止-再開-停止を複数回にわたりくり返していることが示唆された.
翻訳アレストを誘導するポリペプチド鎖は翻訳アレストを起こすために重要なアミノ酸配列(アレスト配列)をもち,それらがリボソームと特異的に相互作用することによりそのペプチジル転移活性を阻害するものと考えられる.多くの場合,アレスト配列はリボソームのトンネルの中ほどにある狭窄部位の付近に位置するmid-tunnel領域に存在するアミノ酸配列と,ペプチジル転移活性中心に近接した特定のアミノ酸配列から構成されている2).以前に,アラニンスキャニング変異解析によりMifMの翻訳アレストに必須のアミノ酸残基を同定したところ,それらはいずれもmid-tunnel領域にのみ見い出され(図2a),ペプチジル転移活性中心に近接した領域における1アミノ酸置換ではMifMの機能はほとんど損なわれることはなかった5).
しかしながら今回,ペプチジル転移活性中心に近接した酸性アミノ酸残基のクラスター(図2a)がMifMのホモログのあいだでよく保存されていることに着目し,この領域の詳細な変異解析を行った.酸性アミノ酸残基からなるAsp-Glu-Glu-Aspをすべて静電気的な性質の異なるアミノ酸残基(たとえば,Ala-Ala-Ala-Alaなど)に置換すると,MifMはyidC2遺伝子の発現誘導活性および翻訳アレストの活性をほぼ完全に失った.したがって,この領域もMifMの翻訳アレストに重要であることが明らかになった.アミノ酸配列が異なっていてもAsp-Asp-Asp-Asp,Glu-Glu-Glu-Glu,Glu-Asp-Asp-Gluのように酸性アミノ酸残基からなる場合は,いずれもMifMは活性を保持していた.さらに,酸性アミノ酸残基の数を4から1まで順に減らしていくと,それに相関してyidC2遺伝子の発現誘導活性は低下した.しかし,酸性アミノ酸残基を1つだけもつMifMにおいても,わずかながら有意の活性が残存していた.
以上のことから,MifMの翻訳アレストにはmid-tunnel領域に存在する重要なアミノ酸配列にくわえ,ペプチジル転移活性中心に近接した酸性アミノ酸クラスターが必須であること,また,この酸性アミノ酸残基クラスターにおいては,特定のアミノ酸配列ではなく負電荷をもつという静電気的な性質が重要であることが示唆された(図2b).
MifMのアレスト配列のさまざまな部位に1残基のアラニン残基を挿入し,yidC2遺伝子の発現誘導活性および翻訳アレストの活性を調べたところ,mid-tunnel領域にある翻訳アレストに必須のアミノ酸配列についてはアミノ酸残基のあいだの距離が1残基でも変わるとMifMの機能は大きく損なわれることがわかった.しかしながら,mid-tunnel領域と酸性残基クラスターとのあいだにアラニン残基を挿入した場合には大幅な活性の低下はひき起こされなかった.mid-tunnel領域においては必須のアミノ酸残基が厳密な距離を保って配置される必要があるものと考えられた.一方,mid-tunnel領域に存在するアミノ酸配列と酸性残基クラスターの位置関係にはある程度の柔軟性があり,この柔軟性がマルチサイト翻訳アレストの基盤のひとつとなっていることが示唆された.
MifMはシングルサイト翻訳アレストを起こすほかのタンパク質と同様に,mid-tunnel領域に存在するアミノ酸配列とペプチジル転移活性中心に近接した酸性残基クラスターの両方でリボソームと相互作用することにより翻訳アレストを起こす(図2b).しかし,ほかのタンパク質ではペプチジル転移活性中心に近接した領域が厳密なアミノ酸配列を要求し,P部位あるいはA部位に位置するアミノ酸残基といった,ペプチジル転移反応に直接かかわるアミノ酸残基が必須となる場合も多い.MifMではP部位あるいはA部位に位置するアミノ酸残基の種類を問わず翻訳アレストを起こし,そこに近接した酸性アミノ酸クラスターも特定のアミノ酸配列を必要としなかった.酸性アミノ酸残基が連続して並ぶことにより,数コドンにわたるペプチド伸長反応のあいだペプチジル転移活性中心を物理化学的に特殊な環境に維持しつづけることが可能となり,そのことが,連続的に翻訳速度を低下させている要因のひとつとなっているのかもしれない.これらMifMに特有の性質がアレスト部位の選択に柔軟性をあたえ,マルチサイト翻訳アレストを可能にしているものと考えられた.
MifMにおけるマルチサイト翻訳アレストの分子機構をより詳細に解明するため,アレスト部位の付近のコドン(90番目,91番目,92番目,94番目,94番目)のひとつを終止コドンに置き換えてプライマー伸長阻害アッセイを行った.その結果,A部位に終止コドンが位置したときにもリボソームは停止することがわかった.このことは,MifMのアレスト配列は翻訳伸長反応のみならず,翻訳終結反応をも阻害する潜在的な活性をもつことを示唆していた.さらに,野生型MifMの翻訳や,90番目のコドンを終止コドンに置換したMifMの翻訳により生じたペプチジル-tRNAは,ピューロマイシンへのペプチジル転移反応に抵抗性を示すことが見い出された.以上の結果,異なる長さをもつ翻訳の途上にあるポリペプチド鎖が,ペプチジル転移活性を阻害することにより,特徴的なマルチサイト翻訳アレストを起こしていることが示唆された.
翻訳におけるポリペプチド鎖の伸長速度は一定ではなく,さまざまな内的要因および外的要因により速度を変化させていることが明らかにされ,さらには,その現象を利用してタンパク質の構造形成や局在化,遺伝子発現などを巧妙に制御する分子機構がつぎつぎとみつかっている1,2).翻訳伸長速度に緩急をつける機構を理解することは,それを介する細胞の機能制御機構を理解するうえで重要であるが,今回,筆者らは,翻訳の途上にあるポリペプチド鎖による翻訳伸長速度の制御の新しい様式として,“マルチサイト翻訳アレスト”を見い出した.翻訳アレストの継続時間は細胞機能制御の効果を左右する重要な要素のひとつであるが,MifMは複数回の翻訳アレストをひき起こすことで全体として翻訳アレストの継続時間をかせぎ,それにより十分な量のYidCの翻訳を可能にしているものと考えられた(図1).今後,MifMがシングルサイト翻訳アレストではなくマルチサイト翻訳アレストを採用したことに理由があるのか,2つの翻訳アレストの様式を比べたとき翻訳アレストの性質やその解除に必要とされる条件にどのような違いがあるのか,などについて解析が進めば,翻訳伸長速度を制御する機構の異同点やその多様性の意味あいがより深く理解できるようになるものと期待される.
略歴:2002年 京都大学大学院理学研究科 修了,同年 京都大学ウイルス研究所 博士研究員,2004年 米国California大学San Diego校 博士研究員,2008年 京都大学ウイルス研究所 博士研究員,2009年 同 助教を経て,2010年より京都産業大学総合生命科学部 助教.
研究テーマ:翻訳の途上にあるMifMのポリペプチド鎖のはたらき.
抱負:機能をもたないとみなされ不遇の(?)扱いをうけてきた翻訳の途上にあるポリペプチド鎖の生理機能と分子機構について,より深く追求したい.
伊藤 維昭(Koreaki Ito)
京都産業大学総合生命科学部 教授.
研究室URL:http://www.cc.kyoto-su.ac.jp/~k4563/index-j.html
© 2012 千葉志信・伊藤維昭 Licensed under CC 表示 2.1 日本
(京都産業大学総合生命科学部 生命システム学科)
email:千葉志信,伊藤維昭
DOI: 10.7875/first.author.2012.109
Multisite ribosomal stalling: a unique mode of regulatory nascent chain action revealed for MifM.
Shinobu Chiba, Koreaki Ito
Molecular Cell, 47, 863-872 (2012)
要 約
枯草菌MifMの翻訳の途上にあるポリペプチド鎖にはタンパク質膜組込み装置の活性をモニターする役割がある.膜組込み活性が低下している場合には,MifMの合成されつつあるポリペプチド鎖はリボソームと相互作用することにより自らの翻訳伸長を停止する(翻訳アレスト).このとき,停止したリボソームがmRNAの二次構造を変化させることにより,タンパク質膜組込み装置の構成タンパク質のひとつであるYidC2の翻訳誘導を起こす.これまで,翻訳の途上にあるポリペプチド鎖に依存する翻訳アレストはいずれも特定のコドンにおいて1回だけ起こることが示されてきたが,今回,筆者らは,in vitro翻訳系を利用した解析により,MifMの翻訳アレストは複数の連続したコドンにおいて順番に起こっていることを見い出した.このマルチサイト翻訳アレストには,リボソームのトンネルの中ほどに位置したMifMのポリペプチド鎖に存在する必須のアミノ酸配列と,ペプチジル転移活性中心に近接した酸性アミノ酸残基クラスターの両方が重要であった.酸性アミノ酸残基クラスターの重要性はアミノ酸配列そのものではなく負電荷をもつことにあり,そのアミノ酸配列に対する非依存性がマルチサイト翻訳アレストを可能にしているものと考えられた.伸長を停止したポリペプチド鎖はピューロマイシンへのペプチジル転移反応を起こさなかったことから,翻訳の途上にあるMifMのポリペプチド鎖はペプチジル転移活性を阻害していることが示唆された.MifMはマルチサイト翻訳アレストにより複数回の翻訳アレストを足し合わせることで,全体として遺伝子発現の制御に十分なリボソームの停止時間を確保するというユニークな戦略をとっているものと考えられた.
はじめに
合成されつつあるポリペプチド鎖がリボソームのトンネルと相互作用することにより翻訳を一時停止(翻訳アレスト)させ,それを介し遺伝子発現のフィードバック制御を行う例が,最近になりいくつも報告されている1,2).たとえば,大腸菌SecMは分泌活性の低下を感知すると,分泌にはたらくモーターATPaseであるSecAの発現を誘導する3,4).枯草菌で見い出されたMifMは,膜タンパク質の細胞膜への組込みが正常に起こっているかどうかをモニターし,膜組込み装置の構成タンパク質のひとつであるYidC2の発現を制御する5).これらのタンパク質はいずれも,翻訳アレストを起こすアミノ酸配列(アレスト配列)が“シス”にはたらいてそれ自体の翻訳を停止させる能力をもつが,モニターすべき細胞の因子の活性が正常なら翻訳アレストは解除され,活性が低下したときには翻訳アレストは継続する.この細胞の状態に呼応してオンとオフが切り替わる翻訳アレストを利用することで,ターゲットとなる遺伝子の発現を制御している.
枯草菌はタンパク質の膜組込みチャネルとしてはたらくYidCファミリーに属する2つのホモログ,SpoIIIJとYidC2をもつ6,7).通常はSpoIIIJが多く発現しておりYidC2はほとんど発現していないが,SpoIIIJの活性が低下し細胞における膜組込み活性が低下すると,それを補うかたちでYidC2が合成される8).MifMは95アミノ酸残基からなる膜タンパク質で,YidC2と同一の1本のmRNAから翻訳される.N末端側に膜貫通領域,C末端側に翻訳アレストに必須のアミノ酸配列をもつ.MifMが3’末端の近傍において翻訳アレストを起こすと,停止したリボソームがmRNAの二次構造を変化させ,かくされていたyidC2遺伝子のSD配列を露出させることでその翻訳を促進する(図1).MifMの翻訳アレストはMifMがSpoIIIJにより膜に組み込まれると解除される.そのため,SpoIIIJのはたらきが十分なときにはMifMは翻訳アレストを起こさずYidC2の翻訳スイッチはオフになり,一方,SpoIIIJのはたらきが不十分なときにはMifMが翻訳アレストを起こしてYidC2の翻訳スイッチをオンにする5).
翻訳の途上にあるポリペプチド鎖のひき起こす翻訳アレストは,リボソームのトンネルの内部と翻訳の途上にあるポリペプチド鎖のもつアレスト配列との特異的な相互作用に依存する.翻訳途中のポリペプチド鎖はリボソームのトンネルのなかを一方向に動いていくので,アレスト配列がリボソームの活性中心部位やトンネル内の特定の相互作用部位と結合できる機会は,1本のポリペプチド鎖の合成過程において1回しかおとずれないものと考えられる.実際に,これまで解析されている翻訳アレストを起こすタンパク質は,いずれも翻訳アレストを特定のコドン1箇所においてのみ起こす2).ところが今回,筆者らは,MifMの翻訳アレストが翻訳の途上にあるポリペプチド鎖の連続する複数のコドンにおいて順番に起こることを見い出した.このMifMの“マルチサイト翻訳アレスト”は,複数回にわたる翻訳アレストの継続時間を足し合わせることにより,全体として遺伝子の発現制御に十分なだけの翻訳アレストの継続時間を確保するユニークな戦略であると考えられた(図1).
1.MifMは複数の連続したコドンにおいて翻訳アレストをひき起こす
以前に筆者らは,大腸菌に由来する精製翻訳因子と枯草菌に由来する精製リボソームとを組み合わせたin vitro精製再構成翻訳系であるBs PURE systemを構築し,この系を用いてMifMの翻訳アレストをin vitroにおいて再現した9).今回,このBs PURE systemを用いて,翻訳アレストを起こしたMifM,リボソーム,mifM mRNAからなる複合体を調製し,プライマー伸長阻害アッセイ(primer extension inhibition assay)を行うことで,mRNAのどの位置でリボソームが停止しているかを解析した.具体的には,mifM mRNAの3’末端付近にアニーリングするDNAプライマーを用いて逆転写反応を行い,停止したリボソームにより逆転写反応の阻害された相補鎖DNAを電気泳動により解析した.その結果,4つの主要な逆転写反応産物が検出され,そのサイズから,mifM mRNAの89番目,90番目,91番目,92番目のコドンにP部位が位置した状態でリボソームが停止していることが示唆された(図2a).また,そのほか4箇所のコドンの前後においても弱い翻訳アレストが起こっている可能性を示唆するマイナーな逆転写反応産物も検出された.1箇所のコドンにおいて翻訳アレストを起こすことが知られているErmCL 10) や,人工のアレスト配列をもつポリペプチドWPPP 11) は,Bs PURE systemを用いた同様の実験により,いずれも過去の報告どおり単一の逆転写反応産物を産生したことから,MifMの解析において観察された複数の逆転写反応産物は,この反応系の性質によるアーティファクトではないことも確認された.
以上の結果から,MifMはほかの翻訳アレストを起こすタンパク質にみられる“シングルサイト翻訳アレスト”とは異なる,“マルチサイト翻訳アレスト”を起こしていることが明らかになった.また,フレームシフト変異などを用いた解析から,このマルチサイト翻訳アレストを起こす原因はmifM mRNAの側ではなく,翻訳の途上にあるMifMのポリペプチド鎖のアミノ酸配列に存在することが確かめられた.
翻訳アレストを起こした複合体を翻訳反応の初期から経時的にサンプリングしてプライマー伸長阻害アッセイを行ったところ,時間の経過にしたがって,停止したリボソームの集団が5’側のアレスト部位から3’側のアレスト部位へと移行していくようすが観察された.このことから,MifMの翻訳において,リボソームは複数の潜在的なアレスト部位のうちのどれか1箇所だけでランダムに停止するのではなく,あたかも“各駅停車”のように,5’側から3’側へと順次移動しつつ停止-再開-停止を複数回にわたりくり返していることが示唆された.
2.MifMの翻訳アレストはmid-tunnel領域に存在するアミノ酸配列とペプチジル転移活性中心に近接した酸性アミノ酸クラスターに依存する
翻訳アレストを誘導するポリペプチド鎖は翻訳アレストを起こすために重要なアミノ酸配列(アレスト配列)をもち,それらがリボソームと特異的に相互作用することによりそのペプチジル転移活性を阻害するものと考えられる.多くの場合,アレスト配列はリボソームのトンネルの中ほどにある狭窄部位の付近に位置するmid-tunnel領域に存在するアミノ酸配列と,ペプチジル転移活性中心に近接した特定のアミノ酸配列から構成されている2).以前に,アラニンスキャニング変異解析によりMifMの翻訳アレストに必須のアミノ酸残基を同定したところ,それらはいずれもmid-tunnel領域にのみ見い出され(図2a),ペプチジル転移活性中心に近接した領域における1アミノ酸置換ではMifMの機能はほとんど損なわれることはなかった5).
しかしながら今回,ペプチジル転移活性中心に近接した酸性アミノ酸残基のクラスター(図2a)がMifMのホモログのあいだでよく保存されていることに着目し,この領域の詳細な変異解析を行った.酸性アミノ酸残基からなるAsp-Glu-Glu-Aspをすべて静電気的な性質の異なるアミノ酸残基(たとえば,Ala-Ala-Ala-Alaなど)に置換すると,MifMはyidC2遺伝子の発現誘導活性および翻訳アレストの活性をほぼ完全に失った.したがって,この領域もMifMの翻訳アレストに重要であることが明らかになった.アミノ酸配列が異なっていてもAsp-Asp-Asp-Asp,Glu-Glu-Glu-Glu,Glu-Asp-Asp-Gluのように酸性アミノ酸残基からなる場合は,いずれもMifMは活性を保持していた.さらに,酸性アミノ酸残基の数を4から1まで順に減らしていくと,それに相関してyidC2遺伝子の発現誘導活性は低下した.しかし,酸性アミノ酸残基を1つだけもつMifMにおいても,わずかながら有意の活性が残存していた.
以上のことから,MifMの翻訳アレストにはmid-tunnel領域に存在する重要なアミノ酸配列にくわえ,ペプチジル転移活性中心に近接した酸性アミノ酸クラスターが必須であること,また,この酸性アミノ酸残基クラスターにおいては,特定のアミノ酸配列ではなく負電荷をもつという静電気的な性質が重要であることが示唆された(図2b).
3.mid-tunnel領域に存在するアミノ酸配列と酸性アミノ酸クラスターとのあいだのアミノ酸残基数の柔軟性
MifMのアレスト配列のさまざまな部位に1残基のアラニン残基を挿入し,yidC2遺伝子の発現誘導活性および翻訳アレストの活性を調べたところ,mid-tunnel領域にある翻訳アレストに必須のアミノ酸配列についてはアミノ酸残基のあいだの距離が1残基でも変わるとMifMの機能は大きく損なわれることがわかった.しかしながら,mid-tunnel領域と酸性残基クラスターとのあいだにアラニン残基を挿入した場合には大幅な活性の低下はひき起こされなかった.mid-tunnel領域においては必須のアミノ酸残基が厳密な距離を保って配置される必要があるものと考えられた.一方,mid-tunnel領域に存在するアミノ酸配列と酸性残基クラスターの位置関係にはある程度の柔軟性があり,この柔軟性がマルチサイト翻訳アレストの基盤のひとつとなっていることが示唆された.
MifMはシングルサイト翻訳アレストを起こすほかのタンパク質と同様に,mid-tunnel領域に存在するアミノ酸配列とペプチジル転移活性中心に近接した酸性残基クラスターの両方でリボソームと相互作用することにより翻訳アレストを起こす(図2b).しかし,ほかのタンパク質ではペプチジル転移活性中心に近接した領域が厳密なアミノ酸配列を要求し,P部位あるいはA部位に位置するアミノ酸残基といった,ペプチジル転移反応に直接かかわるアミノ酸残基が必須となる場合も多い.MifMではP部位あるいはA部位に位置するアミノ酸残基の種類を問わず翻訳アレストを起こし,そこに近接した酸性アミノ酸クラスターも特定のアミノ酸配列を必要としなかった.酸性アミノ酸残基が連続して並ぶことにより,数コドンにわたるペプチド伸長反応のあいだペプチジル転移活性中心を物理化学的に特殊な環境に維持しつづけることが可能となり,そのことが,連続的に翻訳速度を低下させている要因のひとつとなっているのかもしれない.これらMifMに特有の性質がアレスト部位の選択に柔軟性をあたえ,マルチサイト翻訳アレストを可能にしているものと考えられた.
4.翻訳の途上にあるMifMのポリペプチド鎖はペプチジル転移活性を阻害する
MifMにおけるマルチサイト翻訳アレストの分子機構をより詳細に解明するため,アレスト部位の付近のコドン(90番目,91番目,92番目,94番目,94番目)のひとつを終止コドンに置き換えてプライマー伸長阻害アッセイを行った.その結果,A部位に終止コドンが位置したときにもリボソームは停止することがわかった.このことは,MifMのアレスト配列は翻訳伸長反応のみならず,翻訳終結反応をも阻害する潜在的な活性をもつことを示唆していた.さらに,野生型MifMの翻訳や,90番目のコドンを終止コドンに置換したMifMの翻訳により生じたペプチジル-tRNAは,ピューロマイシンへのペプチジル転移反応に抵抗性を示すことが見い出された.以上の結果,異なる長さをもつ翻訳の途上にあるポリペプチド鎖が,ペプチジル転移活性を阻害することにより,特徴的なマルチサイト翻訳アレストを起こしていることが示唆された.
おわりに
翻訳におけるポリペプチド鎖の伸長速度は一定ではなく,さまざまな内的要因および外的要因により速度を変化させていることが明らかにされ,さらには,その現象を利用してタンパク質の構造形成や局在化,遺伝子発現などを巧妙に制御する分子機構がつぎつぎとみつかっている1,2).翻訳伸長速度に緩急をつける機構を理解することは,それを介する細胞の機能制御機構を理解するうえで重要であるが,今回,筆者らは,翻訳の途上にあるポリペプチド鎖による翻訳伸長速度の制御の新しい様式として,“マルチサイト翻訳アレスト”を見い出した.翻訳アレストの継続時間は細胞機能制御の効果を左右する重要な要素のひとつであるが,MifMは複数回の翻訳アレストをひき起こすことで全体として翻訳アレストの継続時間をかせぎ,それにより十分な量のYidCの翻訳を可能にしているものと考えられた(図1).今後,MifMがシングルサイト翻訳アレストではなくマルチサイト翻訳アレストを採用したことに理由があるのか,2つの翻訳アレストの様式を比べたとき翻訳アレストの性質やその解除に必要とされる条件にどのような違いがあるのか,などについて解析が進めば,翻訳伸長速度を制御する機構の異同点やその多様性の意味あいがより深く理解できるようになるものと期待される.
文 献
- Tenson, T. & Ehrenberg, M.: Regulatory nascent peptides in the ribosomal tunnel. Cell, 108, 591-594 (2002)[PubMed]
- Ito, K., Chiba, S. & Pogliano, K.: Divergent stalling sequences sense and control cellular physiology. Biochem. Biophys. Res. Commun., 393, 1-5 (2010)[PubMed]
- Nakatogawa, H. & Ito, K.: The ribosomal exit tunnel functions as a discriminating gate. Cell, 108, 629-636 (2002)[PubMed]
- Nakatogawa, H. & Ito, K.: Secretion monitor, SecM, undergoes self-translation arrest in the cytosol. Mol. Cell, 7, 185-192 (2001)[PubMed]
- Chiba, S., Lamsa, A. & Pogliano, K.: A ribosome-nascent chain sensor of membrane protein biogenesis in Bacillus subtilis. EMBO J., 28, 3461-3475 (2009)[PubMed]
- Tjalsma, H., Bron, S. & van Dijl, J. M.: Complementary impact of paralogous Oxa1-like proteins of Bacillus subtilis on post-translocational stages in protein secretion. J. Biol. Chem., 278, 15622-15632 (2003)[PubMed]
- Murakami, T., Haga, K., Takeuchi, M. et al.: Analysis of the Bacillus subtilis spoIIIJ gene and its paralogue gene, yqjG. J. Bacteriol., 184, 1998-2004 (2002)[PubMed]
- Rubio, A., Jiang, X. & Pogliano, K.: Localization of translocation complex components in Bacillus subtilis: enrichment of the signal recognition particle receptor at early sporulation septa. J. Bacteriol., 187, 5000-5002 (2005)[PubMed]
- Chiba, S., Kanamori, T., Ueda, T. et al.: Recruitment of a species-specific translational arrest module to monitor different cellular processes. Proc. Natl. Acad. Sci. USA, 108, 6073-6078 (2011)[PubMed]
- Vazquez-Laslop, N., Thum, C. & Mankin, A. S.: Molecular mechanism of drug-dependent ribosome stalling. Mol. Cell, 30, 190-202 (2008)[PubMed]
- Tanner, D. R., Cariello, D. A., Woolstenhulme, C. J. et al.: Genetic identification of nascent peptides that induce ribosome stalling. J. Biol. Chem., 284, 34809-34818 (2009)[PubMed]
著者プロフィール
略歴:2002年 京都大学大学院理学研究科 修了,同年 京都大学ウイルス研究所 博士研究員,2004年 米国California大学San Diego校 博士研究員,2008年 京都大学ウイルス研究所 博士研究員,2009年 同 助教を経て,2010年より京都産業大学総合生命科学部 助教.
研究テーマ:翻訳の途上にあるMifMのポリペプチド鎖のはたらき.
抱負:機能をもたないとみなされ不遇の(?)扱いをうけてきた翻訳の途上にあるポリペプチド鎖の生理機能と分子機構について,より深く追求したい.
伊藤 維昭(Koreaki Ito)
京都産業大学総合生命科学部 教授.
研究室URL:http://www.cc.kyoto-su.ac.jp/~k4563/index-j.html
© 2012 千葉志信・伊藤維昭 Licensed under CC 表示 2.1 日本