腫瘍に浸潤した樹状細胞はTIM-3とHMGB1との相互作用を介し核酸に依存性の自然免疫を抑制する
千葉殖幹1・八木田秀雄2・地主将久1
(1北海道大学遺伝子病制御研究所 附属感染癌研究センター,2順天堂大学大学院医学研究科 免疫学講座)
email:地主将久
DOI: 10.7875/first.author.2012.108
Tumor-infiltrating DCs suppress nucleic acid-mediated innate immune responses through interactions between the receptor TIM-3 and the alarmin HMGB1.
Shigeki Chiba, Muhammad Baghdadi, Hisaya Akiba, Hironori Yoshiyama, Ichiro Kinoshita, Hirotoshi Dosaka-Akita, Yoichiro Fujioka, Yusuke Ohba, Jacob V. Gorman, John D. Colgan, Mitsuomi Hirashima, Toshimitsu Uede, Akinori Takaoka, Hideo Yagita, Masahisa Jinushi
Nature Immunology, 13, 832-842 (2012)
発がんの進展および治療に対する応答において腫瘍微小環境は重要なはたらきをもつ.樹状細胞は強力な抗腫瘍免疫アジュバントとして自然免疫と獲得免疫の両方にはたらくが,樹状細胞のもつ自然免疫の制御機構に対し腫瘍微小環境のはたす役割については不明であった.筆者らは,腫瘍に浸潤する樹状細胞において高く発現誘導されるTIM-3が,外来性の核酸リガンドや抗がん剤の処理により放出される自己に由来する核酸リガンドに対する自然免疫を顕著に抑制する重要なタンパク質であることを見い出した.さらにその作用機序として,TIM-3は細胞外に存在するHMGB1との相互作用を介して核酸リガンドの細胞質エンドソームへの移行を阻害することにより,Toll様受容体やRIG-I様受容体を介する核酸リガンドに対する応答を抑制していることを明らかにした.この研究は,腫瘍微小環境による樹状細胞のもつ自然免疫の抑制機構をはじめて明らかにしたとともに,抗がん剤あるいは抗腫瘍免疫アジュバントによる治療において効果の改善につながる重要なものであった.
国内におけるがんの罹患者数は年間60万人であり,死亡者数は30万人強にものぼる.外科手術により除去の可能な初期の固形がんを除き,進行期にある多くの患者においては化学療法や放射線療法がおもな治療手段であるが,十分な治療効果の得られていないのが実情である.その要因として,腫瘍細胞それ自体の遺伝子変異にくわえ,腫瘍組織において免疫細胞および血管や繊維芽細胞などが腫瘍微小環境を構築し,腫瘍細胞との相互作用を介して腫瘍の進展や薬剤耐性の誘導に大きな役割を担っている可能性が指摘されている.事実,間質細胞や血管内皮細胞より産生されるHGF,WNT16B,VEGFなどの増殖因子やサイトカインが,その近傍に存在する腫瘍細胞に作用することで薬剤耐性をひき起こすことが報告されている1,2).さらに近年,自然免疫におけるシグナル伝達は抗がん剤に対する感受性を決定する重要なファクターであると提唱されている3).
樹状細胞は腫瘍に特異的な免疫応答を誘導するうえで重要な役割をはたすことが知られており,その機能制御を基盤とした免疫療法の開発が注目されている4).一方で,ウイルスや細菌の感染にともなう自然免疫による初期の免疫応答の誘導において,樹状細胞はきわめて重要な役割をはたしていることが判明している5).しかしながら,腫瘍微小環境が樹状細胞のもつ自然免疫におけるシグナル伝達やリガンド認識の機構に及ぼす影響は不明である.
今回,筆者らが注目したTIM-3(T cell immunoglobulin and mucin domain 3)というタンパク質は,従来から,慢性ウイルス感染やがんなどにおいてI型ヘルパーT細胞に発現し,ガレクチン9と結合することでT細胞性の免疫不全を誘導することが報告されていた6,7).一方で,樹状細胞やマクロファージにおいてもTIM-3の発現が報告されていたが,これらの細胞においてTIM-3が自然免疫におけるシグナル伝達にあたえる影響については未知であった.そこで,腫瘍微小環境が樹状細胞におけるTIM-3の発現誘導や,自然免疫を介した腫瘍の監視機構にあたえる影響を解析した.
腫瘍微小環境におけるTIM-3の発現を検討するため,肺がんモデルや大腸がんモデルなどマウス固形がんモデルを対象として,腫瘍組織に浸潤している樹状細胞やマクロファージを分離し,ほかの組織に由来する細胞と発現パターンを比較した.その結果,腫瘍を生じていないリンパ節や脾臓に由来する細胞,および,健常モデルに由来する細胞と比較して,腫瘍に浸潤している細胞ではTIM-3の発現がきわめて高いことが判明した.
腫瘍に浸潤した樹状細胞におけるTIM-3の発現の経時的な変化を検証したところ,TIM-3の発現誘導は腫瘍の発生ののち1週間の早期から認められ,腫瘍の発生ののち4週間でのTIM-3陽性率は90%に達した.さらに,ヒトがんにおけるTIM-3の発現を検証するため,非小細胞がん患者より得られた腫瘍に存在する樹状細胞におけるTIM-3の発現を調べたところ,同じがん患者や健常者の末梢血に存在する樹状細胞に比べ,有意に発現の高いことが明らかになった.
がん細胞によるTIM-3の発現誘導を検証したところ,腫瘍細胞株の培養上清に樹状細胞におけるTIM-3の誘導活性が認められた.さらに,TIM-3の発現誘導にかかわる液性タンパク質として,血管内皮増殖因子VEGF-Aやインターロイキン10およびアルギナーゼIなどが主要な役割をはたしていた.
以上より,腫瘍微小環境において産生されるサイトカインや増殖因子などさまざまなタンパク質が,樹状細胞においてTIM-3の発現誘導にはたらいている可能性が示唆された.
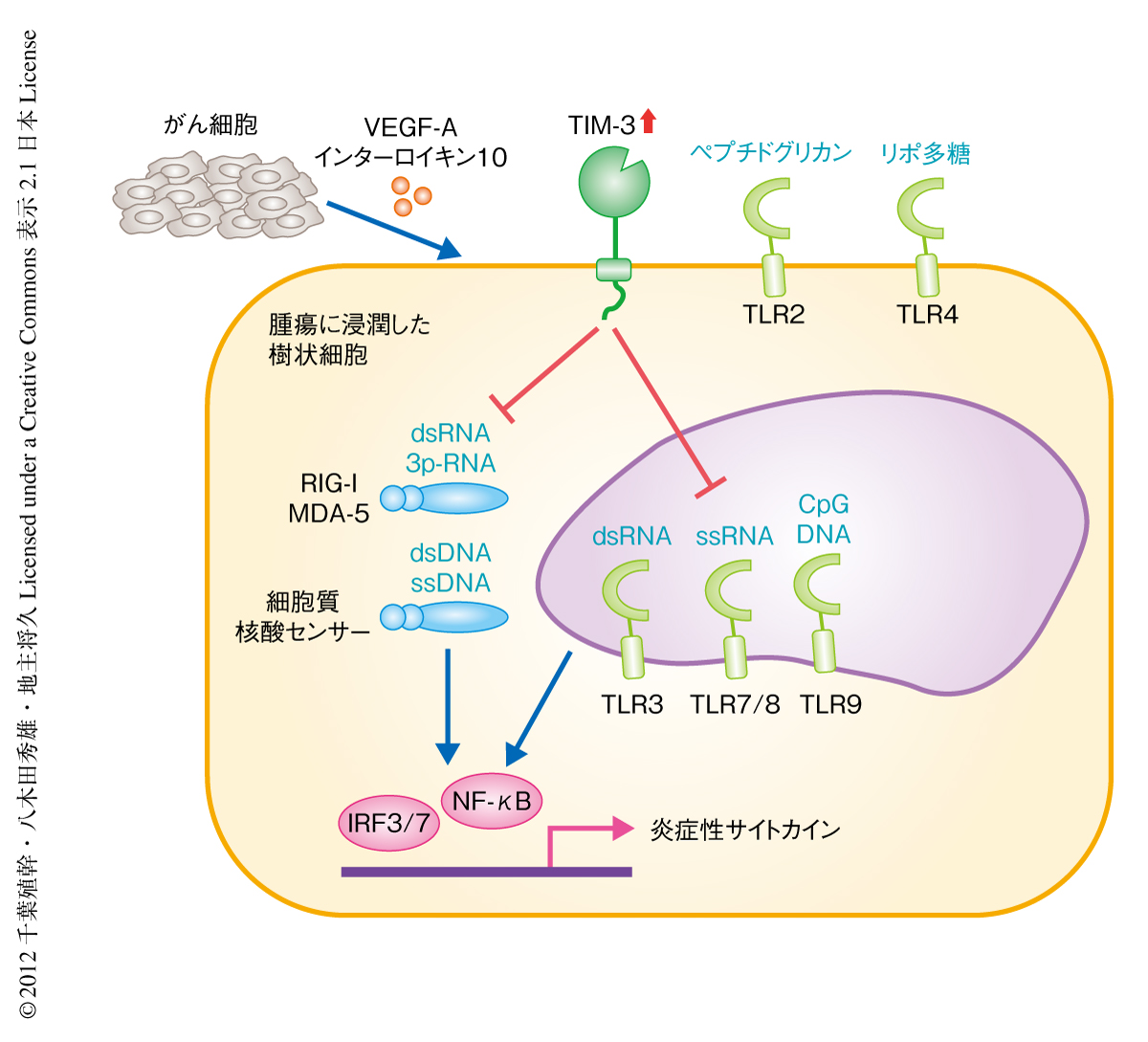
TIM-3が樹状細胞の機能にあたえるインパクトを明らかにするため,TIM-3陽性およびTIM-3陰性の骨髄細胞に由来する樹状細胞,および,TIM-3を欠損した樹状細胞を対象として各種のアッセイを行った.抗原提示能および抗原に特異的な免疫応答における樹状細胞の機能に対しTIM-3の関与は軽微であった.自然免疫に対する活性化能を検証したところ,TIM-3陽性の樹状細胞においては,Toll様受容体(Toll-like receptor:TLR)のうちTLR3,TLR8,TLR9により認識,また,RIG-I様受容体(RIG-I-like receptor:RLR)などの細胞質核酸センサーにより認識される,核酸リガンドの刺激による炎症性サイトカイン(インターロイキン6,インターロイキン12,インターフェロンα,インターフェロンβ)の産生能が,TIM-3を欠損した樹状細胞と比較して顕著に抑制されることが判明した(図1).一方で,TLR2やTLR4を介するリポ多糖など非核酸系の刺激による炎症性サイトカインの発現は,TIM-3陽性の樹状細胞とTIM-3を欠損した樹状細胞とのあいだで差を認めなかった.さらに,TIM-3陽性の樹状細胞を抗TIM-3抗体により処理,あるいは,TIM-3をRNAi法によりノックダウンすることにより,核酸リガンド刺激による炎症性サイトカインの発現は回復することも明らかになった.さらに,マウスやヒトにおける腫瘍に浸潤した樹状細胞を対象とした検証においても,TIM-3が核酸リガンドによる自然免疫を有意に抑制することが明らかになった.以上より,樹状細胞に発現するTIM-3は,核酸リガンド刺激による自然免疫に対する抑制能をもつことが明らかになった.
核酸リガンドに対するTIM-3の自然免疫の制御の分子機構の検証を目的として,自然免疫におけるシグナル伝達タンパク質や関連するタンパク質のスクリーニングを行った.その結果,TIM-3と相互作用する候補タンパク質としてHMGB1(high mobility group box-1)を同定した.HMGB1はp53やNF-κBなどの転写因子の機能の発現に重要なDNA結合タンパク質であると同時に,活性化した樹状細胞やマクロファージ,あるいは,ネクローシスを起こした細胞から細胞外へと放出され,内在性の自然免疫を誘導するリガンドdamage-associated molecular pattern:DAMP,損傷関連分子パターン)として核酸リガンドよりひき起こされる自然免疫に重要な役割をはたすことが報告されている8).また,HMGB1は健常な組織と比較して腫瘍において高く産生されており,腫瘍微小環境における自然免疫に多大な影響を及ぼす可能性が考えられた.
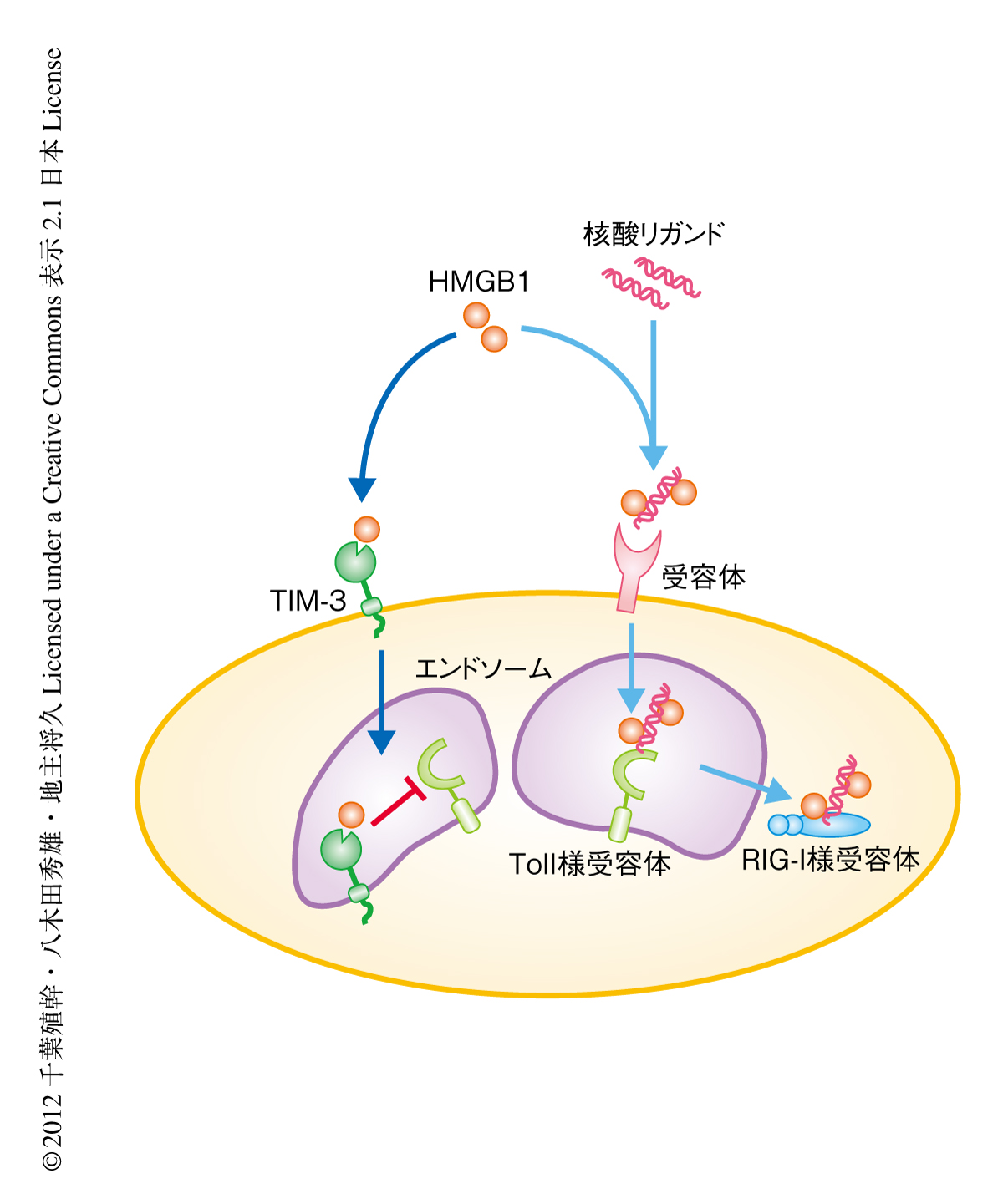
そこで,TIM-3とHMGB1との相互作用が自然免疫にあたえる影響を詳細に検証した.CpG DNAやB-DNAは自然免疫における核酸リガンドのひとつであり,細胞に移行してエンドソーム膜に存在するToll様受容体であるTLR9や,細胞質核酸センサーであるRIG-I様受容体により認識されることで,自然免疫におけるシグナル伝達にはたらいていることが報告されている.ここでは,HMGB1が核酸リガンドと複合体を形成することにより,Toll様受容体のみならず,細胞質核酸センサーに認識される核酸リガンドの細胞質エンドソームへの移行を促進すること,このプロセスが自然免疫におけるシグナル伝達に重要な役割をはたすことが見い出された.それに対し,樹状細胞に存在するTIM-3はHMGB1と結合することにより,HMGB1と核酸リガンドとの結合を競合阻害することが明らかになった.この競合阻害によりTIM-3はHMGB1を介した核酸リガンドのエンドソームへの移行の阻害にはたらくことが判明した.
以上より,TIM-3はHMGB1を介した核酸リガンドのエンドソームへの移行を阻害することにより,自然免疫の抑制にはたらくという新規の分子機構を解明した(図2).
樹状細胞において核酸リガンドは,I型インターフェロンやインターロイキン12をはじめとしたサイトカインの産生を介してキラーT細胞やナチュラルキラー細胞などのエフェクター細胞を活性化することにより,抗腫瘍能を発揮することが報告されてきた9,10).しかしながら,臨床的にはDNAワクチンの抗腫瘍効果は低率であるのが実情である.TIM-3は核酸リガンドを介した自然免疫の抑制タンパク質として機能することより,TIM-3の治療的な阻害がDNAワクチンによる抗腫瘍効果を高めることが期待される.
これらの仮説を検証するため,メラノーマや大腸がん細胞の皮下摂取モデルを対象として,DNAプラスミドやCpG-ODNなどの核酸製剤と抗TIM-3抗体とによる抗腫瘍効果を検証した.その結果,核酸製剤と抗TIM-3抗体とを併用したときには,核酸製剤を単独で用いたときに比べすぐれた抗腫瘍効果を示すことが明らかになった.さらに,獲得免疫能を欠失した免疫不全マウスや,抗体によりT細胞を除去したマウスにおいても,TIM-3の阻害による相乗的な抗腫瘍効果が認められたため,TIM-3の阻害による抗腫瘍効果はTIM-3を発現したT細胞によるものではないこと,さらに,自然免疫によるものであることが示唆された.
樹状細胞において特異的に発現するTIM-3の役割を検証するため,TIM-3ノックアウトマウスおよび野生型CD11c-DTRマウスに由来する骨髄細胞を,致死性の放射線で処置した野生型マウスに1:1で混合移植したキメラマウスを用いた.この混合骨髄キメラマウスは,生体においてジフテリアトキシンの投与により野生型(つまり,TIM-3陽性の)CD11c陽性樹状細胞を選択的に除去することにより,樹状細胞において特異的なTIM-3の欠損を作出することが可能である.このキメラマウスにより樹状細胞に発現したTIM-3が核酸製剤による抗腫瘍効果にはたす役割を検証した.TIM-3陽性の樹状細胞の存在するときには核酸製剤の単独による抗腫瘍効果は不十分であり,抗TIM-3抗体の併用によりすぐれた抗腫瘍効果を認めた.それに対して,ジフテリアトキシンを投与してTIM-3陽性の樹状細胞を除去したときには,核酸製剤の単独による十分な抗腫瘍効果が発揮され,抗TIM-3抗体の併用に効果は認められなかった.
以上より,樹状細胞に存在するTIM-3は,DNAワクチンなど核酸製剤による抗腫瘍効果を負に制御するうえで重要な役割をはたすことが明らかになった.
近年の研究により,一部の抗がん剤は免疫原性の高い細胞死を誘導することにより,自然免疫におけるシグナル伝達や抗腫瘍能を誘導することが報告されている3).また,腫瘍へのワクチン投与により腫瘍微小環境から放出される核酸リガンドが,Toll様受容体などを介した自然免疫を誘導することにより抗腫瘍能の増強にはたらくことが報告されている11).以上より,抗がん剤の投与により細胞死を誘導されたがん細胞の放出する核酸が,自然免疫を誘導する核酸リガンドとして機能すること,その免疫応答を樹状細胞に存在するTIM-3が抑制することで,本来,発揮されるべき抗腫瘍能が抑制されているという仮説が成り立つ.これらの可能性を検証するため,抗がん剤シスプラチンにより処理した大腸がん細胞を,抗TIM-3抗体とともにTIM-3陽性の樹状細胞に投与したところ,I型インターフェロンやインターロイキン12の産生増強を認めた.この反応はDNase処理あるいはRnase処理により有意に抑制されたため,抗がん剤の刺激により放出された核酸リガンドにより誘導される自然免疫の抑制にTIM-3がはたらくことが明らかになった.さらに,さきに述べた混合骨髄キメラマウスを用いて,大腸がん細胞の皮下摂取モデルにおいてシスプラチンと抗TIM-3抗体による治療効果を検証したところ,樹状細胞に発現するTIM-3がシスプラチンによる抗腫瘍能を負に制御していることが明らかになった.
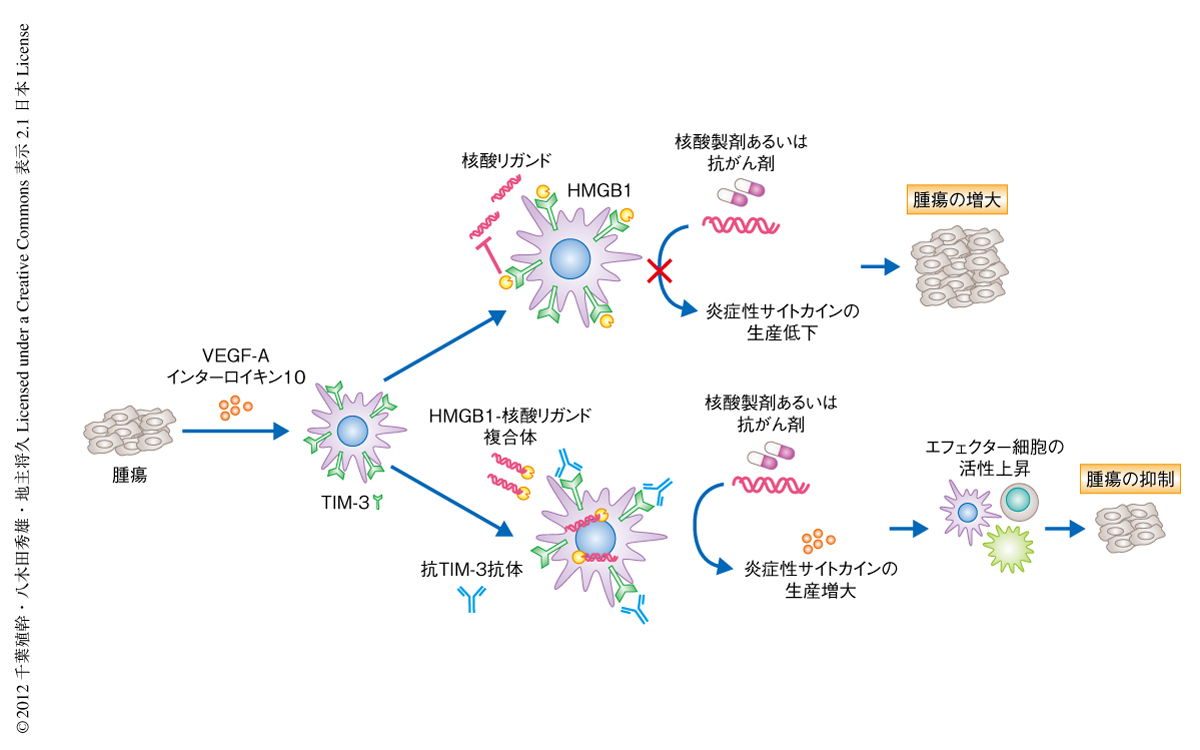
以上より,樹状細胞に発現したTIM-3は,腫瘍において放出される核酸リガンドを介した自然免疫を負に制御していること,さらに,TIM-3とHMGB1との相互作用を標的とした抗TIM-3抗体の投与により,DNAワクチンや抗がん剤による抗腫瘍効果の改善が図れる可能性が示された(図3).
この論文では,腫瘍微小環境による免疫逃避機構の新たなストラテジーとして,樹状細胞に発現したTIM-3による自然免疫の抑制機構の存在を明らかにした.腫瘍微小環境は炎症細胞や腫瘍細胞を介した炎症を特徴としている場合が多く,NF-κBやSTAT3を介した炎症シグナル伝達は腫瘍の進展や転移に重要な意義をもつ.ただし,炎症シグナル伝達はHMGB1をはじめとした内在性の自然免疫を誘導するリガンド(DAMP)の産生を促進することや,腫瘍微小環境における細胞死を介した核酸リガンドの産生により自然免疫の亢進にはたらく可能性が高いと考えられる.その意味で,腫瘍微小環境による樹状細胞へのTIM-3の発現誘導は,炎症シグナル伝達によりひき起こされる自然免疫を負に制御することにより,腫瘍細胞の発がん活性を維持しつつ,免疫逃避機構の獲得にはたらくという点で,すぐれたストラテジーを構築していると考えることができる.
今後の研究の方向性として,TIM-3を介した核酸リガンドの細胞質エンドソームへの移行の阻害にはたらくタンパク質の同定や,それにより制御されるシグナル伝達経路の検証,マクロファージをはじめとしたほかの細胞における自然免疫の制御機構にかかわる分子の同定などがあげられる.以上の研究をとおして腫瘍微小環境による自然免疫の制御機構の網羅的および体系的な理解を深めることにより,腫瘍細胞と免疫細胞とのクロストークの解明に寄与できるものと思われる.
最近,TIM-3は白血病幹細胞に特異的に発現していることが報告され,さらに,治療の標的としても有効であると報告されている12).このことからも,腫瘍微小環境により特異的に発現誘導されるTIM-3陽性細胞を標的とした新たな治療戦略は,免疫療法あるいは抗がん剤の治療効果の改善や,特異的な分子マーカーの開発を視野に入れた臨床応用をめざすうえで重要な意義をもつものと考えられる.
略歴:愛媛大学大学院農学研究科 修了,愛知がんセンター研究所 リサーチレジデントを経て,2010年より北海道大学遺伝子病研究所 博士研究員.
八木田 秀雄(Hideo Yagita)
順天堂大学医学研究科 先任准教授.
地主 将久(Masahisa Jinushi)
北海道大学遺伝子病研究所 准教授.
© 2012 千葉殖幹・八木田秀雄・地主将久 Licensed under CC 表示 2.1 日本
(1北海道大学遺伝子病制御研究所 附属感染癌研究センター,2順天堂大学大学院医学研究科 免疫学講座)
email:地主将久
DOI: 10.7875/first.author.2012.108
Tumor-infiltrating DCs suppress nucleic acid-mediated innate immune responses through interactions between the receptor TIM-3 and the alarmin HMGB1.
Shigeki Chiba, Muhammad Baghdadi, Hisaya Akiba, Hironori Yoshiyama, Ichiro Kinoshita, Hirotoshi Dosaka-Akita, Yoichiro Fujioka, Yusuke Ohba, Jacob V. Gorman, John D. Colgan, Mitsuomi Hirashima, Toshimitsu Uede, Akinori Takaoka, Hideo Yagita, Masahisa Jinushi
Nature Immunology, 13, 832-842 (2012)
要 約
発がんの進展および治療に対する応答において腫瘍微小環境は重要なはたらきをもつ.樹状細胞は強力な抗腫瘍免疫アジュバントとして自然免疫と獲得免疫の両方にはたらくが,樹状細胞のもつ自然免疫の制御機構に対し腫瘍微小環境のはたす役割については不明であった.筆者らは,腫瘍に浸潤する樹状細胞において高く発現誘導されるTIM-3が,外来性の核酸リガンドや抗がん剤の処理により放出される自己に由来する核酸リガンドに対する自然免疫を顕著に抑制する重要なタンパク質であることを見い出した.さらにその作用機序として,TIM-3は細胞外に存在するHMGB1との相互作用を介して核酸リガンドの細胞質エンドソームへの移行を阻害することにより,Toll様受容体やRIG-I様受容体を介する核酸リガンドに対する応答を抑制していることを明らかにした.この研究は,腫瘍微小環境による樹状細胞のもつ自然免疫の抑制機構をはじめて明らかにしたとともに,抗がん剤あるいは抗腫瘍免疫アジュバントによる治療において効果の改善につながる重要なものであった.
はじめに
国内におけるがんの罹患者数は年間60万人であり,死亡者数は30万人強にものぼる.外科手術により除去の可能な初期の固形がんを除き,進行期にある多くの患者においては化学療法や放射線療法がおもな治療手段であるが,十分な治療効果の得られていないのが実情である.その要因として,腫瘍細胞それ自体の遺伝子変異にくわえ,腫瘍組織において免疫細胞および血管や繊維芽細胞などが腫瘍微小環境を構築し,腫瘍細胞との相互作用を介して腫瘍の進展や薬剤耐性の誘導に大きな役割を担っている可能性が指摘されている.事実,間質細胞や血管内皮細胞より産生されるHGF,WNT16B,VEGFなどの増殖因子やサイトカインが,その近傍に存在する腫瘍細胞に作用することで薬剤耐性をひき起こすことが報告されている1,2).さらに近年,自然免疫におけるシグナル伝達は抗がん剤に対する感受性を決定する重要なファクターであると提唱されている3).
樹状細胞は腫瘍に特異的な免疫応答を誘導するうえで重要な役割をはたすことが知られており,その機能制御を基盤とした免疫療法の開発が注目されている4).一方で,ウイルスや細菌の感染にともなう自然免疫による初期の免疫応答の誘導において,樹状細胞はきわめて重要な役割をはたしていることが判明している5).しかしながら,腫瘍微小環境が樹状細胞のもつ自然免疫におけるシグナル伝達やリガンド認識の機構に及ぼす影響は不明である.
今回,筆者らが注目したTIM-3(T cell immunoglobulin and mucin domain 3)というタンパク質は,従来から,慢性ウイルス感染やがんなどにおいてI型ヘルパーT細胞に発現し,ガレクチン9と結合することでT細胞性の免疫不全を誘導することが報告されていた6,7).一方で,樹状細胞やマクロファージにおいてもTIM-3の発現が報告されていたが,これらの細胞においてTIM-3が自然免疫におけるシグナル伝達にあたえる影響については未知であった.そこで,腫瘍微小環境が樹状細胞におけるTIM-3の発現誘導や,自然免疫を介した腫瘍の監視機構にあたえる影響を解析した.
1.腫瘍微小環境を介した樹状細胞におけるTIM-3の発現
腫瘍微小環境におけるTIM-3の発現を検討するため,肺がんモデルや大腸がんモデルなどマウス固形がんモデルを対象として,腫瘍組織に浸潤している樹状細胞やマクロファージを分離し,ほかの組織に由来する細胞と発現パターンを比較した.その結果,腫瘍を生じていないリンパ節や脾臓に由来する細胞,および,健常モデルに由来する細胞と比較して,腫瘍に浸潤している細胞ではTIM-3の発現がきわめて高いことが判明した.
腫瘍に浸潤した樹状細胞におけるTIM-3の発現の経時的な変化を検証したところ,TIM-3の発現誘導は腫瘍の発生ののち1週間の早期から認められ,腫瘍の発生ののち4週間でのTIM-3陽性率は90%に達した.さらに,ヒトがんにおけるTIM-3の発現を検証するため,非小細胞がん患者より得られた腫瘍に存在する樹状細胞におけるTIM-3の発現を調べたところ,同じがん患者や健常者の末梢血に存在する樹状細胞に比べ,有意に発現の高いことが明らかになった.
がん細胞によるTIM-3の発現誘導を検証したところ,腫瘍細胞株の培養上清に樹状細胞におけるTIM-3の誘導活性が認められた.さらに,TIM-3の発現誘導にかかわる液性タンパク質として,血管内皮増殖因子VEGF-Aやインターロイキン10およびアルギナーゼIなどが主要な役割をはたしていた.
以上より,腫瘍微小環境において産生されるサイトカインや増殖因子などさまざまなタンパク質が,樹状細胞においてTIM-3の発現誘導にはたらいている可能性が示唆された.
2.TIM-3が自然免疫におけるシグナル伝達に及ぼす影響
TIM-3が樹状細胞の機能にあたえるインパクトを明らかにするため,TIM-3陽性およびTIM-3陰性の骨髄細胞に由来する樹状細胞,および,TIM-3を欠損した樹状細胞を対象として各種のアッセイを行った.抗原提示能および抗原に特異的な免疫応答における樹状細胞の機能に対しTIM-3の関与は軽微であった.自然免疫に対する活性化能を検証したところ,TIM-3陽性の樹状細胞においては,Toll様受容体(Toll-like receptor:TLR)のうちTLR3,TLR8,TLR9により認識,また,RIG-I様受容体(RIG-I-like receptor:RLR)などの細胞質核酸センサーにより認識される,核酸リガンドの刺激による炎症性サイトカイン(インターロイキン6,インターロイキン12,インターフェロンα,インターフェロンβ)の産生能が,TIM-3を欠損した樹状細胞と比較して顕著に抑制されることが判明した(図1).一方で,TLR2やTLR4を介するリポ多糖など非核酸系の刺激による炎症性サイトカインの発現は,TIM-3陽性の樹状細胞とTIM-3を欠損した樹状細胞とのあいだで差を認めなかった.さらに,TIM-3陽性の樹状細胞を抗TIM-3抗体により処理,あるいは,TIM-3をRNAi法によりノックダウンすることにより,核酸リガンド刺激による炎症性サイトカインの発現は回復することも明らかになった.さらに,マウスやヒトにおける腫瘍に浸潤した樹状細胞を対象とした検証においても,TIM-3が核酸リガンドによる自然免疫を有意に抑制することが明らかになった.以上より,樹状細胞に発現するTIM-3は,核酸リガンド刺激による自然免疫に対する抑制能をもつことが明らかになった.
3.TIM-3を介した自然免疫の制御の分子機構
核酸リガンドに対するTIM-3の自然免疫の制御の分子機構の検証を目的として,自然免疫におけるシグナル伝達タンパク質や関連するタンパク質のスクリーニングを行った.その結果,TIM-3と相互作用する候補タンパク質としてHMGB1(high mobility group box-1)を同定した.HMGB1はp53やNF-κBなどの転写因子の機能の発現に重要なDNA結合タンパク質であると同時に,活性化した樹状細胞やマクロファージ,あるいは,ネクローシスを起こした細胞から細胞外へと放出され,内在性の自然免疫を誘導するリガンドdamage-associated molecular pattern:DAMP,損傷関連分子パターン)として核酸リガンドよりひき起こされる自然免疫に重要な役割をはたすことが報告されている8).また,HMGB1は健常な組織と比較して腫瘍において高く産生されており,腫瘍微小環境における自然免疫に多大な影響を及ぼす可能性が考えられた.
そこで,TIM-3とHMGB1との相互作用が自然免疫にあたえる影響を詳細に検証した.CpG DNAやB-DNAは自然免疫における核酸リガンドのひとつであり,細胞に移行してエンドソーム膜に存在するToll様受容体であるTLR9や,細胞質核酸センサーであるRIG-I様受容体により認識されることで,自然免疫におけるシグナル伝達にはたらいていることが報告されている.ここでは,HMGB1が核酸リガンドと複合体を形成することにより,Toll様受容体のみならず,細胞質核酸センサーに認識される核酸リガンドの細胞質エンドソームへの移行を促進すること,このプロセスが自然免疫におけるシグナル伝達に重要な役割をはたすことが見い出された.それに対し,樹状細胞に存在するTIM-3はHMGB1と結合することにより,HMGB1と核酸リガンドとの結合を競合阻害することが明らかになった.この競合阻害によりTIM-3はHMGB1を介した核酸リガンドのエンドソームへの移行の阻害にはたらくことが判明した.
以上より,TIM-3はHMGB1を介した核酸リガンドのエンドソームへの移行を阻害することにより,自然免疫の抑制にはたらくという新規の分子機構を解明した(図2).
4.TIM-3の阻害による核酸製剤の抗腫瘍能の増強
樹状細胞において核酸リガンドは,I型インターフェロンやインターロイキン12をはじめとしたサイトカインの産生を介してキラーT細胞やナチュラルキラー細胞などのエフェクター細胞を活性化することにより,抗腫瘍能を発揮することが報告されてきた9,10).しかしながら,臨床的にはDNAワクチンの抗腫瘍効果は低率であるのが実情である.TIM-3は核酸リガンドを介した自然免疫の抑制タンパク質として機能することより,TIM-3の治療的な阻害がDNAワクチンによる抗腫瘍効果を高めることが期待される.
これらの仮説を検証するため,メラノーマや大腸がん細胞の皮下摂取モデルを対象として,DNAプラスミドやCpG-ODNなどの核酸製剤と抗TIM-3抗体とによる抗腫瘍効果を検証した.その結果,核酸製剤と抗TIM-3抗体とを併用したときには,核酸製剤を単独で用いたときに比べすぐれた抗腫瘍効果を示すことが明らかになった.さらに,獲得免疫能を欠失した免疫不全マウスや,抗体によりT細胞を除去したマウスにおいても,TIM-3の阻害による相乗的な抗腫瘍効果が認められたため,TIM-3の阻害による抗腫瘍効果はTIM-3を発現したT細胞によるものではないこと,さらに,自然免疫によるものであることが示唆された.
樹状細胞において特異的に発現するTIM-3の役割を検証するため,TIM-3ノックアウトマウスおよび野生型CD11c-DTRマウスに由来する骨髄細胞を,致死性の放射線で処置した野生型マウスに1:1で混合移植したキメラマウスを用いた.この混合骨髄キメラマウスは,生体においてジフテリアトキシンの投与により野生型(つまり,TIM-3陽性の)CD11c陽性樹状細胞を選択的に除去することにより,樹状細胞において特異的なTIM-3の欠損を作出することが可能である.このキメラマウスにより樹状細胞に発現したTIM-3が核酸製剤による抗腫瘍効果にはたす役割を検証した.TIM-3陽性の樹状細胞の存在するときには核酸製剤の単独による抗腫瘍効果は不十分であり,抗TIM-3抗体の併用によりすぐれた抗腫瘍効果を認めた.それに対して,ジフテリアトキシンを投与してTIM-3陽性の樹状細胞を除去したときには,核酸製剤の単独による十分な抗腫瘍効果が発揮され,抗TIM-3抗体の併用に効果は認められなかった.
以上より,樹状細胞に存在するTIM-3は,DNAワクチンなど核酸製剤による抗腫瘍効果を負に制御するうえで重要な役割をはたすことが明らかになった.
5.抗TIM-3抗体の併用による抗がん剤の抗腫瘍能の増強
近年の研究により,一部の抗がん剤は免疫原性の高い細胞死を誘導することにより,自然免疫におけるシグナル伝達や抗腫瘍能を誘導することが報告されている3).また,腫瘍へのワクチン投与により腫瘍微小環境から放出される核酸リガンドが,Toll様受容体などを介した自然免疫を誘導することにより抗腫瘍能の増強にはたらくことが報告されている11).以上より,抗がん剤の投与により細胞死を誘導されたがん細胞の放出する核酸が,自然免疫を誘導する核酸リガンドとして機能すること,その免疫応答を樹状細胞に存在するTIM-3が抑制することで,本来,発揮されるべき抗腫瘍能が抑制されているという仮説が成り立つ.これらの可能性を検証するため,抗がん剤シスプラチンにより処理した大腸がん細胞を,抗TIM-3抗体とともにTIM-3陽性の樹状細胞に投与したところ,I型インターフェロンやインターロイキン12の産生増強を認めた.この反応はDNase処理あるいはRnase処理により有意に抑制されたため,抗がん剤の刺激により放出された核酸リガンドにより誘導される自然免疫の抑制にTIM-3がはたらくことが明らかになった.さらに,さきに述べた混合骨髄キメラマウスを用いて,大腸がん細胞の皮下摂取モデルにおいてシスプラチンと抗TIM-3抗体による治療効果を検証したところ,樹状細胞に発現するTIM-3がシスプラチンによる抗腫瘍能を負に制御していることが明らかになった.
以上より,樹状細胞に発現したTIM-3は,腫瘍において放出される核酸リガンドを介した自然免疫を負に制御していること,さらに,TIM-3とHMGB1との相互作用を標的とした抗TIM-3抗体の投与により,DNAワクチンや抗がん剤による抗腫瘍効果の改善が図れる可能性が示された(図3).
おわりに
この論文では,腫瘍微小環境による免疫逃避機構の新たなストラテジーとして,樹状細胞に発現したTIM-3による自然免疫の抑制機構の存在を明らかにした.腫瘍微小環境は炎症細胞や腫瘍細胞を介した炎症を特徴としている場合が多く,NF-κBやSTAT3を介した炎症シグナル伝達は腫瘍の進展や転移に重要な意義をもつ.ただし,炎症シグナル伝達はHMGB1をはじめとした内在性の自然免疫を誘導するリガンド(DAMP)の産生を促進することや,腫瘍微小環境における細胞死を介した核酸リガンドの産生により自然免疫の亢進にはたらく可能性が高いと考えられる.その意味で,腫瘍微小環境による樹状細胞へのTIM-3の発現誘導は,炎症シグナル伝達によりひき起こされる自然免疫を負に制御することにより,腫瘍細胞の発がん活性を維持しつつ,免疫逃避機構の獲得にはたらくという点で,すぐれたストラテジーを構築していると考えることができる.
今後の研究の方向性として,TIM-3を介した核酸リガンドの細胞質エンドソームへの移行の阻害にはたらくタンパク質の同定や,それにより制御されるシグナル伝達経路の検証,マクロファージをはじめとしたほかの細胞における自然免疫の制御機構にかかわる分子の同定などがあげられる.以上の研究をとおして腫瘍微小環境による自然免疫の制御機構の網羅的および体系的な理解を深めることにより,腫瘍細胞と免疫細胞とのクロストークの解明に寄与できるものと思われる.
最近,TIM-3は白血病幹細胞に特異的に発現していることが報告され,さらに,治療の標的としても有効であると報告されている12).このことからも,腫瘍微小環境により特異的に発現誘導されるTIM-3陽性細胞を標的とした新たな治療戦略は,免疫療法あるいは抗がん剤の治療効果の改善や,特異的な分子マーカーの開発を視野に入れた臨床応用をめざすうえで重要な意義をもつものと考えられる.
文 献
- Straussman, R., Morikawa, T., Shee, K. et al.: Tumour micro-environment elicits innate resistance to RAF inhibitors through HGF secretion. Nature, 487, 500-504 (2012)[PubMed]
- Sun, Y., Campisi, J., Higano, C. et al.: Treatment-induced damage to the tumor microenvironment promotes prostate cancer therapy resistance through WNT16B. Nat. Med., 18, 1359-1368 (2012)[PubMed]
- Green, D. R., Ferguson, T., Zitvogel, L. et al.: Immunogenic and tolerogenic cell death. Nat. Rev. Immunol., 9, 353-363 (2009)[PubMed]
- Steinman, R. M. & Banchereau, J.: Taking dendritic cells into medicine. Nature, 449, 419-426 (2007)[PubMed]
- Takeuchi, O. & Akira, S.: Pattern recognition receptors and inflammation. Cell, 140, 805-820 (2010)[PubMed]
- Zhu, C., Anderson, A. C., Schubart, A. et al.: The Tim-3 ligand galectin-9 negatively regulates T helper type 1 immunity. Nat. Immunol., 6, 1245-1252 (2005)[PubMed]
- Jones, R. B., Ndhlovu, L. C., Barbour, J. D. et al.: Tim-3 expression defines a novel population of dysfunctional T cells with highly elevated frequencies in progressive HIV infection. J. Exp. Med., 205, 2763-2779 (2008)[PubMed]
- Lotze, M. T. & Tracey, K. J.: High-mobility group box 1 protein (HMGB1): nuclear weapon in the immune arsenal. Nat. Rev. Immunol., 5, 331-342 (2005)[PubMed]
- Krieg, A. M.: Development of TLR9 agonists for cancer therapy. J. Clin. Invest., 117, 1184-1194 (2007)[PubMed]
- Akazawa, T., Ebihara, T., Okuno, M. et al.: Antitumor NK activation induced by the Toll-like receptor 3-TICAM-1 (TRIF) pathway in myeloid dendritic cells. Proc. Natl. Acad. Sci. USA, 104, 252-257 (2007)[PubMed]
- Lin, Y., Zhang, L., Cai, A. X. et al.: Effective posttransplant antitumor immunity is associated with TLR-stimulating nucleic acid-immunoglobulin complexes in humans. J. Clin. Invest., 121, 1574-1584 (2011)[PubMed]
- Kikushige, Y., Shima, T., Takayanagi, S. et al.: TIM-3 is a promising target to selectively kill acute myeloid leukemia stem cells. Cell Stem Cell, 7, 708-717 (2010)[PubMed]
著者プロフィール
略歴:愛媛大学大学院農学研究科 修了,愛知がんセンター研究所 リサーチレジデントを経て,2010年より北海道大学遺伝子病研究所 博士研究員.
八木田 秀雄(Hideo Yagita)
順天堂大学医学研究科 先任准教授.
地主 将久(Masahisa Jinushi)
北海道大学遺伝子病研究所 准教授.
© 2012 千葉殖幹・八木田秀雄・地主将久 Licensed under CC 表示 2.1 日本