NLRP3遺伝子の活性型変異によりひき起こされるインターロイキン1βに依存性の皮膚炎における肥満細胞の重要な役割
中村悠美1・神戸直智2・Gabriel Núñez1
(1米国Michigan大学Medical School,Department of Pathology,2千葉大学大学院医学研究院 皮膚科学)
email:中村悠美
DOI: 10.7875/first.author.2012.100
Critical role for mast cells in interleukin-1β-driven skin inflammation associated with an activating mutation in the Nlrp3 protein.
Yuumi Nakamura, Luigi Franchi, Naotomo Kambe, Guangxun Meng, Warren Strober, Gabriel Núñez
Immunity, 37, 85-95 (2012)
クリオピリン関連周期熱症候群はNLRP3遺伝子の活性型変異によりインターロイキン1βが過剰な産生されることを原因とする疾患である.NLRP3の活性化の分子機構は明らかになりつつあるが,活性化したNLRP3が実際にどのような分子機構によりクリオピリン関連周期熱症候群の発症をひき起こすのかについてはいまだ多くが明らかにされていない.筆者らは,ヒトで報告されているNLRP3遺伝子の活性型変異をノックインしたマウスから,肥満細胞を欠損したマウスを作製した.NLRP3遺伝子の活性型変異をもつ肥満細胞はリポ多糖やTNFαに反応して大量のインターロイキン1βを産生し,NLRP3遺伝子活性型変異ノックインマウスでは皮疹を契機とした全身性の炎症が認められるのに対し,肥満細胞を欠損したNLRP3遺伝子活性型変異ノックインマウスではそのような全身性の炎症はほぼ完全に抑制された.興味深いことに,抗TNF抗体や抗生剤の投与によってもNLRP3遺伝子活性型変異ノックインマウスの炎症は劇的に抑制された.肥満細胞の再移入実験の結果から,皮膚に存在する細菌叢が肥満細胞におけるTNFαの産生を介してNLRP3インフラマソームを活性化し,その結果として産生されるインターロイキン1βにより全身性の炎症が惹起されるという分子機構が明らかになった.
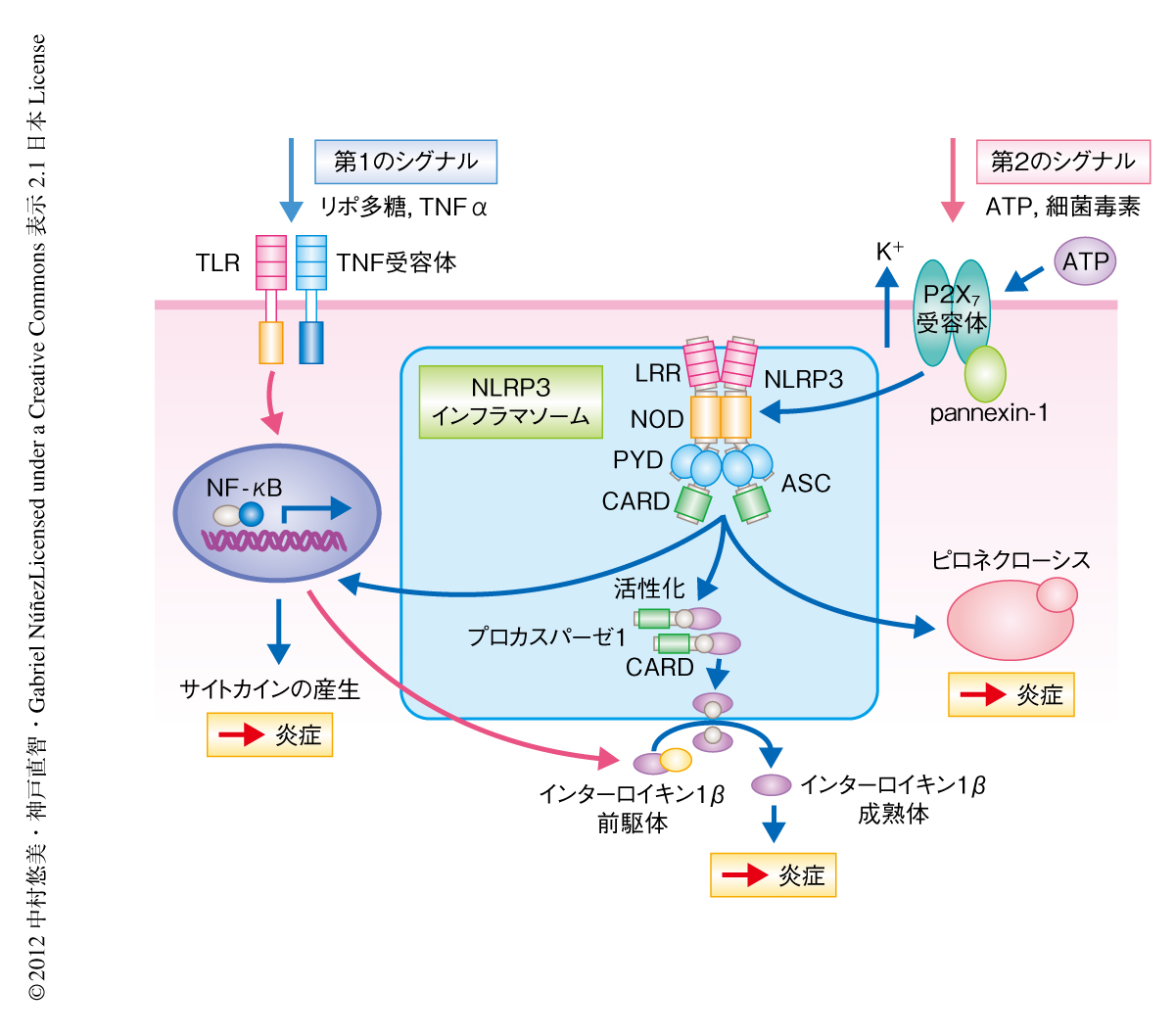
クリオピリン関連周期熱症候群(cryopyrin-associated periodic syndrome:CAPS)は,NLRP3遺伝子(NOD-like receptor family, pryin domain containing 3)の活性型変異によるインターロイキン1βの過剰な産生がその本態である1).胎児期には異常を認めないものの,重症例では生後1週間ほど,ほかの症例においても多くは小児期に発症し,発熱をともなうじんましん様の皮疹,関節の症状,結膜炎を認め,重症例では関節の変形や中枢神経の症状,アミロイドーシスなど重篤な症状を起こし,治療を行わないと生命予後に影響する.その分子機構として,活性型NLRP3は下流のASC(apoptosis-associated speck-like protein containing a CARD)およびカスパーゼ1と結合してインフラマソームとよばれるタンパク質複合体を形成することにより,インターロイキン1β成熟体およびインターロイキン18を産生することが明らかになっている2).このNLRP3の活性化には,まず,これらインフラマソームの構成タンパク質およびサイトカイン前駆体の産生のための第1シグナル,そして,これらのタンパク質によるインフラマソームの活性化のための第2シグナルが必要となる.第1シグナルとしては,NF-κBシグナルを活性化するようなリポ多糖をはじめとするToll様受容体のリガンドや,TNFα,インターロイキン1βが知られている3,4).一方,第2シグナルとしては,ATPや細菌毒素をはじめ,アスベストやシリカ,アラムなどの結晶物質などが報告され,定常状態においては生体において危険信号を認識し防御するという役割をはたしている2)(図1).近年,ヒトにおいて報告されているNLRP3遺伝子の活性型変異をもつノックインマウスが作製され,このノックアウトマウスでは第1シグナルのみが必要で第2シグナルを必要としないことが報告された5,6).以上より,クリオピリン関連周期熱症候群の発症においてはNLRP3遺伝子の変異にくわえ,第1シグナルが関与するのではないかという仮説が考えられた.また,最近,筆者らのグループは,クリオピリン関連周期熱症候群の患者の皮膚において,肥満細胞がインターロイキン1βの産生細胞であることを明らかにした7).そこで今回,NLRP3遺伝子活性型変異ノックインマウスから肥満細胞を欠損したマウスを作製し,クリオピリン関連周期熱症候群における肥満細胞の役割をさらに検討した.
NLRP3遺伝子活性型変異ノックインマウスは出生の直後は正常であったが,生後約1週目を境に全例において後頚部の肛囲に皮膚症状を発症し,生後2週までに皮膚症状はピークをむかえた.この皮疹の発症を境に成長の遅れもみられるようになった.臨床的には皮疹の外観はクリオピリン関連周期熱症候群の患者とは異なるが,病理組織学的にはヒトと同様に好中球性の炎症を呈し,肥満細胞は免疫染色によりインターロイキン1β陽性を示した.一方,肥満細胞を欠損したNLRP3遺伝子活性型変異ノックインマウスには生後1週~2週においてごく軽度の脱毛が認められたものの,組織学的にも皮膚に炎症はなく正常な発達を示した.これらの知見は,なんらかの外的な刺激が肥満細胞を介してインフラマソームの活性化を起こし,クリオピリン関連周期熱症候群の発症にかかわっていることを示唆した.in vitroにおいては,野生型マウスの骨髄より得た培養肥満細胞はインフラマソームの活性化に第1シグナルと第2シグナルを必要とする一方,NLRP3遺伝子活性型変異ノックインマウスの骨髄より得た培養肥満細胞はリポ多糖やTNFαといった第1シグナルのみでインフラマソームを活性化しインターロイキン1βを産生した.
肥満細胞の産生するインターロイキン1βが重要なのかどうかを検討するため,インターロイキン1β遺伝子を欠損したNLRP3遺伝子活性型変異ノックインマウスを作製し,このマウスから培養肥満細胞を作製して,肥満細胞を欠損したNLRP3遺伝子活性型変異ノックインマウスに移入した.発症の起点が生後1週であることから,生後1日の仔マウスの後頚部に肥満細胞を移入した.NLRP3遺伝子活性型変異ノックインマウスから作製した培養肥満細胞を移入した,肥満細胞を欠損したNLRP3遺伝子活性型変異ノックインマウスは,NLRP3遺伝子活性型変異ノックインマウスと同様に,生後1週において後頚部に皮疹を発症し成長障害をきたした.一方,野生型マウス,あるいは,インターロイキン1β遺伝子を欠損したNLRP3遺伝子活性型変異ノックインマウスから作製した培養肥満細胞を移入した,肥満細胞を欠損したNLRP3遺伝子活性型変異ノックインマウスでは発症は認められなかった.このことは,肥満細胞におけるNLRP3インフラマソームの活性化を介したインターロイキン1βの産生が,クリオピリン関連周期熱症候群の発症に重要であることを示していた.
興味深いことに,NLRP3遺伝子活性型変異ノックインマウスから作製した培養肥満細胞を,肥満細胞を欠損したマウスへ移入した際には皮膚炎をはじめとした臨床症状の発症は認められなかった.このことは,マウスにおける臨床症状の発症においてNLRP3に活性型変異をもつ肥満細胞だけでは不十分であり,それ以外の細胞もまた発症に必要であることを示唆していた.
つぎに,皮疹の発症する部位に着目した.マウスにおいて皮疹は生後に母親マウスが頻繁に舐めたり咥えたりする部位に一致して発症した.このことは,なんらかの外的な刺激が発症の契機となることを示唆していた.NLRP3インフラマソームへの第1シグナルとして知られるリポ多糖は細菌に由来するので,まず,細菌を減らすことにより発症が抑制されるかどうかを検証した.その結果,抗生剤の投与により,生後,皮膚に生着してくる細菌を減らしたNLRP3遺伝子活性型変異ノックインマウスの仔では劇的に発症が抑制された.
よく知られている肥満細胞の機能のひとつに感染防御がある.なかでも,脱顆粒という感染の早期におけるイベントにより肥満細胞の顆粒から放出されるTNFαは,さきに述べたように,NLRP3インフラマソームの第1シグナルとしても知られる.そこで,細菌叢による刺激がTNFαの産生を介するかどうかを検討した.抗生剤を投与されたNLRP3遺伝子活性型変異ノックインマウスは皮疹をほぼ発症しなかったが,ここに組換えTNFαを経皮投与すると皮疹が再現された.発症におけるTNFαの役割をさらに確かめるため,抗生剤を投与する代わり生後すぐに仔マウスに抗TNF抗体を投与すると,NLRP3遺伝子活性型変異ノックインマウスにおける発症は完全に抑制された.
以上の結果より,細菌叢の生着による皮膚におけるTNFαの産生がクリオピリン関連周期熱症候群の発症の起点となっていることが示唆された.しかしながら,臨床においては,クリオピリン関連周期熱症候群の患者に対し抗インターロイキン1療法が劇的に奏功する一方で,抗TNF療法はほとんど奏功しない.これは,発症の起点としてはTNFαが非常に重要な役割をはたすものの,いちどインフラマソームが活性化し過剰なインターロイキン1βの産生が起こってしまえばインターロイキン1βもまた第1シグナルとなりうるため,すでにインターロイキン1βの過剰な産生が誘導され発症している患者に対してはTNFαを標的とした治療は奏功しないのではないかと考えた.事実,このことはマウスを用いた検討でも確認され,すでに発症してしまったマウスに抗TNF抗体を投与しても有効性は得られなかった.
皮膚にはマクロファージや樹状細胞など,肥満細胞と同様にin vitroにおいてインターロイキン1βの産生能をもつ細胞が存在するのにもかかわらず,なぜ発症に肥満細胞が重要なのだろうか.肥満細胞の特徴について考えたとき,まず思い浮かぶのはその顆粒の存在であり,実際に感染の場において,肥満細胞の顆粒に由来するTNFαが生体防御において重要であることが報告されている8).そこで,インターロイキン1βの産生のみならず,第1シグナルとなるTNFαの産生に関しても肥満細胞が重要な役割を担っていると考えた.実際に,あらかじめ抗生剤を投与し細菌叢を排除したNLRP3遺伝子活性型変異ノックインマウスの仔に肥満細胞の脱顆粒因子であるcompound48/80を局所投与すると皮疹が再現された.そこで,TNFαを欠損したマウスから作製した培養肥満細胞を,肥満細胞を欠損したNLRP3遺伝子活性型変異ノックインマウスの耳介に移入し,そこにcompound 48/80を投与してやることで皮疹が再現されるかどうかを検討した.すると,野生型マウスから作製した培養肥満細胞を移入したときには皮疹が再現されたのに対し,TNFαを欠損したマウスから作製した培養肥満細胞を移入したときには皮疹は再現されなかった.最後に,この肥満細胞に由来するTNFαが,実際に肥満細胞それ自体からインターロイキン1βの産生を促し皮疹を起こしているのかどうかを検討するため,インターロイキン1βを欠損したマウスから作製した培養肥満細胞を,肥満細胞を欠損したNLRP3遺伝子活性型変異ノックインマウスの耳介に移入し,そこにTNFαを投与することで皮疹が再現されるかどうかを検討した.すると,野生型マウスから作製した培養肥満細胞を移入したときには皮疹が再現されたのに対し,インターロイキン1βを欠損したマウスから作製した培養肥満細胞を移入したときには皮疹は再現されなかった.
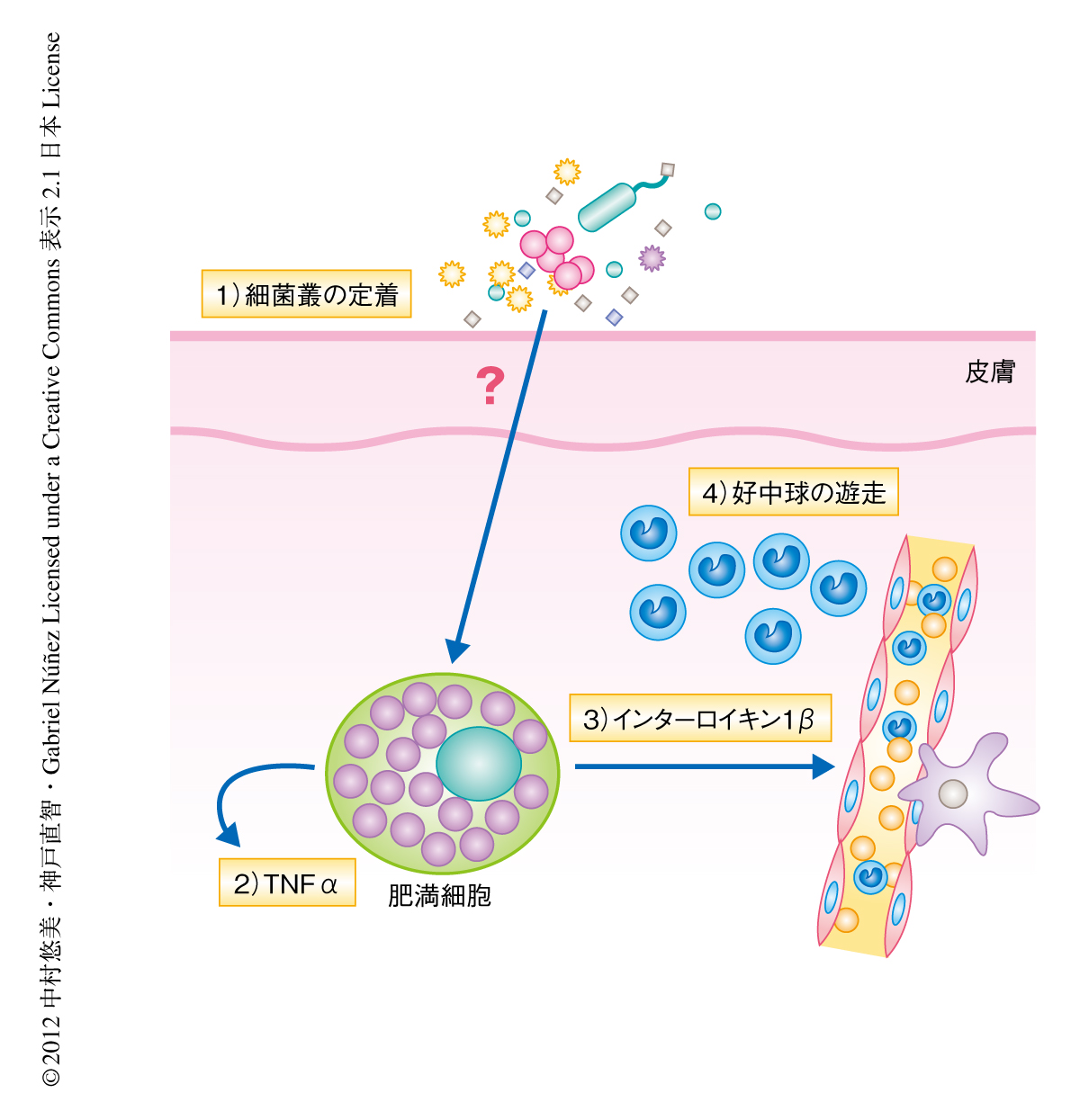
以上の結果より,皮膚における細菌叢の生着は肥満細胞からのTNFαの放出を起こし,これが第1シグナルとなって肥満細胞からのインターロイキン1βの産生を起こして,クリオピリン関連周期熱症候群の発症を制御していることが示唆された(図2).
クリオピリン関連周期熱症候群は国内に50症例あまりの報告があるにすぎない,まれな遺伝性疾患ではあるが,その解析はNLRP3の生体における役割,さらには,肥満細胞を起点とした炎症性サイトカインの制御など,ヒトが環境において恒常性を維持するために備わったたくみな防御機構の一端を示し興味深い.肥満細胞は自然免疫やアレルギーにおいて重要な役割をはたし,皮膚疾患でいえばじんましんのエフェクター細胞として有名である.筆者らの研究は,クリオピリン関連周期熱症候群の患者の皮疹は通常のじんましんと非常によく似た臨床像を呈するにもかかわらず,それと異なり,かゆみをともなわず抗ヒスタミン薬が無効であることから着想を得ている.これまでに,クリオピリン関連周期熱症候群の患者の組織を用いた免疫染色や遺伝子導入した細胞を用いることにより,インターロイキン1βの産生細胞としての肥満細胞の役割を報告した7).今回の研究では,疾患モデルマウスを用いることで,生後に起こる細菌叢への暴露により産生される肥満細胞からのTNFαが発症の契機となっていることを証明した.すなわち,正常なマウスではなんら症状をひき起こさない生理的なレベルのTNFαが,NLRP3が恒常的に活性化している状態では第1シグナルとしてはたらき,肥満細胞からのインターロイキン1βの産生が契機となり過剰な生体防御反応がひき起こされる.
臨床において,クリオピリン関連周期熱症候群は原因遺伝子およびその分子機構が明らかなこともあり,抗インターロイキン1療法が著効する疾患9,10) として治療法は確立しているようにみえる.しかし,この治療法が確立するごく最近まで,最重症に分類される患児はその生命予後の悪さから成人することはなかった.そのため,現時点で,抗インターロイキン1療法について生涯にわたるような長期投与による影響はわかっていない.また,薬剤の全般で起こるアレルギー反応やアナフィラキシー反応など副作用の問題もある.こうした観点から考えると,今後,抗インターロイキン1療法とは別の,インフラマソームの下流を標的とした有効な治療法を模索することが必要になると考えられ,今回の研究はそういった標的を探る足がかりになるかもしれない.
略歴:2009年 千葉大学大学院医学研究科にて博士号取得,同年 千葉大学G-COE特任研究員を経て,米国Michigan大学Medical Schoolリサーチフェロー.
研究テーマ:皮膚における肥満細胞と常在細菌の役割.
抱負:遺伝性の自己炎症性疾患の機能解析を足がかりに,common diseaseといわれるような皮膚疾患の病態の解明に貢献したい.
神戸 直智(Naotomo Kambe)
千葉大学大学院医学研究院 准教授.
Gabriel Núñez
米国Michigan大学Medical School教授.
© 2012 中村悠美・神戸直智・Gabriel Núñez Licensed under CC 表示 2.1 日本
(1米国Michigan大学Medical School,Department of Pathology,2千葉大学大学院医学研究院 皮膚科学)
email:中村悠美
DOI: 10.7875/first.author.2012.100
Critical role for mast cells in interleukin-1β-driven skin inflammation associated with an activating mutation in the Nlrp3 protein.
Yuumi Nakamura, Luigi Franchi, Naotomo Kambe, Guangxun Meng, Warren Strober, Gabriel Núñez
Immunity, 37, 85-95 (2012)
要 約
クリオピリン関連周期熱症候群はNLRP3遺伝子の活性型変異によりインターロイキン1βが過剰な産生されることを原因とする疾患である.NLRP3の活性化の分子機構は明らかになりつつあるが,活性化したNLRP3が実際にどのような分子機構によりクリオピリン関連周期熱症候群の発症をひき起こすのかについてはいまだ多くが明らかにされていない.筆者らは,ヒトで報告されているNLRP3遺伝子の活性型変異をノックインしたマウスから,肥満細胞を欠損したマウスを作製した.NLRP3遺伝子の活性型変異をもつ肥満細胞はリポ多糖やTNFαに反応して大量のインターロイキン1βを産生し,NLRP3遺伝子活性型変異ノックインマウスでは皮疹を契機とした全身性の炎症が認められるのに対し,肥満細胞を欠損したNLRP3遺伝子活性型変異ノックインマウスではそのような全身性の炎症はほぼ完全に抑制された.興味深いことに,抗TNF抗体や抗生剤の投与によってもNLRP3遺伝子活性型変異ノックインマウスの炎症は劇的に抑制された.肥満細胞の再移入実験の結果から,皮膚に存在する細菌叢が肥満細胞におけるTNFαの産生を介してNLRP3インフラマソームを活性化し,その結果として産生されるインターロイキン1βにより全身性の炎症が惹起されるという分子機構が明らかになった.
はじめに
クリオピリン関連周期熱症候群(cryopyrin-associated periodic syndrome:CAPS)は,NLRP3遺伝子(NOD-like receptor family, pryin domain containing 3)の活性型変異によるインターロイキン1βの過剰な産生がその本態である1).胎児期には異常を認めないものの,重症例では生後1週間ほど,ほかの症例においても多くは小児期に発症し,発熱をともなうじんましん様の皮疹,関節の症状,結膜炎を認め,重症例では関節の変形や中枢神経の症状,アミロイドーシスなど重篤な症状を起こし,治療を行わないと生命予後に影響する.その分子機構として,活性型NLRP3は下流のASC(apoptosis-associated speck-like protein containing a CARD)およびカスパーゼ1と結合してインフラマソームとよばれるタンパク質複合体を形成することにより,インターロイキン1β成熟体およびインターロイキン18を産生することが明らかになっている2).このNLRP3の活性化には,まず,これらインフラマソームの構成タンパク質およびサイトカイン前駆体の産生のための第1シグナル,そして,これらのタンパク質によるインフラマソームの活性化のための第2シグナルが必要となる.第1シグナルとしては,NF-κBシグナルを活性化するようなリポ多糖をはじめとするToll様受容体のリガンドや,TNFα,インターロイキン1βが知られている3,4).一方,第2シグナルとしては,ATPや細菌毒素をはじめ,アスベストやシリカ,アラムなどの結晶物質などが報告され,定常状態においては生体において危険信号を認識し防御するという役割をはたしている2)(図1).近年,ヒトにおいて報告されているNLRP3遺伝子の活性型変異をもつノックインマウスが作製され,このノックアウトマウスでは第1シグナルのみが必要で第2シグナルを必要としないことが報告された5,6).以上より,クリオピリン関連周期熱症候群の発症においてはNLRP3遺伝子の変異にくわえ,第1シグナルが関与するのではないかという仮説が考えられた.また,最近,筆者らのグループは,クリオピリン関連周期熱症候群の患者の皮膚において,肥満細胞がインターロイキン1βの産生細胞であることを明らかにした7).そこで今回,NLRP3遺伝子活性型変異ノックインマウスから肥満細胞を欠損したマウスを作製し,クリオピリン関連周期熱症候群における肥満細胞の役割をさらに検討した.
1.NLRP3遺伝子活性型変異ノックインマウスにみられる皮膚炎には肥満細胞の存在が必須である
NLRP3遺伝子活性型変異ノックインマウスは出生の直後は正常であったが,生後約1週目を境に全例において後頚部の肛囲に皮膚症状を発症し,生後2週までに皮膚症状はピークをむかえた.この皮疹の発症を境に成長の遅れもみられるようになった.臨床的には皮疹の外観はクリオピリン関連周期熱症候群の患者とは異なるが,病理組織学的にはヒトと同様に好中球性の炎症を呈し,肥満細胞は免疫染色によりインターロイキン1β陽性を示した.一方,肥満細胞を欠損したNLRP3遺伝子活性型変異ノックインマウスには生後1週~2週においてごく軽度の脱毛が認められたものの,組織学的にも皮膚に炎症はなく正常な発達を示した.これらの知見は,なんらかの外的な刺激が肥満細胞を介してインフラマソームの活性化を起こし,クリオピリン関連周期熱症候群の発症にかかわっていることを示唆した.in vitroにおいては,野生型マウスの骨髄より得た培養肥満細胞はインフラマソームの活性化に第1シグナルと第2シグナルを必要とする一方,NLRP3遺伝子活性型変異ノックインマウスの骨髄より得た培養肥満細胞はリポ多糖やTNFαといった第1シグナルのみでインフラマソームを活性化しインターロイキン1βを産生した.
肥満細胞の産生するインターロイキン1βが重要なのかどうかを検討するため,インターロイキン1β遺伝子を欠損したNLRP3遺伝子活性型変異ノックインマウスを作製し,このマウスから培養肥満細胞を作製して,肥満細胞を欠損したNLRP3遺伝子活性型変異ノックインマウスに移入した.発症の起点が生後1週であることから,生後1日の仔マウスの後頚部に肥満細胞を移入した.NLRP3遺伝子活性型変異ノックインマウスから作製した培養肥満細胞を移入した,肥満細胞を欠損したNLRP3遺伝子活性型変異ノックインマウスは,NLRP3遺伝子活性型変異ノックインマウスと同様に,生後1週において後頚部に皮疹を発症し成長障害をきたした.一方,野生型マウス,あるいは,インターロイキン1β遺伝子を欠損したNLRP3遺伝子活性型変異ノックインマウスから作製した培養肥満細胞を移入した,肥満細胞を欠損したNLRP3遺伝子活性型変異ノックインマウスでは発症は認められなかった.このことは,肥満細胞におけるNLRP3インフラマソームの活性化を介したインターロイキン1βの産生が,クリオピリン関連周期熱症候群の発症に重要であることを示していた.
興味深いことに,NLRP3遺伝子活性型変異ノックインマウスから作製した培養肥満細胞を,肥満細胞を欠損したマウスへ移入した際には皮膚炎をはじめとした臨床症状の発症は認められなかった.このことは,マウスにおける臨床症状の発症においてNLRP3に活性型変異をもつ肥満細胞だけでは不十分であり,それ以外の細胞もまた発症に必要であることを示唆していた.
2.皮膚の細菌叢はTNFαの産生を介してクリオピリン関連周期熱症候群の発症に重要な役割をはたしている
つぎに,皮疹の発症する部位に着目した.マウスにおいて皮疹は生後に母親マウスが頻繁に舐めたり咥えたりする部位に一致して発症した.このことは,なんらかの外的な刺激が発症の契機となることを示唆していた.NLRP3インフラマソームへの第1シグナルとして知られるリポ多糖は細菌に由来するので,まず,細菌を減らすことにより発症が抑制されるかどうかを検証した.その結果,抗生剤の投与により,生後,皮膚に生着してくる細菌を減らしたNLRP3遺伝子活性型変異ノックインマウスの仔では劇的に発症が抑制された.
よく知られている肥満細胞の機能のひとつに感染防御がある.なかでも,脱顆粒という感染の早期におけるイベントにより肥満細胞の顆粒から放出されるTNFαは,さきに述べたように,NLRP3インフラマソームの第1シグナルとしても知られる.そこで,細菌叢による刺激がTNFαの産生を介するかどうかを検討した.抗生剤を投与されたNLRP3遺伝子活性型変異ノックインマウスは皮疹をほぼ発症しなかったが,ここに組換えTNFαを経皮投与すると皮疹が再現された.発症におけるTNFαの役割をさらに確かめるため,抗生剤を投与する代わり生後すぐに仔マウスに抗TNF抗体を投与すると,NLRP3遺伝子活性型変異ノックインマウスにおける発症は完全に抑制された.
以上の結果より,細菌叢の生着による皮膚におけるTNFαの産生がクリオピリン関連周期熱症候群の発症の起点となっていることが示唆された.しかしながら,臨床においては,クリオピリン関連周期熱症候群の患者に対し抗インターロイキン1療法が劇的に奏功する一方で,抗TNF療法はほとんど奏功しない.これは,発症の起点としてはTNFαが非常に重要な役割をはたすものの,いちどインフラマソームが活性化し過剰なインターロイキン1βの産生が起こってしまえばインターロイキン1βもまた第1シグナルとなりうるため,すでにインターロイキン1βの過剰な産生が誘導され発症している患者に対してはTNFαを標的とした治療は奏功しないのではないかと考えた.事実,このことはマウスを用いた検討でも確認され,すでに発症してしまったマウスに抗TNF抗体を投与しても有効性は得られなかった.
3.肥満細胞からのTNFαの産生はNLRP3遺伝子活性型変異ノックインマウスの発症を制御する
皮膚にはマクロファージや樹状細胞など,肥満細胞と同様にin vitroにおいてインターロイキン1βの産生能をもつ細胞が存在するのにもかかわらず,なぜ発症に肥満細胞が重要なのだろうか.肥満細胞の特徴について考えたとき,まず思い浮かぶのはその顆粒の存在であり,実際に感染の場において,肥満細胞の顆粒に由来するTNFαが生体防御において重要であることが報告されている8).そこで,インターロイキン1βの産生のみならず,第1シグナルとなるTNFαの産生に関しても肥満細胞が重要な役割を担っていると考えた.実際に,あらかじめ抗生剤を投与し細菌叢を排除したNLRP3遺伝子活性型変異ノックインマウスの仔に肥満細胞の脱顆粒因子であるcompound48/80を局所投与すると皮疹が再現された.そこで,TNFαを欠損したマウスから作製した培養肥満細胞を,肥満細胞を欠損したNLRP3遺伝子活性型変異ノックインマウスの耳介に移入し,そこにcompound 48/80を投与してやることで皮疹が再現されるかどうかを検討した.すると,野生型マウスから作製した培養肥満細胞を移入したときには皮疹が再現されたのに対し,TNFαを欠損したマウスから作製した培養肥満細胞を移入したときには皮疹は再現されなかった.最後に,この肥満細胞に由来するTNFαが,実際に肥満細胞それ自体からインターロイキン1βの産生を促し皮疹を起こしているのかどうかを検討するため,インターロイキン1βを欠損したマウスから作製した培養肥満細胞を,肥満細胞を欠損したNLRP3遺伝子活性型変異ノックインマウスの耳介に移入し,そこにTNFαを投与することで皮疹が再現されるかどうかを検討した.すると,野生型マウスから作製した培養肥満細胞を移入したときには皮疹が再現されたのに対し,インターロイキン1βを欠損したマウスから作製した培養肥満細胞を移入したときには皮疹は再現されなかった.
以上の結果より,皮膚における細菌叢の生着は肥満細胞からのTNFαの放出を起こし,これが第1シグナルとなって肥満細胞からのインターロイキン1βの産生を起こして,クリオピリン関連周期熱症候群の発症を制御していることが示唆された(図2).
おわりに
クリオピリン関連周期熱症候群は国内に50症例あまりの報告があるにすぎない,まれな遺伝性疾患ではあるが,その解析はNLRP3の生体における役割,さらには,肥満細胞を起点とした炎症性サイトカインの制御など,ヒトが環境において恒常性を維持するために備わったたくみな防御機構の一端を示し興味深い.肥満細胞は自然免疫やアレルギーにおいて重要な役割をはたし,皮膚疾患でいえばじんましんのエフェクター細胞として有名である.筆者らの研究は,クリオピリン関連周期熱症候群の患者の皮疹は通常のじんましんと非常によく似た臨床像を呈するにもかかわらず,それと異なり,かゆみをともなわず抗ヒスタミン薬が無効であることから着想を得ている.これまでに,クリオピリン関連周期熱症候群の患者の組織を用いた免疫染色や遺伝子導入した細胞を用いることにより,インターロイキン1βの産生細胞としての肥満細胞の役割を報告した7).今回の研究では,疾患モデルマウスを用いることで,生後に起こる細菌叢への暴露により産生される肥満細胞からのTNFαが発症の契機となっていることを証明した.すなわち,正常なマウスではなんら症状をひき起こさない生理的なレベルのTNFαが,NLRP3が恒常的に活性化している状態では第1シグナルとしてはたらき,肥満細胞からのインターロイキン1βの産生が契機となり過剰な生体防御反応がひき起こされる.
臨床において,クリオピリン関連周期熱症候群は原因遺伝子およびその分子機構が明らかなこともあり,抗インターロイキン1療法が著効する疾患9,10) として治療法は確立しているようにみえる.しかし,この治療法が確立するごく最近まで,最重症に分類される患児はその生命予後の悪さから成人することはなかった.そのため,現時点で,抗インターロイキン1療法について生涯にわたるような長期投与による影響はわかっていない.また,薬剤の全般で起こるアレルギー反応やアナフィラキシー反応など副作用の問題もある.こうした観点から考えると,今後,抗インターロイキン1療法とは別の,インフラマソームの下流を標的とした有効な治療法を模索することが必要になると考えられ,今回の研究はそういった標的を探る足がかりになるかもしれない.
文 献
- Hoffman, H. M., Mueller, J. L., Broide, D. H. et al.: Mutation of a new gene encoding a putative pyrin-like protein causes familial cold autoinflammatory syndrome and Muckle-Wells syndrome. Nat. Genet., 29, 301-305 (2001)[PubMed]
- Chen, G. Y. & Nunez, G.: Sterile inflammation: sensing and reacting to damage. Nat. Rev. Immunol., 10, 826-837 (2010)[PubMed]
- Franchi, L., Eigenbrod, T. & Nunez, G.: Cutting edge: TNF-α mediates sensitization to ATP and silica via the NLRP3 inflammasome in the absence of microbial stimulation. J. Immunol., 183, 792-796 (2009)[PubMed]
- Kanneganti, T. D., Ozoren, N., Body-Malapel, M. et al.: Bacterial RNA and small antiviral compounds activate caspase-1 through cryopyrin/Nalp3. Nature, 440, 233-236 (2006)[PubMed]
- Brydges, S. D., Mueller, J. L., McGeough, M. D. et al.: Inflammasome-mediated disease animal models reveal roles for innate but not adaptive immunity. Immunity, 30, 875-887 (2009)[PubMed]
- Meng, G., Zhang, F., Fuss, I. et al.: A mutation in the Nlrp3 gene causing inflammasome hyperactivation potentiates Th17 cell-dominant immune responses. Immunity, 30, 860-874 (2009)[PubMed]
- Nakamura, Y., Kambe, N., Saito, M. et al.: Mast cells mediate neutrophil recruitment and vascular leakage through the NLRP3 inflammasome in histamine-independent urticaria. J. Exp. Med., 206, 1037-1046 (2009)[PubMed]
- Gordon, J. R. & Galli, S. J.: Mast cells as a source of both preformed and immunologically inducible TNF-α/cachectin. Nature, 346, 274-276 (1990)[PubMed]
- Goldbach-Mansky, R., Dailey, N. J., Canna, S. W. et al.: Neonatal-onset multisystem inflammatory disease responsive to interleukin-1β inhibition. N. Engl. J. Med., 355, 581-592 (2006)[PubMed]
- Hoffman, H. M., Throne, M. L., Amar, N. J. et al.: Efficacy and safety of rilonacept (interleukin-1 Trap) in patients with cryopyrin-associated periodic syndromes: results from two sequential placebo-controlled studies. Arthritis Rheum., 58, 2443-2452 (2008)[PubMed]
著者プロフィール
略歴:2009年 千葉大学大学院医学研究科にて博士号取得,同年 千葉大学G-COE特任研究員を経て,米国Michigan大学Medical Schoolリサーチフェロー.
研究テーマ:皮膚における肥満細胞と常在細菌の役割.
抱負:遺伝性の自己炎症性疾患の機能解析を足がかりに,common diseaseといわれるような皮膚疾患の病態の解明に貢献したい.
神戸 直智(Naotomo Kambe)
千葉大学大学院医学研究院 准教授.
Gabriel Núñez
米国Michigan大学Medical School教授.
© 2012 中村悠美・神戸直智・Gabriel Núñez Licensed under CC 表示 2.1 日本