熱ストレスのもとでのTOR複合体1のストレス顆粒への局在化
高原照直・前田達哉
(東京大学分子細胞生物学研究所 膜蛋白質解析研究分野)
email:高原照直,前田達哉
DOI: 10.7875/first.author.2012.086
Transient sequestration of TORC1 into stress granules during heat stress.
Terunao Takahara, Tatsuya Maeda
Molecular Cell, 47, 242-252 (2012)
TOR複合体1は栄養源の量を検知して細胞の成長を制御する過程において中心的な役割をはたす,進化的に保存されたプロテインキナーゼ複合体である.栄養源の飢餓のほかにもさまざまなストレスによりその活性は低下することが判明している.しかしながら,個々のストレスに応答したTOR複合体1の活性制御機構についてはまったく不明であった.今回,筆者らは,出芽酵母Saccharomyces cerevisiaeにおいて熱ストレスのもとでのTOR複合体1の活性制御機構をはじめて明らかにした.熱ストレスのもとではTOR複合体1の細胞内における局在は大きく変わり,ストレス顆粒とよばれる細胞質の構造体へと隔離されていた.この隔離は,熱ストレスからの回復期においてTOR複合体1の再活性化のタイミングを制御しており,熱ストレスにより誘起されるゲノム変異を防いでいることが明らかになった.
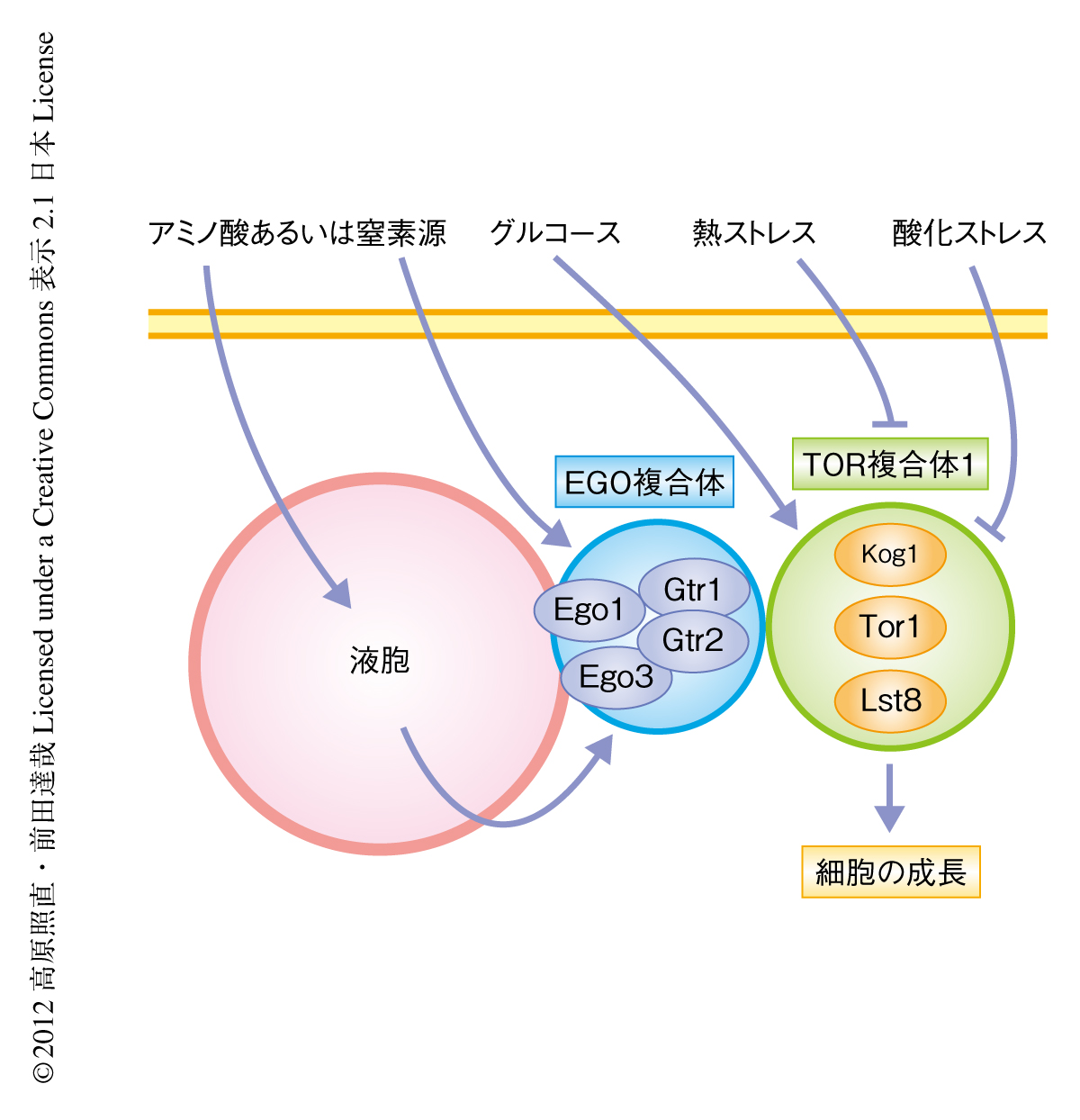
細胞は栄養飢餓,熱,浸透圧といったストレスに対したえず適切に対処しながら成長している.細胞の成長の制御には,進化的に保存されたプロテインキナーゼTOR(target of rapamycin)を触媒タンパク質としてもつシグナル伝達複合体,TOR複合体1(TOR complex 1:TORC1)が主要な役割をはたしている.TORの発見から20年近くたった現在,主要な入力シグナルと考えられるアミノ酸あるいは窒素源によるTOR複合体1の活性化におけるシグナル伝達経路は徐々に明らかになりつつあるが,TORの活性制御と生理機能の全貌の解明にはまだほど遠く,その解析は酵母から哺乳類にいたるさまざまな系において補完的に進められている.TOR複合体1の活性は栄養源の量だけでなく,種々のストレスによっても制御されていることが明らかにされ,さまざまな環境に適応しながら細胞の成長を成し遂げるうえで,TOR複合体1はシグナル伝達における重要なハブとして機能しているものと推察される1).しかしながら,個々のストレスがどのようにしてTOR複合体1の活性を制御し,また,TOR複合体1の活性制御を介した細胞の成長とストレス応答とがどのように処理されているかは,出芽酵母Saccharomyces cerevisiaeにおいてすらまったく不明であった(図1).
今回,筆者らは,出芽酵母において熱ストレスに応答したTOR複合体1の活性制御にストレス顆粒への隔離がかかわっていることを明らかにした.ストレス顆粒は種々のストレスにより形成される進化的に保存された細胞質の構造体で,主要な構成成分であるmRNA-翻訳開始因子複合体の凝集により細胞内においてはフォーカスとして観察できる2).哺乳類の細胞ではストレス顆粒の形成が細胞障害や細胞死に対する生理的な適応機構であることが報告されている.一方,出芽酵母においてはストレス顆粒が熱ストレスやグルコース飢餓に応答して形成されることは知られていたが,その構成成分の詳細や形成機構および形成の意義についての知見はほとんどなかった.今回の結果から,TOR複合体1のストレス顆粒への隔離とそれによる活性制御が,熱ストレスにより生じるゲノム変異を抑制する分子機構として機能していることが明らかになった.
TOR複合体1のもつ広範な役割から,その活性制御にかかわるタンパク質は多数あるものと推察されるが,判明している制御タンパク質の数は限られていた.そこで,新規のTOR複合体1制御タンパク質の同定をめざし,出芽酵母において遺伝学的なスクリーニングを行った.このスクリーニングには,筆者ら独自の材料である活性化型TOR複合体1を利用した.この活性化型TOR複合体1を発現する細胞は,外界の栄養源の量と細胞応答とのアンバランスから低栄養源において生育が困難となる.この生育不良を回復させるような遺伝子を探索した結果,TOR複合体1の負の制御タンパク質としてPbp1を同定した.このPbp1を過剰発現させるとTOR複合体1の阻害剤であるラパマイシンやカフェインに対し高感受性を示すことから,このときTOR複合体1の活性は低下していることが示唆された.さらに,細胞におけるTOR複合体1の活性を直接的に調べるため,その基質であるSch9に対する特異的な抗リン酸化抗体を作製し,Sch9のリン酸化の状態をモニターした.その結果,Pbp1の過剰発現にともないアミノ酸あるいは窒素源,または,グルコースなどの栄養源によるTOR複合体1の活性は抑制されていることが確認され,Pbp1の過剰発現はTOR複合体1の活性を阻害することがわかった.
つぎの課題は,Pbp1の過剰発現がTOR複合体1の活性をどのように抑制しているかを明らかにすることであった.Pbp1の過剰発現によるTOR複合体1の活性の抑制は既知の上流制御タンパク質に依存しておらず,新たな分子機構あるいは経路を介するものであると考えられた.Pbp1はポリA結合タンパク質Pab1に対する結合タンパク質として同定されたが,その具体的な機能については未解明であり,Pbp1とTOR複合体1との関連を明らかにするまでには時間を費やした.
2010年に,Pbp1の過剰発現がストレス顆粒の形成をひき起こすことが報告され3),これを契機として,ストレス顆粒とTOR複合体1の局在との関連を検討しはじめた.出芽酵母のTOR複合体1は,哺乳類のものと同様に,おもに液胞膜(哺乳類のリソソームとの相同オルガネラ)の近傍に局在する(図1).この液胞膜への局在は液胞膜にアンカーされているEGO複合体とTOR複合体1との相互作用により維持されているものと考えられている4).EGO複合体はアミノ酸あるいは窒素源によるTOR複合体1の活性化に重要であり,この活性化は液胞膜の近傍において起こっているものと推察された.TOR複合体1の局在の観察により,Pbp1の過剰発現にともないTOR複合体1の液胞膜への局在が失われ,細胞内においてフォーカスを形成するようになることが見い出された.さらに,このTOR複合体1の形成するフォーカスは,Pbp1の過剰発現により誘導されるストレス顆粒と共局在していた.また,C末端からのさまざまな長さの欠失を導入した一連のPbp1変異体を用いた解析から,ストレス顆粒の形成能とTOR複合体1の活性抑制能とのあいだには相関が認められ,Pbp1の過剰発現はストレス顆粒を形成し,TOR複合体1を液胞膜の近傍からストレス顆粒へと隔離することでその活性を抑制していることが示唆された.
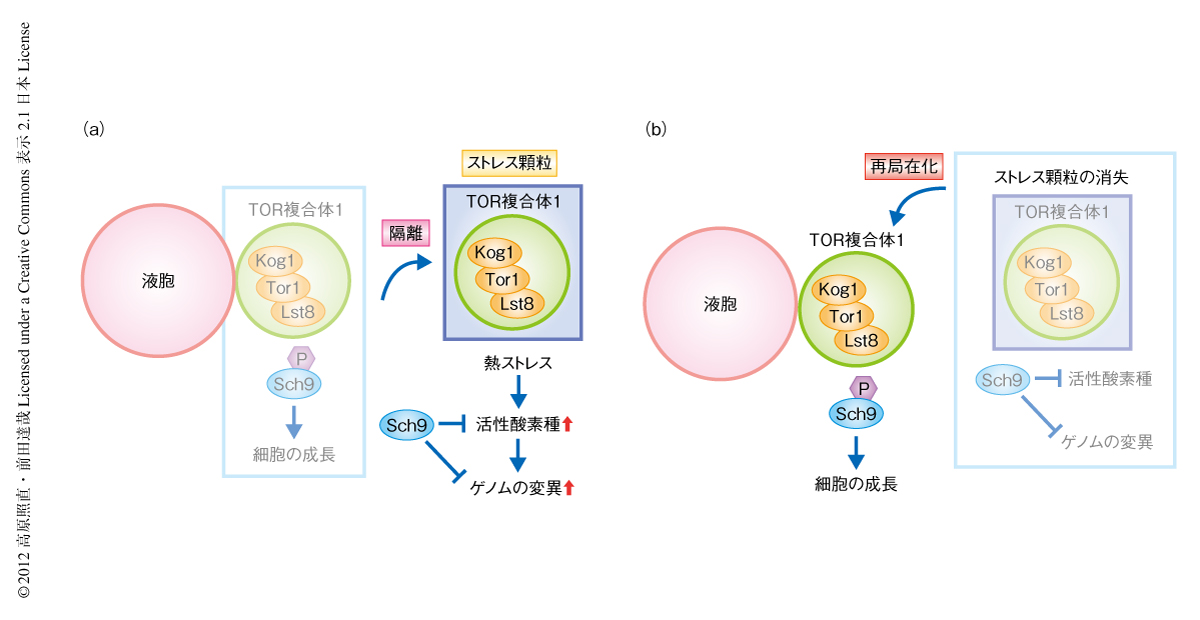
出芽酵母においてストレス顆粒は,熱ストレス,グルコース飢餓,高エタノール濃度により形成されることが報告されている5-8).Pbp1の過剰発現という人為的な条件でみられたTOR複合体1の局在の変化が生理的な条件においても起こっているかどうかを調べるため,熱ストレスによりストレス顆粒を形成させたときのTOR複合体1の局在を観察した.その結果,TOR複合体1は熱ストレスにより液胞膜の近傍から離れ細胞質においてフォーカスを形成し,これらの多くはストレス顆粒と共局在していることがわかった(図2).また,ストレス顆粒の形成の阻害剤であるシクロヘキシミドによりあらかじめ処理したのち熱ストレスにさらすと,ストレス顆粒とともにTOR複合体1の形成するフォーカスも失われたことから,ストレス顆粒の形成に依存的にTOR複合体1のフォーカスは形成されることが示唆された.さらに,熱ストレスののちのストレス顆粒の消失とTOR複合体1の局在を経時的に観察すると,TOR複合体1の液胞膜の近傍への再局在とストレス顆粒の消失とは一致しており,ストレス顆粒が熱ストレスからの回復期においてTOR複合体1の局在を制御していることが示唆された.
ストレス顆粒によるTOR複合体1の局在の制御がTOR複合体1の活性化にあたえる影響について調べた.シクロヘキシミド処理によりストレス顆粒の形成を阻害しても,熱ストレスの直後に起こるTOR複合体1の不活性化に影響はなかった.対照的に,熱ストレスののちの回復期においては,ストレス顆粒の形成阻害によりTOR複合体1の再活性化は亢進した.このことは,ストレス顆粒へのTOR複合体1の隔離はその再活性化のタイミングを遅延するはたらきをもつことを示唆していた.そこで,熱ストレスのもとでもストレス顆粒に隔離されないTOR複合体1の変異体を作出して熱ストレスののちの再活性化について調べると,この変異体では予想どおり再活性化が早まっていた.
また,熱ストレスの前後でTOR複合体1のもつキナーゼ活性が変動するかどうかをin vitroキナーゼアッセイにより調べたところ,キナーゼ活性は低下していなかった.くわえて,活性化型TOR複合体1を発現する細胞においても,熱ストレスののちの再活性化のタイミングは野生株と同様であった.これらの結果から,ストレスののちのTOR複合体1の活性化においては,TOR複合体1のもつキナーゼ活性の制御ではなく,TOR複合体1のストレス顆粒への隔離による空間的な制御が主要であるものと考えられた.さらに,熱ストレスからの回復期においてストレス顆粒の消失速度の異なる変異株を同定し,これら変異体におけるTOR複合体1の再活性化について調べると,ストレス顆粒の消失速度にあわせて再活性化のタイミングも変化していた.これらの結果から,TOR複合体1の再活性化のタイミングは,ストレス顆粒の消失を介したTOR複合体1の局在の変化により制御されていることが強く示唆された.
出芽酵母において,ストレス顆粒の形成の生理学的な意義はほとんどわかっていない.熱ストレスに誘導性のストレス顆粒がTOR複合体1の活性を制御しているという結果から,ストレス顆粒の形成がTOR複合体1の生理的な機能において重要な意義をもつことが推察された.そこで,熱ストレスにより生じる細胞障害とTOR複合体1の活性制御との関連を調べた.着目したのは,熱ストレスが活性酸素種の発生を昂進しゲノム変異を誘発するという報告であった9).TOR1破壊株やSCH9破壊株ではすでに加齢にともなうゲノム変異や活性酸素種による細胞死などに抵抗性を示すことが知られていた10,11).すなわち,TOR複合体1の活性の低下がさまざまな状況におけるゲノム変異を防ぐことに寄与している可能性から,熱ストレスによるストレス顆粒の形成と,それによるTOR複合体1の隔離を介した再活性化の抑制がゲノム変異を抑制しているのではないかと考えた.
そこで,ストレス顆粒の形成阻害により熱ストレスに依存的なゲノム変異は亢進するかどうかを,ゲノム変異の頻度の検出の容易なCAN1遺伝子座において調べた.シクロヘキシミド処理によりストレス顆粒の形成を阻害したのち,熱ストレスにさらすとゲノム変異の頻度は上昇した.シクロヘキシミドはタンパク質合成阻害剤として広く知られるが,対照としてストレス顆粒の形成を阻害しないタンパク質合成阻害剤ヒプリスタノールを用いて同様な実験を行ったときには,CAN1遺伝子座における変異の頻度は上昇しなかったことから,ストレス顆粒の形成阻害がゲノム変異の頻度の上昇をもたらしたものと考えられた.
このゲノム変異の頻度の上昇に,ストレス顆粒の形成を阻害したときに起こるTOR複合体1の早い再活性化が寄与しているかどうかを調べた.TOR複合体1の再活性化のタイミングをその阻害剤であるラパマイシンを作用させることで人為的に遅らせると,ストレス顆粒の形成阻害により頻度の上昇するゲノム変異は抑制された.さらに,Pbp1の過剰発現による人為的なストレス顆粒の形成も熱ストレスに依存的なゲノム変異を抑制することがわかった.これらの結果から,ストレス顆粒の形成とそれによるTOR複合体1の再活性化の遅延が熱ストレスによるゲノム変異を抑制しているものと考えられた(図2).
今回,熱ストレスによる細胞の障害を防ぐ分子機構として,ストレス顆粒の形成を介したTOR複合体1の活性制御がかかわっていることを明らかにした.TOR複合体1-Sch9経路の不活性化がどのようにしてゲノム変異を抑制するのかは不明だが,可能性として,スーパーオキシドジスムターゼなどの亢進を介していることなどが考えられる.
TOR複合体1の活性化は細胞の成長を正に制御しており,良好な生育環境にある細胞の成長にとりTOR複合体1の活性化は望ましい.一方で,TOR複合体1の不活性化がゲノム変異を抑制していたように,TOR複合体1の活性化の状態は細胞成長とストレスによるさまざまな細胞障害への対処という表裏一体の要求をバランスよく制御するのに重要であることが示唆された.熱ストレスによるストレス顆粒の形成は比較的高温においてみられ,顆粒形成の程度はストレスの大きさに依存して変動すると考えられる.熱ストレスの程度に応じたストレス顆粒の形成量とTOR複合体1の隔離とが同時に制御されることで,全体として細胞がうけた熱ストレスによる損傷にあわせTOR複合体1の再活性化のタイミングが制御され,結果として,“ゲノム変異を低頻度に保ちつつ,細胞成長を行うしくみ”として,今回,見い出されたTOR複合体1の活性制御機構は機能しているものと考えられる.
以上のように,この研究では,熱ストレスからの回復期におけるTOR複合体1の活性制御における新しい分子機構を提示した.しかしながら,熱ストレスの直後に起こるTOR複合体1の不活性化の分子機構については依然として不明であり,TOR複合体1の制御機構の全体像を明らかにするうえで,今後,明らかにすべき大きな課題である.また,これまでのTOR研究の歴史の示すとおり,TOR経路の制御と機能は進化をつうじてよく保存されており,出芽酵母において見い出されたこの制御機能が哺乳類にまで保存されている可能性についても検討する必要があるだろう.
略歴:2003年 東京大学大学院総合文化研究科博士課程 修了,2004年より東京大学分子細胞生物学研究所 研究員.
研究テーマ:TOR複合体1の活性制御機構.
関心事:TORネットワークがうまく統制を保つしくみと,その破綻が及ぼす影響.
前田 達哉(Tatsuya Maeda)
東京大学分子細胞生物学研究所 准教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/1KEN/
© 2012 高原照直・前田達哉 Licensed under CC 表示 2.1 日本
(東京大学分子細胞生物学研究所 膜蛋白質解析研究分野)
email:高原照直,前田達哉
DOI: 10.7875/first.author.2012.086
Transient sequestration of TORC1 into stress granules during heat stress.
Terunao Takahara, Tatsuya Maeda
Molecular Cell, 47, 242-252 (2012)
要 約
TOR複合体1は栄養源の量を検知して細胞の成長を制御する過程において中心的な役割をはたす,進化的に保存されたプロテインキナーゼ複合体である.栄養源の飢餓のほかにもさまざまなストレスによりその活性は低下することが判明している.しかしながら,個々のストレスに応答したTOR複合体1の活性制御機構についてはまったく不明であった.今回,筆者らは,出芽酵母Saccharomyces cerevisiaeにおいて熱ストレスのもとでのTOR複合体1の活性制御機構をはじめて明らかにした.熱ストレスのもとではTOR複合体1の細胞内における局在は大きく変わり,ストレス顆粒とよばれる細胞質の構造体へと隔離されていた.この隔離は,熱ストレスからの回復期においてTOR複合体1の再活性化のタイミングを制御しており,熱ストレスにより誘起されるゲノム変異を防いでいることが明らかになった.
はじめに
細胞は栄養飢餓,熱,浸透圧といったストレスに対したえず適切に対処しながら成長している.細胞の成長の制御には,進化的に保存されたプロテインキナーゼTOR(target of rapamycin)を触媒タンパク質としてもつシグナル伝達複合体,TOR複合体1(TOR complex 1:TORC1)が主要な役割をはたしている.TORの発見から20年近くたった現在,主要な入力シグナルと考えられるアミノ酸あるいは窒素源によるTOR複合体1の活性化におけるシグナル伝達経路は徐々に明らかになりつつあるが,TORの活性制御と生理機能の全貌の解明にはまだほど遠く,その解析は酵母から哺乳類にいたるさまざまな系において補完的に進められている.TOR複合体1の活性は栄養源の量だけでなく,種々のストレスによっても制御されていることが明らかにされ,さまざまな環境に適応しながら細胞の成長を成し遂げるうえで,TOR複合体1はシグナル伝達における重要なハブとして機能しているものと推察される1).しかしながら,個々のストレスがどのようにしてTOR複合体1の活性を制御し,また,TOR複合体1の活性制御を介した細胞の成長とストレス応答とがどのように処理されているかは,出芽酵母Saccharomyces cerevisiaeにおいてすらまったく不明であった(図1).
今回,筆者らは,出芽酵母において熱ストレスに応答したTOR複合体1の活性制御にストレス顆粒への隔離がかかわっていることを明らかにした.ストレス顆粒は種々のストレスにより形成される進化的に保存された細胞質の構造体で,主要な構成成分であるmRNA-翻訳開始因子複合体の凝集により細胞内においてはフォーカスとして観察できる2).哺乳類の細胞ではストレス顆粒の形成が細胞障害や細胞死に対する生理的な適応機構であることが報告されている.一方,出芽酵母においてはストレス顆粒が熱ストレスやグルコース飢餓に応答して形成されることは知られていたが,その構成成分の詳細や形成機構および形成の意義についての知見はほとんどなかった.今回の結果から,TOR複合体1のストレス顆粒への隔離とそれによる活性制御が,熱ストレスにより生じるゲノム変異を抑制する分子機構として機能していることが明らかになった.
1.TOR複合体1の新規の制御タンパク質の探索
TOR複合体1のもつ広範な役割から,その活性制御にかかわるタンパク質は多数あるものと推察されるが,判明している制御タンパク質の数は限られていた.そこで,新規のTOR複合体1制御タンパク質の同定をめざし,出芽酵母において遺伝学的なスクリーニングを行った.このスクリーニングには,筆者ら独自の材料である活性化型TOR複合体1を利用した.この活性化型TOR複合体1を発現する細胞は,外界の栄養源の量と細胞応答とのアンバランスから低栄養源において生育が困難となる.この生育不良を回復させるような遺伝子を探索した結果,TOR複合体1の負の制御タンパク質としてPbp1を同定した.このPbp1を過剰発現させるとTOR複合体1の阻害剤であるラパマイシンやカフェインに対し高感受性を示すことから,このときTOR複合体1の活性は低下していることが示唆された.さらに,細胞におけるTOR複合体1の活性を直接的に調べるため,その基質であるSch9に対する特異的な抗リン酸化抗体を作製し,Sch9のリン酸化の状態をモニターした.その結果,Pbp1の過剰発現にともないアミノ酸あるいは窒素源,または,グルコースなどの栄養源によるTOR複合体1の活性は抑制されていることが確認され,Pbp1の過剰発現はTOR複合体1の活性を阻害することがわかった.
2.Pbp1の過剰発現はTOR複合体1をストレス顆粒へとリクルートする
つぎの課題は,Pbp1の過剰発現がTOR複合体1の活性をどのように抑制しているかを明らかにすることであった.Pbp1の過剰発現によるTOR複合体1の活性の抑制は既知の上流制御タンパク質に依存しておらず,新たな分子機構あるいは経路を介するものであると考えられた.Pbp1はポリA結合タンパク質Pab1に対する結合タンパク質として同定されたが,その具体的な機能については未解明であり,Pbp1とTOR複合体1との関連を明らかにするまでには時間を費やした.
2010年に,Pbp1の過剰発現がストレス顆粒の形成をひき起こすことが報告され3),これを契機として,ストレス顆粒とTOR複合体1の局在との関連を検討しはじめた.出芽酵母のTOR複合体1は,哺乳類のものと同様に,おもに液胞膜(哺乳類のリソソームとの相同オルガネラ)の近傍に局在する(図1).この液胞膜への局在は液胞膜にアンカーされているEGO複合体とTOR複合体1との相互作用により維持されているものと考えられている4).EGO複合体はアミノ酸あるいは窒素源によるTOR複合体1の活性化に重要であり,この活性化は液胞膜の近傍において起こっているものと推察された.TOR複合体1の局在の観察により,Pbp1の過剰発現にともないTOR複合体1の液胞膜への局在が失われ,細胞内においてフォーカスを形成するようになることが見い出された.さらに,このTOR複合体1の形成するフォーカスは,Pbp1の過剰発現により誘導されるストレス顆粒と共局在していた.また,C末端からのさまざまな長さの欠失を導入した一連のPbp1変異体を用いた解析から,ストレス顆粒の形成能とTOR複合体1の活性抑制能とのあいだには相関が認められ,Pbp1の過剰発現はストレス顆粒を形成し,TOR複合体1を液胞膜の近傍からストレス顆粒へと隔離することでその活性を抑制していることが示唆された.
3.TOR複合体1は熱ストレスにより形成されるストレス顆粒に隔離される
出芽酵母においてストレス顆粒は,熱ストレス,グルコース飢餓,高エタノール濃度により形成されることが報告されている5-8).Pbp1の過剰発現という人為的な条件でみられたTOR複合体1の局在の変化が生理的な条件においても起こっているかどうかを調べるため,熱ストレスによりストレス顆粒を形成させたときのTOR複合体1の局在を観察した.その結果,TOR複合体1は熱ストレスにより液胞膜の近傍から離れ細胞質においてフォーカスを形成し,これらの多くはストレス顆粒と共局在していることがわかった(図2).また,ストレス顆粒の形成の阻害剤であるシクロヘキシミドによりあらかじめ処理したのち熱ストレスにさらすと,ストレス顆粒とともにTOR複合体1の形成するフォーカスも失われたことから,ストレス顆粒の形成に依存的にTOR複合体1のフォーカスは形成されることが示唆された.さらに,熱ストレスののちのストレス顆粒の消失とTOR複合体1の局在を経時的に観察すると,TOR複合体1の液胞膜の近傍への再局在とストレス顆粒の消失とは一致しており,ストレス顆粒が熱ストレスからの回復期においてTOR複合体1の局在を制御していることが示唆された.
4.ストレス顆粒へのTOR複合体1の隔離は熱ストレスののちの再活性化を遅らせる
ストレス顆粒によるTOR複合体1の局在の制御がTOR複合体1の活性化にあたえる影響について調べた.シクロヘキシミド処理によりストレス顆粒の形成を阻害しても,熱ストレスの直後に起こるTOR複合体1の不活性化に影響はなかった.対照的に,熱ストレスののちの回復期においては,ストレス顆粒の形成阻害によりTOR複合体1の再活性化は亢進した.このことは,ストレス顆粒へのTOR複合体1の隔離はその再活性化のタイミングを遅延するはたらきをもつことを示唆していた.そこで,熱ストレスのもとでもストレス顆粒に隔離されないTOR複合体1の変異体を作出して熱ストレスののちの再活性化について調べると,この変異体では予想どおり再活性化が早まっていた.
また,熱ストレスの前後でTOR複合体1のもつキナーゼ活性が変動するかどうかをin vitroキナーゼアッセイにより調べたところ,キナーゼ活性は低下していなかった.くわえて,活性化型TOR複合体1を発現する細胞においても,熱ストレスののちの再活性化のタイミングは野生株と同様であった.これらの結果から,ストレスののちのTOR複合体1の活性化においては,TOR複合体1のもつキナーゼ活性の制御ではなく,TOR複合体1のストレス顆粒への隔離による空間的な制御が主要であるものと考えられた.さらに,熱ストレスからの回復期においてストレス顆粒の消失速度の異なる変異株を同定し,これら変異体におけるTOR複合体1の再活性化について調べると,ストレス顆粒の消失速度にあわせて再活性化のタイミングも変化していた.これらの結果から,TOR複合体1の再活性化のタイミングは,ストレス顆粒の消失を介したTOR複合体1の局在の変化により制御されていることが強く示唆された.
5.ストレス顆粒の形成によるTOR複合体1の活性抑制は熱ストレスによるゲノム変異を抑制する
出芽酵母において,ストレス顆粒の形成の生理学的な意義はほとんどわかっていない.熱ストレスに誘導性のストレス顆粒がTOR複合体1の活性を制御しているという結果から,ストレス顆粒の形成がTOR複合体1の生理的な機能において重要な意義をもつことが推察された.そこで,熱ストレスにより生じる細胞障害とTOR複合体1の活性制御との関連を調べた.着目したのは,熱ストレスが活性酸素種の発生を昂進しゲノム変異を誘発するという報告であった9).TOR1破壊株やSCH9破壊株ではすでに加齢にともなうゲノム変異や活性酸素種による細胞死などに抵抗性を示すことが知られていた10,11).すなわち,TOR複合体1の活性の低下がさまざまな状況におけるゲノム変異を防ぐことに寄与している可能性から,熱ストレスによるストレス顆粒の形成と,それによるTOR複合体1の隔離を介した再活性化の抑制がゲノム変異を抑制しているのではないかと考えた.
そこで,ストレス顆粒の形成阻害により熱ストレスに依存的なゲノム変異は亢進するかどうかを,ゲノム変異の頻度の検出の容易なCAN1遺伝子座において調べた.シクロヘキシミド処理によりストレス顆粒の形成を阻害したのち,熱ストレスにさらすとゲノム変異の頻度は上昇した.シクロヘキシミドはタンパク質合成阻害剤として広く知られるが,対照としてストレス顆粒の形成を阻害しないタンパク質合成阻害剤ヒプリスタノールを用いて同様な実験を行ったときには,CAN1遺伝子座における変異の頻度は上昇しなかったことから,ストレス顆粒の形成阻害がゲノム変異の頻度の上昇をもたらしたものと考えられた.
このゲノム変異の頻度の上昇に,ストレス顆粒の形成を阻害したときに起こるTOR複合体1の早い再活性化が寄与しているかどうかを調べた.TOR複合体1の再活性化のタイミングをその阻害剤であるラパマイシンを作用させることで人為的に遅らせると,ストレス顆粒の形成阻害により頻度の上昇するゲノム変異は抑制された.さらに,Pbp1の過剰発現による人為的なストレス顆粒の形成も熱ストレスに依存的なゲノム変異を抑制することがわかった.これらの結果から,ストレス顆粒の形成とそれによるTOR複合体1の再活性化の遅延が熱ストレスによるゲノム変異を抑制しているものと考えられた(図2).
おわりに
今回,熱ストレスによる細胞の障害を防ぐ分子機構として,ストレス顆粒の形成を介したTOR複合体1の活性制御がかかわっていることを明らかにした.TOR複合体1-Sch9経路の不活性化がどのようにしてゲノム変異を抑制するのかは不明だが,可能性として,スーパーオキシドジスムターゼなどの亢進を介していることなどが考えられる.
TOR複合体1の活性化は細胞の成長を正に制御しており,良好な生育環境にある細胞の成長にとりTOR複合体1の活性化は望ましい.一方で,TOR複合体1の不活性化がゲノム変異を抑制していたように,TOR複合体1の活性化の状態は細胞成長とストレスによるさまざまな細胞障害への対処という表裏一体の要求をバランスよく制御するのに重要であることが示唆された.熱ストレスによるストレス顆粒の形成は比較的高温においてみられ,顆粒形成の程度はストレスの大きさに依存して変動すると考えられる.熱ストレスの程度に応じたストレス顆粒の形成量とTOR複合体1の隔離とが同時に制御されることで,全体として細胞がうけた熱ストレスによる損傷にあわせTOR複合体1の再活性化のタイミングが制御され,結果として,“ゲノム変異を低頻度に保ちつつ,細胞成長を行うしくみ”として,今回,見い出されたTOR複合体1の活性制御機構は機能しているものと考えられる.
以上のように,この研究では,熱ストレスからの回復期におけるTOR複合体1の活性制御における新しい分子機構を提示した.しかしながら,熱ストレスの直後に起こるTOR複合体1の不活性化の分子機構については依然として不明であり,TOR複合体1の制御機構の全体像を明らかにするうえで,今後,明らかにすべき大きな課題である.また,これまでのTOR研究の歴史の示すとおり,TOR経路の制御と機能は進化をつうじてよく保存されており,出芽酵母において見い出されたこの制御機能が哺乳類にまで保存されている可能性についても検討する必要があるだろう.
文 献
- Loewith, R. & Hall, M. N.: Target of rapamycin (TOR) in nutrient signaling and growth control. Genetics, 189, 1177-1201 (2011)[PubMed]
- Buchan, J. R. & Parker, R.: Eukaryotic stress granules: the ins and outs of translation. Mol. Cell, 36, 932-941 (2009)[PubMed]
- Swisher, K. D. & Parker, R.: Localization to, and effects of Pbp1, Pbp4, Lsm12, Dhh1, and Pab1 on stress granules in Saccharomyces cerevisiae. PLoS One, 5, e10006 (2010)[PubMed]
- Binda, M., Peli-Gulli, M. P., Bonfils, G. et al.: The Vam6 GEF controls TORC1 by activating the EGO complex. Mol. Cell, 35, 563-573 (2009)[PubMed]
- Hoyle, N. P., Castelli, L. M., Campbell, S. G.et al.: Stress-dependent relocalization of translationally primed mRNPs to cytoplasmic granules that are kinetically and spatially distinct from P-bodies. J. Cell. Biol., 179, 65-74 (2007)[PubMed]
- Buchan, J. R., Muhlrad, D. & Parker, R.: P bodies promote stress granule assembly in Saccharomyces cerevisiae. J. Cell. Biol., 183, 441-455 (2008)[PubMed]
- Grousl, T., Ivanov, P., Frydlova, I. et al.: Robust heat shock induces eIF2α-phosphorylation-independent assembly of stress granules containing eIF3 and 40S ribosomal subunits in budding yeast, Saccharomyces cerevisiae. J. Cell. Sci., 122, 2078-2088 (2009)[PubMed]
- Kato, K., Yamamoto, Y. & Izawa, S.: Severe ethanol stress induces assembly of stress granules in Saccharomyces cerevisiae. Yeast, 28, 339-347 (2011)[PubMed]
- Davidson, J. F. & Schiestl, R. H.: Mitochondrial respiratory electron carriers are involved in oxidative stress during heat stress in Saccharomyces cerevisiae. Mol. Cell. Biol., 21, 8483-8489 (2001)[PubMed]
- Fabrizio, P., Pozza, F., Pletcher, S. D. et al.: Regulation of longevity and stress resistance by Sch9 in yeast. Science, 292, 288-290 (2001)[PubMed]
- Madia, F., Wei, M., Yuan, V. et al.: Oncogene homologue Sch9 promotes age-dependent mutations by a superoxide and Rev1/Polζ-dependent mechanism. J. Cell. Biol., 186, 509-523 (2009)[PubMed]
著者プロフィール
略歴:2003年 東京大学大学院総合文化研究科博士課程 修了,2004年より東京大学分子細胞生物学研究所 研究員.
研究テーマ:TOR複合体1の活性制御機構.
関心事:TORネットワークがうまく統制を保つしくみと,その破綻が及ぼす影響.
前田 達哉(Tatsuya Maeda)
東京大学分子細胞生物学研究所 准教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/1KEN/
© 2012 高原照直・前田達哉 Licensed under CC 表示 2.1 日本