マウスの初期胚におけるBMPシグナルのパターンはVam2に依存するエンドサイトーシス経路により制御されている
和田戈虹1・和田 洋2
(1同志社女子大学薬学部 生化学研究室,2大阪大学産業科学研究所 生体分子機能科学研究分野)
email:和田戈虹
DOI: 10.7875/first.author.2012.072
Spatial restriction of bone morphogenetic protein signaling in mouse gastrula through the mVam2-dependent endocytic pathway.
Minako Aoyama, Ge-Hong Sun-Wada, Akitsugu Yamamoto, Masamichi Yamamoto, Hiroshi Hamada, Yoh Wada
Developmental Cell, 22, 1163-1175 (2012)
シグナル伝達経路において負の制御を欠損すると,組織や個体の恒常性を擾乱するような細胞増殖の異常な亢進,すなわち,がんの病態がもたらされる.エンドサイトーシス経路は活性化した受容体と細胞内のメディエーターとの隔離,そして,受容体の分解により,下流のシグナル伝達経路を負に制御するしくみとして理解されている.初期発生においては,比較的短い時間で進行することからシグナル伝達を積極的に終了させるような分子機構が重要であるものと思われるが,その実態は未解明であった.この研究は,後期エンドソームの膜融合装置の構成タンパク質であるVam2を欠損したマウスを用い,エンドソームのダイナミクスがBMPシグナルの活性を制御していることを明らかにした.
胚の形態形成は,TGFβ,FGF,Wntを含む多くのシグナルタンパク質により制御されている1).マウスの初期発生においては,FGFおよびチロシンキナーゼ型受容体はMAPキナーゼカスケードを活性化し,胚体および胚体外における分化を確立する.NodalとTGFβは胎仔の前後軸を確立する際に中心的な役割をはたす.Nodal,TGFβ,アクチビンはタイプIおよびタイプIIのセリン/スレオニンキナーゼ型受容体に結合し,タイプII受容体はタイプI受容体をリン酸化する.このリン酸化はタイプI受容体のもつキナーゼ活性を活性化し,それにより細胞質に存在する下流のトランスデューサーであるSmad2とSmad3のリン酸化が誘導される.同じくTGFβスーパーファミリーに属するBMP(bone morphogenetic protein,骨形成因子)は,TGFβとは異なる受容体をとおしてシグナルを伝達する.BMPの結合によりタイプII受容体はタイプI受容体をリン酸化し,それにより活性化されたタイプI受容体は,Smad1,Smad5,Smad8をリン酸化する2).リン酸化されたこれらのSmadはSmad4と複合体を形成し遺伝子発現を制御する.BMP-Smad1/Smad5/Smad8シグナル伝達経路は中胚葉の形成に必須であることが知られているが,最近,BMP,Nodal,アクチビンのシグナルのバランスが遠位臓側内胚葉の分化を制御することも報告されている3).
発生プログラムを制御する多彩なシグナル伝達経路の活性化と同様に,その適切な不活性化あるいはダウンレギュレーションもきわめて重要である.これまで,シグナルタンパク質のアンタゴニストによる負の制御が知られており,アンタゴニストの欠失による形態形成プログラムの阻害が報告されている.
後期エンドソームおよびリソソームは分解機能をもつオルガネラとして細胞の内外に由来する分子を分解する役割をはたしている.これらのコンパートメントの機能異常はリソソーム病とよばれる多面的な症状を示す遺伝性の疾患をひき起こす.また,後期エンドソームの欠陥に起因する免疫不全,白皮症,神経の異常などさまざまな疾患も遺伝的な解析から明らかになっている.しかしながら,初期発生におけるエンドサイトーシスの役割はほとんど明らかになっていない.
エンドサイトーシス経路はオルガネラの複合したネットワークである.出芽酵母における液胞の形成の研究から,液胞の構築にはHOPS(homotypic vacuole protein sorting)複合体が必須であることがわかっている4,5).その構成タンパク質のひとつVam2をもたない出芽酵母は大きな液胞を組み立てられず多数の小胞が蓄積してしまう.出芽酵母と哺乳動物とは進化的に離れているにもかかわらず,それらのあいだでVam2はよく保存されている.筆者らは,マウスVam2(mVam2)のノックアウトマウスを作製し,エンドサイトーシスが組織および個体のレベルではたす役割を解析した.
mVam2ホモノックアウトアウトマウスは胎生7日で発生を停止し,胎生9日には吸収されてしまった.一方,mVam2遺伝子のイントロンにloxP配列を導入した変異アレルは機能を保っており,そのホモ接合体においても明らかな表現型を示さなかった.そこで,この変異アレルをもつマウスの胎生12.5日の胚より胚性線維芽細胞の初代培養細胞を調製し,そこにCreリコンビナーゼを発現するアデノウイルスを感染させることで,mVam2をホモで欠損する胚性線維芽細胞を作製した.リコンビナーゼを発現するアデノウイルスの感染ののち4日でmVam2タンパク質は検出限界以下となった.
このmVam2欠損細胞では,後期エンドソームのマーカータンパク質Rab7,また,リソソームのマーカータンパク質Lamp2の細胞における局在は野生型の細胞と顕著に異なっていたのに対し,初期エンドソームのマーカーであるSNX1,EEA1,Rab5の分布には野生型の細胞との差が認められなかった.この結果から,mVam2は後期エンドソームの構築に必要であることが示された.
胎生6.2日のmVam2ノックアウトマウスの胚では,臓側内胚葉細胞において頂端液胞とよばれる大きなリソソームが形成されず,これは多数の小胞に断片化していた.エンドサイトーシスのマーカーを用いた細胞内輸送の追跡実験により,エンドサイトーシスの初期過程(取り込み)は正常だが,そののちのリソソームへの輸送がほとんど起こっていないことが示された.
マウスの胚発生では,臓側内胚葉,エピブラスト,胚体外外胚葉など,分化した上皮組織が互いにシグナルタンパク質を介して細胞増殖と形態形成を制御している.mVam2ノックアウトマウスの胚は原腸陥入の時期において正常な胚とは明らかに異なる形態を示し,臓側内胚葉の細胞形態は円柱状になっていた.胎生7日には予定神経領域の外胚葉において顕著な細胞死が観察された.このような表現型は,BMPシグナル,Wntシグナル,TGFβシグナル,あるいは,その下流に異常をもつことを示唆していた.さまざまな組織マーカーを用いて観察した結果,mVam2を欠損した胚では,前後軸は確立していて中胚葉組織はほぼ正確な位置に誘導されていたが,そののち,胚体外中胚葉はよく発達するものの胚体中胚葉の形成が著しく阻害され,神経外胚葉が形成されないことがわかった.
mVam2欠損細胞ではBMPおよびBMP受容体は細胞表層から初期エンドソームへと移行したのちに分解されず,長い時間にわたり細胞に存在することがわかった.mVam2を欠損した胚性線維芽細胞を培養し,低血清培地において休止状態としたのち,TGFβ,BMP4,EGFによる刺激をあたえ,ふたたび低血清培地に置き換えた.時間をおってサンプリングして細胞抽出液を調製し,イムノブロッティング法によりSmad2/Smad3,Smad1/Smad5,p42/p44のリン酸化体を定量した.mVam2欠損細胞ではBMPの刺激に対しSmad1/Smad5のリン酸化が高いレベルに達し持続していたことから,速いキネティクスを示すシグナルの抑制はできないことが明らかになった.それに対し,EGF,TGFβ,アクチビンのシグナルは野生型の細胞とmVam2欠損細胞とにおいて同一のキネティクスをもって減衰したことから,mVam2はBMPシグナルの抑制に選択的に機能しているものと考えられた.mVam2とBMP受容体との相互作用を解析した結果,それらのタンパク質レベルでの相互作用も確認された.
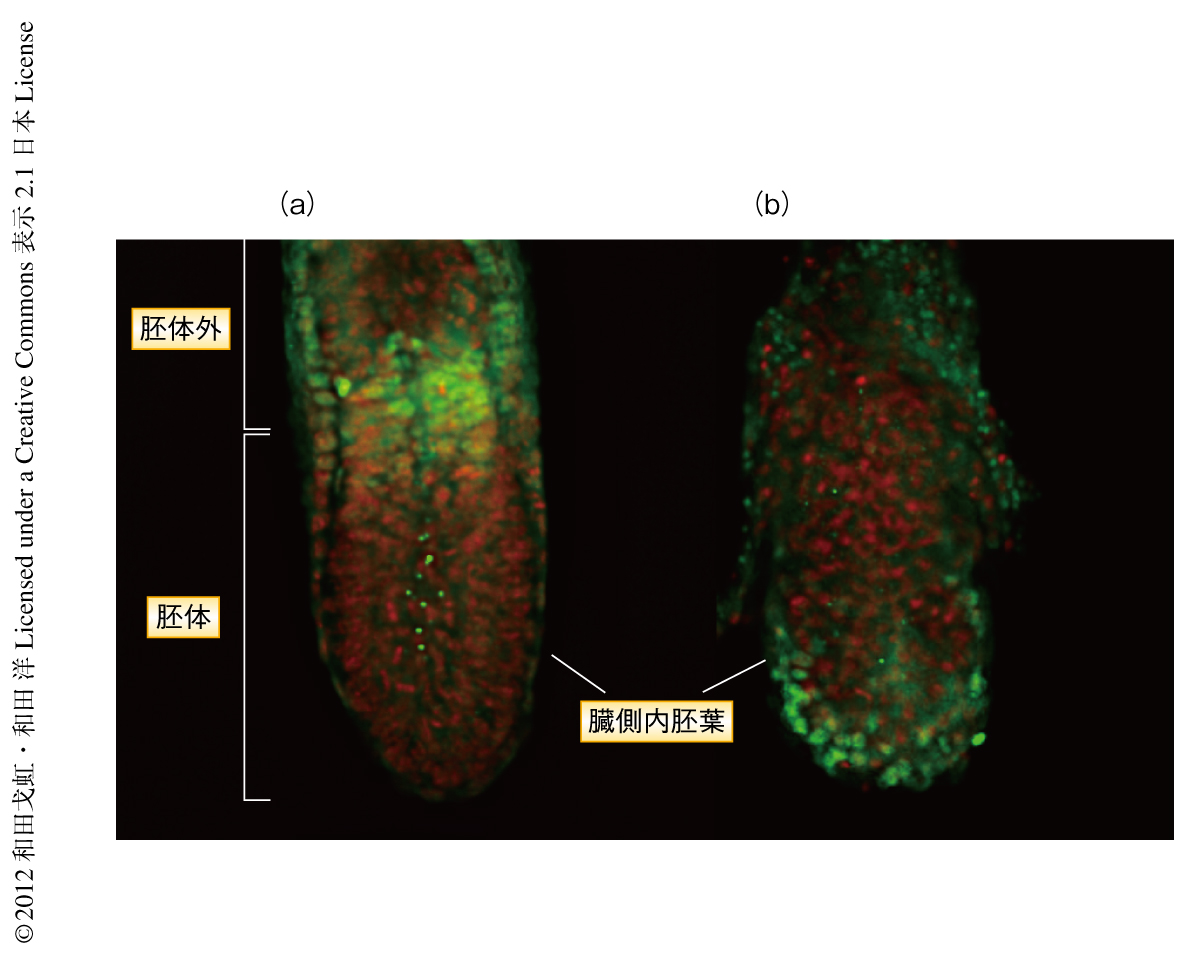
さらに,前原腸胚の形成の段階におけるBMPシグナルを調べたところ,野生型の胚では遠位と近位とにおけるBMP活性の差が胎生6.0日において形成されているのに対し,mVam2欠損胚では胚の全体においてBMPシグナルが活性化されており,胚性線維芽細胞においてみられたBMPシグナルの抑制の異常が,胚におけるシグナル活性パターンに制御異常を起こしていることが明らかになった(図1).
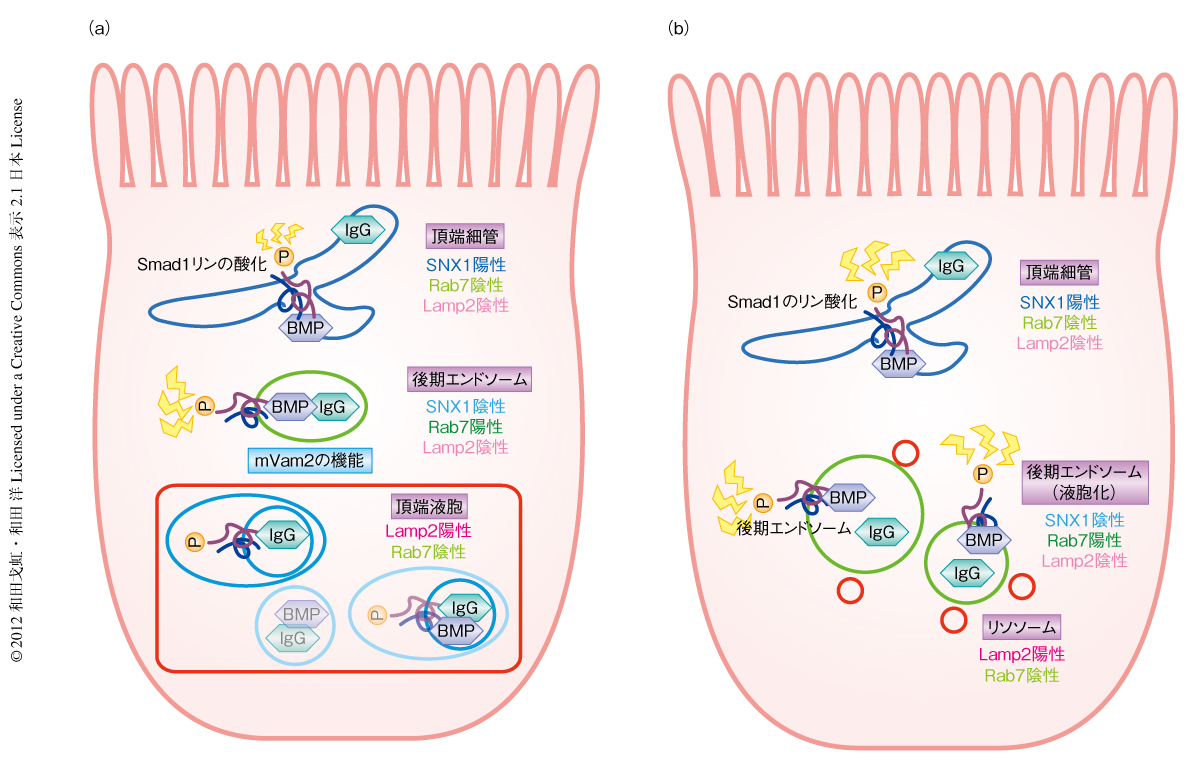
この研究において,筆者らは,エンドサイトーシス経路の後期のステージにおける機能障害が初期発生の異常をもたらすことを示した.臓側内胚葉細胞の頂端液胞において,シグナル伝達タンパク質の隔離および分解はシグナル伝達の活性化している時間と範囲の決定に密接に関与しており,哺乳類のHOPSサブユニットはこの頂端液胞を構築するのに必須な役割をもつ.mVam2変異細胞は活性化された受容体をオルガネラに隔離できず,下流のシグナルタンパク質の持続的な活性化をもたらす結果,BMPシグナルが長期にわたり広汎な場所で活性化されてしまう(図2).
原腸胚の形成にさきだち,遠位臓側内胚葉とよばれる細胞が分化する.BMPは胎生4.5日での原始内胚葉から臓側内胚葉の分化にとり不可欠である.しかし,遠位臓側内胚葉の分化はBMPにより抑制される.したがって,胎生4.5日から胎生5.5日までの短期間に,原始内胚葉から臓側内胚葉を構成しさらに遠位臓側内胚葉を確立するには,BMPシグナルをダイナミックに制御する必要がある.筆者らは,BMP受容体のエンドサイトーシスがこの制御を担う機構の一部であると考えている.
BMPシグナル経路およびほかのシグナル伝達経路は,組織の構築,腫瘍の発生と増殖,骨に関連する疾病,さらには,幹細胞の維持と分化など,多彩な機能に関連している.これらの生理機能,さらには,その破綻に起因する病態生理の理解において,シグナル伝達を負に制御する分子機構としてのエンドサイトーシスは新しい視点を提供すると考えている.
同志社女子大学薬学部 教授.
和田 洋(Yoh Wada)
大阪大学産業科学研究所 准教授.
© 2012 和田戈虹・和田 洋 Licensed under CC 表示 2.1 日本
(1同志社女子大学薬学部 生化学研究室,2大阪大学産業科学研究所 生体分子機能科学研究分野)
email:和田戈虹
DOI: 10.7875/first.author.2012.072
Spatial restriction of bone morphogenetic protein signaling in mouse gastrula through the mVam2-dependent endocytic pathway.
Minako Aoyama, Ge-Hong Sun-Wada, Akitsugu Yamamoto, Masamichi Yamamoto, Hiroshi Hamada, Yoh Wada
Developmental Cell, 22, 1163-1175 (2012)
要 約
シグナル伝達経路において負の制御を欠損すると,組織や個体の恒常性を擾乱するような細胞増殖の異常な亢進,すなわち,がんの病態がもたらされる.エンドサイトーシス経路は活性化した受容体と細胞内のメディエーターとの隔離,そして,受容体の分解により,下流のシグナル伝達経路を負に制御するしくみとして理解されている.初期発生においては,比較的短い時間で進行することからシグナル伝達を積極的に終了させるような分子機構が重要であるものと思われるが,その実態は未解明であった.この研究は,後期エンドソームの膜融合装置の構成タンパク質であるVam2を欠損したマウスを用い,エンドソームのダイナミクスがBMPシグナルの活性を制御していることを明らかにした.
はじめに
胚の形態形成は,TGFβ,FGF,Wntを含む多くのシグナルタンパク質により制御されている1).マウスの初期発生においては,FGFおよびチロシンキナーゼ型受容体はMAPキナーゼカスケードを活性化し,胚体および胚体外における分化を確立する.NodalとTGFβは胎仔の前後軸を確立する際に中心的な役割をはたす.Nodal,TGFβ,アクチビンはタイプIおよびタイプIIのセリン/スレオニンキナーゼ型受容体に結合し,タイプII受容体はタイプI受容体をリン酸化する.このリン酸化はタイプI受容体のもつキナーゼ活性を活性化し,それにより細胞質に存在する下流のトランスデューサーであるSmad2とSmad3のリン酸化が誘導される.同じくTGFβスーパーファミリーに属するBMP(bone morphogenetic protein,骨形成因子)は,TGFβとは異なる受容体をとおしてシグナルを伝達する.BMPの結合によりタイプII受容体はタイプI受容体をリン酸化し,それにより活性化されたタイプI受容体は,Smad1,Smad5,Smad8をリン酸化する2).リン酸化されたこれらのSmadはSmad4と複合体を形成し遺伝子発現を制御する.BMP-Smad1/Smad5/Smad8シグナル伝達経路は中胚葉の形成に必須であることが知られているが,最近,BMP,Nodal,アクチビンのシグナルのバランスが遠位臓側内胚葉の分化を制御することも報告されている3).
発生プログラムを制御する多彩なシグナル伝達経路の活性化と同様に,その適切な不活性化あるいはダウンレギュレーションもきわめて重要である.これまで,シグナルタンパク質のアンタゴニストによる負の制御が知られており,アンタゴニストの欠失による形態形成プログラムの阻害が報告されている.
後期エンドソームおよびリソソームは分解機能をもつオルガネラとして細胞の内外に由来する分子を分解する役割をはたしている.これらのコンパートメントの機能異常はリソソーム病とよばれる多面的な症状を示す遺伝性の疾患をひき起こす.また,後期エンドソームの欠陥に起因する免疫不全,白皮症,神経の異常などさまざまな疾患も遺伝的な解析から明らかになっている.しかしながら,初期発生におけるエンドサイトーシスの役割はほとんど明らかになっていない.
エンドサイトーシス経路はオルガネラの複合したネットワークである.出芽酵母における液胞の形成の研究から,液胞の構築にはHOPS(homotypic vacuole protein sorting)複合体が必須であることがわかっている4,5).その構成タンパク質のひとつVam2をもたない出芽酵母は大きな液胞を組み立てられず多数の小胞が蓄積してしまう.出芽酵母と哺乳動物とは進化的に離れているにもかかわらず,それらのあいだでVam2はよく保存されている.筆者らは,マウスVam2(mVam2)のノックアウトマウスを作製し,エンドサイトーシスが組織および個体のレベルではたす役割を解析した.
1.mVam2は後期エンドソームおよびリソソームの形成に必要である
mVam2ホモノックアウトアウトマウスは胎生7日で発生を停止し,胎生9日には吸収されてしまった.一方,mVam2遺伝子のイントロンにloxP配列を導入した変異アレルは機能を保っており,そのホモ接合体においても明らかな表現型を示さなかった.そこで,この変異アレルをもつマウスの胎生12.5日の胚より胚性線維芽細胞の初代培養細胞を調製し,そこにCreリコンビナーゼを発現するアデノウイルスを感染させることで,mVam2をホモで欠損する胚性線維芽細胞を作製した.リコンビナーゼを発現するアデノウイルスの感染ののち4日でmVam2タンパク質は検出限界以下となった.
このmVam2欠損細胞では,後期エンドソームのマーカータンパク質Rab7,また,リソソームのマーカータンパク質Lamp2の細胞における局在は野生型の細胞と顕著に異なっていたのに対し,初期エンドソームのマーカーであるSNX1,EEA1,Rab5の分布には野生型の細胞との差が認められなかった.この結果から,mVam2は後期エンドソームの構築に必要であることが示された.
2.mVam2は初期発生に必要である
胎生6.2日のmVam2ノックアウトマウスの胚では,臓側内胚葉細胞において頂端液胞とよばれる大きなリソソームが形成されず,これは多数の小胞に断片化していた.エンドサイトーシスのマーカーを用いた細胞内輸送の追跡実験により,エンドサイトーシスの初期過程(取り込み)は正常だが,そののちのリソソームへの輸送がほとんど起こっていないことが示された.
マウスの胚発生では,臓側内胚葉,エピブラスト,胚体外外胚葉など,分化した上皮組織が互いにシグナルタンパク質を介して細胞増殖と形態形成を制御している.mVam2ノックアウトマウスの胚は原腸陥入の時期において正常な胚とは明らかに異なる形態を示し,臓側内胚葉の細胞形態は円柱状になっていた.胎生7日には予定神経領域の外胚葉において顕著な細胞死が観察された.このような表現型は,BMPシグナル,Wntシグナル,TGFβシグナル,あるいは,その下流に異常をもつことを示唆していた.さまざまな組織マーカーを用いて観察した結果,mVam2を欠損した胚では,前後軸は確立していて中胚葉組織はほぼ正確な位置に誘導されていたが,そののち,胚体外中胚葉はよく発達するものの胚体中胚葉の形成が著しく阻害され,神経外胚葉が形成されないことがわかった.
3.mVam2を欠損した細胞ではBMPシグナル伝達系が異常に亢進する
mVam2欠損細胞ではBMPおよびBMP受容体は細胞表層から初期エンドソームへと移行したのちに分解されず,長い時間にわたり細胞に存在することがわかった.mVam2を欠損した胚性線維芽細胞を培養し,低血清培地において休止状態としたのち,TGFβ,BMP4,EGFによる刺激をあたえ,ふたたび低血清培地に置き換えた.時間をおってサンプリングして細胞抽出液を調製し,イムノブロッティング法によりSmad2/Smad3,Smad1/Smad5,p42/p44のリン酸化体を定量した.mVam2欠損細胞ではBMPの刺激に対しSmad1/Smad5のリン酸化が高いレベルに達し持続していたことから,速いキネティクスを示すシグナルの抑制はできないことが明らかになった.それに対し,EGF,TGFβ,アクチビンのシグナルは野生型の細胞とmVam2欠損細胞とにおいて同一のキネティクスをもって減衰したことから,mVam2はBMPシグナルの抑制に選択的に機能しているものと考えられた.mVam2とBMP受容体との相互作用を解析した結果,それらのタンパク質レベルでの相互作用も確認された.
さらに,前原腸胚の形成の段階におけるBMPシグナルを調べたところ,野生型の胚では遠位と近位とにおけるBMP活性の差が胎生6.0日において形成されているのに対し,mVam2欠損胚では胚の全体においてBMPシグナルが活性化されており,胚性線維芽細胞においてみられたBMPシグナルの抑制の異常が,胚におけるシグナル活性パターンに制御異常を起こしていることが明らかになった(図1).
おわりに
この研究において,筆者らは,エンドサイトーシス経路の後期のステージにおける機能障害が初期発生の異常をもたらすことを示した.臓側内胚葉細胞の頂端液胞において,シグナル伝達タンパク質の隔離および分解はシグナル伝達の活性化している時間と範囲の決定に密接に関与しており,哺乳類のHOPSサブユニットはこの頂端液胞を構築するのに必須な役割をもつ.mVam2変異細胞は活性化された受容体をオルガネラに隔離できず,下流のシグナルタンパク質の持続的な活性化をもたらす結果,BMPシグナルが長期にわたり広汎な場所で活性化されてしまう(図2).
原腸胚の形成にさきだち,遠位臓側内胚葉とよばれる細胞が分化する.BMPは胎生4.5日での原始内胚葉から臓側内胚葉の分化にとり不可欠である.しかし,遠位臓側内胚葉の分化はBMPにより抑制される.したがって,胎生4.5日から胎生5.5日までの短期間に,原始内胚葉から臓側内胚葉を構成しさらに遠位臓側内胚葉を確立するには,BMPシグナルをダイナミックに制御する必要がある.筆者らは,BMP受容体のエンドサイトーシスがこの制御を担う機構の一部であると考えている.
BMPシグナル経路およびほかのシグナル伝達経路は,組織の構築,腫瘍の発生と増殖,骨に関連する疾病,さらには,幹細胞の維持と分化など,多彩な機能に関連している.これらの生理機能,さらには,その破綻に起因する病態生理の理解において,シグナル伝達を負に制御する分子機構としてのエンドサイトーシスは新しい視点を提供すると考えている.
文 献
- Hamada, H., Meno, C., Watanabe, D. et al.: Establishment of vertebrate left-right asymmetry. Nat. Rev. Genet., 3, 103-113 (2002)[PubMed]
- Miyazono, K., Maeda, S. & Imamura, T.: BMP receptor signaling: transcriptional targets, regulation of signals, and signaling cross-talk. Cytokine Growth Factor Rev., 16, 251-263 (2005)[PubMed]
- Yamamoto, M., Beppu, H., Takaoka, K. et al.: Antagonism between Smad1 and Smad2 signaling determines the site of distal visceral endoderm formation in the mouse embryo. J. Cell Biol., 184, 323-334 (2009)[PubMed]
- Wada, Y., Ohsumi, Y. & Anraku, Y.: Genes for directing vacuolar morphogenesis in Saccharomyces cerevisiae. I. Isolation and characterization of two classes of vam mutants. J. Biol. Chem., 267, 18665-18670 (1992)[PubMed]
- Nakamura, N., Hirata, A., Ohsumi, Y. et al.: Vam2/Vps41p and Vam6/Vps39p are components of a protein complex on the vacuolar membranes and involved in the vacuolar assembly in the yeast, Saccharomyces cerevisiae. J. Biol. Chem., 272, 11344-11349 (1997)[PubMed]
著者プロフィール
同志社女子大学薬学部 教授.
和田 洋(Yoh Wada)
大阪大学産業科学研究所 准教授.
© 2012 和田戈虹・和田 洋 Licensed under CC 表示 2.1 日本