ウイルスによるmiR-196aの遺伝子導入はCELF2の発現抑制を介し球脊髄性筋萎縮症の表現型を改善する
宮崎 雄・祖父江 元
(名古屋大学大学院医学系研究科 神経内科学)
email:祖父江 元
DOI: 10.7875/first.author.2012.073
Viral delivery of miR-196a ameliorates the SBMA phenotype via the silencing of CELF2.
Yu Miyazaki, Hiroaki Adachi, Masahisa Katsuno, Makoto Minamiyama, Yue-Mei Jiang, Zhe Huang, Hideki Doi, Shinjiro Matsumoto, Naohide Kondo, Madoka Iida, Genki Tohnai, Fumiaki Tanaka, Shin-ichi Muramatsu, Gen Sobue
Nature Medicine, 18, 1136-1141 (2012)
球脊髄性筋萎縮症はアンドロゲン受容体のもつポリグルタミン鎖の異常伸長によりひき起こされる遺伝性の神経変性疾患であり,近位筋の萎縮,筋力の低下,線維束性収縮,および,球麻痺などの症状を示す.マイクロRNAは小分子の非コードRNAのひとつで,動物および植物において遺伝子発現の重要な制御因子となる.最近の研究から,特定のマイクロRNAが病態を修飾する強力な因子となることが示され,マイクロRNAの代謝経路を標的とする治療アプローチの可能性が注目をあつめている.この研究では,アデノ随伴ウイルスベクターを介した特定のマイクロRNAの遺伝子導入による球脊髄性筋萎縮症の新規の治療アプローチを報告した.筆者らは,マイクロRNAのひとつmiR-196aがCELF2の発現を抑制することにより,アンドロゲン受容体をコードするmRNAの分解を亢進することを見い出した.CELF2はアンドロゲン受容体mRNAに直接に作用しその安定性を高めていた.アデノ随伴ウイルスベクターを用いたmiR-196aの遺伝子導入は,マウスモデルにおける球脊髄性筋萎縮症の表現型を改善した.この結果は,疾患に特異的なマイクロRNAの遺伝子導入がほかの神経変性疾患の治療においても有用である可能性を強力な証拠をもって示した.
球脊髄性筋萎縮症(spinal-bulbar muscular atrophy:SBMA)は遺伝性の神経変性疾患のひとつであり,アンドロゲン受容体遺伝子のエキソン1に存在するCAGリピートの数が異常に伸長するポリグルタミン病でもある1,2).球脊髄性筋萎縮症はアンドロゲンに依存した表現型を示し,四肢の筋萎縮,筋力の低下,および,球麻痺などの症状を主徴とする3).これらの症状については,異常なアンドロゲン受容体がニューロンにおいて不溶化した凝集体を形成し神経変性をきたすことで出現するという機序が知られている.筆者らの研究室は,2002年,球脊髄性筋萎縮症のモデルとなるトランスジェニックマウスを作製し,抗アンドロゲン療法をはじめとしたさまざまな治療法を開発してきた.
マイクロRNA(microRNA:miRNA)は標的となるmRNAの3’側非翻訳領域に相補的に結合しその発現を抑制する4).近年,数々のマイクロRNAが神経変性疾患の病態の形成において重要な役割をはたすことが明らかとなり注目されている5-8).また,これらのマイクロRNAの遺伝子導入により,病態形成因子の発現を抑制し表現型を改善させる試みが広く行われている9,10).今回,筆者らは,球脊髄性筋萎縮症モデルとなるトランスジェニックマウスにおいてその脊髄で高発現するマイクロRNAを同定し,球脊髄性筋萎縮症の病態の形成における役割を検討した.
球脊髄性筋萎縮症モデルとなるトランスジェニックマウスにおいてはアンドロゲン受容体遺伝子のエキソン1に存在するCAGリピートの数が97と異常に伸長しており,生化学的および病理学的な検討において球脊髄性筋萎縮症の病態を反映していることが確認されている.一方,対照としたマウスのCAGリピートの数は24であり,野生型マウスと比較した場合にも特異的な神経症状は認められない.
はじめに,病態進行期の球脊髄性筋萎縮症モデルマウスの脊髄において高発現を認めるマイクロRNAをマイクロアレイ解析により同定した.病態進行期の球脊髄性筋萎縮症モデルマウスの脊髄において,対照としたマウスと比較して2倍以上の発現上昇を示したマイクロRNAはmiR-196a,miR-196b,miR-496,miR-323-3p,miR-29b*であった.CAGリピートの数が24の野生型アンドロゲン受容体,あるいは,CAGリピートの数が97の変異型アンドロゲン受容体を一過性に強制発現させる培養細胞モデルにおいて,これらのマイクロRNAのうちmiR-196aとmiR-196bはmRNAレベルおよびタンパク質レベルにおいてアンドロゲン受容体の発現を抑制した.これらの抑制効果は野生型および変異型アンドロゲン受容体の両方にみられた.この培養細胞モデルにおいては,野生型および変異型とも,そのcDNAから作製したプラスミドDNAを導入して発現させているため,これらから合成されるアンドロゲン受容体mRNAは3’側非翻訳領域をもたない.このことから,miR-196aやmiR-196bが直接的な相補性によりアンドロゲン受容体mRNAに作用することはないといえた.アクチノマイシンDを用いたRNA安定化アッセイを行ったところ,miR-196aおよびmiR-196bはアンドロゲン受容体mRNAの安定性を減弱して分解に導いていることが判明した.この結果より,miR-196aとmiR-196bはアンドロゲン受容体mRNAの安定化に寄与する因子の発現を抑制することでこれを分解に導いているものと推測した.
バイオインフォマティクスのプログラムTargetscan 6.0によると,miR-196aおよびmiR-196bの標的となりうるmRNAはそれぞれ200種類近く存在した.これらのmRNAのうちmiR-196aとmiR-196bに対し共通の相補鎖をもつ遺伝子にコードされるCELF2(CUGBP, Elav-like family member 2)に着目した.実際に,培養細胞モデルにおいてもCELF2の発現はmiR-196aおよびmiR-196bにより抑制されていた.培養細胞モデルにおいてsiRNAによりCELF2の発現をノックダウンすると,アンドロゲン受容体のmRNAレベルおよびタンパク質レベルでの発現も抑制された.そして,これらの抑制効果は,siRNAに抵抗性をもつCELF2遺伝子の一過性の強制発現により消失することもわかった.また,CELF2の一過性の強制発現により野生型および変異型のアンドロゲン受容体は,mRNAレベルおよびタンパク質レベルにおいて発現の上昇を認めた.さらに,RNA安定化アッセイによりアンドロゲン受容体mRNAの安定性にはCELF2が必要であることが判明した.
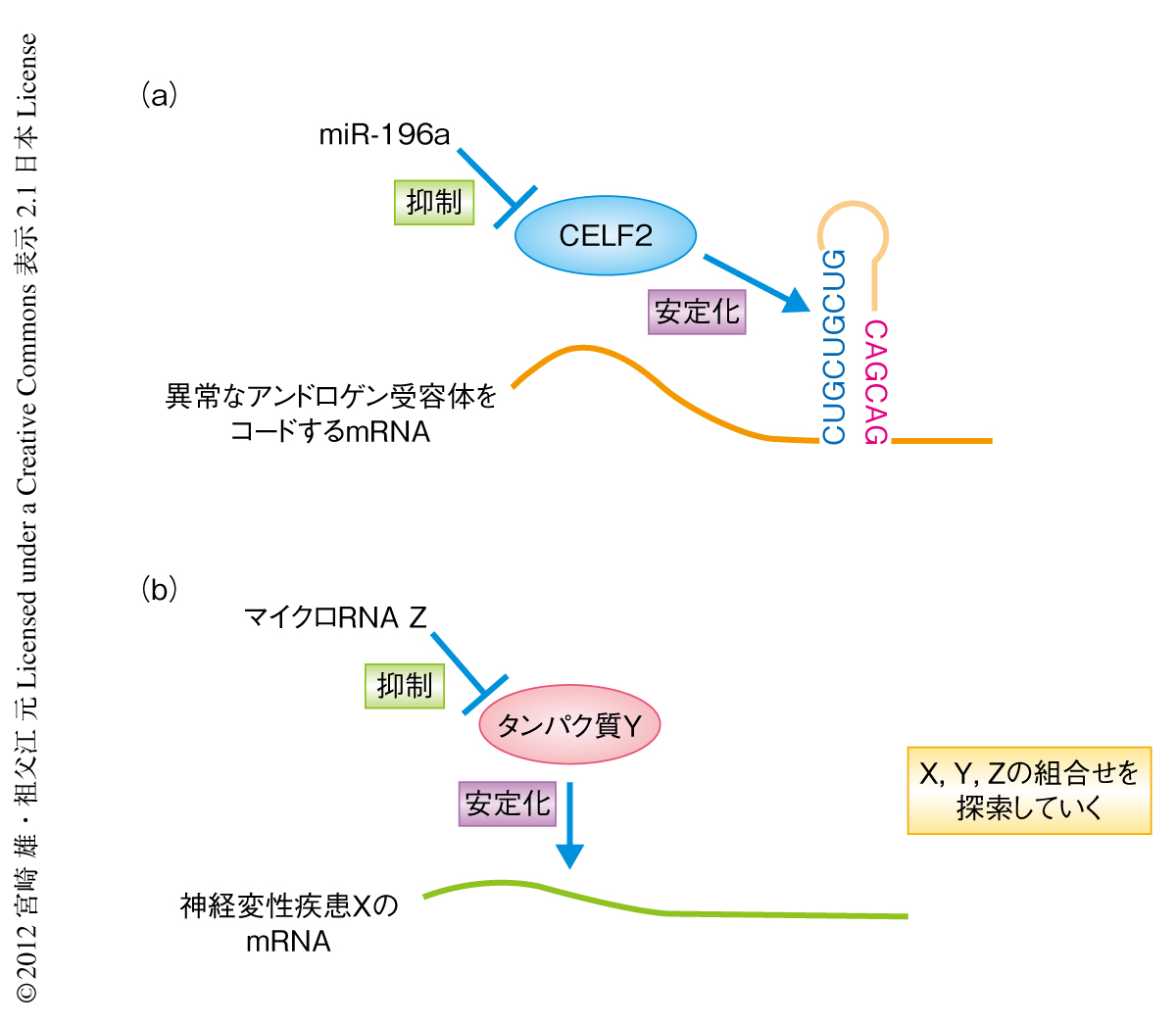
これらの結果をふまえ,CELF2がアンドロゲン受容体mRNAのどの領域に作用するのかを検討した.アンドロゲン受容体mRNAのエキソン1に存在するCAGリピートはヘアピン構造をとるが,これに隣接するくり返し配列CUGCUGCUGに注目した.このくり返し配列を欠損した遺伝子およびCAGリピートをすべて欠損した遺伝子を作製した.CELF2の一過性の強制発現により,CAGリピートをすべて欠損したアンドロゲン受容体はmRNAレベルおよびタンパク質レベルともに発現の上昇を認めたが,CUGCUGCUG配列を欠損したアンドロゲン受容体は,CAGリピートの数が24のものおよびCAGリピートの数が97のもののいずれも,アンドロゲン受容体の発現の上昇がみられなかった.また,抗CELF2抗体による免疫沈降を併用したRT-PCR法により,CELF2とCUGCUGCUG配列との結合を確認した.以上より,miR-196aおよびmiR-196bはCELF2の発現を抑制することにより間接的にアンドロゲン受容体をコードするmRNAの分解を促進し,その結果,アンドロゲン受容体タンパク質の発現を抑制するという機序が導き出された(図1).
in vivoにおけるCELF2を介したアンドロゲン受容体の発現抑制の効果を検討するため,miR-196aと蛍光タンパク質GFPとの融合タンパク質を発現するアデノ随伴ウイルスベクターを作製し,5週齢の球脊髄性筋萎縮症モデルとなるトランスジェニックマウスの下肢筋肉に投与した.投与されたアデノ随伴ウイルスは血行性に全身へ播種し,中枢神経系に効率よく感染し遺伝子導入が起こった.遺伝子導入はGFPの発現により確認した.対照となるアデノ随伴ウイルスと比較して,miR-196aを組み込んだアデノ随伴ウイルスを投与したトランスジェニックモデルマウスでは運動機能,生存率,体重増加など表現型の有意な改善がみられ,病理学的な検討においても異常なアンドロゲン受容体の蓄積や神経原性の筋萎縮,ならびに,神経変性を反映した反応性グリオーシスの点において有意な改善を認めた.miR-196aを組み込んだアデノ随伴ウイルスを投与したトランスジェニックモデルマウスでは,脊髄および筋肉においてmiR-196aの発現が有意に上昇し,CELF2および異常なアンドロゲン受容体の発現を抑制する効果がmRNAレベルおよびタンパク質レベルにおいて確認された.また,これらの遺伝子発現は15週間の観察期間において効果の持続が確認された.さらに,異常なアンドロゲン受容体の発現抑制の効果は,トランスジェニックモデルマウスの血清テストステロン値の変動によらないこと,および,球脊髄性筋萎縮症の患者の線維芽細胞を用いた実験でも同様にみられることが明らかになった.
CELF2はアンドロゲン受容体をコードするmRNAのエキソン1にあるCUGCUGCUG配列に結合しこれを安定化させている.miR-196aは3’非翻訳領域にその相補領域をもつCELF2をコードするmRNAの発現を抑制し,アンドロゲン受容体をコードするmRNAの分解を促進することによりアンドロゲン受容体タンパク質の発現を抑制し,球脊髄性筋萎縮症の病態を改善する(図1).動物モデルに対しては,miR-196aを発現するアデノ随伴ウイルスを投与することで恒常的なアンドロゲン受容体の発現の抑制を実現することができた.神経変性疾患において,病態形成に機能するタンパク質をコードするmRNAと反応するタンパク質の発現をマイクロRNAにより抑制するという方法についてはいまだ報告がなく,マイクロRNAを組み込んだアデノ随伴ウイルスによる遺伝子治療が神経変性疾患の新規で有効な治療法の選択肢となることが示唆された(図2).
略歴:名古屋大学大学院医学研究科博士課程 在学中.
研究テーマ:ポリグルタミン病の治療法の開発.
関心事:神経変性疾患に対するRNAiを用いた治療法の開発.
祖父江 元(Sobue Gen)
名古屋大学大学院医学系研究科 教授.
© 2012 宮崎 雄・祖父江 元 Licensed under CC 表示 2.1 日本
(名古屋大学大学院医学系研究科 神経内科学)
email:祖父江 元
DOI: 10.7875/first.author.2012.073
Viral delivery of miR-196a ameliorates the SBMA phenotype via the silencing of CELF2.
Yu Miyazaki, Hiroaki Adachi, Masahisa Katsuno, Makoto Minamiyama, Yue-Mei Jiang, Zhe Huang, Hideki Doi, Shinjiro Matsumoto, Naohide Kondo, Madoka Iida, Genki Tohnai, Fumiaki Tanaka, Shin-ichi Muramatsu, Gen Sobue
Nature Medicine, 18, 1136-1141 (2012)
要 約
球脊髄性筋萎縮症はアンドロゲン受容体のもつポリグルタミン鎖の異常伸長によりひき起こされる遺伝性の神経変性疾患であり,近位筋の萎縮,筋力の低下,線維束性収縮,および,球麻痺などの症状を示す.マイクロRNAは小分子の非コードRNAのひとつで,動物および植物において遺伝子発現の重要な制御因子となる.最近の研究から,特定のマイクロRNAが病態を修飾する強力な因子となることが示され,マイクロRNAの代謝経路を標的とする治療アプローチの可能性が注目をあつめている.この研究では,アデノ随伴ウイルスベクターを介した特定のマイクロRNAの遺伝子導入による球脊髄性筋萎縮症の新規の治療アプローチを報告した.筆者らは,マイクロRNAのひとつmiR-196aがCELF2の発現を抑制することにより,アンドロゲン受容体をコードするmRNAの分解を亢進することを見い出した.CELF2はアンドロゲン受容体mRNAに直接に作用しその安定性を高めていた.アデノ随伴ウイルスベクターを用いたmiR-196aの遺伝子導入は,マウスモデルにおける球脊髄性筋萎縮症の表現型を改善した.この結果は,疾患に特異的なマイクロRNAの遺伝子導入がほかの神経変性疾患の治療においても有用である可能性を強力な証拠をもって示した.
はじめに
球脊髄性筋萎縮症(spinal-bulbar muscular atrophy:SBMA)は遺伝性の神経変性疾患のひとつであり,アンドロゲン受容体遺伝子のエキソン1に存在するCAGリピートの数が異常に伸長するポリグルタミン病でもある1,2).球脊髄性筋萎縮症はアンドロゲンに依存した表現型を示し,四肢の筋萎縮,筋力の低下,および,球麻痺などの症状を主徴とする3).これらの症状については,異常なアンドロゲン受容体がニューロンにおいて不溶化した凝集体を形成し神経変性をきたすことで出現するという機序が知られている.筆者らの研究室は,2002年,球脊髄性筋萎縮症のモデルとなるトランスジェニックマウスを作製し,抗アンドロゲン療法をはじめとしたさまざまな治療法を開発してきた.
マイクロRNA(microRNA:miRNA)は標的となるmRNAの3’側非翻訳領域に相補的に結合しその発現を抑制する4).近年,数々のマイクロRNAが神経変性疾患の病態の形成において重要な役割をはたすことが明らかとなり注目されている5-8).また,これらのマイクロRNAの遺伝子導入により,病態形成因子の発現を抑制し表現型を改善させる試みが広く行われている9,10).今回,筆者らは,球脊髄性筋萎縮症モデルとなるトランスジェニックマウスにおいてその脊髄で高発現するマイクロRNAを同定し,球脊髄性筋萎縮症の病態の形成における役割を検討した.
1.球脊髄性筋萎縮症において高発現するマイクロRNA
球脊髄性筋萎縮症モデルとなるトランスジェニックマウスにおいてはアンドロゲン受容体遺伝子のエキソン1に存在するCAGリピートの数が97と異常に伸長しており,生化学的および病理学的な検討において球脊髄性筋萎縮症の病態を反映していることが確認されている.一方,対照としたマウスのCAGリピートの数は24であり,野生型マウスと比較した場合にも特異的な神経症状は認められない.
はじめに,病態進行期の球脊髄性筋萎縮症モデルマウスの脊髄において高発現を認めるマイクロRNAをマイクロアレイ解析により同定した.病態進行期の球脊髄性筋萎縮症モデルマウスの脊髄において,対照としたマウスと比較して2倍以上の発現上昇を示したマイクロRNAはmiR-196a,miR-196b,miR-496,miR-323-3p,miR-29b*であった.CAGリピートの数が24の野生型アンドロゲン受容体,あるいは,CAGリピートの数が97の変異型アンドロゲン受容体を一過性に強制発現させる培養細胞モデルにおいて,これらのマイクロRNAのうちmiR-196aとmiR-196bはmRNAレベルおよびタンパク質レベルにおいてアンドロゲン受容体の発現を抑制した.これらの抑制効果は野生型および変異型アンドロゲン受容体の両方にみられた.この培養細胞モデルにおいては,野生型および変異型とも,そのcDNAから作製したプラスミドDNAを導入して発現させているため,これらから合成されるアンドロゲン受容体mRNAは3’側非翻訳領域をもたない.このことから,miR-196aやmiR-196bが直接的な相補性によりアンドロゲン受容体mRNAに作用することはないといえた.アクチノマイシンDを用いたRNA安定化アッセイを行ったところ,miR-196aおよびmiR-196bはアンドロゲン受容体mRNAの安定性を減弱して分解に導いていることが判明した.この結果より,miR-196aとmiR-196bはアンドロゲン受容体mRNAの安定化に寄与する因子の発現を抑制することでこれを分解に導いているものと推測した.
2.CELF2によるアンドロゲン受容体mRNAの安定化
バイオインフォマティクスのプログラムTargetscan 6.0によると,miR-196aおよびmiR-196bの標的となりうるmRNAはそれぞれ200種類近く存在した.これらのmRNAのうちmiR-196aとmiR-196bに対し共通の相補鎖をもつ遺伝子にコードされるCELF2(CUGBP, Elav-like family member 2)に着目した.実際に,培養細胞モデルにおいてもCELF2の発現はmiR-196aおよびmiR-196bにより抑制されていた.培養細胞モデルにおいてsiRNAによりCELF2の発現をノックダウンすると,アンドロゲン受容体のmRNAレベルおよびタンパク質レベルでの発現も抑制された.そして,これらの抑制効果は,siRNAに抵抗性をもつCELF2遺伝子の一過性の強制発現により消失することもわかった.また,CELF2の一過性の強制発現により野生型および変異型のアンドロゲン受容体は,mRNAレベルおよびタンパク質レベルにおいて発現の上昇を認めた.さらに,RNA安定化アッセイによりアンドロゲン受容体mRNAの安定性にはCELF2が必要であることが判明した.
これらの結果をふまえ,CELF2がアンドロゲン受容体mRNAのどの領域に作用するのかを検討した.アンドロゲン受容体mRNAのエキソン1に存在するCAGリピートはヘアピン構造をとるが,これに隣接するくり返し配列CUGCUGCUGに注目した.このくり返し配列を欠損した遺伝子およびCAGリピートをすべて欠損した遺伝子を作製した.CELF2の一過性の強制発現により,CAGリピートをすべて欠損したアンドロゲン受容体はmRNAレベルおよびタンパク質レベルともに発現の上昇を認めたが,CUGCUGCUG配列を欠損したアンドロゲン受容体は,CAGリピートの数が24のものおよびCAGリピートの数が97のもののいずれも,アンドロゲン受容体の発現の上昇がみられなかった.また,抗CELF2抗体による免疫沈降を併用したRT-PCR法により,CELF2とCUGCUGCUG配列との結合を確認した.以上より,miR-196aおよびmiR-196bはCELF2の発現を抑制することにより間接的にアンドロゲン受容体をコードするmRNAの分解を促進し,その結果,アンドロゲン受容体タンパク質の発現を抑制するという機序が導き出された(図1).
3.マウス個体におけるアデノ随伴ウイルスベクターを用いた遺伝子導入
in vivoにおけるCELF2を介したアンドロゲン受容体の発現抑制の効果を検討するため,miR-196aと蛍光タンパク質GFPとの融合タンパク質を発現するアデノ随伴ウイルスベクターを作製し,5週齢の球脊髄性筋萎縮症モデルとなるトランスジェニックマウスの下肢筋肉に投与した.投与されたアデノ随伴ウイルスは血行性に全身へ播種し,中枢神経系に効率よく感染し遺伝子導入が起こった.遺伝子導入はGFPの発現により確認した.対照となるアデノ随伴ウイルスと比較して,miR-196aを組み込んだアデノ随伴ウイルスを投与したトランスジェニックモデルマウスでは運動機能,生存率,体重増加など表現型の有意な改善がみられ,病理学的な検討においても異常なアンドロゲン受容体の蓄積や神経原性の筋萎縮,ならびに,神経変性を反映した反応性グリオーシスの点において有意な改善を認めた.miR-196aを組み込んだアデノ随伴ウイルスを投与したトランスジェニックモデルマウスでは,脊髄および筋肉においてmiR-196aの発現が有意に上昇し,CELF2および異常なアンドロゲン受容体の発現を抑制する効果がmRNAレベルおよびタンパク質レベルにおいて確認された.また,これらの遺伝子発現は15週間の観察期間において効果の持続が確認された.さらに,異常なアンドロゲン受容体の発現抑制の効果は,トランスジェニックモデルマウスの血清テストステロン値の変動によらないこと,および,球脊髄性筋萎縮症の患者の線維芽細胞を用いた実験でも同様にみられることが明らかになった.
おわりに
CELF2はアンドロゲン受容体をコードするmRNAのエキソン1にあるCUGCUGCUG配列に結合しこれを安定化させている.miR-196aは3’非翻訳領域にその相補領域をもつCELF2をコードするmRNAの発現を抑制し,アンドロゲン受容体をコードするmRNAの分解を促進することによりアンドロゲン受容体タンパク質の発現を抑制し,球脊髄性筋萎縮症の病態を改善する(図1).動物モデルに対しては,miR-196aを発現するアデノ随伴ウイルスを投与することで恒常的なアンドロゲン受容体の発現の抑制を実現することができた.神経変性疾患において,病態形成に機能するタンパク質をコードするmRNAと反応するタンパク質の発現をマイクロRNAにより抑制するという方法についてはいまだ報告がなく,マイクロRNAを組み込んだアデノ随伴ウイルスによる遺伝子治療が神経変性疾患の新規で有効な治療法の選択肢となることが示唆された(図2).
文 献
- La Spada, A. R., Wilson, E. M., Lubahn, D. B. et al.: Androgen receptor gene mutations in X-linked spinal and bulbar muscular atrophy. Nature, 352, 77-79 (1991)[PubMed]
- Kennedy, W. R., Alter, M. & Sung, J. H.: Progressive proximal spinal and bulbar muscular atrophy of late onset: a sex-linked recessive trait. Neurology, 50, 583-593 (1998)[PubMed]
- Sobue, G., Hashizume, Y., Mukai, E. et al.: X-linked recessive bulbospinal neuronopathy. A clinicopathological study. Brain, 112, 209-232 (1989)[PubMed]
- Kim, V. N., Han, J. & Siomi, M. C.: Biogenesis of small RNAs in animals. Nat. Rev. Mol. Cell Biol., 10, 126-139 (2009)[PubMed]
- Kim, J., Inoue, K., Ishii, J. et al.: A microRNA feedback circuit in midbrain dopamine neurons. Science, 317, 1220-1224 (2007)[PubMed]
- Karres, J. S., Hilgers, V., Carrera, I. et al.: The conserved microRNA miR-8 tunes atrophin levels to prevent neurodegeneration in Drosophila. Cell, 131, 136-145 (2007)[PubMed]
- Lee, Y., Samaco, R. C., Gatchel, J. R. et al.: miR-19, miR-101 and miR-130 co-regulate ATXN1 levels to potentially modulate SCA1 pathogenesis. Nat. Neurosci., 11, 1137-1139 (2008)[PubMed]
- Williams, A. H., Valdez, G., Moresi, V. et al.: MicroRNA-206 delays ALS progression and promotes regeneration of neuromuscular synapses in mice. Science, 326, 1549-1554 (2009)[PubMed]
- Roshan, R., Ghosh, T., Scaria, V. et al.: MicroRNAs: novel therapeutic targets in neurodegenerative diseases. Drug Discov. Today, 14, 1123-1129 (2009)[PubMed]
- Boudreau, R. L., Rodriguez-Lebron, E. & Davidson, B. L.: RNAi medicine for the brain: progresses and challenges. Hum. Mol. Genet., 20, R21-R27 (2011)[PubMed]
著者プロフィール
略歴:名古屋大学大学院医学研究科博士課程 在学中.
研究テーマ:ポリグルタミン病の治療法の開発.
関心事:神経変性疾患に対するRNAiを用いた治療法の開発.
祖父江 元(Sobue Gen)
名古屋大学大学院医学系研究科 教授.
© 2012 宮崎 雄・祖父江 元 Licensed under CC 表示 2.1 日本