マウスのオスフェロモンESP1の受容機構の解明
はが紗智子・東原和成
(東京大学大学院農学生命科学研究科 応用生命化学専攻生物化学研究室)
email:東原和成
DOI: 10.7875/first.author.2010.001
The male mouse pheromone ESP1 enhances female sexual receptive behaviour through a specific vomeronasal receptor.
Sachiko Haga, Tatsuya Hattori, Toru Sato, Koji Sato, Soichiro Matsuda, Reiko Kobayakawa, Hitoshi Sakano, Yoshihiro Yoshihara, Takefumi Kikusui, Kazushige Touhara
Nature, 466, 118-122 (2010)
動物の社会行動には匂いやフェロモンを用いたケミカルコミュニケーションが欠かせない.なかでもフェロモンは,受容した個体に特定の行動や内分泌変化を直接的にひき起こし,社会行動を制御すると考えられている.近年,筆者らは,オスのマウスの涙に分泌されるフェロモン候補物質,ESP1(Exocrine gland-secreting peptide 1)を発見した.しかしながら,このESP1がどのような受容体と神経回路を介し,どのような行動をひき起こすのかについては,まだ解明されていなかった.今回,筆者らは,ESP1がマウス鋤鼻器官に発現するV2Rp5という単一の受容体で認識され,メスに特異的な神経回路を介して視床下部領域を活性化し,メスのロードシス性行動を促進する効果をもたらすことを明らかにした.これら一連の結果は,哺乳類において,フェロモンと受容体,および,神経回路およびフェロモンによってひき起こされる行動変化を対応づけた初めての例である.今後,この研究を足がかりにして,行動の性差を生み出す神経回路が分子レベルで明らかにされることが期待される.
われわれ人間が言語を用いて互いにコミュニケーションをとりあうように,地球上のあらゆる動物はさまざまな手段を用いて互いに意思を伝達しあっている.ヒトや一部のサルを除く視覚の発達していない動物においては,匂いやフェロモンを用いたケミカルコミュニケーションが情報伝達の重要な手段となる.フェロモンは“ある個体から分泌され,同種の他個体に受容されると,受容した個体に特定の行動や内分泌変化をひき起こす物質”と定義される.たとえば,メスのカイコガから発せられるボンビコールというフェロモンはオスを誘引する効果をもつ.オスのブタの唾液に含まれるアンドロステノンというフェロモンは発情状態のメスに対して交尾姿勢をひき起こさせる.オスのマウスの尿に含まれる揮発性フェロモンは,メスの性周期を調節する一方,別のオスの攻撃行動を誘導することが知られている.すなわち,フェロモンは受容する個体の行動または内分泌系の変化を誘導するという,生物個体間の情報伝達を担っているものと考えられる1).したがって,フェロモンの化学的な実体やその受容機構を明らかにすることは,単に動物の行動制御という応用的な側面にとどまらず,脳へのある特定の刺激とその応答(行動や内分泌変化)はどのような神経回路を介してつながっているのか,という神経科学における基本的な問いにチャレンジするうえで,理想的なモデル系を提供するものと考えられる.
哺乳類のフェロモンの受容に関する研究は,行動学的な知見が豊富であることと分子生物学的な利点とから,おもにマウスを用いて行われてきた.マウスにおいてフェロモンは,鼻腔後方に存在する嗅上皮と,鼻腔下部に存在する鋤鼻器官で受容される.鋤鼻器官を外科的に切除したり分子生物学的に機能欠損させたりしたマウスでは,相手個体の性を識別してひき起こされる攻撃行動や性殖行動に異常が観察される2).すなわち,マウスにおいて鋤鼻器官は,とくに性特異的なフェロモンを受容する機能をもつことが示唆されていた.しかしながら,これまで鋤鼻器官を介して行動や内分泌系を制御することが実証され,受容機構が分子レベルで明らかにされたフェロモンは存在しなかった.
近年,筆者らは,性成熟後のオスのマウスの眼窩外涙腺に特異的に発現し,涙に分泌される新規ペプチドESP1(Exocrine gland-secreting peptide 1)を発見した3).自由行動下のマウスをこのESP1にさらすと,ある特定の鋤鼻神経細胞において神経活性化の指標であるc-Fosの発現が誘導されたことから,ESP1は鋤鼻器官を介しオスの情報をメスに伝達するフェロモンであることが強く示唆されていた3-5).そこで筆者らは,ESP1の受容体を同定し,ESP1により活性化される神経回路,および,実際にひき起こされる行動変化を明らかにすることで,哺乳類におけるフェロモンの受容機構を解明することをめざした.
まず,ESP1の受容体を明らかにすることを試みた.鋤鼻神経にはV1R型およびV2R型とよばれる2種類の3量体Gタンパク質結合型受容体ファミリーが発現しており,これらがフェロモンを受容するものと考えられている.マウスゲノム中には187個のV1R遺伝子および121個のV2R遺伝子が存在するが,原則的に,個々の鋤鼻神経にはそれらのなかの1つの遺伝子のみが相互排他的に発現している6).このうち,V1R型はGタンパク質αサブユニットのサブタイプであるGαi2とともに鋤鼻神経上皮の内腔側に,V2R型はGαoとともに神経上皮の基底層側に,それぞれ層構造をなして発現している.そこで筆者らは,神経刺激によって発現誘導されることが知られているc-Fosを指標に,ESP1がどちらの受容体によって受容されているかを調べた.その結果,ESP1刺激によって発現が誘導されるc-FosはすべてGαo発現細胞層に局在したことから,ESP1はV2R型の受容体によって受容されることがわかった.つぎに,ESP1が具体的にどのV2R型の受容体によって受容されるのかを明らかにするため,V2R遺伝子を段階的にスクリーニングすることのできるcRNAプローブをデザインし,それらを用いてc-Fos抗体との二重染色を行ったところ,すべてのc-Fos陽性細胞にはV2Rp5と名づけた遺伝子のみが発現していた.すなわち,このV2Rp5遺伝子はESP1の受容体候補遺伝子であることが示唆された.
そこで,V2Rp5とESP1との相互作用をよりくわしく検証するために,V2Rp5ノックアウトマウスを作製した.そして,リガンド刺激に対する鋤鼻器官の電気応答を解析したところ,V2Rp5ノックアウトマウスの鋤鼻器官ではESP1刺激にともなう神経電位変化がまったく観察されなかった.一方,ほかの刺激因子に対しては野生型マウスと同じ程度の応答が観察された.このことから,V2Rp5という受容体は鋤鼻神経がESP1に応答するために必要であることが示された.つぎに,BACトランスジェニックマウスの手法を用いて,マウス鋤鼻神経にV2Rp5を外来的に発現させた.外来性V2Rp5を発現する細胞を可視化するためIRES(internal ribosome entry site,配列内リボソーム進入部位)とよばれるDNA配列を用いて赤色蛍光タンパク質であるDsRedを共発現させた.このトランスジェニックマウスをESP1にさらしたところ,内在性V2Rp5を発現する細胞と同様に,DsRed陽性細胞においてもc-Fos発現が誘導されるのが観察された.さらに,ESP1の刺激に対するDsRed発現細胞の応答をリアルタイムで解析するため,鋤鼻器官においてG-CaMP2を用いたCa2+イメージング7) を行った.その結果,DsRed発現細胞において,ESP1以外のESPファミリーペプチドやほかの鋤鼻器官刺激因子は細胞内Ca2+濃度の変化をひき起こさなかったが,ESP1による刺激は細胞内Ca2+濃度の一過的な上昇をひき起こした.以上の結果より,V2Rp5がESP1の受容体であることが実証された.
V2Rp5発現神経で受容されたESP1の情報は,脳のどこに伝達されるのか明らかにすることを試みた.さきのBACトランスジェニックマウスを用いてV2Rp5発現神経軸索の投射先を調べたところ,副嗅球の後方領域に6~10個の糸球体構造を形成しているのが観察された.また,このトランスジェニックマウスをESP1にさらすと,DsRed陽性糸球体の近傍の二次神経細胞層においてのみ,ESP1の刺激にともなってc-Fos発現が誘導されるのが認められた.これらの結果は,ESP1の情報が副嗅球において空間的に限られた領域に集約されて処理されていることを示唆している.
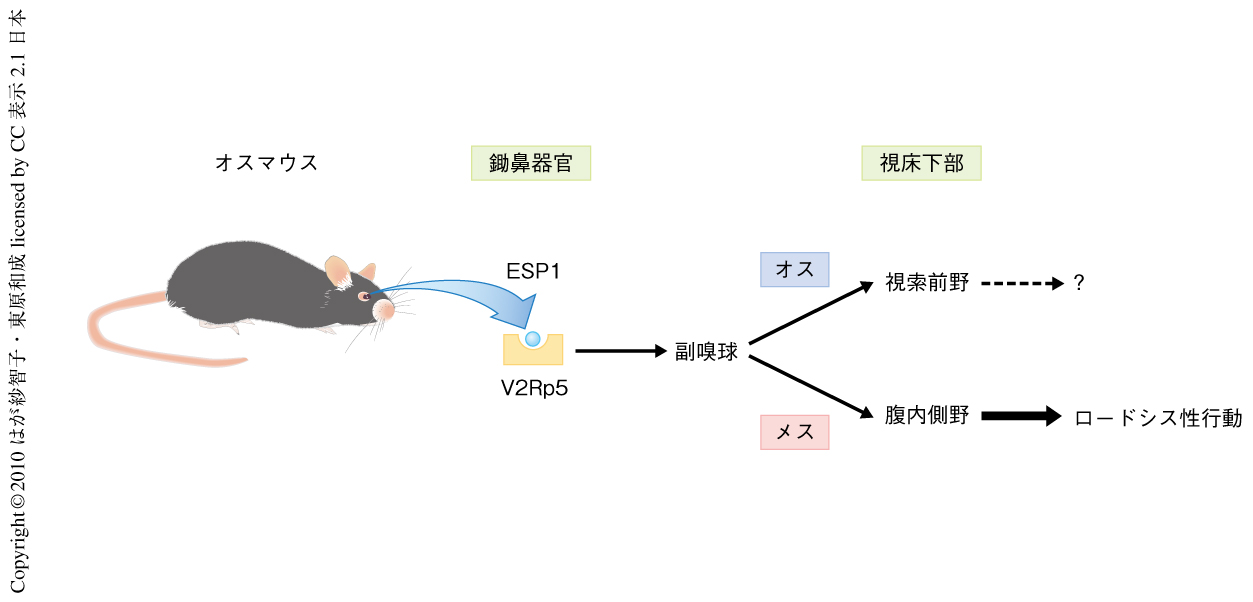
副嗅球二次神経は,分界条床核,扁桃体内側核および後内方扁桃体皮質核へと軸索を投射する8).それらのうち,分界条床核および扁桃体内側核では,ESP1刺激にともないオス・メスともにc-Fos発現細胞の数が上昇した.一方,後内方扁桃体皮質核では,メスにのみc-Fos発現細胞の数の上昇が認められた.さらに,分界条床核,扁桃体内側核および後内方扁桃体皮質核の神経が軸索を投射する視床下部視索前野および視床下部腹内側野を調べると,ESP1刺激にともなって,視床下部視索前野ではオス特異的に,視床下部腹内側野ではメス特異的に,c-Fos発現細胞数の上昇が認められた.一方,V2Rp5ノックアウトマウスのこれらの脳領域においては,ESP1刺激にともなうc-Fos発現細胞数の上昇は観察されなかった.以上の結果より,ESP1の情報はV2Rp5を介した性特異的な神経回路によって視床下部領域へと伝達されていることが明らかとなった.
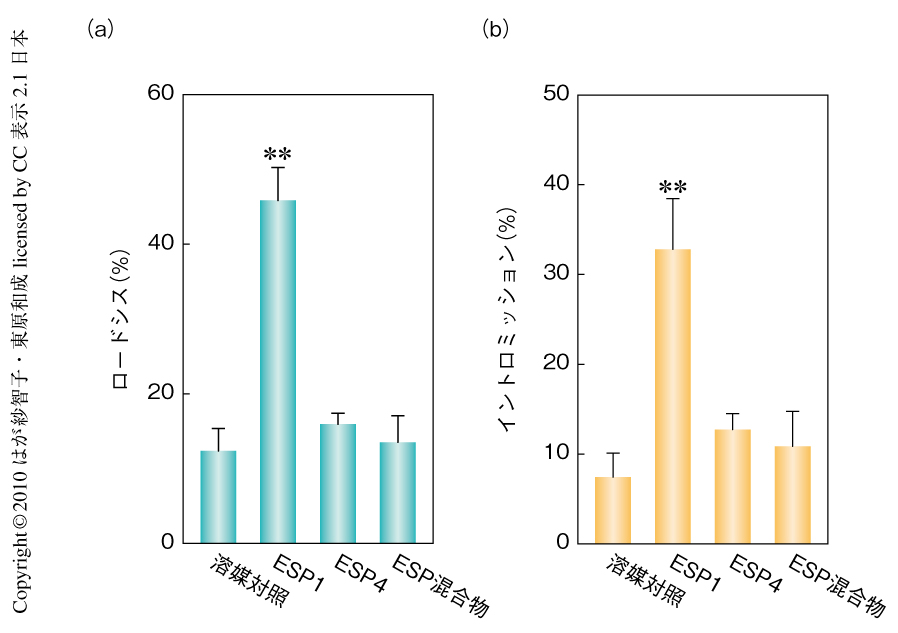
元来,鋤鼻器官は,攻撃行動をひき起こすフェロモン,オスとメスの性行動をひき起こすフェロモン,個体認識にかかわるフェロモンなど,さまざまなフェロモンを受容するものと考えられている2).ESP1はオス特異的に分泌され,メス特異的な神経回路を活性化することから,ESP1はメスにおいて,とくに性行動に影響をあたえる可能性が考えられた.そこで,ESP1を鋤鼻器官に取り込んだメスと取り込んでいないメスとのあいだで性行動の比較を行った.マウスの性行動は,互いによる匂い嗅ぎ探索行動,そののちのオスによるアプローチ(マウント),それにひきつづくメスによるオスの受け入れ行動(ロードシス),および,オスによるペニスの挿入(イントロミッション)の,大きく分けて4つの段階から構成される.それらの段階において,ESP1を鋤鼻器官に取り込んだメスでは,取り込んでいないメスに比べて,ロードシスを示す頻度が数倍から5倍も高くなるのが観察された(図1a).その結果,イントロミッションが成功する割合もESP1を取り込ませたメスで上昇しているのが認められた(図1b).また,メスのV2Rp5ノックアウトマウスにESP1を取り込ませたときにはロードシスの促進はみられなくなり,イントロミッションの亢進も認められなかった.以上の結果より,ESP1はV2Rp5を介してメスのロードシス性行動をひき起こすフェロモンであることが明らかとなった.
興味深いことに,オスのESP1の分泌量はマウスの系統によって異なっており,実験用に人間が飼育してきた近交系マウスではESP1を分泌する系統は少数であることがわかった.ESP1を分泌するBALB/c系統のオスと,分泌しないC57BL/6系統のオスに対するメスの交尾行動を比較すると,メスはESP1を分泌する系統のオスに対してよりロードシスを行なうことが観察された.その一方で,野生由来のマウス系統を調べると,ほとんどすべての系統で大量にESP1を分泌していることがわかった.すなわち,小さなケージで飼育されてきた実験用マウスでは性殖効率を上昇させるフェロモンの必要性が減少したため,遺伝子の変異が拡散して発現量が低下したものと考えられる.野生環境においては交尾の機会が限られるため,ESP1を介した生殖効率の上昇が重要なのであろう.
これまでの結果,オスの分泌するESP1はメスの性行動に影響をあたえることがわかった.さらに,ESP1を分泌しないC57BL/6系統のオスをESP1にさらすと,オス特異的な神経回路を介してメスとは異なる視床下部領域が活性化された.では,オスにおいてESP1を受け取ることに生理的な意義はあるのだろうか? たとえば,ショウジョウバエのオスから分泌される11-cis-バクセニルアセテートは,メスに対しては誘引作用をもつフェロモンとしてはたらく一方,オスに対しては攻撃行動を誘導するフェロモンとしてはたらくことが知られている9).このように,ESP1もメスとオスに対し異なる作用をもたらすフェロモンとして機能する可能性があり,今後の研究が期待される.
筆者らは,この研究において,オスのマウスの分泌するフェロモンESP1は単一の鋤鼻受容体で受容されること,性特異的に脳を活性化し,メスのロードシスという性特異的な行動をひき起こすことを明らかにした(図2).こうした筆者らの研究は,フェロモンというインプットと行動というアウトプットとの関係を分子レベルで明らかにした,世界で初めての研究である.また,同一の受容体を介しているにもかかわらず,ESP1という単一の物質で活性化される脳の領域に性差があるという知見は,行動の性差を生み出すような神経回路の研究において有用なモデル系となるだろう.今後,オスとメスとでESP1がどのような神経回路を活性化しているのかが分子レベルで明らかになることが期待される.
この研究は,行動実験については麻布大学獣医学部の菊水健史教授,遺伝子改変マウスの作製については理化学研究所脳科学総合研究センターの吉原良浩チームリーダーと共同で行った成果である.
(“はが”は土へんに並)
略歴:2007年 東京大学大学院新領域創成科学研究科 博士課程 修了(指導教員:東原和成准教授).東京大学大学院農学生命科学研究科 東原和成教授のもとで特任研究員としてこの研究に取り組んだのち,2010年より米国Stowers Institute for Medical Researchに留学中.
研究テーマ:社会的シグナルを認識する神経回路の解析.
関心事:McClintock博士による女子寮における月経同調の論文を読み,自分の行動が無意識下で他人から放出される物質によって影響をうけている可能性があることに衝撃をうけてフェロモンの研究をはじめた.現在は,フェロモンの情報を処理する神経回路に関心がある.
東原 和成(Kazushige Touhara)
東京大学大学院農学生命科学研究科 教授.
研究室URL:http://park.itc.u-tokyo.ac.jp/biological-chemistry/index.html
© 2010 はが紗智子・東原和成 Licensed under CC 表示 2.1 日本
(東京大学大学院農学生命科学研究科 応用生命化学専攻生物化学研究室)
email:東原和成
DOI: 10.7875/first.author.2010.001
The male mouse pheromone ESP1 enhances female sexual receptive behaviour through a specific vomeronasal receptor.
Sachiko Haga, Tatsuya Hattori, Toru Sato, Koji Sato, Soichiro Matsuda, Reiko Kobayakawa, Hitoshi Sakano, Yoshihiro Yoshihara, Takefumi Kikusui, Kazushige Touhara
Nature, 466, 118-122 (2010)
要 約
動物の社会行動には匂いやフェロモンを用いたケミカルコミュニケーションが欠かせない.なかでもフェロモンは,受容した個体に特定の行動や内分泌変化を直接的にひき起こし,社会行動を制御すると考えられている.近年,筆者らは,オスのマウスの涙に分泌されるフェロモン候補物質,ESP1(Exocrine gland-secreting peptide 1)を発見した.しかしながら,このESP1がどのような受容体と神経回路を介し,どのような行動をひき起こすのかについては,まだ解明されていなかった.今回,筆者らは,ESP1がマウス鋤鼻器官に発現するV2Rp5という単一の受容体で認識され,メスに特異的な神経回路を介して視床下部領域を活性化し,メスのロードシス性行動を促進する効果をもたらすことを明らかにした.これら一連の結果は,哺乳類において,フェロモンと受容体,および,神経回路およびフェロモンによってひき起こされる行動変化を対応づけた初めての例である.今後,この研究を足がかりにして,行動の性差を生み出す神経回路が分子レベルで明らかにされることが期待される.
はじめに
われわれ人間が言語を用いて互いにコミュニケーションをとりあうように,地球上のあらゆる動物はさまざまな手段を用いて互いに意思を伝達しあっている.ヒトや一部のサルを除く視覚の発達していない動物においては,匂いやフェロモンを用いたケミカルコミュニケーションが情報伝達の重要な手段となる.フェロモンは“ある個体から分泌され,同種の他個体に受容されると,受容した個体に特定の行動や内分泌変化をひき起こす物質”と定義される.たとえば,メスのカイコガから発せられるボンビコールというフェロモンはオスを誘引する効果をもつ.オスのブタの唾液に含まれるアンドロステノンというフェロモンは発情状態のメスに対して交尾姿勢をひき起こさせる.オスのマウスの尿に含まれる揮発性フェロモンは,メスの性周期を調節する一方,別のオスの攻撃行動を誘導することが知られている.すなわち,フェロモンは受容する個体の行動または内分泌系の変化を誘導するという,生物個体間の情報伝達を担っているものと考えられる1).したがって,フェロモンの化学的な実体やその受容機構を明らかにすることは,単に動物の行動制御という応用的な側面にとどまらず,脳へのある特定の刺激とその応答(行動や内分泌変化)はどのような神経回路を介してつながっているのか,という神経科学における基本的な問いにチャレンジするうえで,理想的なモデル系を提供するものと考えられる.
哺乳類のフェロモンの受容に関する研究は,行動学的な知見が豊富であることと分子生物学的な利点とから,おもにマウスを用いて行われてきた.マウスにおいてフェロモンは,鼻腔後方に存在する嗅上皮と,鼻腔下部に存在する鋤鼻器官で受容される.鋤鼻器官を外科的に切除したり分子生物学的に機能欠損させたりしたマウスでは,相手個体の性を識別してひき起こされる攻撃行動や性殖行動に異常が観察される2).すなわち,マウスにおいて鋤鼻器官は,とくに性特異的なフェロモンを受容する機能をもつことが示唆されていた.しかしながら,これまで鋤鼻器官を介して行動や内分泌系を制御することが実証され,受容機構が分子レベルで明らかにされたフェロモンは存在しなかった.
近年,筆者らは,性成熟後のオスのマウスの眼窩外涙腺に特異的に発現し,涙に分泌される新規ペプチドESP1(Exocrine gland-secreting peptide 1)を発見した3).自由行動下のマウスをこのESP1にさらすと,ある特定の鋤鼻神経細胞において神経活性化の指標であるc-Fosの発現が誘導されたことから,ESP1は鋤鼻器官を介しオスの情報をメスに伝達するフェロモンであることが強く示唆されていた3-5).そこで筆者らは,ESP1の受容体を同定し,ESP1により活性化される神経回路,および,実際にひき起こされる行動変化を明らかにすることで,哺乳類におけるフェロモンの受容機構を解明することをめざした.
1.ESP1はV2Rp5という単一の鋤鼻受容体によって認識される
まず,ESP1の受容体を明らかにすることを試みた.鋤鼻神経にはV1R型およびV2R型とよばれる2種類の3量体Gタンパク質結合型受容体ファミリーが発現しており,これらがフェロモンを受容するものと考えられている.マウスゲノム中には187個のV1R遺伝子および121個のV2R遺伝子が存在するが,原則的に,個々の鋤鼻神経にはそれらのなかの1つの遺伝子のみが相互排他的に発現している6).このうち,V1R型はGタンパク質αサブユニットのサブタイプであるGαi2とともに鋤鼻神経上皮の内腔側に,V2R型はGαoとともに神経上皮の基底層側に,それぞれ層構造をなして発現している.そこで筆者らは,神経刺激によって発現誘導されることが知られているc-Fosを指標に,ESP1がどちらの受容体によって受容されているかを調べた.その結果,ESP1刺激によって発現が誘導されるc-FosはすべてGαo発現細胞層に局在したことから,ESP1はV2R型の受容体によって受容されることがわかった.つぎに,ESP1が具体的にどのV2R型の受容体によって受容されるのかを明らかにするため,V2R遺伝子を段階的にスクリーニングすることのできるcRNAプローブをデザインし,それらを用いてc-Fos抗体との二重染色を行ったところ,すべてのc-Fos陽性細胞にはV2Rp5と名づけた遺伝子のみが発現していた.すなわち,このV2Rp5遺伝子はESP1の受容体候補遺伝子であることが示唆された.
そこで,V2Rp5とESP1との相互作用をよりくわしく検証するために,V2Rp5ノックアウトマウスを作製した.そして,リガンド刺激に対する鋤鼻器官の電気応答を解析したところ,V2Rp5ノックアウトマウスの鋤鼻器官ではESP1刺激にともなう神経電位変化がまったく観察されなかった.一方,ほかの刺激因子に対しては野生型マウスと同じ程度の応答が観察された.このことから,V2Rp5という受容体は鋤鼻神経がESP1に応答するために必要であることが示された.つぎに,BACトランスジェニックマウスの手法を用いて,マウス鋤鼻神経にV2Rp5を外来的に発現させた.外来性V2Rp5を発現する細胞を可視化するためIRES(internal ribosome entry site,配列内リボソーム進入部位)とよばれるDNA配列を用いて赤色蛍光タンパク質であるDsRedを共発現させた.このトランスジェニックマウスをESP1にさらしたところ,内在性V2Rp5を発現する細胞と同様に,DsRed陽性細胞においてもc-Fos発現が誘導されるのが観察された.さらに,ESP1の刺激に対するDsRed発現細胞の応答をリアルタイムで解析するため,鋤鼻器官においてG-CaMP2を用いたCa2+イメージング7) を行った.その結果,DsRed発現細胞において,ESP1以外のESPファミリーペプチドやほかの鋤鼻器官刺激因子は細胞内Ca2+濃度の変化をひき起こさなかったが,ESP1による刺激は細胞内Ca2+濃度の一過的な上昇をひき起こした.以上の結果より,V2Rp5がESP1の受容体であることが実証された.
2.ESP1情報は性特異的な神経回路によって視床下部へと伝達される
V2Rp5発現神経で受容されたESP1の情報は,脳のどこに伝達されるのか明らかにすることを試みた.さきのBACトランスジェニックマウスを用いてV2Rp5発現神経軸索の投射先を調べたところ,副嗅球の後方領域に6~10個の糸球体構造を形成しているのが観察された.また,このトランスジェニックマウスをESP1にさらすと,DsRed陽性糸球体の近傍の二次神経細胞層においてのみ,ESP1の刺激にともなってc-Fos発現が誘導されるのが認められた.これらの結果は,ESP1の情報が副嗅球において空間的に限られた領域に集約されて処理されていることを示唆している.
副嗅球二次神経は,分界条床核,扁桃体内側核および後内方扁桃体皮質核へと軸索を投射する8).それらのうち,分界条床核および扁桃体内側核では,ESP1刺激にともないオス・メスともにc-Fos発現細胞の数が上昇した.一方,後内方扁桃体皮質核では,メスにのみc-Fos発現細胞の数の上昇が認められた.さらに,分界条床核,扁桃体内側核および後内方扁桃体皮質核の神経が軸索を投射する視床下部視索前野および視床下部腹内側野を調べると,ESP1刺激にともなって,視床下部視索前野ではオス特異的に,視床下部腹内側野ではメス特異的に,c-Fos発現細胞数の上昇が認められた.一方,V2Rp5ノックアウトマウスのこれらの脳領域においては,ESP1刺激にともなうc-Fos発現細胞数の上昇は観察されなかった.以上の結果より,ESP1の情報はV2Rp5を介した性特異的な神経回路によって視床下部領域へと伝達されていることが明らかとなった.
3.ESP1はメスの性行動を促進する
元来,鋤鼻器官は,攻撃行動をひき起こすフェロモン,オスとメスの性行動をひき起こすフェロモン,個体認識にかかわるフェロモンなど,さまざまなフェロモンを受容するものと考えられている2).ESP1はオス特異的に分泌され,メス特異的な神経回路を活性化することから,ESP1はメスにおいて,とくに性行動に影響をあたえる可能性が考えられた.そこで,ESP1を鋤鼻器官に取り込んだメスと取り込んでいないメスとのあいだで性行動の比較を行った.マウスの性行動は,互いによる匂い嗅ぎ探索行動,そののちのオスによるアプローチ(マウント),それにひきつづくメスによるオスの受け入れ行動(ロードシス),および,オスによるペニスの挿入(イントロミッション)の,大きく分けて4つの段階から構成される.それらの段階において,ESP1を鋤鼻器官に取り込んだメスでは,取り込んでいないメスに比べて,ロードシスを示す頻度が数倍から5倍も高くなるのが観察された(図1a).その結果,イントロミッションが成功する割合もESP1を取り込ませたメスで上昇しているのが認められた(図1b).また,メスのV2Rp5ノックアウトマウスにESP1を取り込ませたときにはロードシスの促進はみられなくなり,イントロミッションの亢進も認められなかった.以上の結果より,ESP1はV2Rp5を介してメスのロードシス性行動をひき起こすフェロモンであることが明らかとなった.
4.野生マウスはESP1を分泌している
興味深いことに,オスのESP1の分泌量はマウスの系統によって異なっており,実験用に人間が飼育してきた近交系マウスではESP1を分泌する系統は少数であることがわかった.ESP1を分泌するBALB/c系統のオスと,分泌しないC57BL/6系統のオスに対するメスの交尾行動を比較すると,メスはESP1を分泌する系統のオスに対してよりロードシスを行なうことが観察された.その一方で,野生由来のマウス系統を調べると,ほとんどすべての系統で大量にESP1を分泌していることがわかった.すなわち,小さなケージで飼育されてきた実験用マウスでは性殖効率を上昇させるフェロモンの必要性が減少したため,遺伝子の変異が拡散して発現量が低下したものと考えられる.野生環境においては交尾の機会が限られるため,ESP1を介した生殖効率の上昇が重要なのであろう.
5.ESP1はオスの行動に影響するのか?
これまでの結果,オスの分泌するESP1はメスの性行動に影響をあたえることがわかった.さらに,ESP1を分泌しないC57BL/6系統のオスをESP1にさらすと,オス特異的な神経回路を介してメスとは異なる視床下部領域が活性化された.では,オスにおいてESP1を受け取ることに生理的な意義はあるのだろうか? たとえば,ショウジョウバエのオスから分泌される11-cis-バクセニルアセテートは,メスに対しては誘引作用をもつフェロモンとしてはたらく一方,オスに対しては攻撃行動を誘導するフェロモンとしてはたらくことが知られている9).このように,ESP1もメスとオスに対し異なる作用をもたらすフェロモンとして機能する可能性があり,今後の研究が期待される.
おわりに
筆者らは,この研究において,オスのマウスの分泌するフェロモンESP1は単一の鋤鼻受容体で受容されること,性特異的に脳を活性化し,メスのロードシスという性特異的な行動をひき起こすことを明らかにした(図2).こうした筆者らの研究は,フェロモンというインプットと行動というアウトプットとの関係を分子レベルで明らかにした,世界で初めての研究である.また,同一の受容体を介しているにもかかわらず,ESP1という単一の物質で活性化される脳の領域に性差があるという知見は,行動の性差を生み出すような神経回路の研究において有用なモデル系となるだろう.今後,オスとメスとでESP1がどのような神経回路を活性化しているのかが分子レベルで明らかになることが期待される.
この研究は,行動実験については麻布大学獣医学部の菊水健史教授,遺伝子改変マウスの作製については理化学研究所脳科学総合研究センターの吉原良浩チームリーダーと共同で行った成果である.
文 献
- Wyatt, T. D.: Pheromones and Animal Behaviour, Cambridge University Press (2003)
- Dulac, C. & Torello, A. T.: Molecular detection of pheromone signals in mammals: from genes to behaviour. Nat. Rev. Neurosci., 4, 551-562 (2003) [PubMed]
- Kimoto, H. et al.: Sex-specific peptides from exocrine glands stimulate mouse vomeronasal sensory neurons. Nature, 437, 898-901 (2005) [PubMed]
- Haga, S. et al.: Molecular characterization of vomeronasal sensory neurons responding to a male-specific peptide in tear fluid: Sexual communication in mice. Pure Appl. Chem., 79, 775-784 (2007)
- Kimoto, H. et al.: Sex- and strain-specific expression and vomeronasal activity of mouse ESP family peptides. Curr. Biol., 17, 1879-1884 (2007) [PubMed]
- Touhara, K. & Vosshall, L. B.: Sensing odorants and pheromones with chemosensory receptors. Annu. Rev. Physiol., 71, 307-332 (2009) [PubMed]
- He, J. et al.: Encoding gender and individual information in the mouse vomeronasal organ. Science, 320, 535-538 (2008) [PubMed]
- Meredith, M.: Vomeronasal, olfactory, hormonal convergence in the brain. Cooperation or coincidence? Ann. NY Acad. Sci., 855, 349-361 (1998) [PubMed]
- Wang, L. & Anderson, D. J.: Identification of an aggression-promoting pheromone and its receptor neurons in Drosophila. Nature, 463, 227-231 (2010) [PubMed]
著者プロフィール
(“はが”は土へんに並)
略歴:2007年 東京大学大学院新領域創成科学研究科 博士課程 修了(指導教員:東原和成准教授).東京大学大学院農学生命科学研究科 東原和成教授のもとで特任研究員としてこの研究に取り組んだのち,2010年より米国Stowers Institute for Medical Researchに留学中.
研究テーマ:社会的シグナルを認識する神経回路の解析.
関心事:McClintock博士による女子寮における月経同調の論文を読み,自分の行動が無意識下で他人から放出される物質によって影響をうけている可能性があることに衝撃をうけてフェロモンの研究をはじめた.現在は,フェロモンの情報を処理する神経回路に関心がある.
東原 和成(Kazushige Touhara)
東京大学大学院農学生命科学研究科 教授.
研究室URL:http://park.itc.u-tokyo.ac.jp/biological-chemistry/index.html
© 2010 はが紗智子・東原和成 Licensed under CC 表示 2.1 日本