紫外線高感受性症候群A群の原因遺伝子の同定と転写と共役したDNA修復における機能の解析
西條将文・田中亀代次
(大阪大学大学院生命機能研究科 細胞機能学研究室)
email:西條将文
DOI: 10.7875/first.author.2012.053
Mutations in UVSSA cause UV-sensitive syndrome and destabilize ERCC6 in transcription-coupled DNA repair.
Xue Zhang, Katsuyoshi Horibata, Masafumi Saijo, Chie Ishigami, Akiko Ukai, Shin-ichiro Kanno, Hidetoshi Tahara, Edward G Neilan, Masamitsu Honma, Takehiko Nohmi, Akira Yasui, Kiyoji Tanaka
Nature Genetics, 44, 593-597 (2012)
紫外線高感受性症候群はヌクレオチド除去修復の副経路である転写と共役した修復を欠損する遺伝性疾患である.筆者らは,紫外線高感受性症候群A群の原因遺伝子の候補を微小核融合法とCGHアレイ解析法を用いて特定した.紫外線高感受性症候群A群の患者に由来する細胞においてこの遺伝子のORFに変異が検出され,患者の細胞にこの遺伝子のcDNAを導入することで転写と共役した修復が回復したことから,UVSSA遺伝子と命名されたこの遺伝子が紫外線高感受性症候群A群の原因遺伝子であると結論づけた.その産物であるUVSSAは,ユビキチン鎖分解酵素USP7と複合体を形成すること,紫外線の照射に関係なく転写と共役した修復にかかわるタンパク質であるERCC8と相互作用すること,紫外線を照射した細胞より調製したクロマチン画分において転写と共役した修復にかかわるタンパク質であるERCC6およびRNAポリメラーゼIIと相互作用することが明らかになった.また,UVSSAはUSP7と協調して紫外線を照射したのちのERCC6の安定化と低リン酸化型RNAポリメラーゼIIの回復に関与していた.
紫外線高感受性症候群(ultraviolet -sensitive syndrome)は劣性の遺伝性疾患であり,日光過敏性を示し皮膚にシミやソバカスを多発する.紫外線によるDNAの損傷はヌクレオチド除去修復(nucleotide excision repair:NER)により除去されるが,紫外線高感受性症候群ではその副経路である転写と共役した修復1)(transcription-coupled repair:TCR)が欠損しており,転写の鋳型鎖にあるDNA損傷が迅速に除去されないためRNAポリメラーゼIIがDNA損傷部位で停止したまま転写を再開できない.紫外線高感受性症候群には少なくとも3つの遺伝的な相補性群が存在するが,このうち2つの相補性群の原因遺伝子はERCC8遺伝子(CSA遺伝子)およびERCC6遺伝子(CSB遺伝子)であることが報告されている2-5).ERCC8遺伝子およびERCC6遺伝子は転写と共役した修復を欠損する別の遺伝性疾患であるCockayne症候群の原因遺伝子でもある.紫外線高感受性症候群では臨床症状は比較的軽微なのに対し,Cockayne症候群では成長障害,精神神経症状,早期老化など重篤な症状がみられる.紫外線高感受性症候群とCockayne症候群のどちらにおいても紫外線によりひき起こされる転写と共役した修復が欠損しているにもかかわらず症状に違いの生じる理由について,Cockayne症候群では酸化的なDNA損傷の修復や転写についても影響をうけている可能性が考えられているが,結論はまだでていない.転写と共役した修復は転写の鋳型鎖におけるDNA損傷によりRNAポリメラーゼIIが停止することが引き金になっていると考えられ,ERCC8およびERCC6の関与することがわかっているが,その分子機構は明らかでない.
今回,筆者らは,原因遺伝子のわかっていない紫外線高感受性症候群A群の原因遺伝子の同定を試みた.その遺伝子産物は転写と共役した修復にかかわる新たなタンパク質であり,その機能を解析することは転写と共役した修復の分子機構の解明につながるとともに,紫外線高感受性症候群とCockayne症候群との臨床症状の違いを説明する一助になると考えられる.
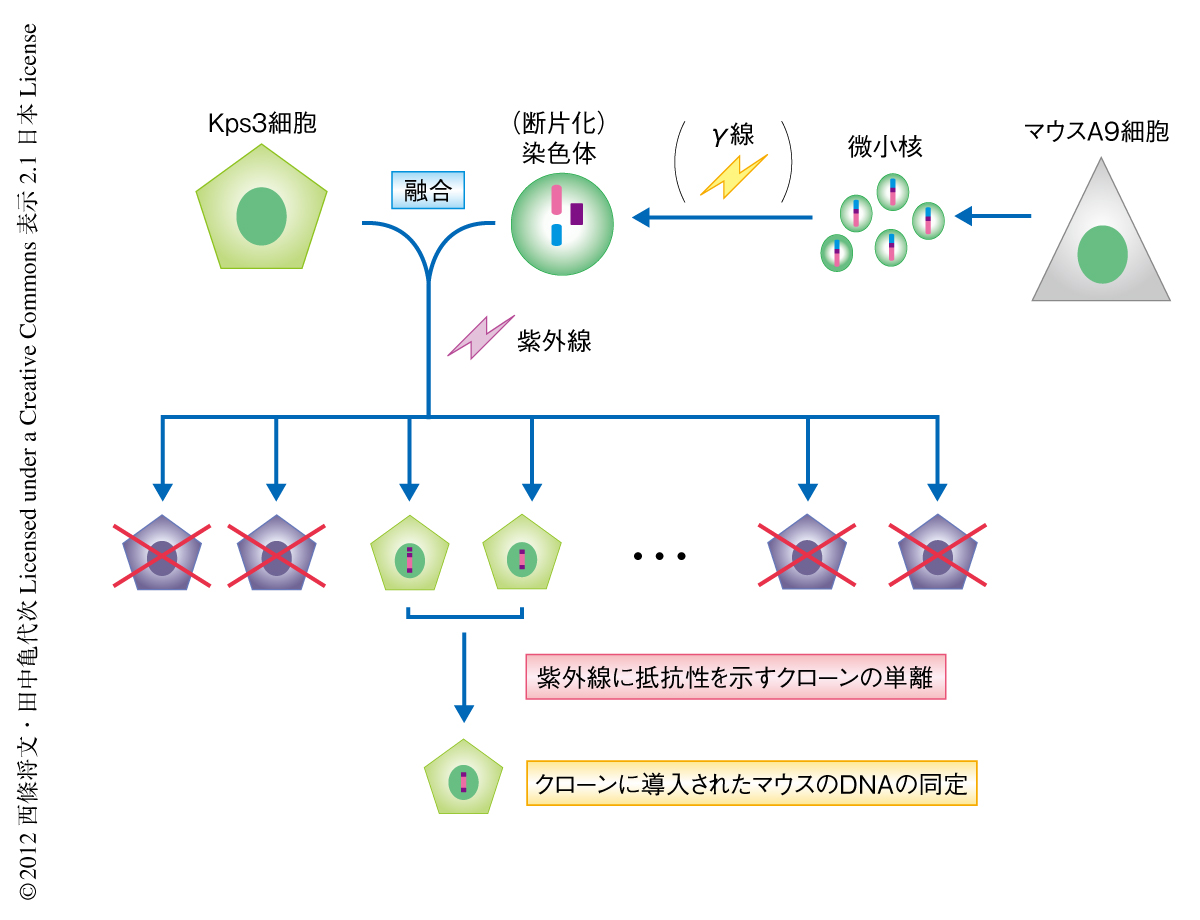
紫外線高感受性症候群A群の患者に由来する繊維芽細胞であるKps3細胞3) は,紫外線に高感受性を示し,紫外線を照射したのちにRNA合成の回復がみられないという特徴がある.紫外線高感受性症候群A群の原因遺伝子をクローニングするため,Kps3細胞に対して微小核融合法6) によりヒトの染色体を1本ずつ導入し紫外線に対し抵抗性を示すクローンの単離を試みたが,正常な細胞と同じ程度の紫外線への抵抗性を示すクローンは得られなかった.そこでつぎに,マウスA9細胞より調製した微小核とKps3細胞とを融合しマウスの染色体をランダムに導入した(図1).紫外線を定期的に照射しながら6週間にわたり培養した結果,紫外線に抵抗性を示す4つの独立したクローンが得られた.これらのクローンは正常な細胞と同じ程度の紫外線への抵抗性と紫外線を照射したのちのRNA合成の回復を示した.
これら4つのクローンに導入されたマウスのDNAを同定するためCGHアレイ解析を行った.4つのうち2つのクローンにはマウス第5染色体の全体(このうち1つには,さらに第12染色体と第17染色体の一部も)が導入されていた.残りの2つのクローンにはマウス第5染色体の断片が導入されていた.導入されたDNAで共通している領域は600 kbで11個の遺伝子が存在していた.
つぎに,この領域をカバーする6つのBACクローンをKps3細胞に導入して紫外線に対する抵抗性を調べたところ,1つの遺伝子(4933407H18Rik)のみを含むBACクローンの導入により紫外線への抵抗性が生じた.この4933407H18RikのヒトにおけるホモログはKIAA1530 7) であり,紫外線高感受性症候群A群の患者に由来する細胞においてこのKIAA1530のcDNAを解析したところ,血縁関係のない日本人の患者2人3,8) においてホモ接合性の同じ変異,また,イラン人の患者2) で別のホモ接合性の変異がみつかった.これらの変異はともに早期翻訳終結をひき起こす.また,KIAA1530のcDNAをKps3細胞に導入することにより,紫外線への抵抗性と紫外線の照射ののちのRNA合成の回復が正常な細胞と同じ程度にまで回復した.以上の結果は,KIAA1530が紫外線高感受性症候群A群の原因遺伝子であることを示しておりUVSSA遺伝子と命名した.
紫外線高感受性症候群の患者においてCockayne症候群の原因遺伝子であるERCC6遺伝子およびERCC8遺伝子のホモ接合性の変異がみつかっている.そこで,Cockayne症候群の臨床症状を示し紫外線によりひき起こされる転写と共役した修復を欠損しているがERCC6遺伝子およびERCC8遺伝子に変異をもたない患者3例について,UVSSA遺伝子のもつORFの塩基配列を調べたが変異はみつからなかった.
UVSSA遺伝子はヒト第4染色体p16.3に座位し709アミノ酸残基からなるタンパク質をコードしている.UVSSAは,N末端側にVHS/ENTHドメイン,C末端側にDUF2043ドメインをもち,シロイヌナズナ,イネ,線虫においてホモログが同定されているがその機能はわかっていない.
転写と共役した修復におけるUVSSAの機能を明らかにするため,UVSSAと相互作用するタンパク質の同定を試みた.エピトープタグを付加したUVSSAをHEK293細胞で発現させて免疫沈降を行い共沈するタンパク質を質量分析法により解析したところ,ユビキチン鎖分解酵素であるUSP7が同定された.USP7のsiRNAを導入した正常な細胞は紫外線に対し感受性となり紫外線の照射ののちのRNA合成の回復が低下したことから,USP7が転写と共役した修復に関与することが示された.興味深いことに,USP7のsiRNAを導入した細胞ではUSP7だけではなくUVSSAの量も減少していることがわかった.逆に,UVSSAのノックダウンではUSP7は減少しなかった.これらの結果は,細胞においてUSP7はUVSSAより大量に存在し,UVSSAはUSP7と複合体を形成することにより安定化されていることを示していた.
つぎに,UVSSAとほかの転写と共役した修復にかかわるタンパク質との相互作用を調べた.紫外線高感受性症候群A群の患者に由来するKps3細胞においてエピトープタグを付加したUVSSAを発現させ免疫沈降を行ったところ,可溶性画分ではERCC8は紫外線の照射に関係なくUVSSAと共沈したが,ERCC6およびRNAポリメラーゼIIは共沈しなかった.一方,紫外線を照射した細胞より調製したクロマチン画分ではERCC6,ERCC8,RNAポリメラーゼIIの共沈がみられた.ERCC6はDNA損傷部位で停止したRNAポリメラーゼIIに対し転写と共役した修復にかかわるタンパク質をリクルートするのに必須であることが知られている9).そこで,UVSSA-USP7複合体あるいはERCC8の紫外線を照射したのちのRNAポリメラーゼIIへの結合がERCC6に依存するかどうかを調べるため,ERCC6を欠損しているCockayne症候群B群の患者に由来する細胞においてエピトープタグを付加したUVSSAを発現させ免疫沈降を行った.この場合には,UVSSAとUSP7,ERCC8の共沈はさきと同様にみられたが,RNAポリメラーゼIIとの共沈は紫外線を照射した細胞より調製したクロマチン画分でもみられなかった.これらの結果は,UVSSA-USP7複合体およびERCC8はERCC6に依存的にDNA損傷部位で停止したRNAポリメラーゼIIに結合することを示していた.ERCC8を欠損しているCockayne症候群A群の患者に由来する細胞においては,USP7は紫外線の照射にかかわらずUVSSAと共沈したが,RNAポリメラーゼIIとの共沈は紫外線を照射した細胞より調製したクロマチン画分でもみられなかった.これらの結果は,DNA損傷部位で停止したRNAポリメラーゼIIおよびERCC6へのUVSSA-USP7複合体の結合はERCC8に依存的であることを示していた.
紫外線の照射により生じるDNA損傷により,RNAポリメラーゼIIによる転写の伸長が阻害されるだけでなく,RNAポリメラーゼIIの最大サブユニットRPB1のC末端領域が低リン酸化型であるRNAポリメラーゼII aが減少する.このRNAポリメラーゼII aは転写の再開に必要であり,紫外線の照射ののち時間とともに回復するが,転写と共役した修復を欠損したCockayne症候群の患者に由来する細胞では回復しないことが報告されている10).Kps3細胞とUVSSAを発現させて正常化したKps3細胞とでRPB1のリン酸化状態を調べると,正常化したKps3細胞では紫外線の照射ののちRNAポリメラーゼII aはいったん減少したあと回復したのに対し,Kps3細胞ではRNAポリメラーゼII aは減少したまま回復しなかった.この結果は,ERCC6,ERCC8にくわえUVSSAもRNAポリメラーゼII aの回復に必要であることを示していた.
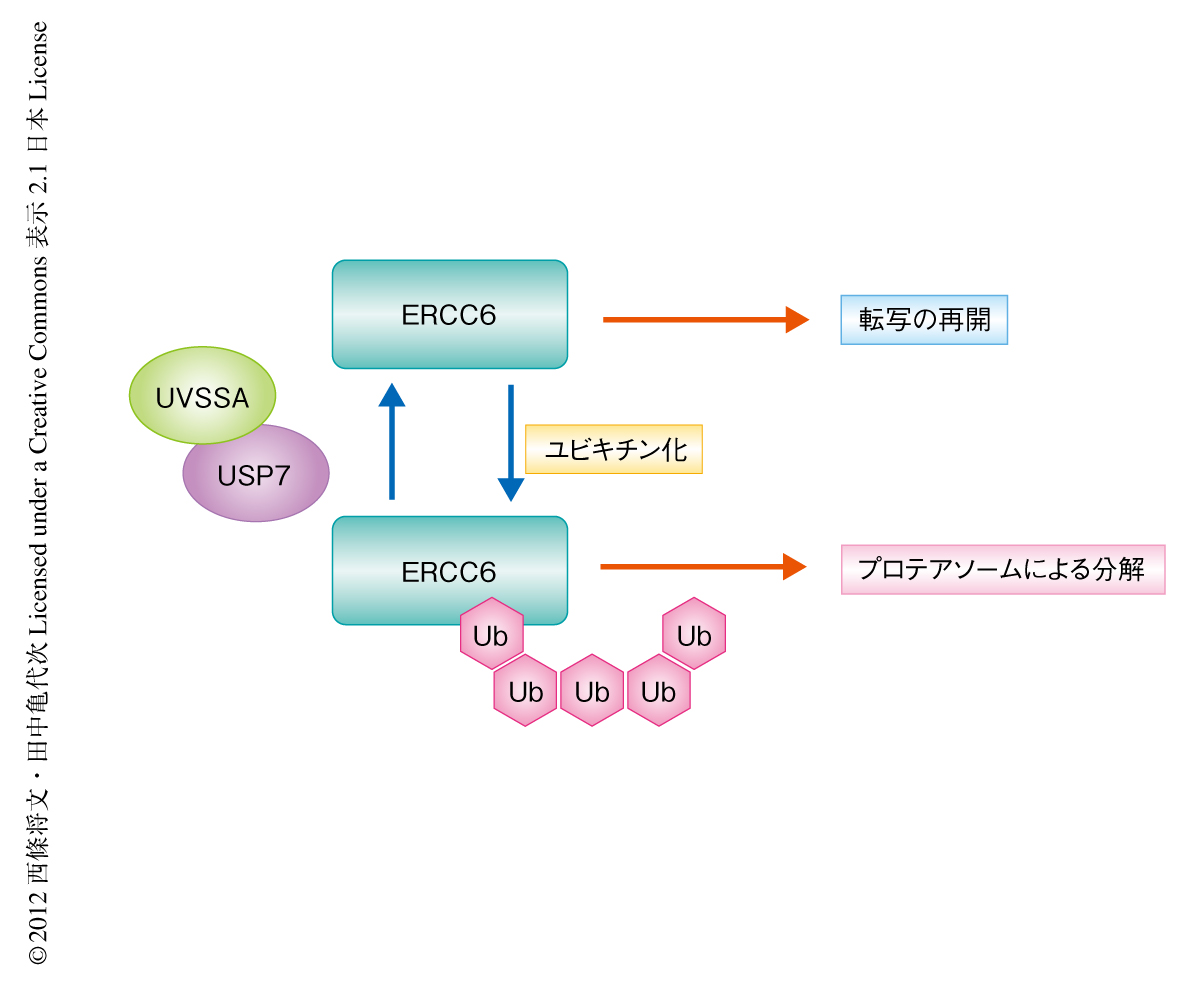
紫外線の照射ののちのタンパク質の量的な変化としては,ERCC6もKps3細胞とUVSSAを発現させて正常化したKps3細胞とで差がみられた.正常化したKps3細胞では紫外線を照射したのちのERCC6の減少はわずかなのに対し,Kps3細胞では大幅な減少がみられた.この結果は,UVSSAは転写と共役した修復においてERCC6を安定化するのに重要な役割をはたしていることを示唆した.紫外線を照射したのちのERCC6の減少は,UVSSAをノックダウンした細胞のみならずUSP7をノックダウンした細胞においても観察された.一方,UVSSAを欠損しているKps3細胞においてUSP7をノックダウンしてもERCC6の減少に変化はなかった.これらの結果より,紫外線の照射ののちにERCC6が分解しないようUVSSAとUSP7とが協調してはたらいているものと考えられた.また,プロテアソーム阻害剤MG132が存在するとKps3細胞における紫外線の照射ののちのERCC6の減少が抑制されるとともに,RNAポリメラーゼII aの回復もみられた.
以上の結果より,UVSSAが機能しないと,紫外線の照射ののちERCC6はユビキチン化されてプロテアソームにより分解され,そのためRNAポリメラーゼII aの回復は起こらないことが示された(図2).
ERCC6はDNA損傷部位で停止したRNAポリメラーゼIIに修復にかかわるほかのタンパク質をリクルートするのに必須であり,また,転写の再開にも必要なタンパク質である.今回の結果より,UVSSA-USP7複合体は紫外線を照射したのちのERCC6の安定化に関与することが示された.このERCC6の安定化によりRNAポリメラーゼII aが回復し転写が再開するものと考えられた.一方,紫外線高感受性症候群A群の患者に由来するKps3細胞では転写の鋳型鎖にあるDNA損傷の除去がみられないことから,UVSSAは転写の再開だけでなくDNA損傷を除去する過程においても必要である.その機能がさきに述べたようなERCC6の安定化によるものなのか,あるいは,別のはたらきがあるのかはまだ不明である.今後,転写と共役した修復にかかわるタンパク質として新たにくわわったUVSSA-USP7複合体の機能を解析することにより,転写と共役した修復の分子機構の明らかになることが期待される.
略歴:1990年 東京大学大学院薬学系研究科 修了,国立がんセンター研究所 リサーチレジデント,大阪大学細胞生体工学センター 助手,助教授を経て,2002年より大阪大学大学院生命機能研究科 准教授.
研究テーマ:ヌクレオチド除去修復の分子機構.
田中 亀代次(Kiyoji Tanaka)
大阪大学大学院生命機能研究科 特任教授.
© 2012 西條将文・田中亀代次 Licensed under CC 表示 2.1 日本
(大阪大学大学院生命機能研究科 細胞機能学研究室)
email:西條将文
DOI: 10.7875/first.author.2012.053
Mutations in UVSSA cause UV-sensitive syndrome and destabilize ERCC6 in transcription-coupled DNA repair.
Xue Zhang, Katsuyoshi Horibata, Masafumi Saijo, Chie Ishigami, Akiko Ukai, Shin-ichiro Kanno, Hidetoshi Tahara, Edward G Neilan, Masamitsu Honma, Takehiko Nohmi, Akira Yasui, Kiyoji Tanaka
Nature Genetics, 44, 593-597 (2012)
要 約
紫外線高感受性症候群はヌクレオチド除去修復の副経路である転写と共役した修復を欠損する遺伝性疾患である.筆者らは,紫外線高感受性症候群A群の原因遺伝子の候補を微小核融合法とCGHアレイ解析法を用いて特定した.紫外線高感受性症候群A群の患者に由来する細胞においてこの遺伝子のORFに変異が検出され,患者の細胞にこの遺伝子のcDNAを導入することで転写と共役した修復が回復したことから,UVSSA遺伝子と命名されたこの遺伝子が紫外線高感受性症候群A群の原因遺伝子であると結論づけた.その産物であるUVSSAは,ユビキチン鎖分解酵素USP7と複合体を形成すること,紫外線の照射に関係なく転写と共役した修復にかかわるタンパク質であるERCC8と相互作用すること,紫外線を照射した細胞より調製したクロマチン画分において転写と共役した修復にかかわるタンパク質であるERCC6およびRNAポリメラーゼIIと相互作用することが明らかになった.また,UVSSAはUSP7と協調して紫外線を照射したのちのERCC6の安定化と低リン酸化型RNAポリメラーゼIIの回復に関与していた.
はじめに
紫外線高感受性症候群(ultraviolet -sensitive syndrome)は劣性の遺伝性疾患であり,日光過敏性を示し皮膚にシミやソバカスを多発する.紫外線によるDNAの損傷はヌクレオチド除去修復(nucleotide excision repair:NER)により除去されるが,紫外線高感受性症候群ではその副経路である転写と共役した修復1)(transcription-coupled repair:TCR)が欠損しており,転写の鋳型鎖にあるDNA損傷が迅速に除去されないためRNAポリメラーゼIIがDNA損傷部位で停止したまま転写を再開できない.紫外線高感受性症候群には少なくとも3つの遺伝的な相補性群が存在するが,このうち2つの相補性群の原因遺伝子はERCC8遺伝子(CSA遺伝子)およびERCC6遺伝子(CSB遺伝子)であることが報告されている2-5).ERCC8遺伝子およびERCC6遺伝子は転写と共役した修復を欠損する別の遺伝性疾患であるCockayne症候群の原因遺伝子でもある.紫外線高感受性症候群では臨床症状は比較的軽微なのに対し,Cockayne症候群では成長障害,精神神経症状,早期老化など重篤な症状がみられる.紫外線高感受性症候群とCockayne症候群のどちらにおいても紫外線によりひき起こされる転写と共役した修復が欠損しているにもかかわらず症状に違いの生じる理由について,Cockayne症候群では酸化的なDNA損傷の修復や転写についても影響をうけている可能性が考えられているが,結論はまだでていない.転写と共役した修復は転写の鋳型鎖におけるDNA損傷によりRNAポリメラーゼIIが停止することが引き金になっていると考えられ,ERCC8およびERCC6の関与することがわかっているが,その分子機構は明らかでない.
今回,筆者らは,原因遺伝子のわかっていない紫外線高感受性症候群A群の原因遺伝子の同定を試みた.その遺伝子産物は転写と共役した修復にかかわる新たなタンパク質であり,その機能を解析することは転写と共役した修復の分子機構の解明につながるとともに,紫外線高感受性症候群とCockayne症候群との臨床症状の違いを説明する一助になると考えられる.
1.紫外線高感受性症候群A群の原因遺伝子の同定
紫外線高感受性症候群A群の患者に由来する繊維芽細胞であるKps3細胞3) は,紫外線に高感受性を示し,紫外線を照射したのちにRNA合成の回復がみられないという特徴がある.紫外線高感受性症候群A群の原因遺伝子をクローニングするため,Kps3細胞に対して微小核融合法6) によりヒトの染色体を1本ずつ導入し紫外線に対し抵抗性を示すクローンの単離を試みたが,正常な細胞と同じ程度の紫外線への抵抗性を示すクローンは得られなかった.そこでつぎに,マウスA9細胞より調製した微小核とKps3細胞とを融合しマウスの染色体をランダムに導入した(図1).紫外線を定期的に照射しながら6週間にわたり培養した結果,紫外線に抵抗性を示す4つの独立したクローンが得られた.これらのクローンは正常な細胞と同じ程度の紫外線への抵抗性と紫外線を照射したのちのRNA合成の回復を示した.
これら4つのクローンに導入されたマウスのDNAを同定するためCGHアレイ解析を行った.4つのうち2つのクローンにはマウス第5染色体の全体(このうち1つには,さらに第12染色体と第17染色体の一部も)が導入されていた.残りの2つのクローンにはマウス第5染色体の断片が導入されていた.導入されたDNAで共通している領域は600 kbで11個の遺伝子が存在していた.
つぎに,この領域をカバーする6つのBACクローンをKps3細胞に導入して紫外線に対する抵抗性を調べたところ,1つの遺伝子(4933407H18Rik)のみを含むBACクローンの導入により紫外線への抵抗性が生じた.この4933407H18RikのヒトにおけるホモログはKIAA1530 7) であり,紫外線高感受性症候群A群の患者に由来する細胞においてこのKIAA1530のcDNAを解析したところ,血縁関係のない日本人の患者2人3,8) においてホモ接合性の同じ変異,また,イラン人の患者2) で別のホモ接合性の変異がみつかった.これらの変異はともに早期翻訳終結をひき起こす.また,KIAA1530のcDNAをKps3細胞に導入することにより,紫外線への抵抗性と紫外線の照射ののちのRNA合成の回復が正常な細胞と同じ程度にまで回復した.以上の結果は,KIAA1530が紫外線高感受性症候群A群の原因遺伝子であることを示しておりUVSSA遺伝子と命名した.
紫外線高感受性症候群の患者においてCockayne症候群の原因遺伝子であるERCC6遺伝子およびERCC8遺伝子のホモ接合性の変異がみつかっている.そこで,Cockayne症候群の臨床症状を示し紫外線によりひき起こされる転写と共役した修復を欠損しているがERCC6遺伝子およびERCC8遺伝子に変異をもたない患者3例について,UVSSA遺伝子のもつORFの塩基配列を調べたが変異はみつからなかった.
UVSSA遺伝子はヒト第4染色体p16.3に座位し709アミノ酸残基からなるタンパク質をコードしている.UVSSAは,N末端側にVHS/ENTHドメイン,C末端側にDUF2043ドメインをもち,シロイヌナズナ,イネ,線虫においてホモログが同定されているがその機能はわかっていない.
2.UVSSAと転写と共役した修復にかかわるタンパク質との相互作用
転写と共役した修復におけるUVSSAの機能を明らかにするため,UVSSAと相互作用するタンパク質の同定を試みた.エピトープタグを付加したUVSSAをHEK293細胞で発現させて免疫沈降を行い共沈するタンパク質を質量分析法により解析したところ,ユビキチン鎖分解酵素であるUSP7が同定された.USP7のsiRNAを導入した正常な細胞は紫外線に対し感受性となり紫外線の照射ののちのRNA合成の回復が低下したことから,USP7が転写と共役した修復に関与することが示された.興味深いことに,USP7のsiRNAを導入した細胞ではUSP7だけではなくUVSSAの量も減少していることがわかった.逆に,UVSSAのノックダウンではUSP7は減少しなかった.これらの結果は,細胞においてUSP7はUVSSAより大量に存在し,UVSSAはUSP7と複合体を形成することにより安定化されていることを示していた.
つぎに,UVSSAとほかの転写と共役した修復にかかわるタンパク質との相互作用を調べた.紫外線高感受性症候群A群の患者に由来するKps3細胞においてエピトープタグを付加したUVSSAを発現させ免疫沈降を行ったところ,可溶性画分ではERCC8は紫外線の照射に関係なくUVSSAと共沈したが,ERCC6およびRNAポリメラーゼIIは共沈しなかった.一方,紫外線を照射した細胞より調製したクロマチン画分ではERCC6,ERCC8,RNAポリメラーゼIIの共沈がみられた.ERCC6はDNA損傷部位で停止したRNAポリメラーゼIIに対し転写と共役した修復にかかわるタンパク質をリクルートするのに必須であることが知られている9).そこで,UVSSA-USP7複合体あるいはERCC8の紫外線を照射したのちのRNAポリメラーゼIIへの結合がERCC6に依存するかどうかを調べるため,ERCC6を欠損しているCockayne症候群B群の患者に由来する細胞においてエピトープタグを付加したUVSSAを発現させ免疫沈降を行った.この場合には,UVSSAとUSP7,ERCC8の共沈はさきと同様にみられたが,RNAポリメラーゼIIとの共沈は紫外線を照射した細胞より調製したクロマチン画分でもみられなかった.これらの結果は,UVSSA-USP7複合体およびERCC8はERCC6に依存的にDNA損傷部位で停止したRNAポリメラーゼIIに結合することを示していた.ERCC8を欠損しているCockayne症候群A群の患者に由来する細胞においては,USP7は紫外線の照射にかかわらずUVSSAと共沈したが,RNAポリメラーゼIIとの共沈は紫外線を照射した細胞より調製したクロマチン画分でもみられなかった.これらの結果は,DNA損傷部位で停止したRNAポリメラーゼIIおよびERCC6へのUVSSA-USP7複合体の結合はERCC8に依存的であることを示していた.
3.UVSSA-USP7複合体のERCC6の安定性への関与
紫外線の照射により生じるDNA損傷により,RNAポリメラーゼIIによる転写の伸長が阻害されるだけでなく,RNAポリメラーゼIIの最大サブユニットRPB1のC末端領域が低リン酸化型であるRNAポリメラーゼII aが減少する.このRNAポリメラーゼII aは転写の再開に必要であり,紫外線の照射ののち時間とともに回復するが,転写と共役した修復を欠損したCockayne症候群の患者に由来する細胞では回復しないことが報告されている10).Kps3細胞とUVSSAを発現させて正常化したKps3細胞とでRPB1のリン酸化状態を調べると,正常化したKps3細胞では紫外線の照射ののちRNAポリメラーゼII aはいったん減少したあと回復したのに対し,Kps3細胞ではRNAポリメラーゼII aは減少したまま回復しなかった.この結果は,ERCC6,ERCC8にくわえUVSSAもRNAポリメラーゼII aの回復に必要であることを示していた.
紫外線の照射ののちのタンパク質の量的な変化としては,ERCC6もKps3細胞とUVSSAを発現させて正常化したKps3細胞とで差がみられた.正常化したKps3細胞では紫外線を照射したのちのERCC6の減少はわずかなのに対し,Kps3細胞では大幅な減少がみられた.この結果は,UVSSAは転写と共役した修復においてERCC6を安定化するのに重要な役割をはたしていることを示唆した.紫外線を照射したのちのERCC6の減少は,UVSSAをノックダウンした細胞のみならずUSP7をノックダウンした細胞においても観察された.一方,UVSSAを欠損しているKps3細胞においてUSP7をノックダウンしてもERCC6の減少に変化はなかった.これらの結果より,紫外線の照射ののちにERCC6が分解しないようUVSSAとUSP7とが協調してはたらいているものと考えられた.また,プロテアソーム阻害剤MG132が存在するとKps3細胞における紫外線の照射ののちのERCC6の減少が抑制されるとともに,RNAポリメラーゼII aの回復もみられた.
以上の結果より,UVSSAが機能しないと,紫外線の照射ののちERCC6はユビキチン化されてプロテアソームにより分解され,そのためRNAポリメラーゼII aの回復は起こらないことが示された(図2).
おわりに
ERCC6はDNA損傷部位で停止したRNAポリメラーゼIIに修復にかかわるほかのタンパク質をリクルートするのに必須であり,また,転写の再開にも必要なタンパク質である.今回の結果より,UVSSA-USP7複合体は紫外線を照射したのちのERCC6の安定化に関与することが示された.このERCC6の安定化によりRNAポリメラーゼII aが回復し転写が再開するものと考えられた.一方,紫外線高感受性症候群A群の患者に由来するKps3細胞では転写の鋳型鎖にあるDNA損傷の除去がみられないことから,UVSSAは転写の再開だけでなくDNA損傷を除去する過程においても必要である.その機能がさきに述べたようなERCC6の安定化によるものなのか,あるいは,別のはたらきがあるのかはまだ不明である.今後,転写と共役した修復にかかわるタンパク質として新たにくわわったUVSSA-USP7複合体の機能を解析することにより,転写と共役した修復の分子機構の明らかになることが期待される.
文 献
- Hanawalt, P. C. & Spivak, G.: Transcription-coupled DNA repair: two decades of progress and surprises. Nat. Rev. Mol. Cell Biol., 9, 958-970 (2008)[PubMed]
- Spivak, G.: UV-sensitive syndrome. Mutat. Res., 577, 162-169 (2005)[PubMed]
- Itoh, T., Ono, T. & Yamaizumi, M.: A new UV-sensitive syndrome not belonging to any complementation groups of xeroderma pigmentosum or Cockayne syndrome: siblings showing biochemical characteristics of Cockayne syndrome without typical clinical manifestations. Mutat. Res., 314, 233-248 (1994)[PubMed]
- Horibata, K., Iwamoto, Y., Kuraoka, I. et al.: Complete absence of Cockayne syndrome group B gene product gives rise to UV-sensitive syndrome but not Cockayne syndrome. Proc. Natl. Acad. Sci. USA, 101, 15410-15415 (2004)[PubMed]
- Nardo, T., Oneda, R., Spivak, G. et al.: A UV-sensitive syndrome patient with a specific CSA mutation reveals separable roles for CSA in response to UV and oxidative DNA damage. Proc. Natl. Acad. Sci. USA, 106, 6209-6214 (2009)[PubMed]
- Sanford, J. A. & Stubblefield, E.: General protocol for microcell-mediated chromosome transfer. Somat. Cell Mol. Genet., 13, 279-284 (1987)[PubMed]
- Nagase, T., Kikuno, R., Ishikawa, K. et al.: Prediction of the coding sequences of unidentified human genes. XVII. The complete sequences of 100 new cDNA clones from brain which code for large proteins in vitro. DNA Res., 7, 143-150 (2000)[PubMed]
- Itoh, T., Linn, S., Ono, T. et al.: Reinvestigation of the classification of five cell strains of xeroderma pigmentosum group E with reclassification of three of them. J. Invest. Dermatol., 114, 1022-1029 (2000)[PubMed]
- Fousteri, M., Vermeulen, W., van Zeeland, A. A. et al.: Cockayne syndrome A and B proteins differentially regulate recruitment of chromatin remodeling and repair factors to stalled RNA polymerase II in vivo. Mol. Cell, 23, 471-482 (2006)[PubMed]
- Rockx, D. A., Mason, R., van Hoffen, A. et al.: UV-induced inhibition of transcription involves repression of transcription initiation and phosphorylation of RNA polymerase II. Proc. Natl. Acad. Sci. USA, 97, 10503-10508 (2000)[PubMed]
著者プロフィール
略歴:1990年 東京大学大学院薬学系研究科 修了,国立がんセンター研究所 リサーチレジデント,大阪大学細胞生体工学センター 助手,助教授を経て,2002年より大阪大学大学院生命機能研究科 准教授.
研究テーマ:ヌクレオチド除去修復の分子機構.
田中 亀代次(Kiyoji Tanaka)
大阪大学大学院生命機能研究科 特任教授.
© 2012 西條将文・田中亀代次 Licensed under CC 表示 2.1 日本