NLRC4を介したインターロイキン1βの産生は病原細菌と腸内常在細菌との識別および生体防御に重要である
鎌田信彦・Gabriel Núñez
(米国Michigan大学Medical School,Department of Pathology)
email:鎌田信彦
DOI: 10.7875/first.author.2012.047
NLRC4-driven production of IL-1β discriminates between pathogenic and commensal bacteria and promotes host intestinal defense.
Luigi Franchi, Nobuhiko Kamada, Yuumi Nakamura, Aaron Burberry, Peter Kuffa, Shiho Suzuki, Michael H Shaw, Yun-Gi Kim, Gabriel Núñez
Nature Immunology, 13, 449-456 (2012)
腸管に常在するマクロファージや樹状細胞などの単核貪食細胞は細菌の抗原に対して不応答性を示し,腸内常在細菌による刺激によりTNFやインターロイキン6などの炎症性サイトカインを産生しない.しかしながら,腸管の単核貪食細胞はやはり炎症性サイトカインのひとつであるインターロイキン1βについて,活性をもたないインターロイキン1β前駆体を腸内常在細菌に依存して恒常的に発現していることが明らかになった.腸内常在細菌はインターロイキン1β前駆体の活性化を誘導せず,その結果,活性をもつインターロイキン1β成熟体は細胞外へ分泌されない.一方,Salmonella菌などの病原細菌はNLRC4インフラマソームを介してインターロイキン1βの活性化および分泌を誘導していた.このように,NLRC4は病原細菌と腸内常在細菌との識別に重要であり,NLRC4-インターロイキン1β経路を介した免疫反応は,病原細菌に特異的な宿主生体防御に関与していた.
腸管は体内に位置しながらつねに外界に接する特殊な臓器であり,腸内細菌や食餌などの外来性の抗原につねに曝露されている.腸管はそれら外来性の抗原と共生するため,ほかの臓器とは異なる特殊な抑制性の免疫系をもち,腸内常在細菌の抗原に対して免疫寛容を誘導する.一方で,病原性をもつ細菌に感染したときには即時に炎症性の免疫反応を誘導し病原細菌を排除する必要がある.このように,腸管では病原細菌と腸内常在細菌とを識別し,炎症誘導と免疫寛容という相反する免疫反応をたくみに制御する分子機構が存在するものと考えられる.
マクロファージや樹状細胞などの単核貪食細胞は細菌などの外来性の抗原に対する自然免疫のおもな担当細胞であり感染防御において重要な役割をはたしている.単核貪食細胞は生体のあらゆる場所に存在しているが,それらは均一な集団ではなく,局在する組織により,クッパー細胞(肝臓),肺胞マクロファージ(肺),ミクログリア(脳)など,異なる名称でよばれている.これらの単核貪食細胞は,形態,機能,表面抗原の発現などの点で異なり,おのおのの組織において固有のはたらきを担っているものと考えられる.このような単核貪食細胞の多様性は生体の防御と恒常性の維持に重要な役割をはたしていると考えられる.
近年,腸管に常在する単核貪食細胞が炎症に抑制的にはたらく性質をもつことがあいついで報告され,腸管という特殊な(つねに抗原に曝されている)組織における恒常性の維持に重要な役割をはたしていることが明らかになってきた1,2).その特殊な性質の例として,炎症や免疫反応の制御タンパク質として重要な役割をはたすサイトカインの産生能における特殊性があげられる.骨髄や末梢血に存在する単球や,単球から試験管内で分化させたマクロファージなどは,リポ多糖など細菌性の刺激に強力に反応し,TNF(tumor necrosis factor,腫瘍壊死因子)やインターロイキン6などの炎症性サイトカインを多量に産生する.一方で,腸管に常在する単核貪食細胞は細菌性の刺激に対してTNFやインターロイキン6を産生しない1,2).すなわち,腸管の単核貪食細胞に特有の細菌性の刺激に対する低い応答性は,腸内常在細菌に対する過剰な免疫応答を回避し腸管における恒常性の維持に重要な役割をはたしているものと考えられる.この特異的な低応答性は,単純に腸内常在細菌に持続的に刺激されることにより免疫寛容が誘導されているわけではなかった.実際に,無菌マウスの腸管の単核貪食細胞を解析した結果,通常のマウスに由来する腸管の単核貪食細胞と同様に,細菌性の刺激に対し低い応答性を示した.
腸管は腸内常在細菌に対しては免疫反応を誘導しないようにする一方,病原細菌に感染したときにはすみやかに反応し,炎症の誘導を介して感染した細菌を排除する必要がある.では,腸管の免疫系は腸内常在細菌と病原細菌とをどのように見分けて異なる免疫応答(免疫寛容と炎症誘導)を制御しているのであろうか? さきに述べたように,腸管の単核貪食細胞はTNFやインターロイキン6などの炎症性サイトカインを産生しない.一方で,腸管の単核貪食細胞は同じく炎症性サイトカインのひとつであるインターロイキン1βを恒常的に発現していることが明らかになった.しかしながら,機能的なインターロイキン1βが産生されているわけではなく,これは,インターロイキン1βがほかの炎症性サイトカインとは異なる特殊な活性化の機序をもつことに起因していた.
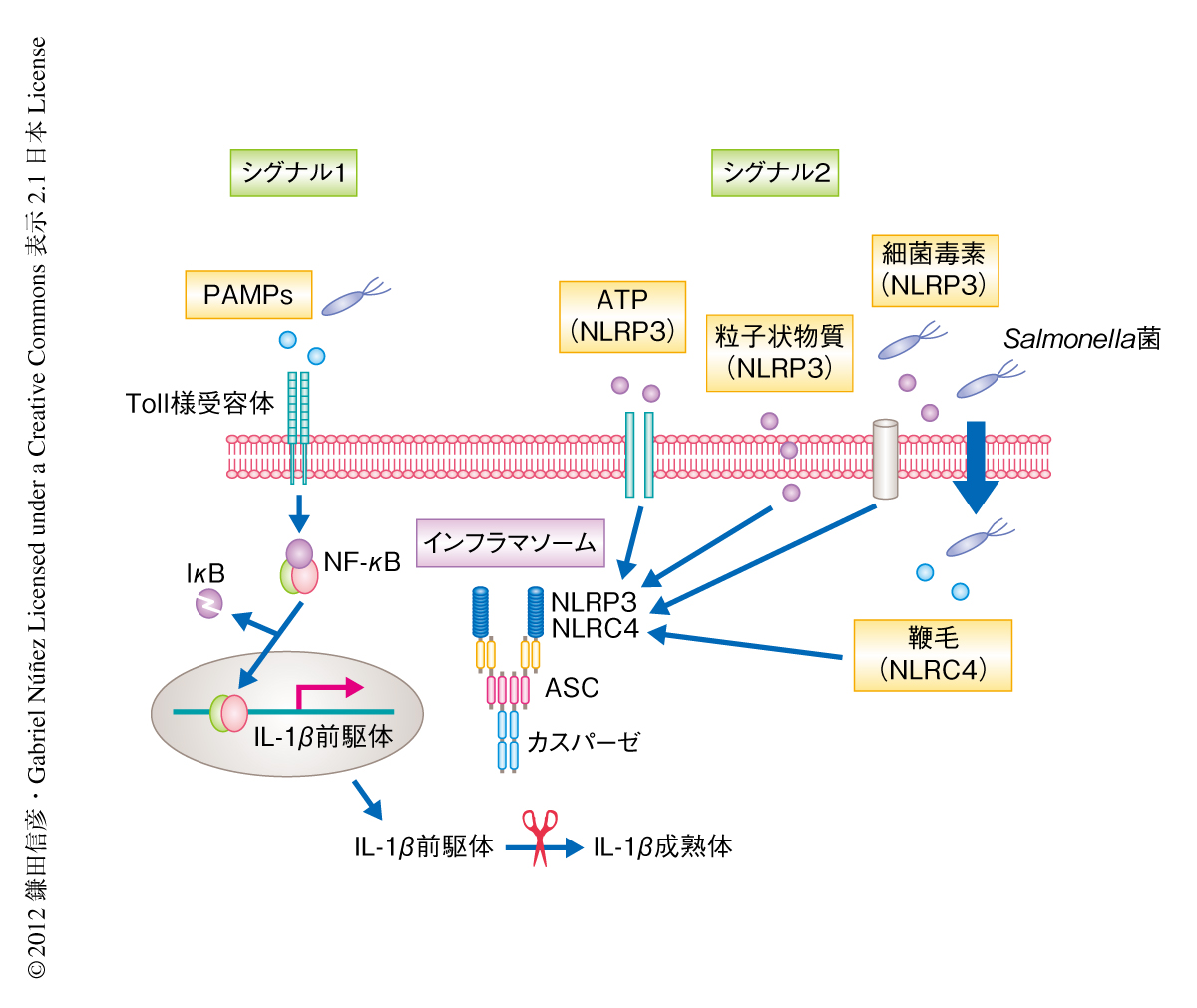
TNFやインターロイキン6などは細菌性の刺激などにより誘導され,一義的に細胞外へと分泌されて炎症反応をひき起こす.一方で,インターロイキン1βは同様に細菌性の刺激などにより誘導されるが,前駆体として細胞に蓄積される.インターロイキン1β前駆体はそのままでは活性をもたず細胞外にも分泌されない.その活性化にはカスパーゼ1とよばれるタンパク質分解酵素による切断が不可欠であり,カスパーゼ1によりインターロイキン1β前駆体は切断されインターロイキン1β成熟体となって細胞外へと分泌される3)(図1).興味深いことに,通常のマウスと無菌マウスとの比較から,腸管の単核貪食細胞におけるインターロイキン1β前駆体の恒常的な発現誘導は腸内常在細菌により制御されていることが明らかになった.
このように,腸管の単核貪食細胞は腸内常在細菌に依存して恒常的にインターロイキン1β前駆体を発現しているが,腸内常在細菌による刺激ではその活性化は起こらず,TNFやインターロイキン6などほかの炎症性サイトカインと同様に,正常な腸管では活性をもつインターロイキン1β成熟体は腸管の単核貪食細胞からは産生されないことが示唆された.
では,なぜ腸管の単核貪食細胞はインターロイキン1β前駆体を細胞に恒常的に蓄えているのであろうか? この恒常的な備蓄は病原細菌に感染したときの即時的な炎症反応の誘導に関与しているのではないかとの仮説をたて,腸管の単核貪食細胞に対し病原細菌による刺激を行った.大腸菌などの腸内常在細菌は腸管の単核貪食細胞においてTNFやインターロイキン6などを誘導せず,インターロイキン1βの活性化も誘導しなかった.また,腸管にSalmonella菌などの病原細菌が感染したときも,大腸菌と同様に,腸管の単核貪食細胞においてTNFやインターロイキン6は産生されなかった.この結果は,腸管の単核貪食細胞は病原細菌が感染したときにも細菌性の抗原に対する低い応答性を維持していることを示していた.しかしながら,Salmonella菌による刺激は腸管の単核貪食細胞におけるインターロイキン1β成熟体の産生を強く誘導することがわかった.すなわち,腸管の単核貪食細胞において,活性をもつインターロイキン1β成熟体はSalmonella菌などの病原細菌のみにより誘導されうることが明らかになった.
興味深いことに,この病原細菌に特異的なインターロイキン1βの活性化は,マウスのみならずヒトの腸管の単核貪食細胞でも同様に認められた.ヒトの腸管に常在するマクロファージは,マウスと同様に,末梢血の単球と比較してリポ多糖や大腸菌,Salmonella菌などに対して低応答性であり,TNFやインターロイキン6なども産生しなかった.しかしながら,ヒトの腸管のマクロファージもSalmonella菌のみに強く反応しインターロイキン1β成熟体を産生した.このように,腸管の単核貪食細胞からのインターロイキン1βの産生は種をこえて保存された,宿主による病原細菌と腸内常在細菌に対する異なる免疫反応であり,腸管の“免疫寛容と炎症誘導”の使い分けを説明する切り口ひとつであるものと考えられた.また,腸管の単核貪食細胞におけるインターロイキン1β前駆体の誘導は腸内常在細菌に依存的であることから,腸内常在細菌は病原細菌に対抗する炎症性の免疫反応の“下準備”を行っており,間接的に病原細菌の排除にかかわっていることが示唆された.
つぎに疑問となったのは,病原細菌によるインターロイキン1βの活性化の機構であった.さきに述べたように,インターロイキン1βの活性化および細胞外への分泌にはカスパーゼ1によるインターロイキン前駆体の切断が不可欠である3).近年,カスパーゼ1を介したインターロイキン1βの活性化にはインフラマソームとよばれるタンパク質複合体が重要な役割をはたしていることが明らかになってきた3)(図1).インフラマソームは,Nod様受容体(Nod-like receptor:NLR)ファミリーに属するNLRP1,NLRP3,NLRC4などの細胞内受容体により病原細菌やウイルスなどの構成成分あるいは細胞障害などの生体に対する危険信号を感知し,カスパーゼ1の活性化とインターロイキン1βの成熟を誘導することが知られている.NLRP3はもっとも研究の進んでいるインフラマソームの構成タンパク質で,多くの炎症性疾患への関与が報告されている3).NLRP3は細胞外のATPなど細胞障害にともなう危険信号や細菌毒素,粒子状物質などを感知する3)(図1).しかしながら,腸管の単核貪食細胞はATPや細菌毒素,シリカなどの粒子状物質には反応せず,カスパーゼ1の活性化およびインターロイキン1βの成熟の誘導も認められなかった.これはすなわち,腸管の単核貪食細胞ではNLRP3インフラマソームは機能していないことを示唆していた.
では,腸管の単核貪食細胞において活性をもつインターロイキン1βの誘導を担うインフラマソームはいったい何か? そこで,腸管の単核貪食細胞において活性をもつインターロイキン1βの誘導をひき起こす病原細菌Salmonella菌の構造に注目した.Salmonella菌のもつ鞭毛はNLRC4の活性化を誘導することが報告されている4,5).NLRC4ノックアウトマウスの腸管の単核貪食細胞を用いてその役割を検討した.その結果,予想したとおり,NLRC4を欠損した腸管の単核貪食細胞ではSalmonella菌の感染によるカスパーゼ1の活性化およびインターロイキン1βの成熟の誘導が著明に減弱していた.さらに,鞭毛の抗原を欠損したSalmonella菌変異株や,鞭毛の抗原の宿主細胞への輸送に関与するIII型分泌機構を欠損したSalmonella菌変異株では,野生型のSalmonella菌に認められた腸管の単核貪食細胞におけるインターロイキン1βの誘導が障害されたことからも,病原細菌によるインターロイキン1βの誘導はNLRC4を介していることが強く示唆された.また,この鞭毛を介したインターロイキン1βの誘導はヒトの腸管の単核貪食細胞でも認められたことから,種をこえて保存された非常に重要な系であると考えられた.
では実際に,Salmonella菌が感染したときの腸管の単核貪食細胞におけるNLRC4-インターロイキンβ経路の活性化はどのように生体防御を担っているのであろうか? この疑問に答えるため,さまざまなノックアウトマウスを用いてin vivoでのSalmonella菌の感染モデルにおけるNLRC4-インターロイキン1β経路の役割を検討した.その結果,予想どおり,NLRC4ノックアウトマウスおよびインターロイキン1受容体ノックアウトマウスは野生型マウスに比べSalmonella菌の感染に対する感受性の高いことがわかった.両方のノックアウトマウスとも腸管の炎症局所におけるSalmonella菌の排除が障害されており,結果として,Salmonella菌の体循環への移行が亢進し菌血症により死にいたっていた.この分子機構のひとつとして,インターロイキン1βによる炎症局所への好中球の遊走の亢進が考えられた.Salmonella菌に感染したとき,インターロイキン1βは血管内皮細胞における好中球接着分子の発現を亢進させ,好中球の腸管局所への遊走を誘導しているものと考えられる.実際に,抗体により好中球を除去したマウスは,NLRC4ノックアウトマウスおよびインターロイキン1受容体ノックアウトマウスと同様の表現型を示した.
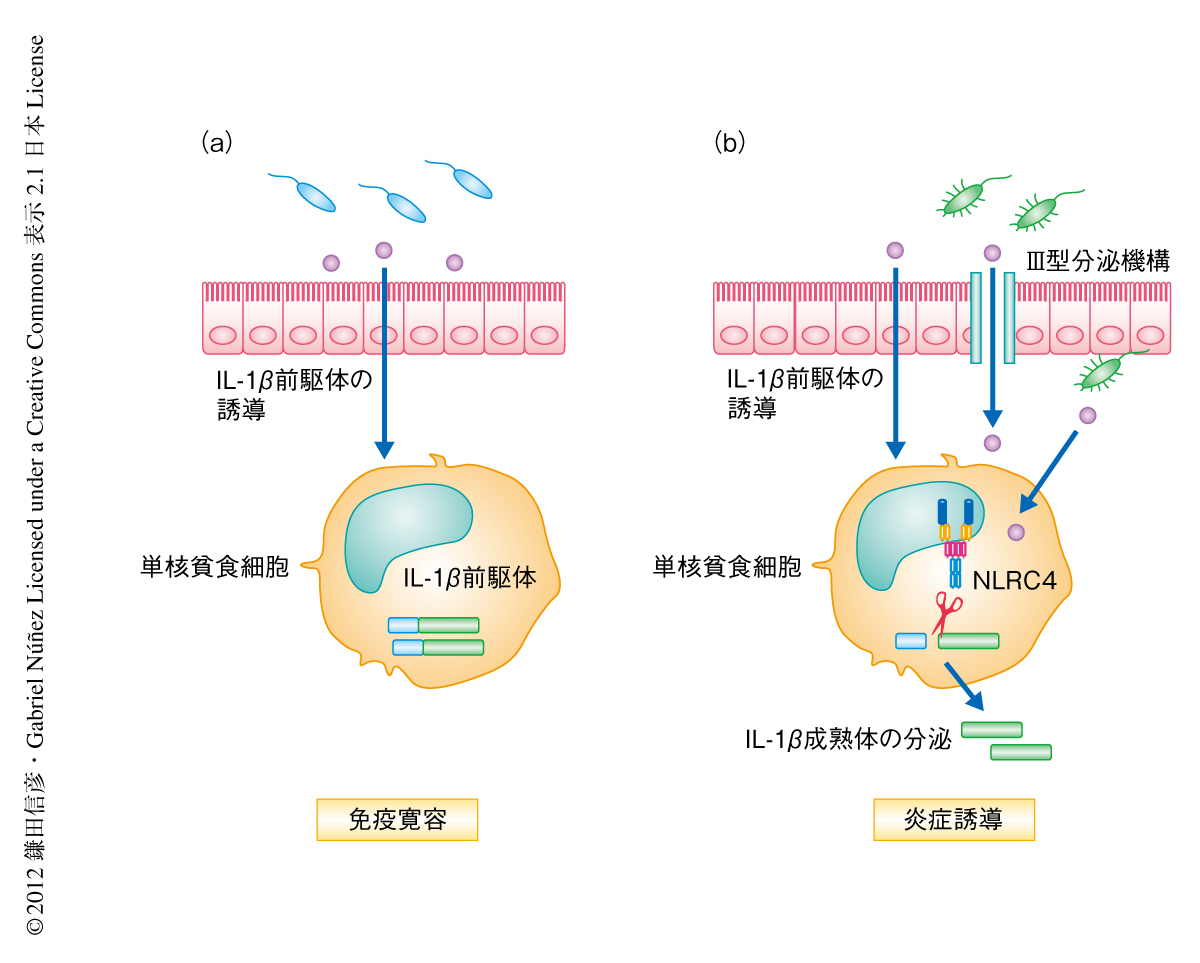
今回の報告により,腸管において病原細菌と腸内常在細菌とを識別する分子機構の一端が明らかになった.腸管の単核貪食細胞はインターロイキン1β前駆体を恒常的に備蓄しているが,腸内常在細菌などの刺激ではそれらは不活性な前駆体のままであり,その結果,腸管の単核貪食細胞は腸内常在細菌に対する過剰な免疫反応を誘導せず腸管における恒常性を維持している(図2a).一方で,Salmonella菌などの病原細菌が感染したときには,NLRC4による病原細菌の特異的な認識を介して備蓄してあるインターロイキン1β前駆体を活性化し,すみやかな炎症性の免疫反応を誘導し病原細菌を排除する(図2b).このように,NLRC4は腸管に常在する単核貪食細胞において,病原細菌と腸内常在細菌との識別に重要な役割をはたしているものと考えられた.
略歴:2007年 慶應義塾大学大学院医学研究科にて博士号取得,同年より慶應義塾大学医学部 助教,2009年より米国Michigan大学Medical Schoolリサーチフェロー.
研究テーマ:腸管感染症および炎症性腸疾患における宿主免疫と腸内細菌の役割.
抱負:腸内細菌の腸疾患における役割や,腸内細菌の認識に関与するマクロファージおよび樹状細胞の機能を明らかにし,感染症や炎症性腸疾患の病態解明および新規の治療法の開発に貢献したい.
Gabriel Núñez
米国Michigan大学Medical School教授.
© 2012 鎌田信彦・Gabriel Núñez Licensed under CC 表示 2.1 日本
(米国Michigan大学Medical School,Department of Pathology)
email:鎌田信彦
DOI: 10.7875/first.author.2012.047
NLRC4-driven production of IL-1β discriminates between pathogenic and commensal bacteria and promotes host intestinal defense.
Luigi Franchi, Nobuhiko Kamada, Yuumi Nakamura, Aaron Burberry, Peter Kuffa, Shiho Suzuki, Michael H Shaw, Yun-Gi Kim, Gabriel Núñez
Nature Immunology, 13, 449-456 (2012)
要 約
腸管に常在するマクロファージや樹状細胞などの単核貪食細胞は細菌の抗原に対して不応答性を示し,腸内常在細菌による刺激によりTNFやインターロイキン6などの炎症性サイトカインを産生しない.しかしながら,腸管の単核貪食細胞はやはり炎症性サイトカインのひとつであるインターロイキン1βについて,活性をもたないインターロイキン1β前駆体を腸内常在細菌に依存して恒常的に発現していることが明らかになった.腸内常在細菌はインターロイキン1β前駆体の活性化を誘導せず,その結果,活性をもつインターロイキン1β成熟体は細胞外へ分泌されない.一方,Salmonella菌などの病原細菌はNLRC4インフラマソームを介してインターロイキン1βの活性化および分泌を誘導していた.このように,NLRC4は病原細菌と腸内常在細菌との識別に重要であり,NLRC4-インターロイキン1β経路を介した免疫反応は,病原細菌に特異的な宿主生体防御に関与していた.
はじめに
腸管は体内に位置しながらつねに外界に接する特殊な臓器であり,腸内細菌や食餌などの外来性の抗原につねに曝露されている.腸管はそれら外来性の抗原と共生するため,ほかの臓器とは異なる特殊な抑制性の免疫系をもち,腸内常在細菌の抗原に対して免疫寛容を誘導する.一方で,病原性をもつ細菌に感染したときには即時に炎症性の免疫反応を誘導し病原細菌を排除する必要がある.このように,腸管では病原細菌と腸内常在細菌とを識別し,炎症誘導と免疫寛容という相反する免疫反応をたくみに制御する分子機構が存在するものと考えられる.
1.腸管の単核貪食細胞は腸内常在細菌に対する応答性が低い
マクロファージや樹状細胞などの単核貪食細胞は細菌などの外来性の抗原に対する自然免疫のおもな担当細胞であり感染防御において重要な役割をはたしている.単核貪食細胞は生体のあらゆる場所に存在しているが,それらは均一な集団ではなく,局在する組織により,クッパー細胞(肝臓),肺胞マクロファージ(肺),ミクログリア(脳)など,異なる名称でよばれている.これらの単核貪食細胞は,形態,機能,表面抗原の発現などの点で異なり,おのおのの組織において固有のはたらきを担っているものと考えられる.このような単核貪食細胞の多様性は生体の防御と恒常性の維持に重要な役割をはたしていると考えられる.
近年,腸管に常在する単核貪食細胞が炎症に抑制的にはたらく性質をもつことがあいついで報告され,腸管という特殊な(つねに抗原に曝されている)組織における恒常性の維持に重要な役割をはたしていることが明らかになってきた1,2).その特殊な性質の例として,炎症や免疫反応の制御タンパク質として重要な役割をはたすサイトカインの産生能における特殊性があげられる.骨髄や末梢血に存在する単球や,単球から試験管内で分化させたマクロファージなどは,リポ多糖など細菌性の刺激に強力に反応し,TNF(tumor necrosis factor,腫瘍壊死因子)やインターロイキン6などの炎症性サイトカインを多量に産生する.一方で,腸管に常在する単核貪食細胞は細菌性の刺激に対してTNFやインターロイキン6を産生しない1,2).すなわち,腸管の単核貪食細胞に特有の細菌性の刺激に対する低い応答性は,腸内常在細菌に対する過剰な免疫応答を回避し腸管における恒常性の維持に重要な役割をはたしているものと考えられる.この特異的な低応答性は,単純に腸内常在細菌に持続的に刺激されることにより免疫寛容が誘導されているわけではなかった.実際に,無菌マウスの腸管の単核貪食細胞を解析した結果,通常のマウスに由来する腸管の単核貪食細胞と同様に,細菌性の刺激に対し低い応答性を示した.
2.腸管の単核貪食細胞は腸内常在細菌に依存してインターロイキン1β前駆体を恒常的に発現する
腸管は腸内常在細菌に対しては免疫反応を誘導しないようにする一方,病原細菌に感染したときにはすみやかに反応し,炎症の誘導を介して感染した細菌を排除する必要がある.では,腸管の免疫系は腸内常在細菌と病原細菌とをどのように見分けて異なる免疫応答(免疫寛容と炎症誘導)を制御しているのであろうか? さきに述べたように,腸管の単核貪食細胞はTNFやインターロイキン6などの炎症性サイトカインを産生しない.一方で,腸管の単核貪食細胞は同じく炎症性サイトカインのひとつであるインターロイキン1βを恒常的に発現していることが明らかになった.しかしながら,機能的なインターロイキン1βが産生されているわけではなく,これは,インターロイキン1βがほかの炎症性サイトカインとは異なる特殊な活性化の機序をもつことに起因していた.
TNFやインターロイキン6などは細菌性の刺激などにより誘導され,一義的に細胞外へと分泌されて炎症反応をひき起こす.一方で,インターロイキン1βは同様に細菌性の刺激などにより誘導されるが,前駆体として細胞に蓄積される.インターロイキン1β前駆体はそのままでは活性をもたず細胞外にも分泌されない.その活性化にはカスパーゼ1とよばれるタンパク質分解酵素による切断が不可欠であり,カスパーゼ1によりインターロイキン1β前駆体は切断されインターロイキン1β成熟体となって細胞外へと分泌される3)(図1).興味深いことに,通常のマウスと無菌マウスとの比較から,腸管の単核貪食細胞におけるインターロイキン1β前駆体の恒常的な発現誘導は腸内常在細菌により制御されていることが明らかになった.
このように,腸管の単核貪食細胞は腸内常在細菌に依存して恒常的にインターロイキン1β前駆体を発現しているが,腸内常在細菌による刺激ではその活性化は起こらず,TNFやインターロイキン6などほかの炎症性サイトカインと同様に,正常な腸管では活性をもつインターロイキン1β成熟体は腸管の単核貪食細胞からは産生されないことが示唆された.
3.腸管の単核貪食細胞は病原細菌による刺激により活性をもつインターロイキン1βを産生する
では,なぜ腸管の単核貪食細胞はインターロイキン1β前駆体を細胞に恒常的に蓄えているのであろうか? この恒常的な備蓄は病原細菌に感染したときの即時的な炎症反応の誘導に関与しているのではないかとの仮説をたて,腸管の単核貪食細胞に対し病原細菌による刺激を行った.大腸菌などの腸内常在細菌は腸管の単核貪食細胞においてTNFやインターロイキン6などを誘導せず,インターロイキン1βの活性化も誘導しなかった.また,腸管にSalmonella菌などの病原細菌が感染したときも,大腸菌と同様に,腸管の単核貪食細胞においてTNFやインターロイキン6は産生されなかった.この結果は,腸管の単核貪食細胞は病原細菌が感染したときにも細菌性の抗原に対する低い応答性を維持していることを示していた.しかしながら,Salmonella菌による刺激は腸管の単核貪食細胞におけるインターロイキン1β成熟体の産生を強く誘導することがわかった.すなわち,腸管の単核貪食細胞において,活性をもつインターロイキン1β成熟体はSalmonella菌などの病原細菌のみにより誘導されうることが明らかになった.
興味深いことに,この病原細菌に特異的なインターロイキン1βの活性化は,マウスのみならずヒトの腸管の単核貪食細胞でも同様に認められた.ヒトの腸管に常在するマクロファージは,マウスと同様に,末梢血の単球と比較してリポ多糖や大腸菌,Salmonella菌などに対して低応答性であり,TNFやインターロイキン6なども産生しなかった.しかしながら,ヒトの腸管のマクロファージもSalmonella菌のみに強く反応しインターロイキン1β成熟体を産生した.このように,腸管の単核貪食細胞からのインターロイキン1βの産生は種をこえて保存された,宿主による病原細菌と腸内常在細菌に対する異なる免疫反応であり,腸管の“免疫寛容と炎症誘導”の使い分けを説明する切り口ひとつであるものと考えられた.また,腸管の単核貪食細胞におけるインターロイキン1β前駆体の誘導は腸内常在細菌に依存的であることから,腸内常在細菌は病原細菌に対抗する炎症性の免疫反応の“下準備”を行っており,間接的に病原細菌の排除にかかわっていることが示唆された.
4.病原細菌によるインターロイキン1βの活性化はNLRC4インフラマソームの活性化を介している
つぎに疑問となったのは,病原細菌によるインターロイキン1βの活性化の機構であった.さきに述べたように,インターロイキン1βの活性化および細胞外への分泌にはカスパーゼ1によるインターロイキン前駆体の切断が不可欠である3).近年,カスパーゼ1を介したインターロイキン1βの活性化にはインフラマソームとよばれるタンパク質複合体が重要な役割をはたしていることが明らかになってきた3)(図1).インフラマソームは,Nod様受容体(Nod-like receptor:NLR)ファミリーに属するNLRP1,NLRP3,NLRC4などの細胞内受容体により病原細菌やウイルスなどの構成成分あるいは細胞障害などの生体に対する危険信号を感知し,カスパーゼ1の活性化とインターロイキン1βの成熟を誘導することが知られている.NLRP3はもっとも研究の進んでいるインフラマソームの構成タンパク質で,多くの炎症性疾患への関与が報告されている3).NLRP3は細胞外のATPなど細胞障害にともなう危険信号や細菌毒素,粒子状物質などを感知する3)(図1).しかしながら,腸管の単核貪食細胞はATPや細菌毒素,シリカなどの粒子状物質には反応せず,カスパーゼ1の活性化およびインターロイキン1βの成熟の誘導も認められなかった.これはすなわち,腸管の単核貪食細胞ではNLRP3インフラマソームは機能していないことを示唆していた.
では,腸管の単核貪食細胞において活性をもつインターロイキン1βの誘導を担うインフラマソームはいったい何か? そこで,腸管の単核貪食細胞において活性をもつインターロイキン1βの誘導をひき起こす病原細菌Salmonella菌の構造に注目した.Salmonella菌のもつ鞭毛はNLRC4の活性化を誘導することが報告されている4,5).NLRC4ノックアウトマウスの腸管の単核貪食細胞を用いてその役割を検討した.その結果,予想したとおり,NLRC4を欠損した腸管の単核貪食細胞ではSalmonella菌の感染によるカスパーゼ1の活性化およびインターロイキン1βの成熟の誘導が著明に減弱していた.さらに,鞭毛の抗原を欠損したSalmonella菌変異株や,鞭毛の抗原の宿主細胞への輸送に関与するIII型分泌機構を欠損したSalmonella菌変異株では,野生型のSalmonella菌に認められた腸管の単核貪食細胞におけるインターロイキン1βの誘導が障害されたことからも,病原細菌によるインターロイキン1βの誘導はNLRC4を介していることが強く示唆された.また,この鞭毛を介したインターロイキン1βの誘導はヒトの腸管の単核貪食細胞でも認められたことから,種をこえて保存された非常に重要な系であると考えられた.
5.NLRC4-インターロイキン1β経路は好中球の遊走を誘導することで宿主防御反応に寄与する
では実際に,Salmonella菌が感染したときの腸管の単核貪食細胞におけるNLRC4-インターロイキンβ経路の活性化はどのように生体防御を担っているのであろうか? この疑問に答えるため,さまざまなノックアウトマウスを用いてin vivoでのSalmonella菌の感染モデルにおけるNLRC4-インターロイキン1β経路の役割を検討した.その結果,予想どおり,NLRC4ノックアウトマウスおよびインターロイキン1受容体ノックアウトマウスは野生型マウスに比べSalmonella菌の感染に対する感受性の高いことがわかった.両方のノックアウトマウスとも腸管の炎症局所におけるSalmonella菌の排除が障害されており,結果として,Salmonella菌の体循環への移行が亢進し菌血症により死にいたっていた.この分子機構のひとつとして,インターロイキン1βによる炎症局所への好中球の遊走の亢進が考えられた.Salmonella菌に感染したとき,インターロイキン1βは血管内皮細胞における好中球接着分子の発現を亢進させ,好中球の腸管局所への遊走を誘導しているものと考えられる.実際に,抗体により好中球を除去したマウスは,NLRC4ノックアウトマウスおよびインターロイキン1受容体ノックアウトマウスと同様の表現型を示した.
おわりに
今回の報告により,腸管において病原細菌と腸内常在細菌とを識別する分子機構の一端が明らかになった.腸管の単核貪食細胞はインターロイキン1β前駆体を恒常的に備蓄しているが,腸内常在細菌などの刺激ではそれらは不活性な前駆体のままであり,その結果,腸管の単核貪食細胞は腸内常在細菌に対する過剰な免疫反応を誘導せず腸管における恒常性を維持している(図2a).一方で,Salmonella菌などの病原細菌が感染したときには,NLRC4による病原細菌の特異的な認識を介して備蓄してあるインターロイキン1β前駆体を活性化し,すみやかな炎症性の免疫反応を誘導し病原細菌を排除する(図2b).このように,NLRC4は腸管に常在する単核貪食細胞において,病原細菌と腸内常在細菌との識別に重要な役割をはたしているものと考えられた.
文 献
- Denning, T. L., Wang, Y. C., Patel, S. R. et al.: Lamina propria macrophages and dendritic cells differentially induce regulatory and interleukin 17-producing T cell responses. Nat. Immunol., 8, 1086-1094 (2007)[PubMed]
- Smith, P. D., Smythies, L. E., Mosteller-Barnum, M. et al.: Intestinal macrophages lack CD14 and CD89 and consequently are down-regulated for LPS- and IgA-mediated activities. J. Immunol., 167, 2651-2656 (2001)[PubMed]
- Franchi, L., Eigenbrod, T., Munoz-Planillo, R. et al.: The inflammasome: a caspase-1-activation platform that regulates immune responses and disease pathogenesis. Nat. Immunol., 10, 241-247 (2009)[PubMed]
- Miao, E. A., Alpuche-Aranda, C. M., Dors, M. et al.: Cytoplasmic flagellin activates caspase-1 and secretion of interleukin 1β via Ipaf. Nat. Immunol., 7, 569-575 (2006)[PubMed]
- Franchi, L., Amer. A., Body-Malapel, M. et al.: Cytosolic flagellin requires Ipaf for activation of caspase-1 and interleukin 1βin salmonella-infected macrophages. Nat. Immunol., 7, 576-582 (2006)[PubMed]
著者プロフィール
略歴:2007年 慶應義塾大学大学院医学研究科にて博士号取得,同年より慶應義塾大学医学部 助教,2009年より米国Michigan大学Medical Schoolリサーチフェロー.
研究テーマ:腸管感染症および炎症性腸疾患における宿主免疫と腸内細菌の役割.
抱負:腸内細菌の腸疾患における役割や,腸内細菌の認識に関与するマクロファージおよび樹状細胞の機能を明らかにし,感染症や炎症性腸疾患の病態解明および新規の治療法の開発に貢献したい.
Gabriel Núñez
米国Michigan大学Medical School教授.
© 2012 鎌田信彦・Gabriel Núñez Licensed under CC 表示 2.1 日本