もっとも悪性度の高いヒト髄芽腫サブタイプの新規のマウスモデルの確立
川内大輔・Martine F. Roussel
(米国St. Jude Children's Research Hospital,Department of Tumor Cell Biology)
email:川内大輔
DOI: 10.7875/first.author.2012.031
A mouse model of the most aggressive subgroup of human medulloblastoma.
Daisuke Kawauchi, Giles Robinson, Tamar Uziel, Paul Gibson, Jerold Rehg, Cuilan Gao, David Finkelstein, Chunxu Qu, Stanley Pounds, David W. Ellison, Richard J. Gilbertson, Martine F. Roussel
Cancer Cell, 21, 155-167 (2012)
髄芽腫はおもに小児の小脳の近傍に起こる悪性の脳腫瘍である.近年,髄芽腫の治療には腫瘍細胞の遺伝子発現パターンに応じた化学療法が選択され一定の効果をあげている.しかしながら,原がん遺伝子であるMYCの遺伝子増幅もしくは発現上昇が認められるタイプの髄芽腫はきわめて予後の悪いことが知られており,化学療法が効果的に機能しない.このため,このヒトMYCタイプの髄芽腫に有効な新規の薬剤を探索する必要性がもとめられており,そのためには動物モデルの確立が不可欠である.今回,筆者らは,ヒトMYCタイプの髄芽腫の性質を反映した新規の髄芽腫のマウスモデルを世界ではじめて報告した.具体的には,がん抑制遺伝子であるTrp53遺伝子を欠損させたマウスの小脳から小脳前駆細胞を採取し,Myc遺伝子を導入したのち,免疫不全マウスの脳に移植することで脳腫瘍を生じさせた.これらの腫瘍は病理学的にヒトMYCタイプの髄芽腫において観察される大細胞性あるいは退形成性の細胞で構成されており,遺伝子発現パターンおよびSHHシグナル抑制剤への応答性はこれまで報告されていたどのマウスモデルよりもヒトMYCタイプの髄芽腫に近いものであった.近い将来,このマウスモデルがヒトMYCタイプの髄芽腫に対する適切な治療法の確立にむけ利用されることが大いに期待される.
髄芽腫は小脳に起こる悪性の腫瘍であり,アストロサイトーマ(星状細胞腫)についで2番目に多い小児の脳腫瘍である.北米では年間で約400例が髄芽腫と診断されているが,外科的な手術にくわえ放射線治療および化学療法により現在では50%以上の患者において予後の経過が良好である.一方で,患者のなかには現在の治療法ではほとんど効果の現われない,きわめて悪性度の高い髄芽腫も報告されている.髄芽腫のあいだで予後の大きく異なる原因は何かを探るため,近年,髄芽腫の患者の全面的な協力を得て大規模な遺伝子プロファイリングが行われ,髄芽腫は遺伝子発現パターンから少なくとも4つのサブタイプに分類されることが明らかになった1,2).最初の2つのサブタイプは,細胞の増殖を制御することが知られるWNTシグナルあるいはSHHシグナルが過剰に活性化したタイプである.WNTタイプの髄芽腫は予後が非常に良好でほぼ100%の患者が回復する一方,SHHタイプの髄芽腫はSHHシグナルの下流にある転写因子Gli1が活性化しておりMYCN遺伝子などの細胞分裂を促進する遺伝子の発現が誘導されている.このタイプはWNTタイプと比べ予後が悪いが,多くの基礎研究の結果を基盤として髄芽腫マウスモデルが作製され,これらを利用した薬剤スクリーニングによりGDC-0449などヒトに効果的な治療薬が開発されはじめている3).第3のサブタイプはMYCタイプの髄芽腫である.このタイプの髄芽腫はMYC遺伝子の増幅もしくは発現上昇が特徴で,きわめて予後が悪く効果的な治療薬も同定されていない.最後の第4のサブタイプは原因と考えられる遺伝子も明確ではなくもっとも知見が少ないが,SHHタイプよりも予後の悪いことからさらなる研究が期待されている.
髄芽腫の患者の効果的な治療法を確立するための道具として,現在まで,多くの髄芽腫マウスモデルが作製されている4).SHHシグナルを抑制する受容体PTCH1の遺伝子に変異のあるヒトGorlin症候群の患者において髄芽腫が観察されることから,Ptch1ノックアウトマウスを用いて髄芽腫マウスモデルが作製されており,現在では,髄芽腫の起源細胞とされる小脳顆粒細胞においてSHHシグナルを活性化させた髄芽腫マウスモデルが主流となっている.これまで,ほぼすべての髄芽腫マウスモデルがヒトSHHタイプの髄芽腫を反映するものであったが,最近,筆者らのグループから,WNTタイプの髄芽腫のマウスモデルが世界ではじめて作製された.驚くべきことに,WNTタイプの髄芽腫は小脳顆粒細胞ではなく後脳の下菱脳唇を起源細胞としていることが明らかになった4,5).すなわち,小脳に発生する異なるサブタイプの髄芽腫は,異なる細胞から異なる遺伝子異常により生み出される別の疾患であるとさえ考えられるようになった.
しかしながら,いまだ残り2つのサブタイプに関してはヒトの髄芽種の性質を反映したマウスモデルは報告されておらず,適切な治療法の確立が遅れている.今回の研究において筆者らは,第3のサブタイプであるMYCタイプの髄芽腫のマウスモデルの作製に取り組むことにより,難治疾患であるこのタイプの髄芽腫の克服のための足がかりをつくることをめざした.
MYCが脳腫瘍の形成に関与する可能性はすでに多くの研究において検討されている.過去の研究報告から,MYCを単独で小脳の神経前駆細胞に導入しても脳腫瘍は形成されないことが知られていることをふまえ,MYCはがん抑制遺伝子の欠損とともにはたらくことで小脳の脳腫瘍を誘導するのではないかという仮説をたてた.MYCなどのがん遺伝子の過剰発現はDNA複製ストレスをもたらし,DNA損傷が起こった場合にATMやATRを介した細胞死を誘導することが知られているため,これらの細胞死の誘導を担うがん抑制遺伝子であるTP53遺伝子(マウスではTrp53遺伝子)を欠損した小脳細胞を用いてMYCの腫瘍形成能を検討した.
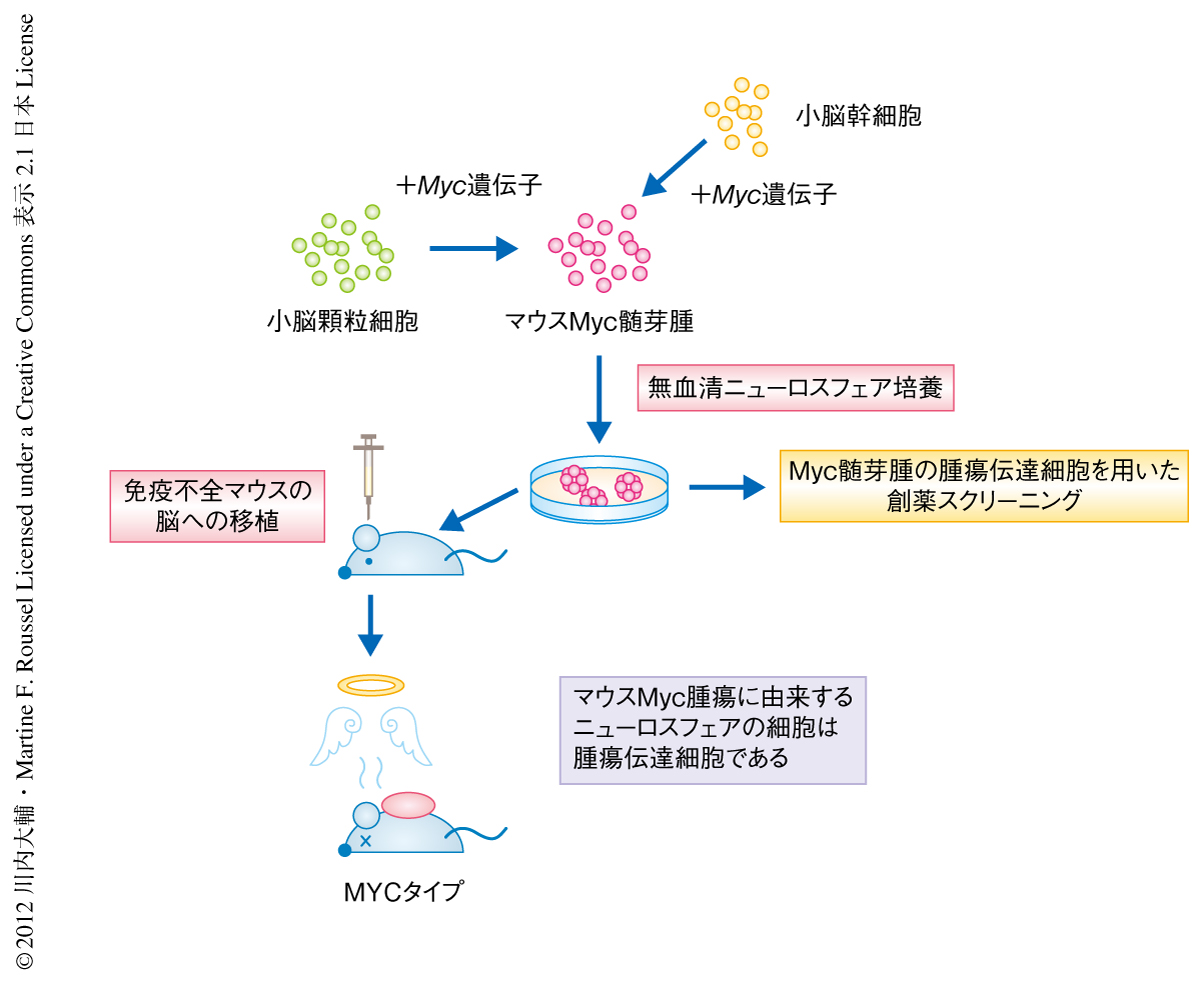
具体的には,Trp53ノックアウトマウスの新生仔の小脳から密度勾配遠心法により小脳顆粒細胞を分離し,レトロウイルスにより培養下でMyc遺伝子を導入したのち,免疫不全マウスの脳に移植した(図1).筆者らの以前の研究により,同様の方法によるMycn遺伝子の過剰な発現はSHHタイプの髄芽腫(マウスMycn髄芽腫)を生み出すことが明らかになっていたことから6),Mycn遺伝子を陽性対照として用いた.その結果,興味深いことに,Mycによる腫瘍の形成はMycnよりも早く起こり病理学的にも異なる細胞形態を示した.さらに,SHHタイプおよびWNTタイプの髄芽腫マウスモデルの腫瘍組織と比較し,Mycにより誘導された腫瘍(マウスMyc髄芽腫)では細胞が肥大し,かつ,TUNEL陽性細胞が有意に多いことを確認した.この表現型はヒトMYCタイプの髄芽腫でおもに観察される大細胞性あるいは退形成性の脳腫瘍に酷似していた.
マウスMyc髄芽腫およびマウスMycn髄芽腫の病理学的な表現型の違いから,腫瘍組織において発現する遺伝子の違いについて検討を進めた.マウスMyc髄芽腫およびマウスMycn髄芽腫にくわえ,WNTタイプの髄芽腫のマウスモデルおよびSHHタイプの髄芽腫のマウスモデルからの腫瘍を採取して大規模マイクロアレイ解析を行ったところ,マウスMyc髄芽腫の遺伝子発現パターンはほかの腫瘍のパターンとはまったく異なることが明らかになった.とくに,マウスMyc髄芽腫では幹細胞のマーカーとして知られるProm1遺伝子やLgr5遺伝子,ヒトMYCタイプの髄芽腫の代表的な腫瘍マーカーであるNpr3遺伝子1) の発現レベルが上昇していた.さらに,筆者らの研究機関のもつヒト髄芽種の遺伝子プロファイリングのデータをもとに,AGDEXとよばれる独自のアルゴリズムを用いて7),マウスMyc髄芽腫の遺伝子発現パターンをヒトの試料と比較した結果,マウスMyc髄芽腫はヒトMYCタイプの髄芽腫のパターンをよく再現していることが明らかになった.
髄芽腫の起源細胞を同定することは腫瘍細胞の性質を考察するうえで重要な手がかりとなる.マウスMyc髄芽腫の起源細胞の候補として小脳顆粒細胞に着目した.小脳顆粒細胞をGFPにより標識したTrp53ノックアウトマウスからGFP陽性の小脳顆粒細胞とGFP陰性の小脳細胞とをセルソーターで分離したのち,それぞれ別々にMyc遺伝子を導入することによりマウスMyc髄芽腫の誘導を試みた.結果的に,GFP陽性およびGFP陰性の両方の細胞から同じ遺伝子発現パターンをもつマウスMyc髄芽腫が誘導された.また,マウスMyc髄芽腫の遺伝子発現パターンはGFP陽性およびGFP陰性の両方の細胞の元来の遺伝子発現パターンとはまったく異なっていた.この結果は,Trp53遺伝子の欠損したマウスの小脳顆粒細胞および非小脳顆粒細胞はMycにより形質転換されマウスMyc髄芽腫となりうる可能性を示していた.
MYCタイプの髄芽腫がきわめて悪性度の高い原因として,腫瘍伝達細胞がほかのタイプの髄芽腫より多く存在する,もしくは,その性質が異なるのではないかと考えた.そこで,SHHタイプの髄芽腫のマウスモデルおよびマウスMyc髄芽腫に由来する腫瘍細胞を免疫不全マウスに限界希釈のうえ細胞移植してその腫瘍形成能を検討した.その結果,SHHタイプの髄芽腫に由来する腫瘍細胞は腫瘍塊を形成するためには200万個以上の細胞を移植する必要があったが,マウスMyc髄芽腫に由来するMYCタイプの腫瘍細胞はたった100個の細胞の移植で十分であった.この実験により,MYCタイプの髄芽腫はSHHタイプの髄芽腫に比べはるかに多い割合で腫瘍伝達細胞を含んでいることが示唆された.
腫瘍伝達細胞のいくつかは幹細胞様の性質をもつことが知られている8).実際に,神経幹細胞の培養に利用されるニューロスフェア培養条件において,マウスMyc髄芽腫に由来する腫瘍細胞はニューロスフェアを形成し増殖できることを確認した.培養下における腫瘍ニューロスフェアはSox2やNestinを含む多くの神経幹細胞マーカーを発現していた.一方で,SHHタイプの髄芽腫のマウスモデルに由来する腫瘍細胞は同様の培養条件においては増殖できなかったことから,2つのタイプの腫瘍細胞の個性,とくに,増殖可能な環境の異なることが明らかになった.さらに,免疫不全マウスに移植されたマウスMyc髄芽腫に由来するニューロスフェアの細胞はふたたび腫瘍塊を形成し,病理学的にも遺伝子発現パターンにおいてもマウスMyc髄芽腫の性質を維持していた(図2).この結果は,マウスMyc髄芽腫に由来するニューロスフェアの細胞は腫瘍伝達細胞であることを示していた.
SHHタイプの髄芽腫はSHHシグナルを活性化させる受容体Smoothenedの機能阻害剤であるシクロパミンやGDC-0449を用いることで効果的に増殖を抑制できることが知られている3,9).また,筆者らの最近の研究により,SHHタイプの髄芽腫に由来する腫瘍細胞においてBMPシグナルを活性化させると分化が誘導されることも明らかになっている10).そこで,マウスMyc髄芽腫に由来する腫瘍細胞を接着培養し,その直後にシクロパミンおよびBMP4を添加することにより細胞の増殖への影響を解析した.その結果,SHHタイプの髄芽腫のマウスモデルに由来する腫瘍細胞では増殖が顕著に抑制されたが,マウスMyc髄芽腫に由来する腫瘍細胞では増殖の抑制効果はほとんど観察されなかった.さらに,マウスMyc髄芽腫の腫瘍伝達細胞における効果を観察するため,ニューロスフェア培養条件において腫瘍ニューロスフェアにシクロパミンおよびBMP4を投与したが,さきと同様に,腫瘍の増殖は抑制されなかった.以上の結果は,ヒトMYCタイプの髄芽腫の薬剤抵抗性と一致しており,今回,同定された髄芽腫マウスモデルはこれまでの髄芽腫マウスモデルとは性質の異なることが薬剤への反応の点からも明らかになった.
今回,作製された新規の髄芽腫マウスモデルはいくつかの点でヒトMYCタイプの髄芽腫の性質を反映していた.一方で,この腫瘍における腫瘍伝達細胞に関する知見はいまだ乏しく,腫瘍を治療するうえで必要不可欠な分野である.たとえば,MYCタイプの髄芽腫の腫瘍組織における腫瘍伝達細胞のマーカーを同定することは必要だろうし,腫瘍ニューロスフェアを形成しない腫瘍細胞は腫瘍伝達細胞になりえないのかといった問題にも取り組む必要があるだろう.また,この研究において,マウスMyc髄芽腫の起源細胞のひとつとして小脳顆粒細胞をあげたが,セルソーターによる細胞の分離は完全ではなく明確な答えを得るにはいたっていない.現在,小脳のニューロンのサブタイプに特異的にMycを誘導するマウスをCre-LoxP系を利用して作製しており,これにより腫瘍の起源細胞が明らかにされるとともに,腫瘍の増殖の微小環境についてもヒトの髄芽腫に類似したMYCタイプの髄芽腫のマウスモデルの確立が期待される.
現在,筆者らの研究機関では,すでにマウスMyc髄芽腫を用いた薬剤スクリーニングプログラムがはじまっており(図2),結果が得られつつあるが,患者への適用へはまださきが長い.しかしながら,今回の研究が難治型の髄芽腫の患者を助ける足がかりとなることを願ってやまない.
略歴:2004年 大阪大学大学院基礎工学研究科 修了,同年 同 生命機能研究科 博士研究員,2005年 千葉大学大学院医学研究院 助教を経て,2009年より米国St. Jude Children's Research Hospital博士研究員.
研究テーマ:小児の髄芽腫の発生の分子機構.
抱負:これまでの神経発生学および腫瘍生物学の研究背景をもとに,医療の現場と研究室とをつなぐ基礎研究にかかわっていきたいと思います.
Martine F. Roussel
米国St. Jude Children's Research HospitalにてProfessor.
© 2012 川内大輔・Martine F. Roussel Licensed under CC 表示 2.1 日本
(米国St. Jude Children's Research Hospital,Department of Tumor Cell Biology)
email:川内大輔
DOI: 10.7875/first.author.2012.031
A mouse model of the most aggressive subgroup of human medulloblastoma.
Daisuke Kawauchi, Giles Robinson, Tamar Uziel, Paul Gibson, Jerold Rehg, Cuilan Gao, David Finkelstein, Chunxu Qu, Stanley Pounds, David W. Ellison, Richard J. Gilbertson, Martine F. Roussel
Cancer Cell, 21, 155-167 (2012)
要 約
髄芽腫はおもに小児の小脳の近傍に起こる悪性の脳腫瘍である.近年,髄芽腫の治療には腫瘍細胞の遺伝子発現パターンに応じた化学療法が選択され一定の効果をあげている.しかしながら,原がん遺伝子であるMYCの遺伝子増幅もしくは発現上昇が認められるタイプの髄芽腫はきわめて予後の悪いことが知られており,化学療法が効果的に機能しない.このため,このヒトMYCタイプの髄芽腫に有効な新規の薬剤を探索する必要性がもとめられており,そのためには動物モデルの確立が不可欠である.今回,筆者らは,ヒトMYCタイプの髄芽腫の性質を反映した新規の髄芽腫のマウスモデルを世界ではじめて報告した.具体的には,がん抑制遺伝子であるTrp53遺伝子を欠損させたマウスの小脳から小脳前駆細胞を採取し,Myc遺伝子を導入したのち,免疫不全マウスの脳に移植することで脳腫瘍を生じさせた.これらの腫瘍は病理学的にヒトMYCタイプの髄芽腫において観察される大細胞性あるいは退形成性の細胞で構成されており,遺伝子発現パターンおよびSHHシグナル抑制剤への応答性はこれまで報告されていたどのマウスモデルよりもヒトMYCタイプの髄芽腫に近いものであった.近い将来,このマウスモデルがヒトMYCタイプの髄芽腫に対する適切な治療法の確立にむけ利用されることが大いに期待される.
はじめに
髄芽腫は小脳に起こる悪性の腫瘍であり,アストロサイトーマ(星状細胞腫)についで2番目に多い小児の脳腫瘍である.北米では年間で約400例が髄芽腫と診断されているが,外科的な手術にくわえ放射線治療および化学療法により現在では50%以上の患者において予後の経過が良好である.一方で,患者のなかには現在の治療法ではほとんど効果の現われない,きわめて悪性度の高い髄芽腫も報告されている.髄芽腫のあいだで予後の大きく異なる原因は何かを探るため,近年,髄芽腫の患者の全面的な協力を得て大規模な遺伝子プロファイリングが行われ,髄芽腫は遺伝子発現パターンから少なくとも4つのサブタイプに分類されることが明らかになった1,2).最初の2つのサブタイプは,細胞の増殖を制御することが知られるWNTシグナルあるいはSHHシグナルが過剰に活性化したタイプである.WNTタイプの髄芽腫は予後が非常に良好でほぼ100%の患者が回復する一方,SHHタイプの髄芽腫はSHHシグナルの下流にある転写因子Gli1が活性化しておりMYCN遺伝子などの細胞分裂を促進する遺伝子の発現が誘導されている.このタイプはWNTタイプと比べ予後が悪いが,多くの基礎研究の結果を基盤として髄芽腫マウスモデルが作製され,これらを利用した薬剤スクリーニングによりGDC-0449などヒトに効果的な治療薬が開発されはじめている3).第3のサブタイプはMYCタイプの髄芽腫である.このタイプの髄芽腫はMYC遺伝子の増幅もしくは発現上昇が特徴で,きわめて予後が悪く効果的な治療薬も同定されていない.最後の第4のサブタイプは原因と考えられる遺伝子も明確ではなくもっとも知見が少ないが,SHHタイプよりも予後の悪いことからさらなる研究が期待されている.
髄芽腫の患者の効果的な治療法を確立するための道具として,現在まで,多くの髄芽腫マウスモデルが作製されている4).SHHシグナルを抑制する受容体PTCH1の遺伝子に変異のあるヒトGorlin症候群の患者において髄芽腫が観察されることから,Ptch1ノックアウトマウスを用いて髄芽腫マウスモデルが作製されており,現在では,髄芽腫の起源細胞とされる小脳顆粒細胞においてSHHシグナルを活性化させた髄芽腫マウスモデルが主流となっている.これまで,ほぼすべての髄芽腫マウスモデルがヒトSHHタイプの髄芽腫を反映するものであったが,最近,筆者らのグループから,WNTタイプの髄芽腫のマウスモデルが世界ではじめて作製された.驚くべきことに,WNTタイプの髄芽腫は小脳顆粒細胞ではなく後脳の下菱脳唇を起源細胞としていることが明らかになった4,5).すなわち,小脳に発生する異なるサブタイプの髄芽腫は,異なる細胞から異なる遺伝子異常により生み出される別の疾患であるとさえ考えられるようになった.
しかしながら,いまだ残り2つのサブタイプに関してはヒトの髄芽種の性質を反映したマウスモデルは報告されておらず,適切な治療法の確立が遅れている.今回の研究において筆者らは,第3のサブタイプであるMYCタイプの髄芽腫のマウスモデルの作製に取り組むことにより,難治疾患であるこのタイプの髄芽腫の克服のための足がかりをつくることをめざした.
1.Trp53ノックアウトマウスの小脳の神経前駆細胞におけるMyc遺伝子の強制発現により大細胞性あるいは退形成性の脳腫瘍が生じる
MYCが脳腫瘍の形成に関与する可能性はすでに多くの研究において検討されている.過去の研究報告から,MYCを単独で小脳の神経前駆細胞に導入しても脳腫瘍は形成されないことが知られていることをふまえ,MYCはがん抑制遺伝子の欠損とともにはたらくことで小脳の脳腫瘍を誘導するのではないかという仮説をたてた.MYCなどのがん遺伝子の過剰発現はDNA複製ストレスをもたらし,DNA損傷が起こった場合にATMやATRを介した細胞死を誘導することが知られているため,これらの細胞死の誘導を担うがん抑制遺伝子であるTP53遺伝子(マウスではTrp53遺伝子)を欠損した小脳細胞を用いてMYCの腫瘍形成能を検討した.
具体的には,Trp53ノックアウトマウスの新生仔の小脳から密度勾配遠心法により小脳顆粒細胞を分離し,レトロウイルスにより培養下でMyc遺伝子を導入したのち,免疫不全マウスの脳に移植した(図1).筆者らの以前の研究により,同様の方法によるMycn遺伝子の過剰な発現はSHHタイプの髄芽腫(マウスMycn髄芽腫)を生み出すことが明らかになっていたことから6),Mycn遺伝子を陽性対照として用いた.その結果,興味深いことに,Mycによる腫瘍の形成はMycnよりも早く起こり病理学的にも異なる細胞形態を示した.さらに,SHHタイプおよびWNTタイプの髄芽腫マウスモデルの腫瘍組織と比較し,Mycにより誘導された腫瘍(マウスMyc髄芽腫)では細胞が肥大し,かつ,TUNEL陽性細胞が有意に多いことを確認した.この表現型はヒトMYCタイプの髄芽腫でおもに観察される大細胞性あるいは退形成性の脳腫瘍に酷似していた.
2.マウスMyc髄芽腫はヒトMYCタイプの髄芽腫に似た遺伝子発現パターンを示す
マウスMyc髄芽腫およびマウスMycn髄芽腫の病理学的な表現型の違いから,腫瘍組織において発現する遺伝子の違いについて検討を進めた.マウスMyc髄芽腫およびマウスMycn髄芽腫にくわえ,WNTタイプの髄芽腫のマウスモデルおよびSHHタイプの髄芽腫のマウスモデルからの腫瘍を採取して大規模マイクロアレイ解析を行ったところ,マウスMyc髄芽腫の遺伝子発現パターンはほかの腫瘍のパターンとはまったく異なることが明らかになった.とくに,マウスMyc髄芽腫では幹細胞のマーカーとして知られるProm1遺伝子やLgr5遺伝子,ヒトMYCタイプの髄芽腫の代表的な腫瘍マーカーであるNpr3遺伝子1) の発現レベルが上昇していた.さらに,筆者らの研究機関のもつヒト髄芽種の遺伝子プロファイリングのデータをもとに,AGDEXとよばれる独自のアルゴリズムを用いて7),マウスMyc髄芽腫の遺伝子発現パターンをヒトの試料と比較した結果,マウスMyc髄芽腫はヒトMYCタイプの髄芽腫のパターンをよく再現していることが明らかになった.
3.マウスMyc髄芽腫は小脳の神経前駆細胞の形質転換により生じるのかもしれない
髄芽腫の起源細胞を同定することは腫瘍細胞の性質を考察するうえで重要な手がかりとなる.マウスMyc髄芽腫の起源細胞の候補として小脳顆粒細胞に着目した.小脳顆粒細胞をGFPにより標識したTrp53ノックアウトマウスからGFP陽性の小脳顆粒細胞とGFP陰性の小脳細胞とをセルソーターで分離したのち,それぞれ別々にMyc遺伝子を導入することによりマウスMyc髄芽腫の誘導を試みた.結果的に,GFP陽性およびGFP陰性の両方の細胞から同じ遺伝子発現パターンをもつマウスMyc髄芽腫が誘導された.また,マウスMyc髄芽腫の遺伝子発現パターンはGFP陽性およびGFP陰性の両方の細胞の元来の遺伝子発現パターンとはまったく異なっていた.この結果は,Trp53遺伝子の欠損したマウスの小脳顆粒細胞および非小脳顆粒細胞はMycにより形質転換されマウスMyc髄芽腫となりうる可能性を示していた.
4.マウスMyc髄芽腫の腫瘍伝達細胞は培養下でニューロスフェアを形成し増殖する
MYCタイプの髄芽腫がきわめて悪性度の高い原因として,腫瘍伝達細胞がほかのタイプの髄芽腫より多く存在する,もしくは,その性質が異なるのではないかと考えた.そこで,SHHタイプの髄芽腫のマウスモデルおよびマウスMyc髄芽腫に由来する腫瘍細胞を免疫不全マウスに限界希釈のうえ細胞移植してその腫瘍形成能を検討した.その結果,SHHタイプの髄芽腫に由来する腫瘍細胞は腫瘍塊を形成するためには200万個以上の細胞を移植する必要があったが,マウスMyc髄芽腫に由来するMYCタイプの腫瘍細胞はたった100個の細胞の移植で十分であった.この実験により,MYCタイプの髄芽腫はSHHタイプの髄芽腫に比べはるかに多い割合で腫瘍伝達細胞を含んでいることが示唆された.
腫瘍伝達細胞のいくつかは幹細胞様の性質をもつことが知られている8).実際に,神経幹細胞の培養に利用されるニューロスフェア培養条件において,マウスMyc髄芽腫に由来する腫瘍細胞はニューロスフェアを形成し増殖できることを確認した.培養下における腫瘍ニューロスフェアはSox2やNestinを含む多くの神経幹細胞マーカーを発現していた.一方で,SHHタイプの髄芽腫のマウスモデルに由来する腫瘍細胞は同様の培養条件においては増殖できなかったことから,2つのタイプの腫瘍細胞の個性,とくに,増殖可能な環境の異なることが明らかになった.さらに,免疫不全マウスに移植されたマウスMyc髄芽腫に由来するニューロスフェアの細胞はふたたび腫瘍塊を形成し,病理学的にも遺伝子発現パターンにおいてもマウスMyc髄芽腫の性質を維持していた(図2).この結果は,マウスMyc髄芽腫に由来するニューロスフェアの細胞は腫瘍伝達細胞であることを示していた.
5.マウスMyc髄芽腫はSHHシグナル抑制剤に抵抗性である
SHHタイプの髄芽腫はSHHシグナルを活性化させる受容体Smoothenedの機能阻害剤であるシクロパミンやGDC-0449を用いることで効果的に増殖を抑制できることが知られている3,9).また,筆者らの最近の研究により,SHHタイプの髄芽腫に由来する腫瘍細胞においてBMPシグナルを活性化させると分化が誘導されることも明らかになっている10).そこで,マウスMyc髄芽腫に由来する腫瘍細胞を接着培養し,その直後にシクロパミンおよびBMP4を添加することにより細胞の増殖への影響を解析した.その結果,SHHタイプの髄芽腫のマウスモデルに由来する腫瘍細胞では増殖が顕著に抑制されたが,マウスMyc髄芽腫に由来する腫瘍細胞では増殖の抑制効果はほとんど観察されなかった.さらに,マウスMyc髄芽腫の腫瘍伝達細胞における効果を観察するため,ニューロスフェア培養条件において腫瘍ニューロスフェアにシクロパミンおよびBMP4を投与したが,さきと同様に,腫瘍の増殖は抑制されなかった.以上の結果は,ヒトMYCタイプの髄芽腫の薬剤抵抗性と一致しており,今回,同定された髄芽腫マウスモデルはこれまでの髄芽腫マウスモデルとは性質の異なることが薬剤への反応の点からも明らかになった.
おわりに
今回,作製された新規の髄芽腫マウスモデルはいくつかの点でヒトMYCタイプの髄芽腫の性質を反映していた.一方で,この腫瘍における腫瘍伝達細胞に関する知見はいまだ乏しく,腫瘍を治療するうえで必要不可欠な分野である.たとえば,MYCタイプの髄芽腫の腫瘍組織における腫瘍伝達細胞のマーカーを同定することは必要だろうし,腫瘍ニューロスフェアを形成しない腫瘍細胞は腫瘍伝達細胞になりえないのかといった問題にも取り組む必要があるだろう.また,この研究において,マウスMyc髄芽腫の起源細胞のひとつとして小脳顆粒細胞をあげたが,セルソーターによる細胞の分離は完全ではなく明確な答えを得るにはいたっていない.現在,小脳のニューロンのサブタイプに特異的にMycを誘導するマウスをCre-LoxP系を利用して作製しており,これにより腫瘍の起源細胞が明らかにされるとともに,腫瘍の増殖の微小環境についてもヒトの髄芽腫に類似したMYCタイプの髄芽腫のマウスモデルの確立が期待される.
現在,筆者らの研究機関では,すでにマウスMyc髄芽腫を用いた薬剤スクリーニングプログラムがはじまっており(図2),結果が得られつつあるが,患者への適用へはまださきが長い.しかしながら,今回の研究が難治型の髄芽腫の患者を助ける足がかりとなることを願ってやまない.
文 献
- Northcott, P. A., Korshunov, A., Witt, H. et al.: Medulloblastoma comprises four distinct molecular variants. J. Clin. Oncol., 29, 1408-1414 (2011)[PubMed]
- Taylor, M. D., Northcott, P. A., Korshunov, A. et al.: Molecular subgroups of medulloblastoma: the current consensus. Acta Neuropathol., 123, 465-472 (2012)[PubMed]
- Yauch, R. L., Dijkgraaf, G. J. P., Alicke, B. et al.: Smoothened mutation confers resistance to a hedgehog pathway inhibitor in medulloblastoma. Science, 326, 572-574 (2009)[PubMed]
- Wu, X., Northcott, P. A., Croul, S. et al.: Mouse models of medulloblastoma. Chin. J. Cancer, 30, 442-449 (2011)[PubMed]
- Gibson, P., Tong, Y., Robinson, G. et al.: Subtypes of medulloblastoma have distinct developmental origins. Nature, 468, 1095-1099 (2010)[PubMed]
- Zindy, F., Uziel, T., Ayrault, O. et al.: Genetic alterations in mouse medulloblastomas and generation of tumors de novo from primary cerebellar granule neuron precursors. Cancer Res., 67, 2676-2684 (2007)[PubMed]
- Johnson, R. A., Wright, K. D., Poppleton, H. et al.: Cross-species genomics matches driver mutations and cell. Nature, 466, 632-636 (2010)[PubMed]
- Visvader, J. E. & Lindeman, G. J.: Cancer stem cells in solid tumors: accumulating evidence and unresolved questions. Nat. Rev. Cancer, 8, 755-768 (2008)[PubMed]
- Berman, D. M., Karhadkar, S. S., Hallahan, A. R. et al.: Medulloblastoma growth inhibition by hedgehog pathway blockade. Science, 297, 1559-1561 (2002)[PubMed]
- Zhao, H., Ayrault, O., Zindy, F. et al.: Post-transcriptional down-regulation of Atoh1/Math1 by bone morphogenic proteins suppresses medulloblastoma development. Genes Dev., 22, 722-727 (2008)[PubMed]
著者プロフィール
略歴:2004年 大阪大学大学院基礎工学研究科 修了,同年 同 生命機能研究科 博士研究員,2005年 千葉大学大学院医学研究院 助教を経て,2009年より米国St. Jude Children's Research Hospital博士研究員.
研究テーマ:小児の髄芽腫の発生の分子機構.
抱負:これまでの神経発生学および腫瘍生物学の研究背景をもとに,医療の現場と研究室とをつなぐ基礎研究にかかわっていきたいと思います.
Martine F. Roussel
米国St. Jude Children's Research HospitalにてProfessor.
© 2012 川内大輔・Martine F. Roussel Licensed under CC 表示 2.1 日本