局所的な神経の活性化により血液脳関門における免疫細胞のゲートが形成される
村上 正晃
(大阪大学大学院生命機能研究科 免疫発生学研究室)
email:村上正晃
DOI: 10.7875/first.author.2012.025
Regional neural activation defines a gateway for autoreactive T cells to cross the blood-brain barrier.
Yasunobu Arima, Masaya Harada, Daisuke Kamimura, Jin-Haeng Park, Fuminori Kawano, Fiona E. Yull, Tadafumi Kawamoto, Yoichiro Iwakura, Ulrich A.K. Betz, Gabriel Márquez, Timothy S. Blackwell, Yoshinobu Ohira, Toshio Hirano, Masaaki Murakami
Cell, 148, 447-457 (2012)
中枢神経系である脳や脊髄の血管は,細菌やウイルスなどの影響を防ぐための特殊な関所として血液脳関門を形成している.免疫細胞はもとより大きなタンパク質なども血液脳関門を通過できない.しかし,中枢神経系にも細菌やウイルスが感染しがんや炎症などに起因する難病が発症する.こうした背景から,病原体や免疫細胞などが中枢神経系へと入るゲートの存在する可能性が考えられてきた.しかし,そのゲートがどこにあり,また,どのように形成されるのかなど,その実体は不明だった.筆者らは,中枢神経系の難病である多発性硬化症の動物モデルを用いて血液脳関門におけるゲートの部位とその形成機構を調べ,第5腰椎の背側の血管がそのゲートであることを世界ではじめてつきとめた.また,地球からの重力による日常的な刺激が第5腰椎の付近の神経を活性化させ,それが慢性炎症の誘導機構である“IL-6アンプ”を活性化することでこのゲートが形成されることをつきとめた.今回の成果により,精神的なストレスによりさまざまな疾患が増悪するしくみなど,これまで不明であった神経や精神と免疫系との相互作用の分子基盤の解明が期待される.
脊椎動物の神経系は,脳や脊髄からなる中枢神経系と,体性神経系および自律神経系からなる末梢神経系とに分けられる.中枢神経系はニューロンの集まった塊であるのに対し,末梢神経系は神経節と神経繊維からなり,体の各部と中枢神経系とのあいだで神経刺激を伝達する役割をはたす.中枢神経系の臓器である脳や脊髄の血管は,細菌やウイルスなどの血液を介する影響を極力防ぐため,特殊な関所として血液脳関門を形成していることが判明していた.具体的には,血液脳関門は中枢神経系の血管に備わる,血液と中枢神経系の組織液とのあいだでの物質交換を制限する機構で,中枢神経系の血管を構成する内皮細胞が非常に強固に結合しあうことで,血液中の大きなタンパク質や免疫細胞などを中枢神経系へと通過させないよう機能している1,2).つまり,中枢神経系には末梢でのさまざまな出来事による血管内の変化が直接には伝わらないよう,血液脳関門により制御されているのである.しかし,ある状況では中枢神経系にも細菌やウイルスが感染し,がんや炎症などに起因する難病が発症する3,4).たとえば,インフルエンザでもHIVの感染でも脳炎を生じることがある.また,血液に存在する免疫細胞はこのような病態や疾患を防ぐ一方で,あるときは過度な炎症の原因となったり悪化させたりすることもある.こうした背景から,血液脳関門には病原体や免疫細胞などが中枢神経系へと入るゲートの存在する可能性が示唆されていた2,5).しかし,そのゲートがどこにあるのか,また,どのように形成されるのかなど,その実体は不明であった.そこで今回,筆者らは,なお治療法のない中枢神経系の難病である多発性硬化症の動物モデルである実験的自己免疫性脳脊髄炎を用いて,血液脳関門に存在するゲートの位置とその形成機構を検討した.
中枢神経系に存在するミエリンオリゴデンドロサイト糖タンパク質を正常マウスに免疫するとヘルパーT細胞が抗原に特異的に反応し,自己反応性ヘルパーT細胞(Th17細胞とTh1細胞)として機能することで実験的自己免疫性脳脊髄炎が誘導される.このミエリンオリゴデンドロサイト糖タンパク質に特異的な自己反応性のTh17細胞とTh1細胞を疾患マウスから採取して正常マウスの静脈に移入すると,正常マウスの中枢神経系に実験的自己免疫性脳脊髄炎が誘導される6-8).これは,血液中の自己反応性をもつ病原性T細胞が血液脳関門をこえて中枢神経系に侵入し疾患を誘導したことを示すものである.そこで,この実験モデルを用いて血液脳関門におけるゲートの部位とその形成機構を調べることにした.
まず,正常マウスの血管に存在するミエリンオリゴデンドロサイト糖タンパク質に特異的な病原性T細胞が,血管から中枢神経系へと入り込む部位を特定するため,自己反応性T細胞を移入してからまだ疾患の発症していない移入5日後に,マクロトームを用いて脊髄や脳を薄くスライスし,自己反応性T細胞の局在を蛍光顕微鏡により解析した.その結果,血管内の病原性T細胞は第5腰椎の背側の血管から脊髄に入ることをつきとめた.
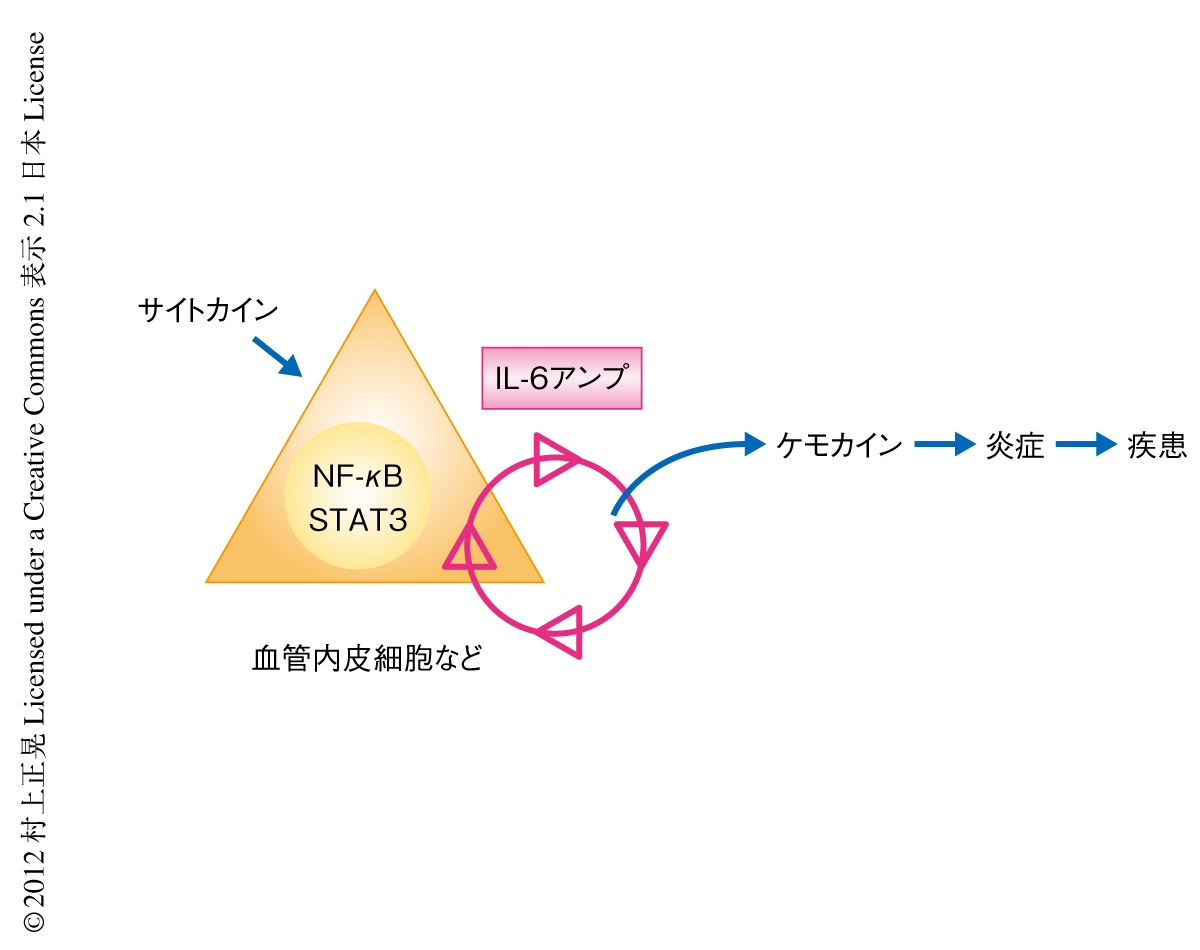
なぜその部位だけが自己反応性ヘルパーT細胞の中枢神経系へのゲートとなっているのか,そのしくみを調べた.はじめに,自己反応性ヘルパーT細胞のうち,インターロイキン17Aを発現するTh17細胞とインターフェロンγを発現するTh1細胞のどちらがこのゲートへの浸潤に関与しているかを,インターロイキン17Aやインターフェロンγをもたない自己反応性ヘルパーT細胞を準備して実験した.その結果,インターフェロンγをもたない自己反応性ヘルパーT細胞は浸潤するのに対し,インターロイキン17Aをもたない自己反応性ヘルパーT細胞は第5腰椎に浸潤できないことがわかった.筆者らは,これまで,インターロイキン17Aに依存性の炎症の誘導機構として,“IL-6アンプ”を研究してきた.IL-6アンプとは,血管内皮細胞や線維芽細胞などの間葉系細胞にインターロイキン17Aやインターロイキン6(IL-6)などのサイトカインが作用して相乗的なNF-κBおよびSTAT3の活性化が生じると,大量のケモカインが産生されてさまざまな細胞がその局所に浸潤し,自己免疫疾患を含む慢性炎症を誘導するという機構である7-9)(図1).細胞膜にあるシグナル伝達タンパク質gp130や細胞内におけるシグナル伝達タンパク質STAT3を欠損させることで間葉系細胞や血管内皮細胞において1型コラーゲンCreマウスを用いて特異的にインターロイキン6シグナルを遮断したところ,自己反応性ヘルパーT細胞の第5腰椎への浸潤が抑制された.さらに,第5腰椎の背側の血管内皮細胞では,ほかの脊椎の血管と比べて,STAT3およびNF-κBの活性化が生じていることもわかった.これまでの研究でTh17細胞はCCL20にひきよせられることがわかっていたので,この部位のIL-6アンプの活性化の標的となるケモカインとしてCCL20に注目した.実際に,CCL20は第5腰椎の背側の血管内皮細胞においてIL-6アンプに依存的に発現していた.さらに,CCL20の受容体であるCCR6をもたない自己反応性のTh17細胞は第5腰椎に浸潤することができなかった.中和抗体により全身においてCCL20が機能しないようにすると疾患の発症も抑制された.重要なことに,第5腰椎の背側の血管では定常状態においてCCL20以外の多くのケモカインも発現していることがわかった.つまり,第5腰椎の背側の血管は定常状態においてさまざまなケモカインを発現し,自己反応性T細胞を含む免疫細胞や血液細胞の血管から中枢神経系へのゲートとなっていることがわかった.
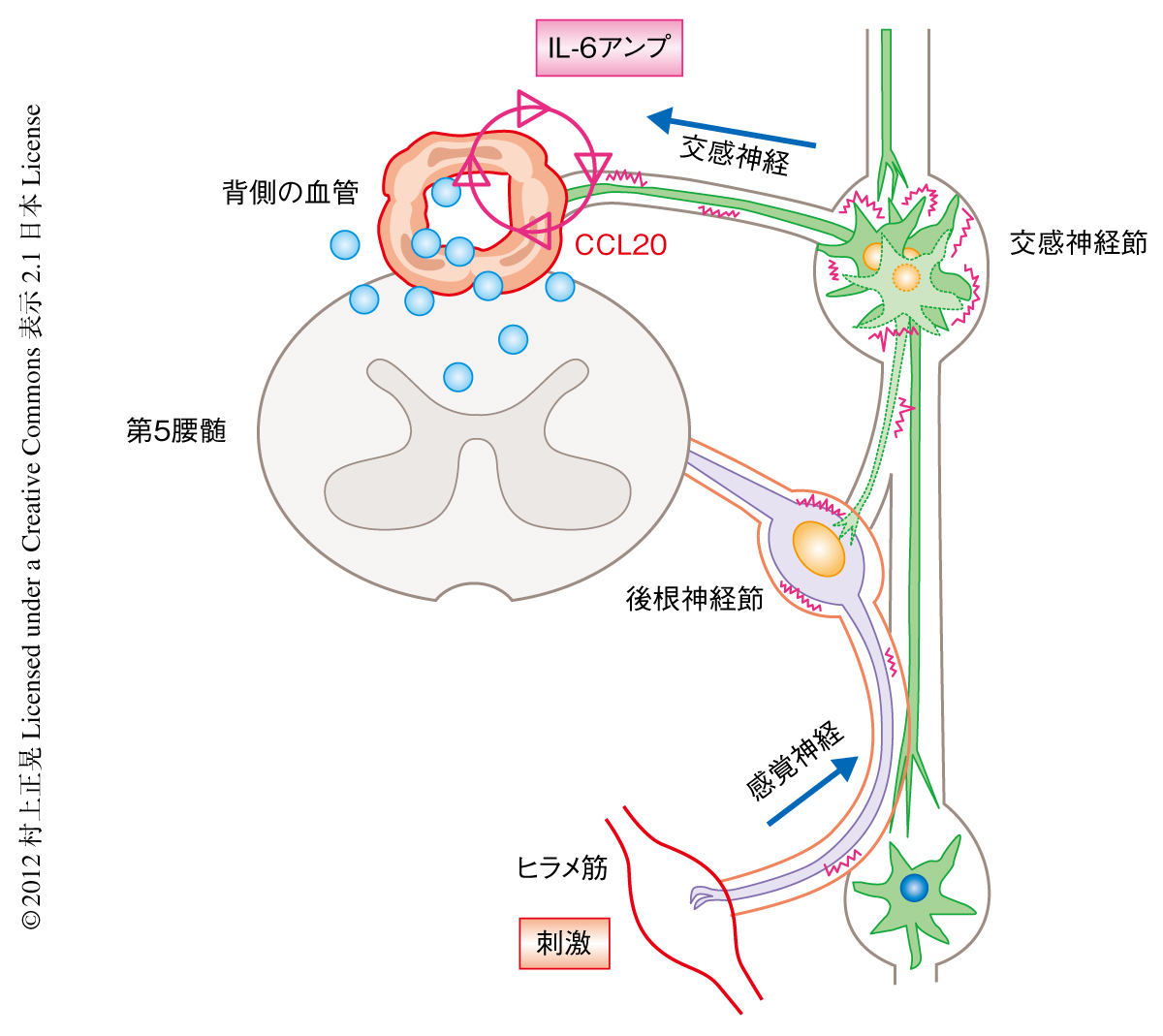
つぎの疑問は,どうして第5腰椎の背側の血管がそのようなゲートとなっているかであった.いい換えると,なぜこの部位でIL-6アンプが特異的に活性化しているのであろうか? そこで,ヒラメ筋からの感覚神経の神経節が第5腰椎の背側に位置することに着目した.体の感覚や運動を制御する体性神経系には感覚神経と運動神経がある.そして,ヒラメ筋はふくらはぎの付近に存在して大きな重力を受け止める抗重力筋として知られている.絶え間のない重力刺激に対抗するヒラメ筋の応答が感覚神経の過剰な活性化を誘導し,これが原因で第5腰椎の背側の血管においてIL-6アンプを活性化しているのではないかという仮説をたてた.この仮説を実証するのに,NASA(米国航空宇宙局)で行われていた実験法に注目した10,11).つまり,マウスのしっぽを天井からつるし(後肢懸垂法),ヒラメ筋への重力刺激をなくし感覚神経への刺激を排除したときの第5腰椎の状態を調べた.その結果,この後肢懸垂法を適用すると第5腰椎の背側の血管におけるCCL20の発現および病原性T細胞の集積はみられず,実験的自己免疫性脳脊髄炎の発症も有意に抑制された.また,後肢懸垂法を適用したマウスのヒラメ筋に電気刺激をあたえるとその時間に比例してCCL20の発現量が増加することもわかった.
後肢懸垂法は非常に不自然な体の姿勢を1週間以上も保持させるので,この方法が体全体の神経系や骨格筋系などの恒常性を乱していないことを証明する必要があった.後肢懸垂法を適用したマウスに対し大腿四頭筋あるいは上腕三頭筋を電気刺激すると,それぞれ,第3腰椎あるいは頸椎から胸椎の背側の血管においてCCL20が発現すること,そして,その近傍の後根神経節も活性化することがわかった.これらの結果は,後肢懸垂法を適用したマウスにおいても,局所的な感覚神経の活性化が生じると,その神経の細胞体が存在する後根神経節の近傍の血管の状態が変化することを示していた.さらに,後肢懸垂法を適用しても脳,内臓,前肢,後肢,体表などにおける血流速度は変化しなかった.また,関節をギブスにより固定して屈曲させると,短期間的には筋肉の収縮刺激が感覚神経を経由して後根神経節を活性化させることが知られている.実際,後肢懸垂法を適用したのちのギブス固定によるヒラメ筋の収縮刺激により第5腰椎の背側の血管におけるCCL20の発現は上昇した.また,後根神経節から脊椎に延びる感覚神経のみを遮断する手術を行うと,体のバランスは保たれるが後根神経節の活性化は抑制されることがわかっている11).この手術を行ったマウスでは第5腰椎の背側の血管におけるCCL20の発現および病原性T細胞の集積はみられなかった.これらの実験結果から,後肢懸垂法は体全体の恒常性の変化は誘導せずに,主として後肢への重力刺激を欠損させた状態を反映していることが証明された.
つづく疑問は,感覚神経の活性化がどのように血管の状態の変化をひき起こすかであった.この疑問のヒントは,血流速度の測定から得られた.後肢懸垂法を適用すると第5腰椎の背側の血管の血流速度が有意に低下し,ヒラメ筋に電気刺激を行うとその血流速度が上昇した.通常,血管の状態は自律神経系により制御されている.内臓や血管などを自動的に制御する自律神経系には交感神経と副交感神経とがあり,血流速度は交感神経の活性化により上昇する.これらの結果から,重力に対抗するため緊張するヒラメ筋から脊髄に伝えられる感覚神経の活性化は,近傍の交感神経の活性化をひき起こしていることが推測された.試験管内での実験から,IL-6アンプの活性化をノルアドレナリンが濃度に依存的に増強することがわかり,交感神経の末端から放出されるノルアドレナリンに対し,ノルアドレナリン受容体の阻害剤を全身性に投与すると,第5腰椎の背側の血管内皮細胞からのCCL20の発現や病原性T細胞の集積,また,疾患の発症もすべて有意に抑制された.
これらの結果から,第5腰椎の背側の血管内皮細胞に血液細胞の中枢神経系へのゲートが存在すること,このゲートの形成機構は,重力刺激を起点とした感覚神経および交感神経の活性化が近傍の血管内皮細胞にIL-6アンプの過剰な活性化を誘導しケモカインの大量発現をひき起こすことであることが明らかにされた(図2).
今回の研究結果から,中枢神経系の血液脳関門に存在する免疫細胞の通過するゲートが局所的な神経刺激により形成されることが明らかになった.定常状態では重力刺激にともなうヒラメ筋の活性化が第5腰椎の背側の血管内皮細胞に交感神経を経由するノルアドレナリンの発現を誘導し,IL-6アンプの活性化を亢進させ多くのケモカインを誘導していることがわかった.今回の実験では,病原性T細胞としてTh17細胞を静脈に投与したためその遊走因子であるCCL20の発現に注目したが,ほかの免疫細胞,たとえば,キラーT細胞,ナチュラルキラー細胞,マクロファージ,好中球などを遊走させることが知られているケモカインもこの部位で過剰に発現していたことから,この部位が中枢神経系における免疫監視系の入り口である可能性が高いものと思われる.さらに,ミクログリアのように血球細胞に由来する脳の構成細胞の前駆体も,このゲートを介して中枢神経系に浸潤している可能性もある.今後,局所の感覚神経あるいは交感神経の活性化を抑制または刺激することで,人為的にこのゲートを閉じたり,別の部位に形成したり,より強く開いたりすることが可能になり,中枢神経系おける免疫細胞の存在数を制御できるようになれば,中枢神経系における感染,がん,難病などの予防や治療につながることが期待される.
神経の活性化は,今回の実験で明らかにされた重力ばかりでなく,現代生活につきまとうストレスなどさまざまな外的な刺激でも生じる.さらに,慢性の疼痛と疾患との関連も示唆されている.そのため,今回の成果から,さまざまな疾患が精神的なストレスなどで増悪するしくみ,あるいは,適度な運動が疾患や病態を改善する分子機構,さらに,針治療によりなぜ疾患や病態が改善するのかなど,これまで不明であった神経や精神と免疫系との相互作用の分子基盤が解明されることが期待される.さらに,中枢神経系ばかりでなくさまざまな臓器においても,免疫細胞は特定の血管から流入する.この血管の制御も神経刺激により大きな影響をうけている可能性がある.関連する交感神経や副交感神経が活性化あるいは不活性化することで,血管の活性化の状態が制御されている可能性も考えられる.このことは,臓器に特異的な自己免疫疾患や慢性の炎症性の疾患の発症機構も,特定の神経の活性化による特定の血管へのゲートの形成により説明できる可能性を示唆し,その制御により新たな治療法の開発に結びつくことが期待される.
略歴:1993年 大阪大学大学院医学系研究科 修了,同年 北海道大学免疫科学研究所 助手,2001年 米国Colorado大学 客員准教授,2002年 大阪大学大学院医学系研究科 助教授を経て,2007年より大阪大学大学院生命機能研究科 准教授.
研究テーマ:神経刺激とIL-6アンプによる炎症の形成.
関心事:神経と免疫との間葉系細胞を介する相互作用.NF-κBを制御する機構.
© 2012 村上 正晃 Licensed under CC 表示 2.1 日本
(大阪大学大学院生命機能研究科 免疫発生学研究室)
email:村上正晃
DOI: 10.7875/first.author.2012.025
Regional neural activation defines a gateway for autoreactive T cells to cross the blood-brain barrier.
Yasunobu Arima, Masaya Harada, Daisuke Kamimura, Jin-Haeng Park, Fuminori Kawano, Fiona E. Yull, Tadafumi Kawamoto, Yoichiro Iwakura, Ulrich A.K. Betz, Gabriel Márquez, Timothy S. Blackwell, Yoshinobu Ohira, Toshio Hirano, Masaaki Murakami
Cell, 148, 447-457 (2012)
この論文に出現する遺伝子・タンパク質のUniprot ID
IL-6(P08505), ミエリンオリゴデンドロサイト糖タンパク質(Q61885), インターロイキン17A(Q62386), インターフェロンγ(P01580), インターロイキン6(P08505), サイトカイン, NF-κB, STAT3(P42227), ケモカイン, gp130(Q00560), 1型コラーゲン, CCL20(O89093), CCR6(O54689)
要 約
中枢神経系である脳や脊髄の血管は,細菌やウイルスなどの影響を防ぐための特殊な関所として血液脳関門を形成している.免疫細胞はもとより大きなタンパク質なども血液脳関門を通過できない.しかし,中枢神経系にも細菌やウイルスが感染しがんや炎症などに起因する難病が発症する.こうした背景から,病原体や免疫細胞などが中枢神経系へと入るゲートの存在する可能性が考えられてきた.しかし,そのゲートがどこにあり,また,どのように形成されるのかなど,その実体は不明だった.筆者らは,中枢神経系の難病である多発性硬化症の動物モデルを用いて血液脳関門におけるゲートの部位とその形成機構を調べ,第5腰椎の背側の血管がそのゲートであることを世界ではじめてつきとめた.また,地球からの重力による日常的な刺激が第5腰椎の付近の神経を活性化させ,それが慢性炎症の誘導機構である“IL-6アンプ”を活性化することでこのゲートが形成されることをつきとめた.今回の成果により,精神的なストレスによりさまざまな疾患が増悪するしくみなど,これまで不明であった神経や精神と免疫系との相互作用の分子基盤の解明が期待される.
はじめに
脊椎動物の神経系は,脳や脊髄からなる中枢神経系と,体性神経系および自律神経系からなる末梢神経系とに分けられる.中枢神経系はニューロンの集まった塊であるのに対し,末梢神経系は神経節と神経繊維からなり,体の各部と中枢神経系とのあいだで神経刺激を伝達する役割をはたす.中枢神経系の臓器である脳や脊髄の血管は,細菌やウイルスなどの血液を介する影響を極力防ぐため,特殊な関所として血液脳関門を形成していることが判明していた.具体的には,血液脳関門は中枢神経系の血管に備わる,血液と中枢神経系の組織液とのあいだでの物質交換を制限する機構で,中枢神経系の血管を構成する内皮細胞が非常に強固に結合しあうことで,血液中の大きなタンパク質や免疫細胞などを中枢神経系へと通過させないよう機能している1,2).つまり,中枢神経系には末梢でのさまざまな出来事による血管内の変化が直接には伝わらないよう,血液脳関門により制御されているのである.しかし,ある状況では中枢神経系にも細菌やウイルスが感染し,がんや炎症などに起因する難病が発症する3,4).たとえば,インフルエンザでもHIVの感染でも脳炎を生じることがある.また,血液に存在する免疫細胞はこのような病態や疾患を防ぐ一方で,あるときは過度な炎症の原因となったり悪化させたりすることもある.こうした背景から,血液脳関門には病原体や免疫細胞などが中枢神経系へと入るゲートの存在する可能性が示唆されていた2,5).しかし,そのゲートがどこにあるのか,また,どのように形成されるのかなど,その実体は不明であった.そこで今回,筆者らは,なお治療法のない中枢神経系の難病である多発性硬化症の動物モデルである実験的自己免疫性脳脊髄炎を用いて,血液脳関門に存在するゲートの位置とその形成機構を検討した.
1.血液脳関門にある病原性T細胞のゲートの存在
中枢神経系に存在するミエリンオリゴデンドロサイト糖タンパク質を正常マウスに免疫するとヘルパーT細胞が抗原に特異的に反応し,自己反応性ヘルパーT細胞(Th17細胞とTh1細胞)として機能することで実験的自己免疫性脳脊髄炎が誘導される.このミエリンオリゴデンドロサイト糖タンパク質に特異的な自己反応性のTh17細胞とTh1細胞を疾患マウスから採取して正常マウスの静脈に移入すると,正常マウスの中枢神経系に実験的自己免疫性脳脊髄炎が誘導される6-8).これは,血液中の自己反応性をもつ病原性T細胞が血液脳関門をこえて中枢神経系に侵入し疾患を誘導したことを示すものである.そこで,この実験モデルを用いて血液脳関門におけるゲートの部位とその形成機構を調べることにした.
2.病原性T細胞のゲートは第5腰椎の背側の血管にある
まず,正常マウスの血管に存在するミエリンオリゴデンドロサイト糖タンパク質に特異的な病原性T細胞が,血管から中枢神経系へと入り込む部位を特定するため,自己反応性T細胞を移入してからまだ疾患の発症していない移入5日後に,マクロトームを用いて脊髄や脳を薄くスライスし,自己反応性T細胞の局在を蛍光顕微鏡により解析した.その結果,血管内の病原性T細胞は第5腰椎の背側の血管から脊髄に入ることをつきとめた.
3.血管内皮細胞でのIL-6アンプの活性化とゲートの形成
なぜその部位だけが自己反応性ヘルパーT細胞の中枢神経系へのゲートとなっているのか,そのしくみを調べた.はじめに,自己反応性ヘルパーT細胞のうち,インターロイキン17Aを発現するTh17細胞とインターフェロンγを発現するTh1細胞のどちらがこのゲートへの浸潤に関与しているかを,インターロイキン17Aやインターフェロンγをもたない自己反応性ヘルパーT細胞を準備して実験した.その結果,インターフェロンγをもたない自己反応性ヘルパーT細胞は浸潤するのに対し,インターロイキン17Aをもたない自己反応性ヘルパーT細胞は第5腰椎に浸潤できないことがわかった.筆者らは,これまで,インターロイキン17Aに依存性の炎症の誘導機構として,“IL-6アンプ”を研究してきた.IL-6アンプとは,血管内皮細胞や線維芽細胞などの間葉系細胞にインターロイキン17Aやインターロイキン6(IL-6)などのサイトカインが作用して相乗的なNF-κBおよびSTAT3の活性化が生じると,大量のケモカインが産生されてさまざまな細胞がその局所に浸潤し,自己免疫疾患を含む慢性炎症を誘導するという機構である7-9)(図1).細胞膜にあるシグナル伝達タンパク質gp130や細胞内におけるシグナル伝達タンパク質STAT3を欠損させることで間葉系細胞や血管内皮細胞において1型コラーゲンCreマウスを用いて特異的にインターロイキン6シグナルを遮断したところ,自己反応性ヘルパーT細胞の第5腰椎への浸潤が抑制された.さらに,第5腰椎の背側の血管内皮細胞では,ほかの脊椎の血管と比べて,STAT3およびNF-κBの活性化が生じていることもわかった.これまでの研究でTh17細胞はCCL20にひきよせられることがわかっていたので,この部位のIL-6アンプの活性化の標的となるケモカインとしてCCL20に注目した.実際に,CCL20は第5腰椎の背側の血管内皮細胞においてIL-6アンプに依存的に発現していた.さらに,CCL20の受容体であるCCR6をもたない自己反応性のTh17細胞は第5腰椎に浸潤することができなかった.中和抗体により全身においてCCL20が機能しないようにすると疾患の発症も抑制された.重要なことに,第5腰椎の背側の血管では定常状態においてCCL20以外の多くのケモカインも発現していることがわかった.つまり,第5腰椎の背側の血管は定常状態においてさまざまなケモカインを発現し,自己反応性T細胞を含む免疫細胞や血液細胞の血管から中枢神経系へのゲートとなっていることがわかった.
4.感覚神経の刺激とゲートの形成
つぎの疑問は,どうして第5腰椎の背側の血管がそのようなゲートとなっているかであった.いい換えると,なぜこの部位でIL-6アンプが特異的に活性化しているのであろうか? そこで,ヒラメ筋からの感覚神経の神経節が第5腰椎の背側に位置することに着目した.体の感覚や運動を制御する体性神経系には感覚神経と運動神経がある.そして,ヒラメ筋はふくらはぎの付近に存在して大きな重力を受け止める抗重力筋として知られている.絶え間のない重力刺激に対抗するヒラメ筋の応答が感覚神経の過剰な活性化を誘導し,これが原因で第5腰椎の背側の血管においてIL-6アンプを活性化しているのではないかという仮説をたてた.この仮説を実証するのに,NASA(米国航空宇宙局)で行われていた実験法に注目した10,11).つまり,マウスのしっぽを天井からつるし(後肢懸垂法),ヒラメ筋への重力刺激をなくし感覚神経への刺激を排除したときの第5腰椎の状態を調べた.その結果,この後肢懸垂法を適用すると第5腰椎の背側の血管におけるCCL20の発現および病原性T細胞の集積はみられず,実験的自己免疫性脳脊髄炎の発症も有意に抑制された.また,後肢懸垂法を適用したマウスのヒラメ筋に電気刺激をあたえるとその時間に比例してCCL20の発現量が増加することもわかった.
後肢懸垂法は非常に不自然な体の姿勢を1週間以上も保持させるので,この方法が体全体の神経系や骨格筋系などの恒常性を乱していないことを証明する必要があった.後肢懸垂法を適用したマウスに対し大腿四頭筋あるいは上腕三頭筋を電気刺激すると,それぞれ,第3腰椎あるいは頸椎から胸椎の背側の血管においてCCL20が発現すること,そして,その近傍の後根神経節も活性化することがわかった.これらの結果は,後肢懸垂法を適用したマウスにおいても,局所的な感覚神経の活性化が生じると,その神経の細胞体が存在する後根神経節の近傍の血管の状態が変化することを示していた.さらに,後肢懸垂法を適用しても脳,内臓,前肢,後肢,体表などにおける血流速度は変化しなかった.また,関節をギブスにより固定して屈曲させると,短期間的には筋肉の収縮刺激が感覚神経を経由して後根神経節を活性化させることが知られている.実際,後肢懸垂法を適用したのちのギブス固定によるヒラメ筋の収縮刺激により第5腰椎の背側の血管におけるCCL20の発現は上昇した.また,後根神経節から脊椎に延びる感覚神経のみを遮断する手術を行うと,体のバランスは保たれるが後根神経節の活性化は抑制されることがわかっている11).この手術を行ったマウスでは第5腰椎の背側の血管におけるCCL20の発現および病原性T細胞の集積はみられなかった.これらの実験結果から,後肢懸垂法は体全体の恒常性の変化は誘導せずに,主として後肢への重力刺激を欠損させた状態を反映していることが証明された.
5.感覚神経と交感神経との相互作用とゲートの形成
つづく疑問は,感覚神経の活性化がどのように血管の状態の変化をひき起こすかであった.この疑問のヒントは,血流速度の測定から得られた.後肢懸垂法を適用すると第5腰椎の背側の血管の血流速度が有意に低下し,ヒラメ筋に電気刺激を行うとその血流速度が上昇した.通常,血管の状態は自律神経系により制御されている.内臓や血管などを自動的に制御する自律神経系には交感神経と副交感神経とがあり,血流速度は交感神経の活性化により上昇する.これらの結果から,重力に対抗するため緊張するヒラメ筋から脊髄に伝えられる感覚神経の活性化は,近傍の交感神経の活性化をひき起こしていることが推測された.試験管内での実験から,IL-6アンプの活性化をノルアドレナリンが濃度に依存的に増強することがわかり,交感神経の末端から放出されるノルアドレナリンに対し,ノルアドレナリン受容体の阻害剤を全身性に投与すると,第5腰椎の背側の血管内皮細胞からのCCL20の発現や病原性T細胞の集積,また,疾患の発症もすべて有意に抑制された.
これらの結果から,第5腰椎の背側の血管内皮細胞に血液細胞の中枢神経系へのゲートが存在すること,このゲートの形成機構は,重力刺激を起点とした感覚神経および交感神経の活性化が近傍の血管内皮細胞にIL-6アンプの過剰な活性化を誘導しケモカインの大量発現をひき起こすことであることが明らかにされた(図2).
おわりに
今回の研究結果から,中枢神経系の血液脳関門に存在する免疫細胞の通過するゲートが局所的な神経刺激により形成されることが明らかになった.定常状態では重力刺激にともなうヒラメ筋の活性化が第5腰椎の背側の血管内皮細胞に交感神経を経由するノルアドレナリンの発現を誘導し,IL-6アンプの活性化を亢進させ多くのケモカインを誘導していることがわかった.今回の実験では,病原性T細胞としてTh17細胞を静脈に投与したためその遊走因子であるCCL20の発現に注目したが,ほかの免疫細胞,たとえば,キラーT細胞,ナチュラルキラー細胞,マクロファージ,好中球などを遊走させることが知られているケモカインもこの部位で過剰に発現していたことから,この部位が中枢神経系における免疫監視系の入り口である可能性が高いものと思われる.さらに,ミクログリアのように血球細胞に由来する脳の構成細胞の前駆体も,このゲートを介して中枢神経系に浸潤している可能性もある.今後,局所の感覚神経あるいは交感神経の活性化を抑制または刺激することで,人為的にこのゲートを閉じたり,別の部位に形成したり,より強く開いたりすることが可能になり,中枢神経系おける免疫細胞の存在数を制御できるようになれば,中枢神経系における感染,がん,難病などの予防や治療につながることが期待される.
神経の活性化は,今回の実験で明らかにされた重力ばかりでなく,現代生活につきまとうストレスなどさまざまな外的な刺激でも生じる.さらに,慢性の疼痛と疾患との関連も示唆されている.そのため,今回の成果から,さまざまな疾患が精神的なストレスなどで増悪するしくみ,あるいは,適度な運動が疾患や病態を改善する分子機構,さらに,針治療によりなぜ疾患や病態が改善するのかなど,これまで不明であった神経や精神と免疫系との相互作用の分子基盤が解明されることが期待される.さらに,中枢神経系ばかりでなくさまざまな臓器においても,免疫細胞は特定の血管から流入する.この血管の制御も神経刺激により大きな影響をうけている可能性がある.関連する交感神経や副交感神経が活性化あるいは不活性化することで,血管の活性化の状態が制御されている可能性も考えられる.このことは,臓器に特異的な自己免疫疾患や慢性の炎症性の疾患の発症機構も,特定の神経の活性化による特定の血管へのゲートの形成により説明できる可能性を示唆し,その制御により新たな治療法の開発に結びつくことが期待される.
文 献
- Galea, I., Bechmann, I. & Perry, V. H.: What is immune privilege (not)? Trends Immunol., 28, 12-18 (2007)[PubMed]
- Wilson, E. H., Weninger, W. & Hunter, C. A.: Trafficking of immune cells in the central nervous system. J. Clin. Invest., 120, 1368-1379 (2010)[PubMed]
- Salinas, S., Schiavo, G. & Kremer, E. J.: A hitchhiker's guide to the nervous system: the complex journey of viruses and toxins. Nat. Rev. Microbiol., 8, 645-655 (2010)[PubMed]
- McGavern, D. B. & Kang, S. S.: Illuminating viral infections in the nervous system. Nat. Rev. Immunol., 11, 318-329 (2011)[PubMed]
- Reboldi, A., Coisne, C., Baumjohann, D. et al.: C-C chemokine receptor 6-regulated entry of TH-17 cells into the CNS through the choroid plexus is required for the initiation of EAE. Nat. Immunol., 10, 514-523 (2009)[PubMed]
- Hirano, T.: Interleukin 6 in autoimmune and inflammatory diseases: a personal memoir. Proc. Jpn. Acad. Ser. B., 86, 717-730 (2010)[PubMed]
- Murakami, M. & Hirano, T.: A four step model for the IL-6 amplifier, a critical regulator of chromic inflammations in tissue specific MHC class II-associated autoimmune diseases. Front. Immunol., 2, 22 (2011)
- Ogura, H., Murakami, M., Okuyama, Y. et al.: Interleukin-17 promotes autoimmunity by triggering a positive-feedback loop via interleukin-6 induction. Immunity, 29, 628-636 (2008)[PubMed]
- Murakami, M., Okuyama, Y., Ogura, H. et al.: Local microbleeding facilitates IL-6- and IL-17-dependent arthritis in the absence of tissue antigen recognition by activated T cells. J. Exp. Med., 208, 103-114 (2011)[PubMed]
- De-Doncker, L., Kasri, M., Picquet, F. et al.: Physiologically adaptive changes of the L5 afferent neurogram and of the rat soleus EMG activity during 14 days of hindlimb unloading and recovery. J. Exp. Biol., 208, 4585-4592 (2005)[PubMed]
- Kawano, F., Matsuoka, Y., Oke, Y. et al.: Role(s) of nucleoli and phosphorylation of ribosomal protein S6 and/or HSP27 in the regulation of muscle mass. Am. J. Physiol. Cell Physiol., 293, C35-44 (2006)[PubMed]
著者プロフィール
略歴:1993年 大阪大学大学院医学系研究科 修了,同年 北海道大学免疫科学研究所 助手,2001年 米国Colorado大学 客員准教授,2002年 大阪大学大学院医学系研究科 助教授を経て,2007年より大阪大学大学院生命機能研究科 准教授.
研究テーマ:神経刺激とIL-6アンプによる炎症の形成.
関心事:神経と免疫との間葉系細胞を介する相互作用.NF-κBを制御する機構.
© 2012 村上 正晃 Licensed under CC 表示 2.1 日本