新規の神経修飾因子の可視化法により明らかになったドーパミンを介した空腹時の味覚制御
稲垣 秀彦
(米国California Institute of Technology,Division of Biology)
email:稲垣秀彦
DOI: 10.7875/first.author.2012.024
Visualizing neuromodulation in vivo: TANGO-mapping of dopamine signaling reveals appetite control of sugar sensing.
Hidehiko K. Inagaki, Shlomo Ben-Tabou de-Leon, Allan M. Wong, Smitha Jagadish, Hiroshi Ishimoto, Gilad Barnea, Toshihiro Kitamoto, Richard Axel, David J. Anderson
Cell, 148, 583-595 (2012)
動物は空腹や覚醒などの状態に応じ適切に行動を変化させる.ドーパミンやセロトニンなどの神経修飾因子は神経回路にはたらきその情報処理を変化させることから,脳における状態制御にかかわることが示唆されてきた.しかし,これらの神経修飾因子が脳の“いつ”“どこ”で機能しているのか,神経回路のレベルで調べる汎用的な手法が存在しなかったため知見は不足していた.今回,筆者らは,脳において神経修飾因子の作用した神経回路を可視化する新規の手法を開発した.実際に,ショウジョウバエの脳においてこの手法を応用しドーパミンの量を測定した結果,空腹時における摂食行動の変化はドーパミンが甘み感覚ニューロンへのCa2+の流入量を増加させることにより誘起されていることが判明した.このように,この手法により神経修飾因子による行動の変化が神経回路のレベルで説明できるようになった.この手法を発展させほかの生物種にも応用することで,今後,脳における状態制御の分子機構の理解が進むものと期待される.
生物は状態に応じ行動を適切に変化させる.たとえば,同じ食べ物が目のまえにあっても,満腹時は食べないが空腹時には食べる1).同じものを見ても,同じことを聞いても,覚醒のレベルや気分しだいで感じ方がまったく変わることもある.このように,同じ感覚(脳への入力)があっても,状態により行動(脳からの出力)の変化することは,ヒトを含め多くの生物種で知られている.状態に応じて最適な行動をとることを可能にするこの“状態制御”は,生存のため非常に重要である.また,ヒトの気分や情動などもこれに似た現象であり,その異常が精神疾患の原因とも考えられている.そのため,脳の状態制御の機構を理解することは,脳の基本的な分子機構の解明のみならず,精神疾患の治療のためにも重要である.
このような脳の状態制御は,脳における情報処理が状態により切り替わることで実現されていると考えられる.このような情報処理の切り替えを制御するものとして,ドーパミン,セロトニン,神経タンパク質など,“神経修飾因子”とよばれる化学物質が重要であると考えられてきた.これらの神経修飾因子は情報の演算単位であるシナプスどうしの結合の強さを変化させることで,神経回路の情報処理および出力を変化させる2,3).実際に,カニやザリガニの消化器官を動かす神経節は,たった十個以下のニューロンからなる非常に小さな回路であるにもかかわらず,異なった神経修飾因子がはたらくことで数十種類もの異なった運動を制御していることが知られている4).さらに大きな神経節である脳における,より複雑な状態ごとの行動変化も,同様に神経修飾因子により制御されている可能性が非常に高い.実際,多くの神経疾患にかかわる薬剤は神経修飾因子のアゴニストやアンタゴニストである.しかし,これら神経修飾因子が“どの状態のとき”“脳のどの部位”を修飾しているのかについての知見は少数の例外を除いてほとんどなく5-7),状態制御の詳細な分子機構に関する知見はほぼない.これは,神経修飾因子が脳の“いつ”“どこ”ではたらきかけているかを可視化する方法がこれまで存在しなかったためである.そこで今回,筆者らは,脳における神経修飾因子の作用を可視化する手法を開発した.遺伝学的なツールが豊富に存在することで開発の容易なショウジョウバエを用い,この手法を用いて空腹時の摂食行動の制御の分子機構の解明をめざした.
神経修飾因子はそれぞれ異なるGタンパク質共役型受容体を介してニューロンに作用する.たとえば,ドーパミンはドーパミン受容体,セロトニンはセロトニン受容体を介してニューロンどうしの結合の強度や遺伝子発現などを変化させている.この際,神経修飾因子の結合により活性化したGタンパク質共役型受容体はアレスチンとよばれるタンパク質と結合することが知られている.すなわち,アレスチンとGタンパク質共役型受容体との相互作用を測定することで,神経修飾因子がニューロンに作用したかどうかを調べることが可能になる.
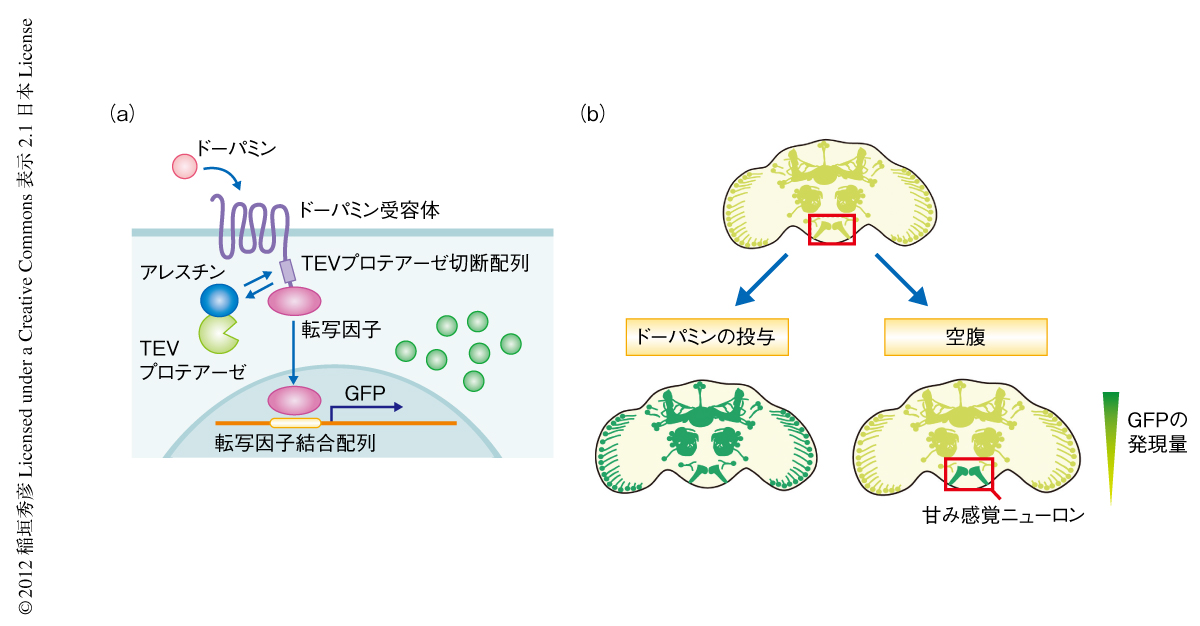
そこで,アレスチンがタンパク質共役型受容体に結合したときのみニューロンにおいて蛍光タンパク質が発現するような人工シグナル伝達系を構築した(図1a).この人工シグナル伝達系は2種類の人工タンパク質よりなる.ひとつはGタンパク質共役型受容体をTEVプロテアーゼの切断配列を介し転写因子と結合させた融合タンパク質,もうひとつはアレスチンとTEVプロテアーゼとの融合タンパク質である.神経修飾因子がGタンパク質共役型受容体と転写因子との融合タンパク質に結合すると,アレスチン-TEVプロテアーゼ融合タンパク質がGタンパク質共役型受容体の側に結合し転写因子とのあいだにあるTEVプロテアーゼ切断配列を切断する.すると,転写因子が遊離し核へと移行することが可能となり,この転写因子がGFPなど蛍光タンパク質をコードするレポーター遺伝子を発現させる.この人工シグナル伝達系を用いることで,原理的には神経修飾因子のはたらいた度合いに応じニューロンにおける蛍光タンパク質の量を変化させることができる.
そこで実際に,Gタンパク質共役型受容体としてドーパミン受容体を用いたこの人工シグナル伝達系をショウジョウバエの脳において発現させ,脳におけるドーパミンの量を薬剤の投与により増減させてみた.その結果,脳における蛍光タンパク質の量もドーパミンの量に応じ変化した(図1b).これより,神経修飾因子の量に応じてGFPが発現する可視化ツールの作製に成功したものと判断した.なお,この手法はドーパミン受容体に依存的な方法ではなく,測定したい神経修飾因子それぞれの受容体を用いることでさまざまな神経修飾因子それぞれに特異的な測定が可能であった.この手法のもととなった,培養細胞においてGタンパク質共役型受容体の活性を測定する方法であるTango法にもとづき8),この手法をTangoマップと名づけた.
このツールを用いて,本来の目的である状態制御の分子機構の解明を試みた.そのためのモデル系として,もっとも原始的な状態制御のひとつと考えられる“空腹”と“満腹”にともなう行動の変化を選択した.まず,空腹時と満腹時での脳におけるドーパミンによる修飾の差をドーパミン受容体のTangoマップを用いて測定した.その結果,空腹時には甘みを検知する味覚ニューロンがドーパミンにより修飾されていることが判明した(図1b).すなわち,空腹時にはドーパミンが味覚の変化をひき起こしていることが予想された.
そこで,行動実験により空腹時の味覚の変化を解析し,それがドーパミンにより制御されているのかどうかを調べた.空腹時には餓死をさけるため糖分の低い食料でも食べられるよう甘みの感受性の上昇することが多くの生物種において知られている1).まず,同様の変化がショウジョウバエでもみられるか調べるため,ショウジョウバエの口吻に異なった濃度のスクロース水溶液を提示し摂食行動を示すかどうか調べた(図2).さまざまな濃度のスクロース水溶液を用意しショウジョウバエが口吻を伸ばすかどうかを調べることで,摂食行動におけるスクロースに対する感受性を測定することができる.その結果,満腹時に比べ空腹時にはスクロースに対する感受性の上昇していることが測定された.よって,ほかの生物種と同様に,ショウジョウバエにおいても空腹時には甘みの感受性の上昇することが示された.
つぎに,ドーパミンがこの変化を誘起しているのかどうか調べるため,脳におけるドーパミンの量を薬理学的または遺伝学的に増加させスクロースに対する摂食行動を調べた.その結果,空腹時と同様に,この操作によっても甘みの感受性の上昇することがわかった.つまり,ドーパミンの量の増加が空腹を模倣することが明らかになった.また,Tangoマップのデータからは空腹時にはドーパミンが甘み感覚ニューロンに作用することが明らかになっていたため,空腹時の甘み感受性の上昇もドーパミンにより制御されていることに矛盾はなかった.
そこで,ドーパミンが甘み感覚ニューロンにはたらくことにより空腹時における甘み感受性が上昇しているのかどうか調べた.具体的には,甘み感覚ニューロンにおいて特異的にドーパミン受容体を阻害し,空腹時に甘み感受性が変化するかどうかを調べた.まず,甘み感覚ニューロンからRNAを抽出し,そこに発現しているドーパミン受容体の種類を同定した.つぎに,甘み感覚ニューロンに発現していたドーパミン受容体をRNAi法により特異的にノックダウンした.その結果,予想どおり,空腹時における甘み感受性の上昇が阻害された.すなわち,空腹時にはドーパミンが甘み感覚ニューロンにはたらくことで甘みに対する感受性の上昇していることが遺伝学的に実証された.
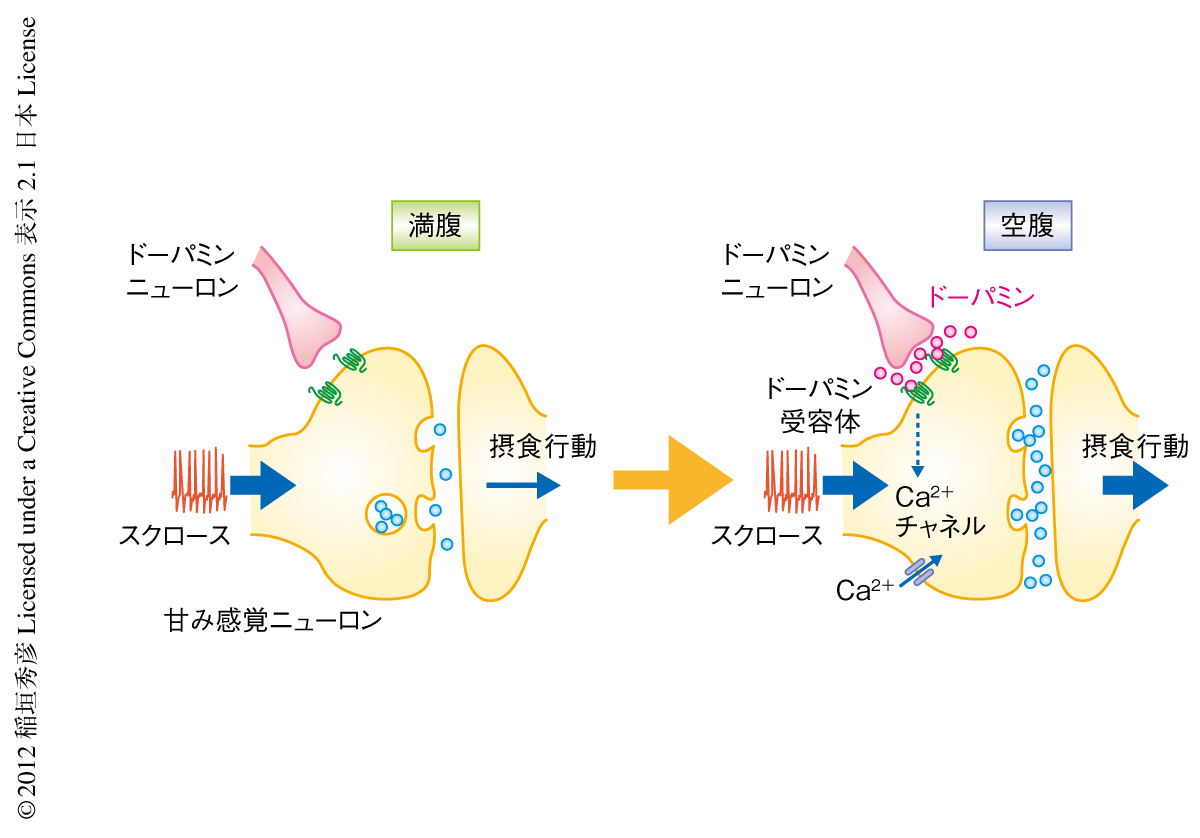
ドーパミンは甘み感覚ニューロンにどのように作用することで摂食行動を変化させているのだろうか? これを調べるため,空腹時における甘み感覚ニューロンの生理学的な性質の変化を調べた.まず,スクロースに対する応答を電気生理学的な手法により調べたところ,驚くべきことに,空腹時と満腹時とのあいだで発火の頻度には顕著な差が測定されなかった.すなわち,空腹は甘み感覚ニューロンの発火の頻度には影響をあたえずにその出力を変えていることになった.そこで,甘み感覚ニューロンがほかのニューロンへと出力する神経終末におけるCa2+の流入量を,遺伝学的なCa2+センサーであるGCaMP3を用いたCa2+イメージング法により調べた9).その結果,同じスクロース水溶液に対するCa2+流入量が空腹時には空腹時に比べ増加していた.また,ドーパミンを脳に直接にくわえることでも同じ変化が測定され,ドーパミン受容体の変異体ではこの変化は測定されなかった.すなわち,空腹時にはドーパミンを介したシグナルが甘み感覚ニューロンに作用することでその神経末端におけるCa2+流入量が増加し,同じスクロース水溶液を提示されても摂食行動が亢進していることが明確に示された(図3).
新規のツールTangoマップを用いることで,“どの状態のとき”に脳の“どの部位”で“どの神経修飾因子”が作用しているか,可視化することが可能になった.さらに,この可視化された情報にもとづき,遺伝学的な手法や神経生理学的な手法と組み合わせることで,“状態”がどのように制御されているのか,その分子機構を神経回路のレベルで研究することが可能になった.実際にこの研究では,このツールを用いることで空腹時の行動変化(スクロースに対する摂食行動の頻度の増加)がどのように起こるかを説明できた.この手法Tangoマップは,行動中の動物の脳における神経修飾因子の活動を神経回路のレベル,かつ,神経修飾因子に特異的に測定できるという大きなメリットがある.ただし,シグナル/ノイズ比や時間分解能にはまだ改善の余地が大いにあり,今後も改良する予定である.
脳の“状態”がどのように制御されているか,どのように表現されているかについての知見は,ほぼない.これまでに明らかになっていることとしては,“状態”どうしが排他的であることがあげられる.たとえば,“空腹”と“満腹”とは共存せず排他的である.このことから,異なった状態は異なった中枢で制御されておりそれぞれが抑制しあっている,また,ひとつの中枢がいくつもの状態を活動状態の違いとして表現しているためほかの状態は同時には存在しえない,など,いくつかの可能性が予想される.今後,神経修飾因子の可視化の手法をほかの高等生物あるいはほかの高等な“状態”にも応用していくことで,脳の重要な機能である“状態制御”の分子機構の解明が進むことを期待している.
略歴:米国California Institute of Technology大学院博士課程 在学中.
研究テーマ:脳における状態制御の分子機構.
抱負:新規の手法の開発や集団イメージング,電気生理学的な手法を活用し,集団としてのニューロンがどのように情報や状態をコードしているかを明らかにしたい.
© 2012 稲垣 秀彦 Licensed under CC 表示 2.1 日本
(米国California Institute of Technology,Division of Biology)
email:稲垣秀彦
DOI: 10.7875/first.author.2012.024
Visualizing neuromodulation in vivo: TANGO-mapping of dopamine signaling reveals appetite control of sugar sensing.
Hidehiko K. Inagaki, Shlomo Ben-Tabou de-Leon, Allan M. Wong, Smitha Jagadish, Hiroshi Ishimoto, Gilad Barnea, Toshihiro Kitamoto, Richard Axel, David J. Anderson
Cell, 148, 583-595 (2012)
要 約
動物は空腹や覚醒などの状態に応じ適切に行動を変化させる.ドーパミンやセロトニンなどの神経修飾因子は神経回路にはたらきその情報処理を変化させることから,脳における状態制御にかかわることが示唆されてきた.しかし,これらの神経修飾因子が脳の“いつ”“どこ”で機能しているのか,神経回路のレベルで調べる汎用的な手法が存在しなかったため知見は不足していた.今回,筆者らは,脳において神経修飾因子の作用した神経回路を可視化する新規の手法を開発した.実際に,ショウジョウバエの脳においてこの手法を応用しドーパミンの量を測定した結果,空腹時における摂食行動の変化はドーパミンが甘み感覚ニューロンへのCa2+の流入量を増加させることにより誘起されていることが判明した.このように,この手法により神経修飾因子による行動の変化が神経回路のレベルで説明できるようになった.この手法を発展させほかの生物種にも応用することで,今後,脳における状態制御の分子機構の理解が進むものと期待される.
はじめに
生物は状態に応じ行動を適切に変化させる.たとえば,同じ食べ物が目のまえにあっても,満腹時は食べないが空腹時には食べる1).同じものを見ても,同じことを聞いても,覚醒のレベルや気分しだいで感じ方がまったく変わることもある.このように,同じ感覚(脳への入力)があっても,状態により行動(脳からの出力)の変化することは,ヒトを含め多くの生物種で知られている.状態に応じて最適な行動をとることを可能にするこの“状態制御”は,生存のため非常に重要である.また,ヒトの気分や情動などもこれに似た現象であり,その異常が精神疾患の原因とも考えられている.そのため,脳の状態制御の機構を理解することは,脳の基本的な分子機構の解明のみならず,精神疾患の治療のためにも重要である.
このような脳の状態制御は,脳における情報処理が状態により切り替わることで実現されていると考えられる.このような情報処理の切り替えを制御するものとして,ドーパミン,セロトニン,神経タンパク質など,“神経修飾因子”とよばれる化学物質が重要であると考えられてきた.これらの神経修飾因子は情報の演算単位であるシナプスどうしの結合の強さを変化させることで,神経回路の情報処理および出力を変化させる2,3).実際に,カニやザリガニの消化器官を動かす神経節は,たった十個以下のニューロンからなる非常に小さな回路であるにもかかわらず,異なった神経修飾因子がはたらくことで数十種類もの異なった運動を制御していることが知られている4).さらに大きな神経節である脳における,より複雑な状態ごとの行動変化も,同様に神経修飾因子により制御されている可能性が非常に高い.実際,多くの神経疾患にかかわる薬剤は神経修飾因子のアゴニストやアンタゴニストである.しかし,これら神経修飾因子が“どの状態のとき”“脳のどの部位”を修飾しているのかについての知見は少数の例外を除いてほとんどなく5-7),状態制御の詳細な分子機構に関する知見はほぼない.これは,神経修飾因子が脳の“いつ”“どこ”ではたらきかけているかを可視化する方法がこれまで存在しなかったためである.そこで今回,筆者らは,脳における神経修飾因子の作用を可視化する手法を開発した.遺伝学的なツールが豊富に存在することで開発の容易なショウジョウバエを用い,この手法を用いて空腹時の摂食行動の制御の分子機構の解明をめざした.
1.新規の手法Tangoマップにより脳におけるドーパミンの量を測定できる
神経修飾因子はそれぞれ異なるGタンパク質共役型受容体を介してニューロンに作用する.たとえば,ドーパミンはドーパミン受容体,セロトニンはセロトニン受容体を介してニューロンどうしの結合の強度や遺伝子発現などを変化させている.この際,神経修飾因子の結合により活性化したGタンパク質共役型受容体はアレスチンとよばれるタンパク質と結合することが知られている.すなわち,アレスチンとGタンパク質共役型受容体との相互作用を測定することで,神経修飾因子がニューロンに作用したかどうかを調べることが可能になる.
そこで,アレスチンがタンパク質共役型受容体に結合したときのみニューロンにおいて蛍光タンパク質が発現するような人工シグナル伝達系を構築した(図1a).この人工シグナル伝達系は2種類の人工タンパク質よりなる.ひとつはGタンパク質共役型受容体をTEVプロテアーゼの切断配列を介し転写因子と結合させた融合タンパク質,もうひとつはアレスチンとTEVプロテアーゼとの融合タンパク質である.神経修飾因子がGタンパク質共役型受容体と転写因子との融合タンパク質に結合すると,アレスチン-TEVプロテアーゼ融合タンパク質がGタンパク質共役型受容体の側に結合し転写因子とのあいだにあるTEVプロテアーゼ切断配列を切断する.すると,転写因子が遊離し核へと移行することが可能となり,この転写因子がGFPなど蛍光タンパク質をコードするレポーター遺伝子を発現させる.この人工シグナル伝達系を用いることで,原理的には神経修飾因子のはたらいた度合いに応じニューロンにおける蛍光タンパク質の量を変化させることができる.
そこで実際に,Gタンパク質共役型受容体としてドーパミン受容体を用いたこの人工シグナル伝達系をショウジョウバエの脳において発現させ,脳におけるドーパミンの量を薬剤の投与により増減させてみた.その結果,脳における蛍光タンパク質の量もドーパミンの量に応じ変化した(図1b).これより,神経修飾因子の量に応じてGFPが発現する可視化ツールの作製に成功したものと判断した.なお,この手法はドーパミン受容体に依存的な方法ではなく,測定したい神経修飾因子それぞれの受容体を用いることでさまざまな神経修飾因子それぞれに特異的な測定が可能であった.この手法のもととなった,培養細胞においてGタンパク質共役型受容体の活性を測定する方法であるTango法にもとづき8),この手法をTangoマップと名づけた.
2.空腹時にはドーパミンが甘みを検知する味覚ニューロンを修飾しその感度を変化させる
このツールを用いて,本来の目的である状態制御の分子機構の解明を試みた.そのためのモデル系として,もっとも原始的な状態制御のひとつと考えられる“空腹”と“満腹”にともなう行動の変化を選択した.まず,空腹時と満腹時での脳におけるドーパミンによる修飾の差をドーパミン受容体のTangoマップを用いて測定した.その結果,空腹時には甘みを検知する味覚ニューロンがドーパミンにより修飾されていることが判明した(図1b).すなわち,空腹時にはドーパミンが味覚の変化をひき起こしていることが予想された.
そこで,行動実験により空腹時の味覚の変化を解析し,それがドーパミンにより制御されているのかどうかを調べた.空腹時には餓死をさけるため糖分の低い食料でも食べられるよう甘みの感受性の上昇することが多くの生物種において知られている1).まず,同様の変化がショウジョウバエでもみられるか調べるため,ショウジョウバエの口吻に異なった濃度のスクロース水溶液を提示し摂食行動を示すかどうか調べた(図2).さまざまな濃度のスクロース水溶液を用意しショウジョウバエが口吻を伸ばすかどうかを調べることで,摂食行動におけるスクロースに対する感受性を測定することができる.その結果,満腹時に比べ空腹時にはスクロースに対する感受性の上昇していることが測定された.よって,ほかの生物種と同様に,ショウジョウバエにおいても空腹時には甘みの感受性の上昇することが示された.
つぎに,ドーパミンがこの変化を誘起しているのかどうか調べるため,脳におけるドーパミンの量を薬理学的または遺伝学的に増加させスクロースに対する摂食行動を調べた.その結果,空腹時と同様に,この操作によっても甘みの感受性の上昇することがわかった.つまり,ドーパミンの量の増加が空腹を模倣することが明らかになった.また,Tangoマップのデータからは空腹時にはドーパミンが甘み感覚ニューロンに作用することが明らかになっていたため,空腹時の甘み感受性の上昇もドーパミンにより制御されていることに矛盾はなかった.
そこで,ドーパミンが甘み感覚ニューロンにはたらくことにより空腹時における甘み感受性が上昇しているのかどうか調べた.具体的には,甘み感覚ニューロンにおいて特異的にドーパミン受容体を阻害し,空腹時に甘み感受性が変化するかどうかを調べた.まず,甘み感覚ニューロンからRNAを抽出し,そこに発現しているドーパミン受容体の種類を同定した.つぎに,甘み感覚ニューロンに発現していたドーパミン受容体をRNAi法により特異的にノックダウンした.その結果,予想どおり,空腹時における甘み感受性の上昇が阻害された.すなわち,空腹時にはドーパミンが甘み感覚ニューロンにはたらくことで甘みに対する感受性の上昇していることが遺伝学的に実証された.
3.ドーパミンは甘み感覚ニューロンへのCa2+の流入量を制御することで感度の変化をひき起こす
ドーパミンは甘み感覚ニューロンにどのように作用することで摂食行動を変化させているのだろうか? これを調べるため,空腹時における甘み感覚ニューロンの生理学的な性質の変化を調べた.まず,スクロースに対する応答を電気生理学的な手法により調べたところ,驚くべきことに,空腹時と満腹時とのあいだで発火の頻度には顕著な差が測定されなかった.すなわち,空腹は甘み感覚ニューロンの発火の頻度には影響をあたえずにその出力を変えていることになった.そこで,甘み感覚ニューロンがほかのニューロンへと出力する神経終末におけるCa2+の流入量を,遺伝学的なCa2+センサーであるGCaMP3を用いたCa2+イメージング法により調べた9).その結果,同じスクロース水溶液に対するCa2+流入量が空腹時には空腹時に比べ増加していた.また,ドーパミンを脳に直接にくわえることでも同じ変化が測定され,ドーパミン受容体の変異体ではこの変化は測定されなかった.すなわち,空腹時にはドーパミンを介したシグナルが甘み感覚ニューロンに作用することでその神経末端におけるCa2+流入量が増加し,同じスクロース水溶液を提示されても摂食行動が亢進していることが明確に示された(図3).
おわりに
新規のツールTangoマップを用いることで,“どの状態のとき”に脳の“どの部位”で“どの神経修飾因子”が作用しているか,可視化することが可能になった.さらに,この可視化された情報にもとづき,遺伝学的な手法や神経生理学的な手法と組み合わせることで,“状態”がどのように制御されているのか,その分子機構を神経回路のレベルで研究することが可能になった.実際にこの研究では,このツールを用いることで空腹時の行動変化(スクロースに対する摂食行動の頻度の増加)がどのように起こるかを説明できた.この手法Tangoマップは,行動中の動物の脳における神経修飾因子の活動を神経回路のレベル,かつ,神経修飾因子に特異的に測定できるという大きなメリットがある.ただし,シグナル/ノイズ比や時間分解能にはまだ改善の余地が大いにあり,今後も改良する予定である.
脳の“状態”がどのように制御されているか,どのように表現されているかについての知見は,ほぼない.これまでに明らかになっていることとしては,“状態”どうしが排他的であることがあげられる.たとえば,“空腹”と“満腹”とは共存せず排他的である.このことから,異なった状態は異なった中枢で制御されておりそれぞれが抑制しあっている,また,ひとつの中枢がいくつもの状態を活動状態の違いとして表現しているためほかの状態は同時には存在しえない,など,いくつかの可能性が予想される.今後,神経修飾因子の可視化の手法をほかの高等生物あるいはほかの高等な“状態”にも応用していくことで,脳の重要な機能である“状態制御”の分子機構の解明が進むことを期待している.
文 献
- Dethier, V. G.: The Hungry Fly: A Physiological Study of the Behavior Associated with Feeding. Harvard University Press, Cambridge (1976)
- Birmingham, J. T. & Tauck, D. L.: Neuromodulation in invertebrate sensory systems: from biophysics to behavior. J. Exp. Biol., 206, 3541-3546 (2003)[PubMed]
- Hurley, L. M., Devilbiss, D. M. & Waterhouse, B. D.: A matter of focus: monoaminergic modulation of stimulus coding in mammalian sensory networks. Curr. Opin. Neurobiol., 14, 488-495 (2004)[PubMed]
- Harris-Warrick, R. M. & Marder, E.: Modulation of neural networks for behavior. Annu. Rev. Neurosci., 14, 39-57 (1991)[PubMed]
- Lebestky, T., Chang, J. S., Dankert, H. et al.: Two different forms of arousal in Drosophila are oppositely regulated by the dopamine D1 receptor ortholog DopR via distinct neural circuits. Neuron, 64, 522-536 (2009)[PubMed]
- Krashes, M. J., DasGupta, S., Vreede, A. et al.: A neural circuit mechanism integrating motivational state with memory expression in Drosophila. Cell, 139, 416-427 (2009)[PubMed]
- Root, C. M., Ko, K. I., Jafari, A. et al.: Presynaptic facilitation by neuropeptide signaling mediates odor-driven food search. Cell, 145, 133-144 (2011)[PubMed]
- Barnea, G., Strapps, W., Herrada, G. et al.: The genetic design of signaling cascades to record receptor activation. Proc. Natl. Acad. Sci. USA, 105, 64-69 (2008)[PubMed]
- Tian, L., Hires, S. A., Mao, T. et al.: Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat Methods, 6, 875-881 (2009)[PubMed]
著者プロフィール
略歴:米国California Institute of Technology大学院博士課程 在学中.
研究テーマ:脳における状態制御の分子機構.
抱負:新規の手法の開発や集団イメージング,電気生理学的な手法を活用し,集団としてのニューロンがどのように情報や状態をコードしているかを明らかにしたい.
© 2012 稲垣 秀彦 Licensed under CC 表示 2.1 日本