生細胞におけるブール代数を用いた論理ゲートの構築
宮本崇史・井上尊生
(米国Johns Hopkins大学School of Medicine,Department of Cell Biology)
email:宮本崇史,井上尊生
DOI: 10.7875/first.author.2012.039
Rapid and orthogonal logic gating with a gibberellin-induced dimerization system.
Takafumi Miyamoto, Robert DeRose, Allison Suarez, Tasuku Ueno, Melinda Chen, Tai-ping Sun, Michael J. Wolfgang, Chandrani Mukherjee, David J. Meyers, Takanari Inoue
Nature Chemical Biology, 8, 465-470 (2012)
生体の構成単位である細胞は,光,温度,圧力,pH,栄養物質などの化学物質といった細胞の外部のさまざまな環境構成要素の変化に対応して,細胞分裂,分化,遊走などの細胞機能を選択し実行する.この際,細胞にはりめぐらされた生化学反応ネットワークは複数の入力情報を数秒から数分の単位で統合処理し,それぞれに適応した細胞機能を出力する.こうした複雑な情報処理がμmオーダーのかぎられた空間でいったいどのようにして達成されているのかはいまだ解明されていない.近年の研究から,生化学反応ネットワークにはタンパク質などのシグナル情報伝達物質により構成される多数の論理ゲートが含まれていることが明らかになった.これらの論理ゲートの機能をより深く理解するため,筆者らは,合成生物学の理念にもとづきそれらを生きた細胞において“合成”することを試みている.今回,筆者らは,従来のラパマイシンを用いた化学誘導二量体形成法と直交的に機能する,植物ホルモンであるジベレリンを用いた新たな化学誘導二量体形成法を開発し,2つの異なるタンパク質を時空間的に独立して,さらには,秒のオーダーをもって自在にあやつることを可能にした.また,これら2つの化学誘導二量体形成法を用いることで,生細胞において迅速な処理速度をもつ論理ゲートの構築に成功した.
細胞では動的な膜構造体が構築する複雑な空間のなか,かぎられた数のタンパク質が時間的かつ空間的な制御をうけてその機能を発揮することで,実に多彩な細胞機能を生み出している.この細胞機能の選択は,複数の遺伝子制御ネットワークやシグナル伝達系などから構成される生化学反応ネットワークからの入力情報が統合処理された結果であり,その過程ではさまざまな条件にもとづいた情報処理が行われている(図1).合成生物学の分野では,この複雑な生化学反応ネットワークを再現することで多様な生命現象の全体像を把握し,これをさらに改良する試みが行われている.そのひとつとして,生化学反応ネットワークにみられる論理ゲートの試験管内や生細胞における構築が行われているが1-5),これまでに開発された論理ゲートのほとんどは遺伝子の転写や翻訳といった過程を介することから,アウトプットを得るまでに数時間以上の処理時間を要していた.そのため,実際の生化学反応ネットワークでみられる数秒から数分での処理速度をもつ論理ゲートを生細胞において再現することは非常に困難で,いまだに達成されていない.
筆者らが研究を進めている化学誘導二量体形成法(chemically inducible dimerization system)については,1993年に,FK1012を二量体形成物質としたモデルがはじめて提唱された6).そののち,マクロライド系抗生物質であるラパマイシンを二量体形成物質としてFK506結合タンパク質(FK506-binding protein:FKBP)とFK506結合タンパク質とラパマイシンとの複合体に対する結合タンパク質であるFRBを用いた方法をはじめ,さまざまな手法が開発されている7-10).筆者らのグループは,これらの手法をもとに,標的となるタンパク質を細胞における任意の場所に迅速かつ特異的に局在させる手法を新たに開発してきた11-13).
生化学反応ネットワークでみられる多くの論理ゲートは2つ以上の入力情報をもとにしている.この入力情報は複数のタンパク質が時間的かつ空間的に特異的な場所で機能を発現しあうことにより決定される.化学誘導二量体形成法では標的タンパク質を秒のオーダーかつ空間的に任意のタイミングであやつることができるため,理論的には,直交的に機能しうる化学誘導二量体形成法を組み合わせればより本来の処理速度に近い論理ゲートの構築が可能であると考えられる.しかしながら,既存の化学誘導二量体形成法では直交的かつ同等の速度をもって機能する2種類以上の手法は報告されておらず,新たな化学誘導二量体形成法の確立が待たれていた.筆者らは,ラパマイシンを用いた化学誘導二量体形成法と直交的に機能する,植物ホルモンであるジベレリンのひとつジベレリン酸を用いた新規の化学誘導二量体形成法を開発した.また,この化学誘導二量体形成法を従来のラパマイシンを用いた化学誘導二量体形成法とともに用いることで,生細胞における論理ゲートの構築を実現した.
植物ホルモンのひとつであるジベレリンは,植物の生長,発芽,花芽の形成,果実の肥大促進など多くの生理現象にかかわっていることが報告されている14).結晶構造解析から,ジベレリンはジベレリン受容体であるGID1の結合ポケットに入り込んでその構造変化をひき起こすことが報告されている15,16).DELLAタンパク質のひとつであるGAIは,このジベレリンにより構造変化の起こったGID1と結合する.筆者らはまず,シロイヌナズナに由来するGID1およびGAIにそれぞれ蛍光タンパク質であるYFPおよびCFPを融合し,哺乳類培養細胞において発現させ,ジベレリン酸がこれらタンパク質の結合を誘導するかどうかを蛍光共鳴エネルギー移動法(fluorescence resonance energy transfer,FRET法)により検討した.しかし,単純にジベレリン酸を細胞に添加したのみではGAIとGID1との結合を確認することができなかった.これは負に荷電したジベレリン酸のカルボキシル基が細胞膜の透過性を低下させているためであろうと考え,このカルボキシル基にアセトキシメチル基をエステル結合させたアナログを合成した.このジベレリン酸-AMではジベレリン酸の電荷はマスクされ細胞内へと拡散することができる.細胞内へ拡散したジベレリン酸-AMは多種類の細胞に恒常的に存在するエステラーゼによりアセトキシメチル基が加水分解されジベレリン酸として機能する.予想どおり,ジベレリン酸-AMを細胞に投与すると細胞内においてGID1とGAIとの結合が誘導されることが確認された.
つづいて,GAIとGID1のサイズを最小化することで,より効率的なジベレリン酸による化学誘導二量体形成法を開発できるのではないかと考えた.いくつかの候補を検討し,最終的にGID1の全領域とGAIのN末端側の92アミノ酸残基(GAI(1-92))を用いることでジベレリン酸による三者複合体の形成がもっとも効率的に誘導されることを見い出した.
つぎに,実際にジベレリン酸-AMを用いた化学誘導二量体形成法により細胞における特定の領域に標的となるタンパク質を移行させることができるかどうか確認するため,HeLa細胞を用い,チロシンキナーゼであるLynに由来する細胞膜移行シグナルを融合したGAI(1-92) を細胞膜に繋留し,一方で,YFPを融合したGID1を細胞質に発現させて,ジベレリン酸-AMの投与による移行実験を行った.その結果,ジベレリン酸-AMの投与ののち細胞質に局在していたGID1は十数秒以内にGAI(1-92) の局在する細胞膜へと移行しはじめた.細胞質における蛍光強度の定量的な解析から,速度定数は10μMのジベレリン酸-AMを投与した場合でおおよそ0.012 sec-1と見積もられた.ほかの細胞株を用いても同様な結果が確認され,この手法が汎用性にすぐれていることが示唆された.さらに,RhoファミリーGTPaseのひとつであるRac1のグアニンヌクレオチド交換因子Tiam1をGID1に融合させて同様な実験を行った.Tiam1は細胞膜に局在した場合,Rac1の活性化を介して細胞膜の波打ち運動(ラッフリング)を誘導することが知られている.ジベレリン酸-AMの投与のまえにはTiam1は細胞質に局在しておりラッフリングは誘導されなかったが,ジベレリン酸-AMを投与するとTiam1は迅速に細胞膜へと移行し数十秒以内にラッフリングを誘導した.また,細胞膜移行シグナルに代えて核移行シグナルをGAI(1-92) に融合すると,ジベレリン酸-AMの投与ののち細胞質に発現していたGID1は核へと集積することも確認された.
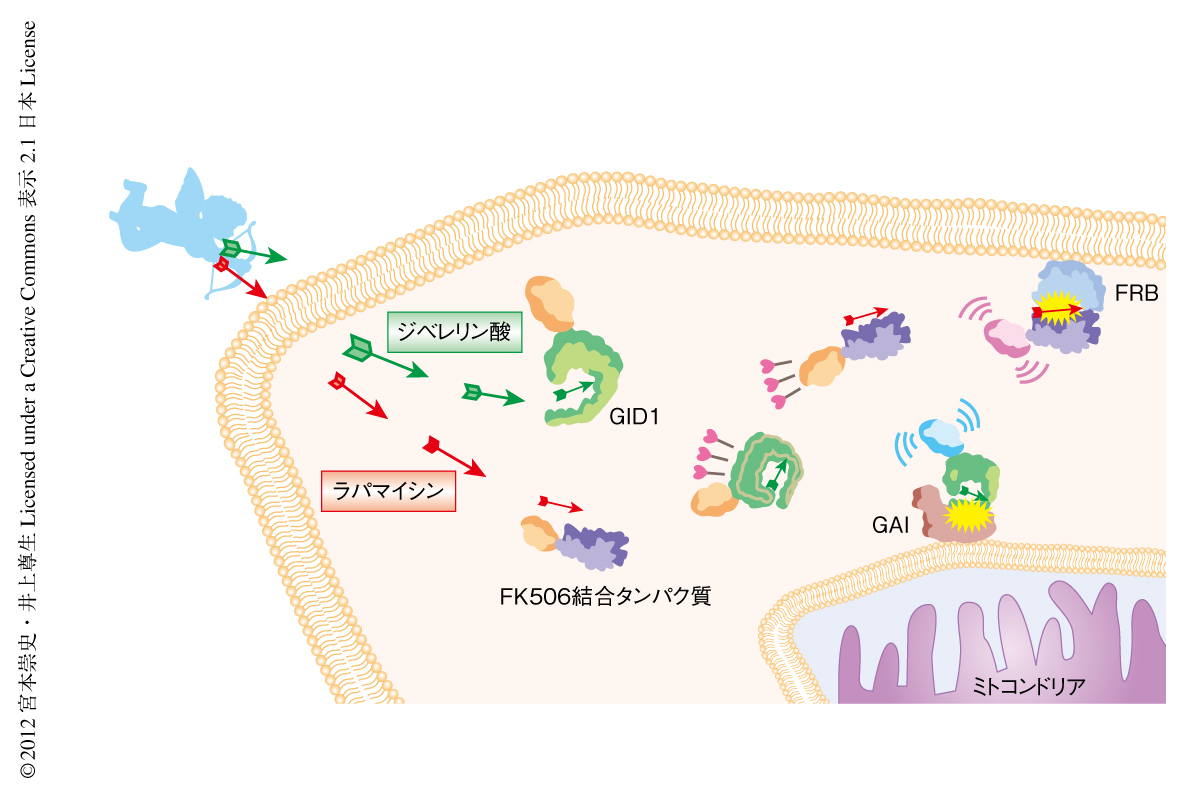
つぎに,ジベレリン酸による化学誘導二量体形成法がラパマイシンによる化学誘導二量体形成法と直交的に機能するかどうかを検討するため,FRBを細胞膜に,GAI(1-92) をミトコンドリアにそれぞれ繋留し,FK506結合タンパク質とGID1を細胞質に発現させた(図2).この細胞にラパマイシンを添加したところ,1分以内にFK506結合タンパク質の細胞膜への明確な移行が確認されたが,GID1は細胞質にとどまったままであった.つづいて,同じ細胞にジベレリン酸-AMを添加したところGID1のミトコンドリアへの迅速な移行が確認されたが,この際,FK506結合タンパク質は細胞膜にとどまったままであった.さらに,別の細胞においてラパマイシンとジベレリン酸-AMとを同時に添加したところ,FK506結合タンパク質は細胞膜へ,GID1はミトコンドリアへと,特異的かつ同じ程度の時間スケールで急速に移行することが確認された.これらの結果は,ジベレリン酸による化学誘導二量体形成法がラパマイシンによる化学誘導二量体形成法と直交的に機能すること示していた.
化学誘導二量体形成法による生化学反応ネットワークの再構築を実現するため,生細胞においてブール代数を用いた論理ゲートの構築を試みた.ブール代数では変数および関数値は“0”か“1”の2値しかとらない.ここでは論理和と論理積に対応した論理ゲートの構築を試みた.論理和では2つの変数のいずれかが“1”であれば関数値は“1”となり,論理積では2つの変数の両方が“1”の場合のみ関数値は“1”となる.
はじめに,生細胞において論理和に対応した論理ゲート(ORゲート)の構築を試みた.この回路ではLyn,FRB,GAI(1-92) からなる融合タンパク質(Lyn-FRB-GAI)を細胞膜に繋留し,Tiam1,FK506結合タンパク質,GID1からなる融合タンパク質(FKBP-Tiam1-GID1)を細胞質に発現させた.アウトプットとしてTiam1によるラッフリングの誘導を利用し,ラッフリングが生じた場合の関数値を“1”,生じなかった場合の関数値を“0”と定義した.また,変数は“ラパマイシンの添加”と“ジベレリン酸-AMの添加”の2種類とし,“添加あり”を“1”,“添加なし”を“0”と定義した.Lyn-FRB-GAIとFKBP-Tiam1-GID1とを細胞において同時に発現させると,ラパマイシンのみを添加した場合 [(Rapa, GA3-AM) = (1, 0)],ジベレリン酸-AMのみを添加した場合 [(Rapa, GA3-AM) = (0, 1)],両方を同時に添加した場合 [(Rapa, GA3-AM) = (1, 1)],のいずれの条件においてもTiam1が細胞膜へと移行しラッフリングが誘導されるため関数値はいずれの場合も“1”となる.逆に,ラパマイシンもジベレリン酸-AMも添加しない場合 [(Rapa, GA3-AM) = (0, 0)] においてラッフリングは誘導されないため関数値は“0”となる.実際に生細胞を用いてこのORゲートを試験したところ,いずれかの変数値を“1”とすればすべてのケースにおいてラッフリングが誘導された.
つぎに,生細胞において論理積に対応した論理ゲート(ANDゲート)の構築を試みた.この回路ではGAI(1-92) とLynとの融合タンパク質(Lyn-GAI(1-92))を細胞膜に繋留し,FK506結合タンパク質とGID1との融合タンパク質(FKBP-GID1),および,FRBとTiam1との融合タンパク質(FRB-Tiam1)を細胞質に発現させた.この回路ではラパマイシンとジベレリン酸-AMとが同時に添加された場合 [(Rapa, GA3-AM)=(1, 1)] のみTiam1は細胞膜へと移行しラッフリングが誘導される.実際に生細胞を用いてこのANDゲートを試験したところ,2つの変数値のいずれもが“1”の場合のみラッフリングが誘導され,これ以外の変数値の入力ではラッフリングは誘導されなかった.
1839年に“細胞説”がとなえられたのち,実に多くの現象がこのわずか数十μmからなる膜の内部で起こっていることが証明されてきた.しかしいまだに細胞をゼロから構築することは困難であり,未解明な現象の多いことが示唆される.合成生物学の分野では,この複雑な生命現象を解明するため人為的に作製した遺伝子やタンパク質などを利用したさまざまな研究手法が開発されている.化学誘導二量体形成法もそのひとつで,とくにシグナルタンパク質の時間的および空間的な変化が必要とされる生化学反応ネットワークの研究分野で有用な手法であることが,筆者らやほかのグループにより示されてきた.
今回,筆者らの開発したジベレリンを用いた化学誘導二量体形成法は,ラパマイシンを用いた化学誘導二量体形成法と直交的かつ同等な速度で機能し,これを応用することで生細胞における人工的な論理ゲートの構築が可能であることが示された.実際に,生化学反応ネットワークにはイノシトールトリスリン酸受容体やアデニル酸シクラーゼ,PI3キナーゼ,N-WASPなど,細胞がもつ天然の論理ゲートが存在しており,直交性をもつ2種類以上の化学誘導二量体形成法を組み合わせることで,今後,さらに詳細な生化学反応ネットワークの研究が可能になるものと考えている.
毎年2月になると愛の神キューピッドにまつわる話を耳にする機会が増える.キューピッドが持つ矢に射られた者はその恋心を自由に操られてしまうと伝えられている.化学誘導二量体形成法では,二量体形成物質をキューピッドの矢として,標的となるタンパク質の恋心を自由に操ることができる(図2).“夕暮れは雲のはたてにものぞ思ふ あまつ空なる人を恋ふとて”という想いの込められた二量体形成物質は標的タンパク質へと届けられ,そののち,標的タンパク質の自身を恋い慕う相手のもとへと訪れるさまは,さながら感動的な映画を鑑賞しているかのようである.
この研究の展開として,さらに多くの論理ゲートをネットワーク化させ,シリコンベースの現在のコンピューターを生細胞を構築する物質で置換することで,特殊な計算処理能力をもつコンピューターを開発することや,疾患に特異的な複数のマイクロRNAやタンパク質の発現の変化がそろった場合のみ,特定の細胞機能が誘導されるような論理ゲートを開発し,新規の治療法の確立をめざすことなどがあげられる.このような生細胞を使った論理ゲートを構築する利点は,実際に生体において論理ゲートの構築の可能性を検討することのできる点にある.当然,安全性および倫理的な問題をクリアしたうえでの話ではあるが,遺伝子操作により自律増殖能と全身における移動能,および,特定の機能を獲得した細胞を移植することで,より複雑な論理ゲートを生体の全身で構築し,疾患の早期発見や再生治療への応用への可能性を模索することもできるかもしれない.
略歴:2008年 神戸大学大学院医学研究科博士課程 修了,同年 国立がん研究センター研究所 リサーチレジデントを経て,2011年より米国Johns Hopkins大学School of Medicineポスドク.
研究テーマ:細胞シグナル伝達系における時間的および空間的な制御機構.
抱負:がん治療法の開発に必要な基礎医学的な情報を提供したい.
井上 尊生(Takanari Inoue)
米国Johns Hopkins大学School of MedicineにてAssistant Professor.
研究室URL:http://www.jhu.edu/inouelab/
© 2012 宮本崇史・井上尊生 Licensed under CC 表示 2.1 日本
(米国Johns Hopkins大学School of Medicine,Department of Cell Biology)
email:宮本崇史,井上尊生
DOI: 10.7875/first.author.2012.039
Rapid and orthogonal logic gating with a gibberellin-induced dimerization system.
Takafumi Miyamoto, Robert DeRose, Allison Suarez, Tasuku Ueno, Melinda Chen, Tai-ping Sun, Michael J. Wolfgang, Chandrani Mukherjee, David J. Meyers, Takanari Inoue
Nature Chemical Biology, 8, 465-470 (2012)
要 約
生体の構成単位である細胞は,光,温度,圧力,pH,栄養物質などの化学物質といった細胞の外部のさまざまな環境構成要素の変化に対応して,細胞分裂,分化,遊走などの細胞機能を選択し実行する.この際,細胞にはりめぐらされた生化学反応ネットワークは複数の入力情報を数秒から数分の単位で統合処理し,それぞれに適応した細胞機能を出力する.こうした複雑な情報処理がμmオーダーのかぎられた空間でいったいどのようにして達成されているのかはいまだ解明されていない.近年の研究から,生化学反応ネットワークにはタンパク質などのシグナル情報伝達物質により構成される多数の論理ゲートが含まれていることが明らかになった.これらの論理ゲートの機能をより深く理解するため,筆者らは,合成生物学の理念にもとづきそれらを生きた細胞において“合成”することを試みている.今回,筆者らは,従来のラパマイシンを用いた化学誘導二量体形成法と直交的に機能する,植物ホルモンであるジベレリンを用いた新たな化学誘導二量体形成法を開発し,2つの異なるタンパク質を時空間的に独立して,さらには,秒のオーダーをもって自在にあやつることを可能にした.また,これら2つの化学誘導二量体形成法を用いることで,生細胞において迅速な処理速度をもつ論理ゲートの構築に成功した.
はじめに
細胞では動的な膜構造体が構築する複雑な空間のなか,かぎられた数のタンパク質が時間的かつ空間的な制御をうけてその機能を発揮することで,実に多彩な細胞機能を生み出している.この細胞機能の選択は,複数の遺伝子制御ネットワークやシグナル伝達系などから構成される生化学反応ネットワークからの入力情報が統合処理された結果であり,その過程ではさまざまな条件にもとづいた情報処理が行われている(図1).合成生物学の分野では,この複雑な生化学反応ネットワークを再現することで多様な生命現象の全体像を把握し,これをさらに改良する試みが行われている.そのひとつとして,生化学反応ネットワークにみられる論理ゲートの試験管内や生細胞における構築が行われているが1-5),これまでに開発された論理ゲートのほとんどは遺伝子の転写や翻訳といった過程を介することから,アウトプットを得るまでに数時間以上の処理時間を要していた.そのため,実際の生化学反応ネットワークでみられる数秒から数分での処理速度をもつ論理ゲートを生細胞において再現することは非常に困難で,いまだに達成されていない.
筆者らが研究を進めている化学誘導二量体形成法(chemically inducible dimerization system)については,1993年に,FK1012を二量体形成物質としたモデルがはじめて提唱された6).そののち,マクロライド系抗生物質であるラパマイシンを二量体形成物質としてFK506結合タンパク質(FK506-binding protein:FKBP)とFK506結合タンパク質とラパマイシンとの複合体に対する結合タンパク質であるFRBを用いた方法をはじめ,さまざまな手法が開発されている7-10).筆者らのグループは,これらの手法をもとに,標的となるタンパク質を細胞における任意の場所に迅速かつ特異的に局在させる手法を新たに開発してきた11-13).
生化学反応ネットワークでみられる多くの論理ゲートは2つ以上の入力情報をもとにしている.この入力情報は複数のタンパク質が時間的かつ空間的に特異的な場所で機能を発現しあうことにより決定される.化学誘導二量体形成法では標的タンパク質を秒のオーダーかつ空間的に任意のタイミングであやつることができるため,理論的には,直交的に機能しうる化学誘導二量体形成法を組み合わせればより本来の処理速度に近い論理ゲートの構築が可能であると考えられる.しかしながら,既存の化学誘導二量体形成法では直交的かつ同等の速度をもって機能する2種類以上の手法は報告されておらず,新たな化学誘導二量体形成法の確立が待たれていた.筆者らは,ラパマイシンを用いた化学誘導二量体形成法と直交的に機能する,植物ホルモンであるジベレリンのひとつジベレリン酸を用いた新規の化学誘導二量体形成法を開発した.また,この化学誘導二量体形成法を従来のラパマイシンを用いた化学誘導二量体形成法とともに用いることで,生細胞における論理ゲートの構築を実現した.
1.ジベレリンを用いた化学誘導二量体形成法の構築
植物ホルモンのひとつであるジベレリンは,植物の生長,発芽,花芽の形成,果実の肥大促進など多くの生理現象にかかわっていることが報告されている14).結晶構造解析から,ジベレリンはジベレリン受容体であるGID1の結合ポケットに入り込んでその構造変化をひき起こすことが報告されている15,16).DELLAタンパク質のひとつであるGAIは,このジベレリンにより構造変化の起こったGID1と結合する.筆者らはまず,シロイヌナズナに由来するGID1およびGAIにそれぞれ蛍光タンパク質であるYFPおよびCFPを融合し,哺乳類培養細胞において発現させ,ジベレリン酸がこれらタンパク質の結合を誘導するかどうかを蛍光共鳴エネルギー移動法(fluorescence resonance energy transfer,FRET法)により検討した.しかし,単純にジベレリン酸を細胞に添加したのみではGAIとGID1との結合を確認することができなかった.これは負に荷電したジベレリン酸のカルボキシル基が細胞膜の透過性を低下させているためであろうと考え,このカルボキシル基にアセトキシメチル基をエステル結合させたアナログを合成した.このジベレリン酸-AMではジベレリン酸の電荷はマスクされ細胞内へと拡散することができる.細胞内へ拡散したジベレリン酸-AMは多種類の細胞に恒常的に存在するエステラーゼによりアセトキシメチル基が加水分解されジベレリン酸として機能する.予想どおり,ジベレリン酸-AMを細胞に投与すると細胞内においてGID1とGAIとの結合が誘導されることが確認された.
つづいて,GAIとGID1のサイズを最小化することで,より効率的なジベレリン酸による化学誘導二量体形成法を開発できるのではないかと考えた.いくつかの候補を検討し,最終的にGID1の全領域とGAIのN末端側の92アミノ酸残基(GAI(1-92))を用いることでジベレリン酸による三者複合体の形成がもっとも効率的に誘導されることを見い出した.
つぎに,実際にジベレリン酸-AMを用いた化学誘導二量体形成法により細胞における特定の領域に標的となるタンパク質を移行させることができるかどうか確認するため,HeLa細胞を用い,チロシンキナーゼであるLynに由来する細胞膜移行シグナルを融合したGAI(1-92) を細胞膜に繋留し,一方で,YFPを融合したGID1を細胞質に発現させて,ジベレリン酸-AMの投与による移行実験を行った.その結果,ジベレリン酸-AMの投与ののち細胞質に局在していたGID1は十数秒以内にGAI(1-92) の局在する細胞膜へと移行しはじめた.細胞質における蛍光強度の定量的な解析から,速度定数は10μMのジベレリン酸-AMを投与した場合でおおよそ0.012 sec-1と見積もられた.ほかの細胞株を用いても同様な結果が確認され,この手法が汎用性にすぐれていることが示唆された.さらに,RhoファミリーGTPaseのひとつであるRac1のグアニンヌクレオチド交換因子Tiam1をGID1に融合させて同様な実験を行った.Tiam1は細胞膜に局在した場合,Rac1の活性化を介して細胞膜の波打ち運動(ラッフリング)を誘導することが知られている.ジベレリン酸-AMの投与のまえにはTiam1は細胞質に局在しておりラッフリングは誘導されなかったが,ジベレリン酸-AMを投与するとTiam1は迅速に細胞膜へと移行し数十秒以内にラッフリングを誘導した.また,細胞膜移行シグナルに代えて核移行シグナルをGAI(1-92) に融合すると,ジベレリン酸-AMの投与ののち細胞質に発現していたGID1は核へと集積することも確認された.
つぎに,ジベレリン酸による化学誘導二量体形成法がラパマイシンによる化学誘導二量体形成法と直交的に機能するかどうかを検討するため,FRBを細胞膜に,GAI(1-92) をミトコンドリアにそれぞれ繋留し,FK506結合タンパク質とGID1を細胞質に発現させた(図2).この細胞にラパマイシンを添加したところ,1分以内にFK506結合タンパク質の細胞膜への明確な移行が確認されたが,GID1は細胞質にとどまったままであった.つづいて,同じ細胞にジベレリン酸-AMを添加したところGID1のミトコンドリアへの迅速な移行が確認されたが,この際,FK506結合タンパク質は細胞膜にとどまったままであった.さらに,別の細胞においてラパマイシンとジベレリン酸-AMとを同時に添加したところ,FK506結合タンパク質は細胞膜へ,GID1はミトコンドリアへと,特異的かつ同じ程度の時間スケールで急速に移行することが確認された.これらの結果は,ジベレリン酸による化学誘導二量体形成法がラパマイシンによる化学誘導二量体形成法と直交的に機能すること示していた.
2.生細胞におけるブール代数による論理ゲートの構築
化学誘導二量体形成法による生化学反応ネットワークの再構築を実現するため,生細胞においてブール代数を用いた論理ゲートの構築を試みた.ブール代数では変数および関数値は“0”か“1”の2値しかとらない.ここでは論理和と論理積に対応した論理ゲートの構築を試みた.論理和では2つの変数のいずれかが“1”であれば関数値は“1”となり,論理積では2つの変数の両方が“1”の場合のみ関数値は“1”となる.
はじめに,生細胞において論理和に対応した論理ゲート(ORゲート)の構築を試みた.この回路ではLyn,FRB,GAI(1-92) からなる融合タンパク質(Lyn-FRB-GAI)を細胞膜に繋留し,Tiam1,FK506結合タンパク質,GID1からなる融合タンパク質(FKBP-Tiam1-GID1)を細胞質に発現させた.アウトプットとしてTiam1によるラッフリングの誘導を利用し,ラッフリングが生じた場合の関数値を“1”,生じなかった場合の関数値を“0”と定義した.また,変数は“ラパマイシンの添加”と“ジベレリン酸-AMの添加”の2種類とし,“添加あり”を“1”,“添加なし”を“0”と定義した.Lyn-FRB-GAIとFKBP-Tiam1-GID1とを細胞において同時に発現させると,ラパマイシンのみを添加した場合 [(Rapa, GA3-AM) = (1, 0)],ジベレリン酸-AMのみを添加した場合 [(Rapa, GA3-AM) = (0, 1)],両方を同時に添加した場合 [(Rapa, GA3-AM) = (1, 1)],のいずれの条件においてもTiam1が細胞膜へと移行しラッフリングが誘導されるため関数値はいずれの場合も“1”となる.逆に,ラパマイシンもジベレリン酸-AMも添加しない場合 [(Rapa, GA3-AM) = (0, 0)] においてラッフリングは誘導されないため関数値は“0”となる.実際に生細胞を用いてこのORゲートを試験したところ,いずれかの変数値を“1”とすればすべてのケースにおいてラッフリングが誘導された.
つぎに,生細胞において論理積に対応した論理ゲート(ANDゲート)の構築を試みた.この回路ではGAI(1-92) とLynとの融合タンパク質(Lyn-GAI(1-92))を細胞膜に繋留し,FK506結合タンパク質とGID1との融合タンパク質(FKBP-GID1),および,FRBとTiam1との融合タンパク質(FRB-Tiam1)を細胞質に発現させた.この回路ではラパマイシンとジベレリン酸-AMとが同時に添加された場合 [(Rapa, GA3-AM)=(1, 1)] のみTiam1は細胞膜へと移行しラッフリングが誘導される.実際に生細胞を用いてこのANDゲートを試験したところ,2つの変数値のいずれもが“1”の場合のみラッフリングが誘導され,これ以外の変数値の入力ではラッフリングは誘導されなかった.
おわりに
1839年に“細胞説”がとなえられたのち,実に多くの現象がこのわずか数十μmからなる膜の内部で起こっていることが証明されてきた.しかしいまだに細胞をゼロから構築することは困難であり,未解明な現象の多いことが示唆される.合成生物学の分野では,この複雑な生命現象を解明するため人為的に作製した遺伝子やタンパク質などを利用したさまざまな研究手法が開発されている.化学誘導二量体形成法もそのひとつで,とくにシグナルタンパク質の時間的および空間的な変化が必要とされる生化学反応ネットワークの研究分野で有用な手法であることが,筆者らやほかのグループにより示されてきた.
今回,筆者らの開発したジベレリンを用いた化学誘導二量体形成法は,ラパマイシンを用いた化学誘導二量体形成法と直交的かつ同等な速度で機能し,これを応用することで生細胞における人工的な論理ゲートの構築が可能であることが示された.実際に,生化学反応ネットワークにはイノシトールトリスリン酸受容体やアデニル酸シクラーゼ,PI3キナーゼ,N-WASPなど,細胞がもつ天然の論理ゲートが存在しており,直交性をもつ2種類以上の化学誘導二量体形成法を組み合わせることで,今後,さらに詳細な生化学反応ネットワークの研究が可能になるものと考えている.
毎年2月になると愛の神キューピッドにまつわる話を耳にする機会が増える.キューピッドが持つ矢に射られた者はその恋心を自由に操られてしまうと伝えられている.化学誘導二量体形成法では,二量体形成物質をキューピッドの矢として,標的となるタンパク質の恋心を自由に操ることができる(図2).“夕暮れは雲のはたてにものぞ思ふ あまつ空なる人を恋ふとて”という想いの込められた二量体形成物質は標的タンパク質へと届けられ,そののち,標的タンパク質の自身を恋い慕う相手のもとへと訪れるさまは,さながら感動的な映画を鑑賞しているかのようである.
この研究の展開として,さらに多くの論理ゲートをネットワーク化させ,シリコンベースの現在のコンピューターを生細胞を構築する物質で置換することで,特殊な計算処理能力をもつコンピューターを開発することや,疾患に特異的な複数のマイクロRNAやタンパク質の発現の変化がそろった場合のみ,特定の細胞機能が誘導されるような論理ゲートを開発し,新規の治療法の確立をめざすことなどがあげられる.このような生細胞を使った論理ゲートを構築する利点は,実際に生体において論理ゲートの構築の可能性を検討することのできる点にある.当然,安全性および倫理的な問題をクリアしたうえでの話ではあるが,遺伝子操作により自律増殖能と全身における移動能,および,特定の機能を獲得した細胞を移植することで,より複雑な論理ゲートを生体の全身で構築し,疾患の早期発見や再生治療への応用への可能性を模索することもできるかもしれない.
文 献
- Li, B. & You, L.: Synthetic biology: division of logic labour. Nature, 469, 171-172 (2011)[PubMed]
- Yoshida, W. & Yokobayashi, Y.: Photonic Boolean logic gates based on DNA aptamers. Chem. Commun., 2, 195-197 (2007)[PubMed]
- Qian, L. & Winfree, E.: Scaling up digital circuit computation with DNA strand displacement cascades. Science, 332, 1196-1201 (2011)[PubMed]
- Katz, E. & Privman, V.: Enzyme-based logic systems for information processing. Chem. Soc. Rev., 39, 1835-1857 (2010)[PubMed]
- Tamsir, A., Tabor, J. J. & Voigt, C. A.: Robust multicellular computing using genetically encoded NOR gates and chemical ‘wires’. Nature, 469, 212-215 (2011)[PubMed]
- Spencer, D. M., Wandless, T. J., Schreiber, S. L. et al.: Controlling signal transduction with synthetic ligands. Science, 262, 1019-1024 (1993)[PubMed]
- Bayle, J. H., Grimley, J. S., Stankunas, K. et al.: Rapamycin analogs with differential binding specificity permit orthogonal control of protein activity. Chem. Biol., 13, 99-107 (2006)[PubMed]
- Czlapinski, J. L. Schelle, M. W., Miller, L. W. et al.: Conditional glycosylation in eukaryotic cells using a biocompatible chemical inducer of dimerization. J. Am. Chem. Soc., 130, 13186-13187 (2008)[PubMed]
- Liang, F. S., Ho, W. Q. & Crabtree, G. R.: Engineering the ABA plant stress pathway for regulation of induced proximity. Sci. Signal., 4, rs2 (2011)[PubMed]
- Liberles, S. D., Diver, S. T., Austin, D.J. et al.: Inducible gene expression and protein translocation using nontoxic ligands identified by a mammalian three-hybrid screen. Proc. Natl. Acad. Sci. USA, 94, 7825-7830 (1997)[PubMed]
- Ueno, T., Falkenburger, B. H., Pohlmeyer, C. et al.: Triggering actin comets versus membrane ruffles: distinctive effects of phosphoinositides on actin reorganization. Sci. Signal., 4, ra87 (2011)[PubMed]
- Umeda, N., Ueno, T., Pohlmeyer, C. et al.: A photocleavable Rapamycin conjugate for spatiotemporal control of small GTPase activity. J. Am. Chem. Soc.,133, 12-14 (2011)[PubMed]
- Komatsu, T., Kukelyansky, I., McCaffery, J. M. et al.: Organelle-specific, rapid induction of molecular activities and membrane tethering. Nat. Methods, 7, 206-208 (2010)[PubMed]
- Richards, D. E., King, K. E., Ait-Ali, T. et al.: How gibberellin regulates plant growth and development: a molecular genetic analysis of gibberellin signaling. Annu. Rev. Plant Physiol. Plant Mol. Biol., 52, 67-88 (2001)[PubMed]
- Murase, K., Hirano, Y., Sun, T. P. et al.: Gibberellin-induced DELLA recognition by the gibberellin receptor GID1. Nature, 456, 459-463 (2008)[PubMed]
- Shimada, A., Ueguchi-Tanaka, M., Nakatsu, T. et al.: Structural basis for gibberellin recognition by its receptor GID1. Nature, 456, 520-523 (2008)[PubMed]
著者プロフィール
略歴:2008年 神戸大学大学院医学研究科博士課程 修了,同年 国立がん研究センター研究所 リサーチレジデントを経て,2011年より米国Johns Hopkins大学School of Medicineポスドク.
研究テーマ:細胞シグナル伝達系における時間的および空間的な制御機構.
抱負:がん治療法の開発に必要な基礎医学的な情報を提供したい.
井上 尊生(Takanari Inoue)
米国Johns Hopkins大学School of MedicineにてAssistant Professor.
研究室URL:http://www.jhu.edu/inouelab/
© 2012 宮本崇史・井上尊生 Licensed under CC 表示 2.1 日本