6-硫酸化コンドロイチンの過剰な発現により大脳皮質の可塑性が維持される
宮田真路・北川裕之
(神戸薬科大学 生化学研究室)
email:北川裕之
DOI: 10.7875/first.author.2012.020
Persistent cortical plasticity by upregulation of chondroitin 6-sulfation.
Shinji Miyata, Yukio Komatsu, Yumiko Yoshimura, Choji Taya, Hiroshi Kitagawa
Nature Neuroscience, 15, 414-422 (2012)
可塑性は臨界期とよばれる生後初期の一定期間にのみ強くみられるが,成体になると可塑性の低下する機構はよくわかっていない.筆者らは,脳の主要な細胞外マトリックスの成分であるコンドロイチン硫酸プロテオグリカンのもつコンドロイチン硫酸鎖における6-硫酸化に対する4-硫酸化の比率が生後に増加することで臨界期の終了がもたらされることを見い出した.6-硫酸化コンドロイチンを過剰に発現することで4-硫酸化コンドロイチンの比率を低く保ったトランスジェニックマウスは,パルブアルブミン陽性抑制性ニューロンの周囲に形成されるペリニューロナルネットに異常がみられた.パルブアルブミン陽性抑制性ニューロン自体が生合成する4-硫酸化コンドロイチンの増加は,その成熟を促進させるホメオタンパク質Otx2の蓄積に必要であることがわかった.さらに,6-硫酸化コンドロイチンを過剰に発現するトランスジェニックマウスのパルブアルブミン陽性抑制性ニューロンは電気生理学的な性質において未熟であることを示した.以上のことから,コンドロイチン硫酸鎖の硫酸化パターンによりパルブアルブミン陽性抑制性ニューロンの成熟が制御され,その結果,臨界期の時期が制御されていることが明らかになった.
一般に,子どもの脳は大人の脳に比べ柔軟だといわれる.言語の習得が好例で,幼少期での外国語の学習は大人に比べ容易である.可塑性とは外界の刺激や経験により神経回路が構造的および機能的に再編成される性質をさすが,この可塑性は臨界期とよばれる生後初期の一定期間にのみ高くそののちには低下する.大脳皮質の視覚野における眼優位性の可塑性はこのような臨界期における可塑性の代表例として研究が進んでいる1).視覚野の両眼性の領域に存在するニューロンは両方の眼から視覚入力を受け取っている.しかし,短期間のあいだ片眼を遮蔽するとニューロンは遮蔽されたほうの眼への応答性を低下させ開いているほうの眼への応答性を上昇させる.この可塑性はマウスでは生後19~32日の期間にのみ顕著にみられるが成体では低下する2).多くの研究から,興奮性と抑制性の神経回路のバランスにより眼優位性の可塑性の臨界期の時期が制御されていることが示されている.最近ではとくに,抑制性ニューロンの一種であるパルブアルブミン陽性ニューロンの成熟が眼優位性の可塑性の制御に重要であると考えられている1).
コンドロイチン硫酸プロテオグリカンはコアタンパク質にグリコサミノグリカンのひとつであるコンドロイチン硫酸鎖が1本以上共有結合した糖タンパク質で,中枢神経系の主要な細胞外マトリックスの成分である.大脳皮質の発生にともないコンドロイチン硫酸プロテオグリカンはパルブアルブミン陽性抑制性ニューロンの周囲に濃縮し,ペリニューロナルネットとよばれるシナプスをとりかこむ特殊な細胞外マトリックスを形成する.興味深いことに,臨界期の終了した成体の脳にコンドロイチナーゼを注入しコンドロイチン硫酸鎖を分解すると眼優位性の可塑性が回復する3).コンドロイチン硫酸鎖は損傷した神経軸索の再生をさまたげることも知られており,これまで,コンドロイチン硫酸鎖は可塑性を非特異的に阻害する物理的な障壁であるものと認識されていた4).しかし,コンドロイチン硫酸鎖は可塑性の高い臨界期の脳にも豊富に存在しており,すべてのコンドロイチン硫酸鎖が可塑性を阻害しているとは考えにくい.
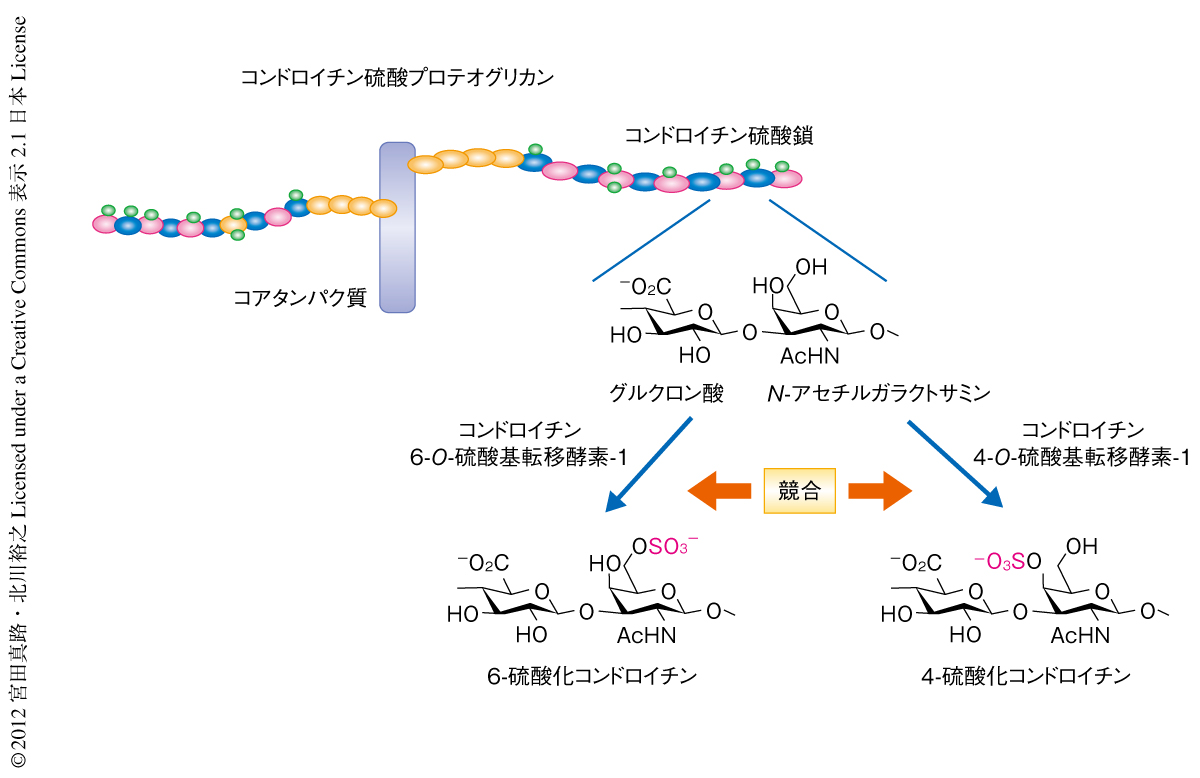
最近の研究から,コンドロイチン硫酸プロテオグリカンの機能はコンドロイチン硫酸鎖の特異的な硫酸化修飾により特徴づけられる“硫酸化コード”に書き込まれていると提唱されている.コンドロイチン硫酸鎖はグルクロン酸とN-アセチルガラクトサミンの二糖が数十回も交互にくり返し重合した直鎖状の糖鎖を基本骨格にもつ.生合成の過程で,N-アセチルガラクトサミン残基の大部分はコンドロイチン6-O-硫酸基転移酵素-1もしくはコンドロイチン4-O-硫酸基転移酵素-1により硫酸化され6-硫酸化コンドロイチンもしくは4-硫酸化コンドロイチンとなる(図1).筆者らの研究室では,以前に,特定の硫酸化パターンをもつコンドロイチン硫酸鎖がニューロンの表面にあるコンタクチン-1受容体との特異的な相互作用を介して神経突起の伸長を促進することを明らかにしている5).これまで,おもにin vitroでの研究からコンドロイチン硫酸鎖の硫酸化パターンの重要性が示されてきたが,生体における機能はよくわかっていない.コンドロイチナーゼを用いたこれまでの実験では硫酸化パターンにかかわらずすべてのコンドロイチン硫酸鎖を分解しているので,特定の硫酸化パターンの機能はみすごされてきた可能性もある.筆者らは,脳の発生にともないコンドロイチン硫酸鎖の硫酸化パターンが変動することに着目し6),コンドロイチン硫酸鎖の硫酸化パターンにより臨界期の可塑性が制御されているのではないかと考えた.そこで,この仮説を検証するため,コンドロイチン6-O-硫酸基転移酵素-1を過剰に発現するトランスジェニックマウスを作製した.
まず,マウスの脳の発生にともないコンドロイチン硫酸鎖の硫酸化パターンがどのように変化するのかを解析した.野生型マウスでは6-硫酸化コンドロイチンは発生の初期に多く存在し発生の進行にともない減少した.一方,4-硫酸化コンドロイチンは発生の進行にともない増加し,成体ではコンドロイチン硫酸鎖の全体の90%以上が4-硫酸化コンドロイチンであった.その結果,6-硫酸化コンドロイチンに対する4-硫酸化コンドロイチンの比率は臨界期をはさんで顕著に増加することがわかった.コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスの脳では野生型マウスと比べ6-硫酸化コンドロイチンが増加し4-硫酸化コンドロイチンが減少していた.その結果,野生型マウスと比べ6-硫酸化コンドロイチンに対する4-硫酸化コンドロイチンの割合が顕著に低下しており成体でも未熟な硫酸化パターンを維持していた.コンドロイチン硫酸鎖の硫酸化パターンの変動に対しコンドロイチン硫酸鎖の総量は発生の進行にともない一定に保たれており,野生型マウスとコンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスとで差はなかった.
そこで,コンドロイチン硫酸鎖の硫酸化パターンが眼優位性の可塑性に影響するのかどうか検討した.視覚野の両眼視領域において視覚刺激により誘発される電位を記録すると,同側眼からの視覚入力に比べ対側眼からの視覚入力に2倍ほど強く応答する.生後24~26日の臨界期のあいだに対側眼を3~6日間にわたり遮蔽すると対側眼と同側眼との視覚誘発電位の比率は約1にまで低下する.この低下は2つの時間的に異なった機構によりもたらされていた.まず,遮蔽ののち3日までに遮蔽された対側眼への応答が減弱し,遮蔽ののち6日までに遮蔽されていない同側眼への応答が増強した.臨界期における眼優位性の可塑性は野生型マウスとコンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスとで同様にみられた.
つぎに,臨界期の終了した成体(生後60~90日)における単眼の遮蔽の影響を調べた.野生型マウスでは可塑性が低下しており3日間の単眼の遮蔽により対側眼と同側眼との視覚誘発電位の比率は変化しなかったが,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスは有意な低下を示した.成体の野生型マウスでも6日間にわたり単眼を遮蔽すると対側眼と同側眼との視覚誘発電位の比率がわずかに低下したが,この反応は遮蔽されていない同側眼への応答の増強によりもたらされていた.つまり,遮蔽された眼への応答性の低下は臨界期に限定しており成体ではみられなかった.一方,成体のコンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスでは6日間の単眼の遮蔽により同側眼への応答が増強したことにくわえ,遮蔽された対側眼への応答の減弱もみられた.よって,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスは通常の臨界期が終了した成体においても臨界期と同様の眼優位性の可塑性を維持していることが明らかになった.
つぎに,コンドロイチン硫酸鎖の硫酸化パターンがパルブアルブミン陽性抑制性ニューロンの周囲に形成されるペリニューロナルネットにあたえる影響を検討した.ペリニューロナルネットは古典的なマーカーであるWFAレクチンにより染色され,成体の野生型マウスの視覚野では約90%のパルブアルブミン陽性抑制性ニューロンがWFAレクチン陽性を示すペリニューロナルネットによりおおわれていた.一方,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスではWFAレクチン陽性を示すペリニューロナルネットの数は有意に減少していたが,パルブアルブミン陽性抑制性ニューロンの数自体は野生型マウスと同じ程度であった.さらに,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスではパルブアルブミン陽性抑制性ニューロンの周囲にペリニューロナルネットが形成されないわけではなく,WFAレクチン陽性のペリニューロナルネットとは異なるペリニューロナルネットが形成されていることがわかった.つまり,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスの一部のパルブアルブミン陽性抑制性ニューロンの周囲には6-硫酸化コンドロイチンを認識するCS56抗体により染色されるペリニューロナルネットが形成されており,このCS56抗体陽性を示すペリニューロナルネットはWFAレクチン陽性を示すペリニューロナルネットとは共局在しなかった.以上の結果から,コンドロイチン6-O-硫酸基転移酵素-1を過剰に発現させることによりパルブアルブミン陽性抑制性ニューロンの周囲のWFAレクチン陽性のペリニューロナルネットの形成は低下し,6-硫酸化コンドロイチンに富むCS56抗体陽性のペリニューロナルネットが形成されることがわかった.
それでは,パルブアルブミン陽性抑制性ニューロンの周囲のペリニューロナルネットの硫酸化パターンが変化することで,なぜ,臨界期の可塑性が影響をうけるのであろうか? パルブアルブミン陽性抑制性ニューロンの成熟には網膜と外側膝状体で合成されたホメオタンパク質Otx2が軸索内を輸送されて視覚野まで到達し,パルブアルブミン陽性抑制性ニューロンに選択的に蓄積されることが必要である7).しかし,外側膝状体から視覚野に投射する軸索の末端のうち,パルブアルブミン陽性抑制性ニューロンを含めた抑制性ニューロンとシナプスを形成するのはわずか20%であり,どのようにしてOtx2がパルブアルブミン陽性抑制性ニューロンに選択的に蓄積するかは不明であった.そこで,ペリニューロナルネットの硫酸化パターンがOtx2の取り込みに関与しているのではないかと考えた.これまでの報告どおり,Otx2遺伝子をコードするmRNAは網膜と外側膝状体に発現しており,その発現量は野生型マウスとコンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスとで違いはなかったが,視覚野における発現は遺伝子型にかかわらず検出限界以下であった.特異的な抗体を用いて視覚野におけるOtx2タンパク質の局在を解析したところ,野生型マウスでは多くのパルブアルブミン陽性抑制性ニューロンにOtx2の蓄積がみられたが,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスではOtx2に陽性の細胞数が顕著に減少していた.さらに,野生型マウスではOtx2の蓄積がみられたパルブアルブミン陽性抑制性ニューロンのほとんどはWFAレクチン陽性のペリニューロナルネットによりおおわれていたが,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスでみられたCS56抗体陽性のペリニューロナルネットにおおわれたパルブアルブミン陽性抑制性ニューロンにはOtx2は蓄積していないことがわかった.詳細な形態解析の結果,WFAレクチン陽性のペリニューロナルネットは網目状の構造をもつのに対し,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスに存在するCS56抗体陽性のペリニューロナルネットはしっかりとした網目構造を形成できないことが示された.野生型マウスでは外側膝状体から視覚野のパルブアルブミン陽性抑制性ニューロンに投射するシナプスはWFAレクチン陽性のペリニューロナルネットの形成する網目構造により強固におおわれているのに対し,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスではこれらのシナプスは網目構造におおわれてはいなかった.この結果から,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスでは6-硫酸化コンドロイチンに富むCS56抗体陽性のペリニューロナルネットが形成されるが,このペリニューロナルネットはパルブアルブミン陽性抑制性ニューロンの周囲のシナプスを強固におおいかこむことはできず,軸索の末端から分泌されたOtx2は拡散してしまいパルブアルブミン陽性抑制性ニューロンへの蓄積は低下してしまうものと考えられた(図2).
コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスはβアクチン遺伝子プロモーターの下流においてコンドロイチン6-O-硫酸基転移酵素-1遺伝子を発現しているので,すべての細胞においてコンドロイチン6-O-硫酸基転移酵素-1が過剰に発現している.そのため,どの細胞が生合成するコンドロイチン硫酸鎖によりペリニューロナルネットの構造が変化しているのかは不明であった.そこで,パルブアルブミン陽性抑制性ニューロンにおいて選択的にコンドロイチン硫酸鎖の硫酸化パターンを改変することを試みた.大脳皮質の興奮性細胞は大脳皮質の脳室帯で誕生し放射状に移動するのに対し,パルブアルブミン陽性抑制性ニューロンを含めた抑制性ニューロンは大脳の基底核原基で誕生し接線の方向に長い距離を移動して大脳皮質に進入する8).そこで,子宮内エレクトロポレーション法を用いて9),胎生12日目の野生型マウスの大脳の基底核原基にコンドロイチン6-O-硫酸基転移酵素-1遺伝子の発現プラスミドを導入した.そののち,生後30日において視覚野の免疫染色を行ったところ,予想どおり,一部のパルブアルブミン陽性抑制性ニューロンに選択的にコンドロイチン6-O-硫酸基転移酵素-1遺伝子が導入されていることがわかった.さらに,コンドロイチン6-O-硫酸基転移酵素-1遺伝子が導入されたパルブアルブミン陽性抑制性ニューロンの周囲にのみCS56抗体陽性のペリニューロナルネットが形成されており,コンドロイチン6-O-硫酸基転移酵素-1遺伝子の導入されていないパルブアルブミン陽性抑制性ニューロンの周囲にはCS56抗体陽性のペリニューロナルネットは形成されなかった.また,コンドロイチン6-O-硫酸基転移酵素-1遺伝子が導入されCS56抗体陽性のペリニューロナルネットでおおわれたパルブアルブミン陽性抑制性ニューロンにはOtx2は蓄積していなかった.以上の結果から,パルブアルブミン陽性抑制性ニューロン自体が生合成するコンドロイチン硫酸鎖の硫酸化パターンによりペリニューロナルネットの構造とOtx2の取り込みとが制御されていることがわかった.
最後に,コンドロイチン硫酸鎖の硫酸化パターンがパルブアルブミン陽性抑制性ニューロンの電気生理学的な性質にどのような影響をあたえているのか解析した.パルブアルブミン陽性抑制性ニューロンは電気生理学的な性質からfast-spiking細胞ともよばれ,電流の注入によりスパイク幅の短い活動電位を高頻度で発生させる.この特徴的な性質はパルブアルブミン陽性抑制性ニューロンの生後の成熟にともない獲得される.コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスのパルブアルブミン陽性抑制性ニューロンでは発火の頻度は正常だがスパイク幅が野生型マウスに比べ有意に長かった.また,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスではパルブアルブミン陽性抑制性ニューロンの静止膜の電位も野生型マウスに比べ脱分極側に変化しており,これらの電気生理学的な特性は未熟なパルブアルブミン陽性抑制性ニューロンの性質と類似していた.そこで,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスでは実際に抑制性の神経回路の効果が低下しているのかどうか視覚野ニューロンにおける視覚応答性を比較することで検討した.通常,視覚野ニューロンは視覚刺激の提示ののちすみやかに発火を停止するが,抑制性の神経回路の効果が弱いと視覚刺激の提示ののちも発火が持続することが知られている.コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスは野生型マウスに比べ視覚刺激の提示ののちの発火が持続していた.以上の結果から,6-硫酸化コンドロイチンの過剰な発現によりパルブアルブミン陽性抑制性ニューロンは電気生理学的な性質について成熟できず,抑制性の神経回路の効果が低下していることがわかった.
これまでの研究から,臨界期の終了をもたらす分子ブレーキには機能的なブレーキと構造的なブレーキの2種類が存在することが知られている10).機能的なブレーキは興奮性と抑制性の神経回路のバランスを制御することで可塑性を制御する.一方,コンドロイチン硫酸鎖のような構造的なブレーキは軸索の伸長に対する物理的な障壁となることで非特異的に可塑性を阻害するものと考えられてきた.しかし,今回の筆者らの研究により,コンドロイチン硫酸鎖は単なる物理的な障壁ではなく,コンドロイチン硫酸鎖の硫酸化パターンに依存的にパルブアルブミン陽性抑制性ニューロンの機能を制御することで臨界期の時期を制御していることが明らかになった.脊椎の損傷ののちコンドロイチナーゼを注入することで軸索は再生し機能的に回復することから,コンドロイチン硫酸鎖は軸索の再生に対しても物理的な障壁となるものと認識されている.筆者らの研究は,損傷した神経の再生においてもコンドロイチン硫酸鎖の硫酸化パターンが重要である可能性を示しており,臨界期の可塑性と神経の再生とに共通の機構が存在するかもしれない.また,パルブアルブミン陽性抑制性ニューロンの成熟は臨界期の可塑性だけでなく統合失調症など精神疾患にも大きく関与することが知られている.最近では,統合失調症の患者の脳ではペリニューロナルネットの形成が減少していることも報告された.今後,コンドロイチン硫酸鎖の機能を制御することがこれら疾患に対する創薬開発の手がかりとなることが期待される.
略歴:2006年 名古屋大学大学院生命農学研究科博士課程 修了,同年 米国California大学San Diego校 ポストドクトラルフェローを経て,2007年より神戸薬科大学 特別契約研究員,2008年より神戸大学医学部 グローバルCOEプログラム研究員を兼務.
研究テーマ:コンドロイチン硫酸鎖の硫酸化コードによる神経機能の制御.
抱負:第三の生命鎖である糖鎖による生命現象の制御の基本原理の解明.
北川 裕之(Hiroshi Kitagawa)
神戸薬科大学 教授.
研究室URL:http://www.kobepharma-u.ac.jp/~biochem/
© 2012 宮田真路・北川裕之 Licensed under CC 表示 2.1 日本
(神戸薬科大学 生化学研究室)
email:北川裕之
DOI: 10.7875/first.author.2012.020
Persistent cortical plasticity by upregulation of chondroitin 6-sulfation.
Shinji Miyata, Yukio Komatsu, Yumiko Yoshimura, Choji Taya, Hiroshi Kitagawa
Nature Neuroscience, 15, 414-422 (2012)
要 約
可塑性は臨界期とよばれる生後初期の一定期間にのみ強くみられるが,成体になると可塑性の低下する機構はよくわかっていない.筆者らは,脳の主要な細胞外マトリックスの成分であるコンドロイチン硫酸プロテオグリカンのもつコンドロイチン硫酸鎖における6-硫酸化に対する4-硫酸化の比率が生後に増加することで臨界期の終了がもたらされることを見い出した.6-硫酸化コンドロイチンを過剰に発現することで4-硫酸化コンドロイチンの比率を低く保ったトランスジェニックマウスは,パルブアルブミン陽性抑制性ニューロンの周囲に形成されるペリニューロナルネットに異常がみられた.パルブアルブミン陽性抑制性ニューロン自体が生合成する4-硫酸化コンドロイチンの増加は,その成熟を促進させるホメオタンパク質Otx2の蓄積に必要であることがわかった.さらに,6-硫酸化コンドロイチンを過剰に発現するトランスジェニックマウスのパルブアルブミン陽性抑制性ニューロンは電気生理学的な性質において未熟であることを示した.以上のことから,コンドロイチン硫酸鎖の硫酸化パターンによりパルブアルブミン陽性抑制性ニューロンの成熟が制御され,その結果,臨界期の時期が制御されていることが明らかになった.
はじめに
一般に,子どもの脳は大人の脳に比べ柔軟だといわれる.言語の習得が好例で,幼少期での外国語の学習は大人に比べ容易である.可塑性とは外界の刺激や経験により神経回路が構造的および機能的に再編成される性質をさすが,この可塑性は臨界期とよばれる生後初期の一定期間にのみ高くそののちには低下する.大脳皮質の視覚野における眼優位性の可塑性はこのような臨界期における可塑性の代表例として研究が進んでいる1).視覚野の両眼性の領域に存在するニューロンは両方の眼から視覚入力を受け取っている.しかし,短期間のあいだ片眼を遮蔽するとニューロンは遮蔽されたほうの眼への応答性を低下させ開いているほうの眼への応答性を上昇させる.この可塑性はマウスでは生後19~32日の期間にのみ顕著にみられるが成体では低下する2).多くの研究から,興奮性と抑制性の神経回路のバランスにより眼優位性の可塑性の臨界期の時期が制御されていることが示されている.最近ではとくに,抑制性ニューロンの一種であるパルブアルブミン陽性ニューロンの成熟が眼優位性の可塑性の制御に重要であると考えられている1).
コンドロイチン硫酸プロテオグリカンはコアタンパク質にグリコサミノグリカンのひとつであるコンドロイチン硫酸鎖が1本以上共有結合した糖タンパク質で,中枢神経系の主要な細胞外マトリックスの成分である.大脳皮質の発生にともないコンドロイチン硫酸プロテオグリカンはパルブアルブミン陽性抑制性ニューロンの周囲に濃縮し,ペリニューロナルネットとよばれるシナプスをとりかこむ特殊な細胞外マトリックスを形成する.興味深いことに,臨界期の終了した成体の脳にコンドロイチナーゼを注入しコンドロイチン硫酸鎖を分解すると眼優位性の可塑性が回復する3).コンドロイチン硫酸鎖は損傷した神経軸索の再生をさまたげることも知られており,これまで,コンドロイチン硫酸鎖は可塑性を非特異的に阻害する物理的な障壁であるものと認識されていた4).しかし,コンドロイチン硫酸鎖は可塑性の高い臨界期の脳にも豊富に存在しており,すべてのコンドロイチン硫酸鎖が可塑性を阻害しているとは考えにくい.
最近の研究から,コンドロイチン硫酸プロテオグリカンの機能はコンドロイチン硫酸鎖の特異的な硫酸化修飾により特徴づけられる“硫酸化コード”に書き込まれていると提唱されている.コンドロイチン硫酸鎖はグルクロン酸とN-アセチルガラクトサミンの二糖が数十回も交互にくり返し重合した直鎖状の糖鎖を基本骨格にもつ.生合成の過程で,N-アセチルガラクトサミン残基の大部分はコンドロイチン6-O-硫酸基転移酵素-1もしくはコンドロイチン4-O-硫酸基転移酵素-1により硫酸化され6-硫酸化コンドロイチンもしくは4-硫酸化コンドロイチンとなる(図1).筆者らの研究室では,以前に,特定の硫酸化パターンをもつコンドロイチン硫酸鎖がニューロンの表面にあるコンタクチン-1受容体との特異的な相互作用を介して神経突起の伸長を促進することを明らかにしている5).これまで,おもにin vitroでの研究からコンドロイチン硫酸鎖の硫酸化パターンの重要性が示されてきたが,生体における機能はよくわかっていない.コンドロイチナーゼを用いたこれまでの実験では硫酸化パターンにかかわらずすべてのコンドロイチン硫酸鎖を分解しているので,特定の硫酸化パターンの機能はみすごされてきた可能性もある.筆者らは,脳の発生にともないコンドロイチン硫酸鎖の硫酸化パターンが変動することに着目し6),コンドロイチン硫酸鎖の硫酸化パターンにより臨界期の可塑性が制御されているのではないかと考えた.そこで,この仮説を検証するため,コンドロイチン6-O-硫酸基転移酵素-1を過剰に発現するトランスジェニックマウスを作製した.
1.マウスの脳の発生にともなうコンドロイチン硫酸鎖の硫酸化パターンの変動
まず,マウスの脳の発生にともないコンドロイチン硫酸鎖の硫酸化パターンがどのように変化するのかを解析した.野生型マウスでは6-硫酸化コンドロイチンは発生の初期に多く存在し発生の進行にともない減少した.一方,4-硫酸化コンドロイチンは発生の進行にともない増加し,成体ではコンドロイチン硫酸鎖の全体の90%以上が4-硫酸化コンドロイチンであった.その結果,6-硫酸化コンドロイチンに対する4-硫酸化コンドロイチンの比率は臨界期をはさんで顕著に増加することがわかった.コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスの脳では野生型マウスと比べ6-硫酸化コンドロイチンが増加し4-硫酸化コンドロイチンが減少していた.その結果,野生型マウスと比べ6-硫酸化コンドロイチンに対する4-硫酸化コンドロイチンの割合が顕著に低下しており成体でも未熟な硫酸化パターンを維持していた.コンドロイチン硫酸鎖の硫酸化パターンの変動に対しコンドロイチン硫酸鎖の総量は発生の進行にともない一定に保たれており,野生型マウスとコンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスとで差はなかった.
2.コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスは成体でも眼優位の可塑性が維持される
そこで,コンドロイチン硫酸鎖の硫酸化パターンが眼優位性の可塑性に影響するのかどうか検討した.視覚野の両眼視領域において視覚刺激により誘発される電位を記録すると,同側眼からの視覚入力に比べ対側眼からの視覚入力に2倍ほど強く応答する.生後24~26日の臨界期のあいだに対側眼を3~6日間にわたり遮蔽すると対側眼と同側眼との視覚誘発電位の比率は約1にまで低下する.この低下は2つの時間的に異なった機構によりもたらされていた.まず,遮蔽ののち3日までに遮蔽された対側眼への応答が減弱し,遮蔽ののち6日までに遮蔽されていない同側眼への応答が増強した.臨界期における眼優位性の可塑性は野生型マウスとコンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスとで同様にみられた.
つぎに,臨界期の終了した成体(生後60~90日)における単眼の遮蔽の影響を調べた.野生型マウスでは可塑性が低下しており3日間の単眼の遮蔽により対側眼と同側眼との視覚誘発電位の比率は変化しなかったが,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスは有意な低下を示した.成体の野生型マウスでも6日間にわたり単眼を遮蔽すると対側眼と同側眼との視覚誘発電位の比率がわずかに低下したが,この反応は遮蔽されていない同側眼への応答の増強によりもたらされていた.つまり,遮蔽された眼への応答性の低下は臨界期に限定しており成体ではみられなかった.一方,成体のコンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスでは6日間の単眼の遮蔽により同側眼への応答が増強したことにくわえ,遮蔽された対側眼への応答の減弱もみられた.よって,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスは通常の臨界期が終了した成体においても臨界期と同様の眼優位性の可塑性を維持していることが明らかになった.
3.コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスにおけるペリニューロナルネットの形成
つぎに,コンドロイチン硫酸鎖の硫酸化パターンがパルブアルブミン陽性抑制性ニューロンの周囲に形成されるペリニューロナルネットにあたえる影響を検討した.ペリニューロナルネットは古典的なマーカーであるWFAレクチンにより染色され,成体の野生型マウスの視覚野では約90%のパルブアルブミン陽性抑制性ニューロンがWFAレクチン陽性を示すペリニューロナルネットによりおおわれていた.一方,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスではWFAレクチン陽性を示すペリニューロナルネットの数は有意に減少していたが,パルブアルブミン陽性抑制性ニューロンの数自体は野生型マウスと同じ程度であった.さらに,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスではパルブアルブミン陽性抑制性ニューロンの周囲にペリニューロナルネットが形成されないわけではなく,WFAレクチン陽性のペリニューロナルネットとは異なるペリニューロナルネットが形成されていることがわかった.つまり,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスの一部のパルブアルブミン陽性抑制性ニューロンの周囲には6-硫酸化コンドロイチンを認識するCS56抗体により染色されるペリニューロナルネットが形成されており,このCS56抗体陽性を示すペリニューロナルネットはWFAレクチン陽性を示すペリニューロナルネットとは共局在しなかった.以上の結果から,コンドロイチン6-O-硫酸基転移酵素-1を過剰に発現させることによりパルブアルブミン陽性抑制性ニューロンの周囲のWFAレクチン陽性のペリニューロナルネットの形成は低下し,6-硫酸化コンドロイチンに富むCS56抗体陽性のペリニューロナルネットが形成されることがわかった.
4.ペリニューロナルネットの硫酸化パターンによりホメオタンパク質Otx2の蓄積が制御されている
それでは,パルブアルブミン陽性抑制性ニューロンの周囲のペリニューロナルネットの硫酸化パターンが変化することで,なぜ,臨界期の可塑性が影響をうけるのであろうか? パルブアルブミン陽性抑制性ニューロンの成熟には網膜と外側膝状体で合成されたホメオタンパク質Otx2が軸索内を輸送されて視覚野まで到達し,パルブアルブミン陽性抑制性ニューロンに選択的に蓄積されることが必要である7).しかし,外側膝状体から視覚野に投射する軸索の末端のうち,パルブアルブミン陽性抑制性ニューロンを含めた抑制性ニューロンとシナプスを形成するのはわずか20%であり,どのようにしてOtx2がパルブアルブミン陽性抑制性ニューロンに選択的に蓄積するかは不明であった.そこで,ペリニューロナルネットの硫酸化パターンがOtx2の取り込みに関与しているのではないかと考えた.これまでの報告どおり,Otx2遺伝子をコードするmRNAは網膜と外側膝状体に発現しており,その発現量は野生型マウスとコンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスとで違いはなかったが,視覚野における発現は遺伝子型にかかわらず検出限界以下であった.特異的な抗体を用いて視覚野におけるOtx2タンパク質の局在を解析したところ,野生型マウスでは多くのパルブアルブミン陽性抑制性ニューロンにOtx2の蓄積がみられたが,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスではOtx2に陽性の細胞数が顕著に減少していた.さらに,野生型マウスではOtx2の蓄積がみられたパルブアルブミン陽性抑制性ニューロンのほとんどはWFAレクチン陽性のペリニューロナルネットによりおおわれていたが,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスでみられたCS56抗体陽性のペリニューロナルネットにおおわれたパルブアルブミン陽性抑制性ニューロンにはOtx2は蓄積していないことがわかった.詳細な形態解析の結果,WFAレクチン陽性のペリニューロナルネットは網目状の構造をもつのに対し,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスに存在するCS56抗体陽性のペリニューロナルネットはしっかりとした網目構造を形成できないことが示された.野生型マウスでは外側膝状体から視覚野のパルブアルブミン陽性抑制性ニューロンに投射するシナプスはWFAレクチン陽性のペリニューロナルネットの形成する網目構造により強固におおわれているのに対し,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスではこれらのシナプスは網目構造におおわれてはいなかった.この結果から,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスでは6-硫酸化コンドロイチンに富むCS56抗体陽性のペリニューロナルネットが形成されるが,このペリニューロナルネットはパルブアルブミン陽性抑制性ニューロンの周囲のシナプスを強固におおいかこむことはできず,軸索の末端から分泌されたOtx2は拡散してしまいパルブアルブミン陽性抑制性ニューロンへの蓄積は低下してしまうものと考えられた(図2).
5.パルブアルブミン陽性抑制性ニューロン自体が生合成する6-硫酸化コンドロイチンによりペリニューロナルネットの構造は変化する
コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスはβアクチン遺伝子プロモーターの下流においてコンドロイチン6-O-硫酸基転移酵素-1遺伝子を発現しているので,すべての細胞においてコンドロイチン6-O-硫酸基転移酵素-1が過剰に発現している.そのため,どの細胞が生合成するコンドロイチン硫酸鎖によりペリニューロナルネットの構造が変化しているのかは不明であった.そこで,パルブアルブミン陽性抑制性ニューロンにおいて選択的にコンドロイチン硫酸鎖の硫酸化パターンを改変することを試みた.大脳皮質の興奮性細胞は大脳皮質の脳室帯で誕生し放射状に移動するのに対し,パルブアルブミン陽性抑制性ニューロンを含めた抑制性ニューロンは大脳の基底核原基で誕生し接線の方向に長い距離を移動して大脳皮質に進入する8).そこで,子宮内エレクトロポレーション法を用いて9),胎生12日目の野生型マウスの大脳の基底核原基にコンドロイチン6-O-硫酸基転移酵素-1遺伝子の発現プラスミドを導入した.そののち,生後30日において視覚野の免疫染色を行ったところ,予想どおり,一部のパルブアルブミン陽性抑制性ニューロンに選択的にコンドロイチン6-O-硫酸基転移酵素-1遺伝子が導入されていることがわかった.さらに,コンドロイチン6-O-硫酸基転移酵素-1遺伝子が導入されたパルブアルブミン陽性抑制性ニューロンの周囲にのみCS56抗体陽性のペリニューロナルネットが形成されており,コンドロイチン6-O-硫酸基転移酵素-1遺伝子の導入されていないパルブアルブミン陽性抑制性ニューロンの周囲にはCS56抗体陽性のペリニューロナルネットは形成されなかった.また,コンドロイチン6-O-硫酸基転移酵素-1遺伝子が導入されCS56抗体陽性のペリニューロナルネットでおおわれたパルブアルブミン陽性抑制性ニューロンにはOtx2は蓄積していなかった.以上の結果から,パルブアルブミン陽性抑制性ニューロン自体が生合成するコンドロイチン硫酸鎖の硫酸化パターンによりペリニューロナルネットの構造とOtx2の取り込みとが制御されていることがわかった.
6.コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスにおけるパルブアルブミン陽性抑制性ニューロンの電気生理学的な性質
最後に,コンドロイチン硫酸鎖の硫酸化パターンがパルブアルブミン陽性抑制性ニューロンの電気生理学的な性質にどのような影響をあたえているのか解析した.パルブアルブミン陽性抑制性ニューロンは電気生理学的な性質からfast-spiking細胞ともよばれ,電流の注入によりスパイク幅の短い活動電位を高頻度で発生させる.この特徴的な性質はパルブアルブミン陽性抑制性ニューロンの生後の成熟にともない獲得される.コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスのパルブアルブミン陽性抑制性ニューロンでは発火の頻度は正常だがスパイク幅が野生型マウスに比べ有意に長かった.また,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスではパルブアルブミン陽性抑制性ニューロンの静止膜の電位も野生型マウスに比べ脱分極側に変化しており,これらの電気生理学的な特性は未熟なパルブアルブミン陽性抑制性ニューロンの性質と類似していた.そこで,コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスでは実際に抑制性の神経回路の効果が低下しているのかどうか視覚野ニューロンにおける視覚応答性を比較することで検討した.通常,視覚野ニューロンは視覚刺激の提示ののちすみやかに発火を停止するが,抑制性の神経回路の効果が弱いと視覚刺激の提示ののちも発火が持続することが知られている.コンドロイチン6-O-硫酸基転移酵素-1トランスジェニックマウスは野生型マウスに比べ視覚刺激の提示ののちの発火が持続していた.以上の結果から,6-硫酸化コンドロイチンの過剰な発現によりパルブアルブミン陽性抑制性ニューロンは電気生理学的な性質について成熟できず,抑制性の神経回路の効果が低下していることがわかった.
おわりに
これまでの研究から,臨界期の終了をもたらす分子ブレーキには機能的なブレーキと構造的なブレーキの2種類が存在することが知られている10).機能的なブレーキは興奮性と抑制性の神経回路のバランスを制御することで可塑性を制御する.一方,コンドロイチン硫酸鎖のような構造的なブレーキは軸索の伸長に対する物理的な障壁となることで非特異的に可塑性を阻害するものと考えられてきた.しかし,今回の筆者らの研究により,コンドロイチン硫酸鎖は単なる物理的な障壁ではなく,コンドロイチン硫酸鎖の硫酸化パターンに依存的にパルブアルブミン陽性抑制性ニューロンの機能を制御することで臨界期の時期を制御していることが明らかになった.脊椎の損傷ののちコンドロイチナーゼを注入することで軸索は再生し機能的に回復することから,コンドロイチン硫酸鎖は軸索の再生に対しても物理的な障壁となるものと認識されている.筆者らの研究は,損傷した神経の再生においてもコンドロイチン硫酸鎖の硫酸化パターンが重要である可能性を示しており,臨界期の可塑性と神経の再生とに共通の機構が存在するかもしれない.また,パルブアルブミン陽性抑制性ニューロンの成熟は臨界期の可塑性だけでなく統合失調症など精神疾患にも大きく関与することが知られている.最近では,統合失調症の患者の脳ではペリニューロナルネットの形成が減少していることも報告された.今後,コンドロイチン硫酸鎖の機能を制御することがこれら疾患に対する創薬開発の手がかりとなることが期待される.
文 献
- Hensch, T. K.: Critical period plasticity in local cortical circuits. Nat. Rev. Neurosci., 6, 877-888 (2005)[PubMed]
- Gordon, J. A. & Stryker, M. P.: Experience-dependent plasticity of binocular responses in the primary visual cortex of the mouse. J. Neurosci., 16, 3274-3286 (1996)[PubMed]
- Pizzorusso, T., Medini, P., Berardi, N. et al.: Reactivation of ocular dominance plasticity in the adult visual cortex. Science, 298, 1248-1251 (2002)[PubMed]
- Bradbury, E. J., Moon, L. D., Popat, R. J. et al.: Chondroitinase ABC promotes functional recovery after spinal cord injury. Nature, 416, 636-640 (2002)[PubMed]
- Mikami, T., Yasunaga, D. & Kitagawa, H.: Contactin-1 is a functional receptor for neuroregulatory chondroitin sulfate-E. J. Biol. Chem., 284, 4494-4499 (2009)[PubMed]
- Kitagawa, H., Tsutsumi, K., Tone, Y. et al.: Developmental regulation of the sulfation profile of chondroitin sulfate chains in the chicken embryo brain. J. Biol. Chem., 272, 31377-31381 (1997)[PubMed]
- Sugiyama, S., Di Nardo, A. A., Aizawa, S. et al.: Experience-dependent transfer of Otx2 homeoprotein into the visual cortex activates postnatal plasticity. Cell, 134, 508-520 (2008)[PubMed]
- Marin, O. & Rubenstein, J. L.: A long, remarkable journey: tangential migration in the telencephalon. Nat. Rev. Neurosci., 2, 780-790 (2001)[PubMed]
- Tanaka, D. H., Yanagida, M., Zhu, Y. et al.: Random walk behavior of migrating cortical interneurons in the marginal zone: time-lapse analysis in flat-mount cortex. J. Neurosci., 29, 1300-1311 (2009)[PubMed]
- Bavelier, D., Levi, D. M., Li, R. W. et al.: Removing brakes on adult brain plasticity: from molecular to behavioral interventions. J. Neurosci., 30, 14964-14971 (2010)[PubMed]
著者プロフィール
略歴:2006年 名古屋大学大学院生命農学研究科博士課程 修了,同年 米国California大学San Diego校 ポストドクトラルフェローを経て,2007年より神戸薬科大学 特別契約研究員,2008年より神戸大学医学部 グローバルCOEプログラム研究員を兼務.
研究テーマ:コンドロイチン硫酸鎖の硫酸化コードによる神経機能の制御.
抱負:第三の生命鎖である糖鎖による生命現象の制御の基本原理の解明.
北川 裕之(Hiroshi Kitagawa)
神戸薬科大学 教授.
研究室URL:http://www.kobepharma-u.ac.jp/~biochem/
© 2012 宮田真路・北川裕之 Licensed under CC 表示 2.1 日本