シナプス後膜におけるホスファチジルイノシトール-4-リン酸-5-キナーゼによる長期抑圧の誘導の制御
柚崎通介1・金保安則2
(1慶應義塾大学医学部 生理学教室,2筑波大学大学院人間総合科学研究科 生命システム医学専攻生理化学教室)
email:柚崎通介,金保安則
DOI: 10.7875/first.author.2012.015
NMDA receptor-mediated PIP5K activation to produce PI(4,5)P2 is essential for AMPA receptor endocytosis during LTD.
Takamitsu Unoki, Shinji Matsuda, Wataru Kakegawa, Ngo Thai Bich Van, Kazuhisa Kohda, Atsushi Suzuki, Yuji Funakoshi, Hiroshi Hasegawa, Michisuke Yuzaki, Yasunori Kanaho
Neuron, 73, 135-148 (2012)
脳の記憶および学習の機能はニューロンのあいだのシナプス伝達効率の動的な変化,すなわち,シナプス可塑性によりささえられている.シナプス伝達効率を持続的に低下させるシナプス可塑性として長期抑圧があるが,それをもたらす分子機構には不明な点が多く残されている.長期抑圧を発現する分子機構のひとつとしてシナプス後膜におけるクラスリン依存性エンドサイトーシスによるAMPA受容体の除去がよく知られているが,神経活動の変化がどのようにしてこの機構を制御しているのかは不明であった.この研究では,NMDA受容体の活性化がホスファチジルイノシトール-4-リン酸-5-キナーゼのアイソザイムのひとつPIP5Kγ661の酵素活性を上昇させること,これにより産生されるホスファチジルイノシトール4,5-ビスリン酸がAMPA受容体のクラスリン依存性エンドサイトーシスを亢進することが,海馬のニューロンにおける長期抑圧の発揮に必須であることを明らかにした.
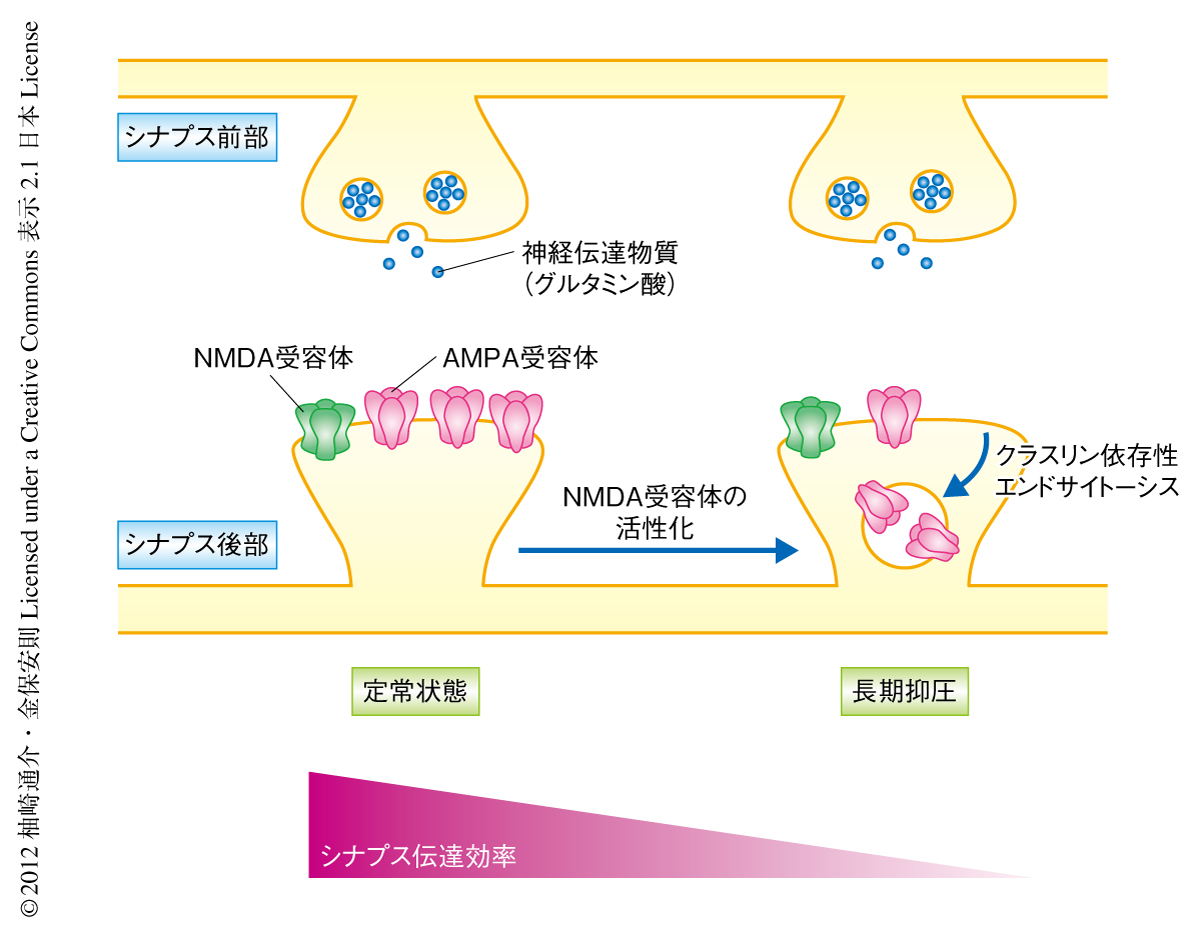
中枢神経系のニューロンにおいてシナプス伝達強度は動的に変化し可塑性を発揮する.脳の記憶および学習の基盤となる機構はシナプス可塑性により実現されていると考えられているため,その発現機構の解明は非常に興味深い課題である.シナプス伝達効率を持続的に低下させるシナプス可塑性としては長期抑圧(long-term depression:LTD)があり,その発現機構の一翼は,速い興奮性のシナプス伝達を担うグルタミン酸受容体であるAMPA受容体がクラスリン依存性エンドサイトーシスをうけシナプス後膜から除去されることによる1-3)(図1).この引き金となるのはほかのグルタミン酸受容体であるNMDA受容体の活性化とそれにつづく細胞へのCa2+の流入であるが,NMDA受容体の活性化がいかにしてAMPA受容体のクラスリン依存性エンドサイトーシスを誘導するのか,その機序は不明であった.
クラスリン依存性エンドサイトーシスには多くの分子が関与する.その初期の過程において細胞膜の微量構成リン脂質であるホスファチジルイノシトール4,5-ビスリン酸(PI(4,5)P2)がアダプタータンパク質であるAP-2などを細胞膜に集積させることがクラスリン被覆小胞の形成に重要だと考えられている.また,哺乳動物においてホスファチジルイノシトール4,5-ビスリン酸を産生する主要な代謝酵素はホスファチジルイノシトール-4-リン酸-5-キナーゼ(PIP5K)であり,とりわけ,脳においてはそのアイソザイムのひとつであるPIP5Kγ661がホスファチジルイノシトール4,5-ビスリン酸の産生に必須であることが知られている4,5).このことから,NMDA受容体の活性化による長期抑圧の誘導に際しこのPIP5Kγ661がなんらかの積極的な酵素活性の制御をうけてホスファチジルイノシトール4,5-ビスリン酸を産生し,AMPA受容体のエンドサイトーシスを制御しうるのではないかと想定された.
長期抑圧の誘導の際にはNMDA受容体の活性化にともなう細胞へのCa2+の流入によりセリン/スレオニンホスファターゼであるカルシニューリンおよびプロテインホスファターゼ1が活性化され,AMPA受容体のサブユニットであるGluA1やエンドサイトーシスの後期の過程に関与するダイナミンなどさまざまなタンパク質を脱リン酸化することが知られている6).海馬に由来する培養ニューロンをNMDA受容体に特異的なアゴニストであるNMDAにより刺激したのち,PIP5Kγ661のリン酸化の状態を解析したところ,定常状態においてはそのほとんどがリン酸化型であったPIP5Kγ661の顕著な脱リン酸化が観察された.さらに,種々の阻害剤を用いた解析から,この脱リン酸化もまたNMDA受容体からのCa2+の流入をうけカルシニューリンおよびプロテインホスファターゼ1を介して行われていることが明らかとなり,PIP5Kγ661がNMDA受容体の活性化に依存して脱リン酸化をうける新規の基質であることが明らかになった.
以前に筆者らは,ホスファチジルイノシトール-4-リン酸-5-キナーゼのアイソザイムのうちPIP5Kγ661に特異的に存在するSer645の脱リン酸化により,PIP5Kγ661とAP-2のサブユニットであるβ2 adaptinのearドメインとの直接の結合がひき起こされることを見い出している7).そこで,海馬に由来する培養ニューロンをNMDAにより刺激したのち,その細胞抽出液を標品として抗PIP5Kγ抗体を用いた免疫沈降実験を行ったところ,内在性のPIP5Kγ661とβ2 adaptinとの結合が見い出された.さらに,BiFC(bimolecular fluorescent complementation)法を用いて,この結合がニューロンのいかなる部位で生じたのかを空間的に解析した8).具体的には,蛍光タンパク質VenusをN末端領域とC末端領域とに二分し,それぞれのサブフラグメントをβ2 adaptinのearドメインおよびPIP5Kγ661に融合させたタンパク質を用いた.これにより,PIP5Kγ661とβ2 adaptinのearドメインとの結合がひき起こされた場合のみVenusの立体構造が再構築され二者の結合を蛍光シグナルとして可視化できる.この融合タンパク質を海馬のニューロンに発現させてNMDAにより刺激したところ,刺激の2~3分のちにVenusの点状の蛍光シグナルがMAP-2陽性として観察される樹状突起にそって急速に出現した.さらに,この蛍光シグナルはシナプス後部に集積するPSD-95およびFアクチンと共局在した.このことより,NMDA受容体の活性化により脱リン酸化されたPIP5Kγ661はシナプス後部においてAP-2と結合することが示され,これはAMPA受容体がエンドサイトーシスをうける場と一致することが明らかになった.
NMDA受容体の活性化に依存してひき起こされるシナプス後部でのPIP5Kγ661とAP-2との結合はどのような生理的な意義をもつのだろうか? 以前に筆者らは,PIP5Kγ661のSer645の脱リン酸化に依存してもたらされるPIP5Kγ661とAP-2との結合がPIP5Kγ661の酵素活性を上昇させること,この過程がシナプス前部におけるクラスリン依存性エンドサイトーシスによるシナプス小胞の再回収に必須であることを報告している7).そこで,Ser645をAlaに置換することでこの残基の脱リン酸化状態を疑似したPIP5Kγ661のC末端領域の断片を海馬のニューロンに過剰発現させ内在性のPIP5Kγ661とAP-2との結合阻害を行ったところ,NMDAの刺激によるAMPA受容体のエンドサイトーシスは顕著に阻害された.また,マウス海馬の急速切片においてCA1領域の錐体細胞にこのSer645の脱リン酸化状態を疑似したPIP5Kγ661のC末端領域の断片を導入して電気生理学的な解析を試みたところ,PIP5Kγ661とAP-2との結合阻害は定常状態におけるシナプス伝達には顕著な影響を及ぼさなかったが,Schaffer側枝を低頻度で刺激することでNMDA受容体に依存的に誘導されるCA1領域の錐体細胞における長期抑圧は顕著に阻害された.このことから,NMDA受容体の活性化に依存したPIP5Kγ661とAP-2との結合はAMPA受容体のエンドサイトーシスおよび長期抑圧の発揮に必須であることが明らかになった.
さきに述べたとおり,PIP5Kγ661とAP-2との結合はPIP5Kγ661の酵素活性を顕著に上昇させる.したがって,AP-2との結合により活性化されたPIP5Kγ661がシナプス後部の局所におけるホスファチジルイノシトール4,5-ビスリン酸の量の上昇をもたらし,これがAMPA受容体のエンドサイトーシスを誘導する引き金となることが想定された.そこで,PIP5Kγ661の酵素活性がAMPA受容体のエンドサイトーシスに必要であるかどうかを検討するため,海馬に由来する培養ニューロンに酵素活性を欠失したPIP5Kγ661変異体を過剰発現させNMDAにより刺激したところ,AMPA受容体のエンドサイトーシスは顕著に阻害された.同様に,shRNAの発現によりPIP5Kγ661をノックダウンした際にもNMDA依存性のAMPA受容体のエンドサイトーシスは阻害された.また,CA1領域の錐体細胞に組換え型シンドビスウイルスを感染させることにより酵素活性を欠失したPIP5Kγ661変異体を過剰発現させた海馬の急速切片を用いて電気生理学的な解析を行ったところ,CA1領域の錐体細胞における長期抑圧の誘導は顕著に阻害された.このことより,PIP5Kγ661の活性化によるホスファチジルイノシトール4,5-ビスリン酸の産生がNMDA受容体に依存性のAMPA受容体のエンドサイトーシスならびに長期抑圧の誘導に必須であることが示された.
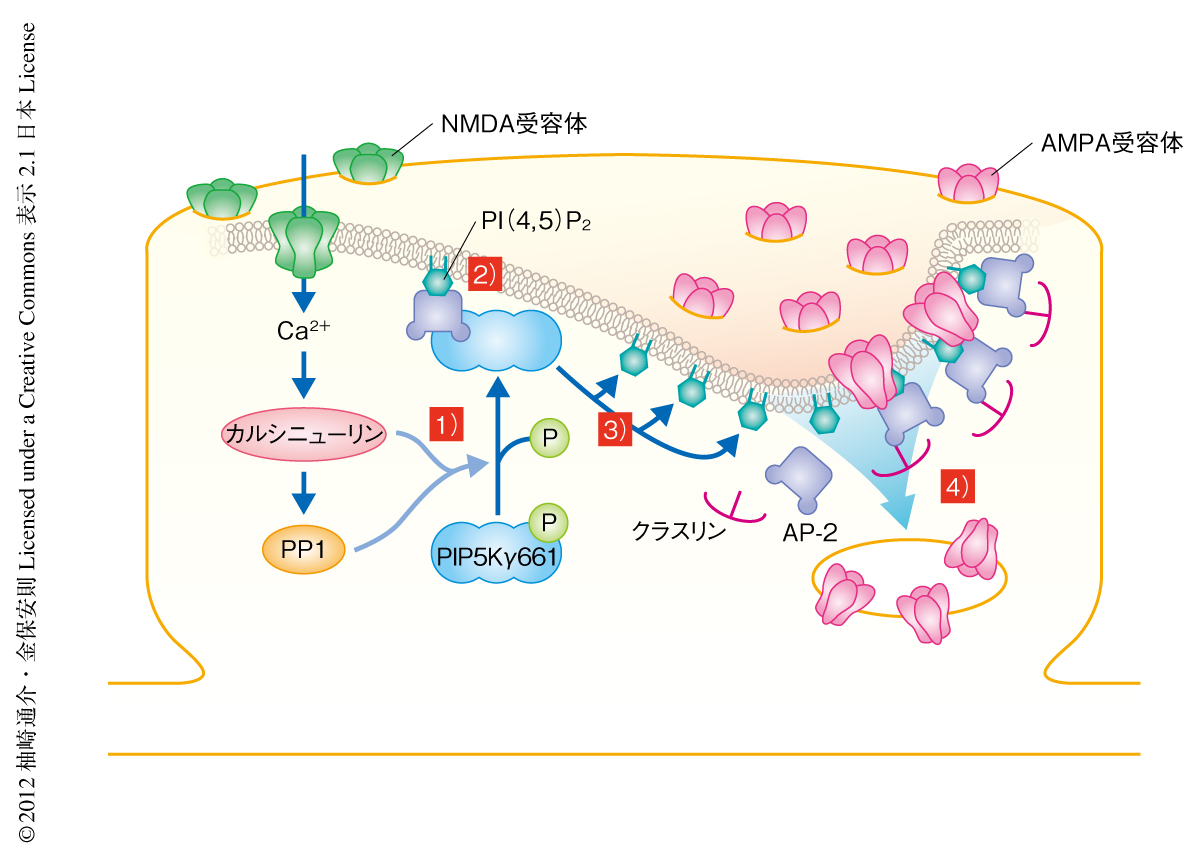
以上の知見を考え合わせ,NMDA受容体に依存性のAMPA受容体のエンドサイトーシスをもたらす新規の分子機構を提唱した(図2).すなわち,1)NMDA受容体を介したCa2+の流入により活性化されたカルシニューリンおよびプロテインホスファターゼ1がPIP5Kγ661を脱リン酸化する.2)脱リン酸化されたPIP5Kγ661はシナプス後部においてAP-2と結合する.3)AP-2との結合によりPIP5Kγ661は活性化され細胞膜において局所的なホスファチジルイノシトール4,5-ビスリン酸の産生をもたらす.4)産生されたホスファチジルイノシトール4,5-ビスリン酸はAP-2などを集積させクラスリン依存性エンドサイトーシスによるAMPA受容体の細胞内への取り込みを亢進させる.その結果,シナプス後膜のAMPA受容体の数が減少し,シナプス伝達効率が低下するため長期抑圧がもたらされる.これは,神経活動の変化がAMPA受容体の局在を変化させるために,その取り込み機構自体を積極的に制御するという新たなモデルである.
慶應義塾大学医学部 教授.
金保 安則(Yasunori Kanaho)
筑波大学大学院人間総合科学研究科 教授.
© 2012 柚崎通介・金保安則 Licensed under CC 表示 2.1 日本
(1慶應義塾大学医学部 生理学教室,2筑波大学大学院人間総合科学研究科 生命システム医学専攻生理化学教室)
email:柚崎通介,金保安則
DOI: 10.7875/first.author.2012.015
NMDA receptor-mediated PIP5K activation to produce PI(4,5)P2 is essential for AMPA receptor endocytosis during LTD.
Takamitsu Unoki, Shinji Matsuda, Wataru Kakegawa, Ngo Thai Bich Van, Kazuhisa Kohda, Atsushi Suzuki, Yuji Funakoshi, Hiroshi Hasegawa, Michisuke Yuzaki, Yasunori Kanaho
Neuron, 73, 135-148 (2012)
要 約
脳の記憶および学習の機能はニューロンのあいだのシナプス伝達効率の動的な変化,すなわち,シナプス可塑性によりささえられている.シナプス伝達効率を持続的に低下させるシナプス可塑性として長期抑圧があるが,それをもたらす分子機構には不明な点が多く残されている.長期抑圧を発現する分子機構のひとつとしてシナプス後膜におけるクラスリン依存性エンドサイトーシスによるAMPA受容体の除去がよく知られているが,神経活動の変化がどのようにしてこの機構を制御しているのかは不明であった.この研究では,NMDA受容体の活性化がホスファチジルイノシトール-4-リン酸-5-キナーゼのアイソザイムのひとつPIP5Kγ661の酵素活性を上昇させること,これにより産生されるホスファチジルイノシトール4,5-ビスリン酸がAMPA受容体のクラスリン依存性エンドサイトーシスを亢進することが,海馬のニューロンにおける長期抑圧の発揮に必須であることを明らかにした.
はじめに
中枢神経系のニューロンにおいてシナプス伝達強度は動的に変化し可塑性を発揮する.脳の記憶および学習の基盤となる機構はシナプス可塑性により実現されていると考えられているため,その発現機構の解明は非常に興味深い課題である.シナプス伝達効率を持続的に低下させるシナプス可塑性としては長期抑圧(long-term depression:LTD)があり,その発現機構の一翼は,速い興奮性のシナプス伝達を担うグルタミン酸受容体であるAMPA受容体がクラスリン依存性エンドサイトーシスをうけシナプス後膜から除去されることによる1-3)(図1).この引き金となるのはほかのグルタミン酸受容体であるNMDA受容体の活性化とそれにつづく細胞へのCa2+の流入であるが,NMDA受容体の活性化がいかにしてAMPA受容体のクラスリン依存性エンドサイトーシスを誘導するのか,その機序は不明であった.
クラスリン依存性エンドサイトーシスには多くの分子が関与する.その初期の過程において細胞膜の微量構成リン脂質であるホスファチジルイノシトール4,5-ビスリン酸(PI(4,5)P2)がアダプタータンパク質であるAP-2などを細胞膜に集積させることがクラスリン被覆小胞の形成に重要だと考えられている.また,哺乳動物においてホスファチジルイノシトール4,5-ビスリン酸を産生する主要な代謝酵素はホスファチジルイノシトール-4-リン酸-5-キナーゼ(PIP5K)であり,とりわけ,脳においてはそのアイソザイムのひとつであるPIP5Kγ661がホスファチジルイノシトール4,5-ビスリン酸の産生に必須であることが知られている4,5).このことから,NMDA受容体の活性化による長期抑圧の誘導に際しこのPIP5Kγ661がなんらかの積極的な酵素活性の制御をうけてホスファチジルイノシトール4,5-ビスリン酸を産生し,AMPA受容体のエンドサイトーシスを制御しうるのではないかと想定された.
1.NMDA受容体の活性化はPIP5Kγ661の脱リン酸化をもたらす
長期抑圧の誘導の際にはNMDA受容体の活性化にともなう細胞へのCa2+の流入によりセリン/スレオニンホスファターゼであるカルシニューリンおよびプロテインホスファターゼ1が活性化され,AMPA受容体のサブユニットであるGluA1やエンドサイトーシスの後期の過程に関与するダイナミンなどさまざまなタンパク質を脱リン酸化することが知られている6).海馬に由来する培養ニューロンをNMDA受容体に特異的なアゴニストであるNMDAにより刺激したのち,PIP5Kγ661のリン酸化の状態を解析したところ,定常状態においてはそのほとんどがリン酸化型であったPIP5Kγ661の顕著な脱リン酸化が観察された.さらに,種々の阻害剤を用いた解析から,この脱リン酸化もまたNMDA受容体からのCa2+の流入をうけカルシニューリンおよびプロテインホスファターゼ1を介して行われていることが明らかとなり,PIP5Kγ661がNMDA受容体の活性化に依存して脱リン酸化をうける新規の基質であることが明らかになった.
2.NMDA受容体の活性化はシナプス後膜におけるPIP5Kγ661とAP-2との結合をひき起こす
以前に筆者らは,ホスファチジルイノシトール-4-リン酸-5-キナーゼのアイソザイムのうちPIP5Kγ661に特異的に存在するSer645の脱リン酸化により,PIP5Kγ661とAP-2のサブユニットであるβ2 adaptinのearドメインとの直接の結合がひき起こされることを見い出している7).そこで,海馬に由来する培養ニューロンをNMDAにより刺激したのち,その細胞抽出液を標品として抗PIP5Kγ抗体を用いた免疫沈降実験を行ったところ,内在性のPIP5Kγ661とβ2 adaptinとの結合が見い出された.さらに,BiFC(bimolecular fluorescent complementation)法を用いて,この結合がニューロンのいかなる部位で生じたのかを空間的に解析した8).具体的には,蛍光タンパク質VenusをN末端領域とC末端領域とに二分し,それぞれのサブフラグメントをβ2 adaptinのearドメインおよびPIP5Kγ661に融合させたタンパク質を用いた.これにより,PIP5Kγ661とβ2 adaptinのearドメインとの結合がひき起こされた場合のみVenusの立体構造が再構築され二者の結合を蛍光シグナルとして可視化できる.この融合タンパク質を海馬のニューロンに発現させてNMDAにより刺激したところ,刺激の2~3分のちにVenusの点状の蛍光シグナルがMAP-2陽性として観察される樹状突起にそって急速に出現した.さらに,この蛍光シグナルはシナプス後部に集積するPSD-95およびFアクチンと共局在した.このことより,NMDA受容体の活性化により脱リン酸化されたPIP5Kγ661はシナプス後部においてAP-2と結合することが示され,これはAMPA受容体がエンドサイトーシスをうける場と一致することが明らかになった.
3.PIP5Kγ661とAP-2との結合はNMDA受容体に依存した長期抑圧の発揮に必須である
NMDA受容体の活性化に依存してひき起こされるシナプス後部でのPIP5Kγ661とAP-2との結合はどのような生理的な意義をもつのだろうか? 以前に筆者らは,PIP5Kγ661のSer645の脱リン酸化に依存してもたらされるPIP5Kγ661とAP-2との結合がPIP5Kγ661の酵素活性を上昇させること,この過程がシナプス前部におけるクラスリン依存性エンドサイトーシスによるシナプス小胞の再回収に必須であることを報告している7).そこで,Ser645をAlaに置換することでこの残基の脱リン酸化状態を疑似したPIP5Kγ661のC末端領域の断片を海馬のニューロンに過剰発現させ内在性のPIP5Kγ661とAP-2との結合阻害を行ったところ,NMDAの刺激によるAMPA受容体のエンドサイトーシスは顕著に阻害された.また,マウス海馬の急速切片においてCA1領域の錐体細胞にこのSer645の脱リン酸化状態を疑似したPIP5Kγ661のC末端領域の断片を導入して電気生理学的な解析を試みたところ,PIP5Kγ661とAP-2との結合阻害は定常状態におけるシナプス伝達には顕著な影響を及ぼさなかったが,Schaffer側枝を低頻度で刺激することでNMDA受容体に依存的に誘導されるCA1領域の錐体細胞における長期抑圧は顕著に阻害された.このことから,NMDA受容体の活性化に依存したPIP5Kγ661とAP-2との結合はAMPA受容体のエンドサイトーシスおよび長期抑圧の発揮に必須であることが明らかになった.
4.PIP5Kγ661の活性化によるホスファチジルイノシトール4,5-ビスリン酸の産生はNMDA受容体に依存した長期抑圧の誘導に必須である
さきに述べたとおり,PIP5Kγ661とAP-2との結合はPIP5Kγ661の酵素活性を顕著に上昇させる.したがって,AP-2との結合により活性化されたPIP5Kγ661がシナプス後部の局所におけるホスファチジルイノシトール4,5-ビスリン酸の量の上昇をもたらし,これがAMPA受容体のエンドサイトーシスを誘導する引き金となることが想定された.そこで,PIP5Kγ661の酵素活性がAMPA受容体のエンドサイトーシスに必要であるかどうかを検討するため,海馬に由来する培養ニューロンに酵素活性を欠失したPIP5Kγ661変異体を過剰発現させNMDAにより刺激したところ,AMPA受容体のエンドサイトーシスは顕著に阻害された.同様に,shRNAの発現によりPIP5Kγ661をノックダウンした際にもNMDA依存性のAMPA受容体のエンドサイトーシスは阻害された.また,CA1領域の錐体細胞に組換え型シンドビスウイルスを感染させることにより酵素活性を欠失したPIP5Kγ661変異体を過剰発現させた海馬の急速切片を用いて電気生理学的な解析を行ったところ,CA1領域の錐体細胞における長期抑圧の誘導は顕著に阻害された.このことより,PIP5Kγ661の活性化によるホスファチジルイノシトール4,5-ビスリン酸の産生がNMDA受容体に依存性のAMPA受容体のエンドサイトーシスならびに長期抑圧の誘導に必須であることが示された.
おわりに
以上の知見を考え合わせ,NMDA受容体に依存性のAMPA受容体のエンドサイトーシスをもたらす新規の分子機構を提唱した(図2).すなわち,1)NMDA受容体を介したCa2+の流入により活性化されたカルシニューリンおよびプロテインホスファターゼ1がPIP5Kγ661を脱リン酸化する.2)脱リン酸化されたPIP5Kγ661はシナプス後部においてAP-2と結合する.3)AP-2との結合によりPIP5Kγ661は活性化され細胞膜において局所的なホスファチジルイノシトール4,5-ビスリン酸の産生をもたらす.4)産生されたホスファチジルイノシトール4,5-ビスリン酸はAP-2などを集積させクラスリン依存性エンドサイトーシスによるAMPA受容体の細胞内への取り込みを亢進させる.その結果,シナプス後膜のAMPA受容体の数が減少し,シナプス伝達効率が低下するため長期抑圧がもたらされる.これは,神経活動の変化がAMPA受容体の局在を変化させるために,その取り込み機構自体を積極的に制御するという新たなモデルである.
文 献
- Bredt, D. S. & Nicoll, R. A.: AMPA receptor trafficking at excitatory synapses. Neuron, 40, 361-379 (2003)[PubMed]
- Lee, S. H., Liu, L., Wang, Y. T. et al.: Clathrin adaptor AP2 and NSF interact with overlapping sites of GluR2 and play distinct roles in AMPA receptor trafficking and hippocampal LTD. Neuron, 36, 661-674 (2002)[PubMed]
- Man, H. Y., Lin, J. W., Ju, W. H. et al.: Regulation of AMPA receptor-mediated synaptic transmission by clathrin-dependent receptor internalization. Neuron, 25, 649-662 (2000)[PubMed]
- Loijens, J. C. & Anderson, R. A.: Type I phosphatidylinositol-4-phosphate 5-kinases are distinct members of this novel lipid kinase family. J. Biol. Chem., 271, 32937-32943 (1996)[PubMed]
- Di Paolo, G., Moskowitz, H. S., Gipson, K. et al.: Impaired PtdIns(4,5)P2 synthesis in nerve terminals produces defects in synaptic vesicle trafficking. Nature, 431, 415-422 (2004)[PubMed]
- Mulkey, R. M., Endo, S., Shenolikar, S. et al.: Involvement of a calcineurin/inhibitor-1 phosphatase cascade in hippocampal long-term depression. Nature, 369, 486-488 (1994)[PubMed]
- Nakano-Kobayashi, A., Yamazaki, M., Unoki, T. et al.: Role of activation of PIP5Kγ661 by AP-2 complex in synaptic vesicle endocytosis. EMBO J., 26, 1105-1116 (2007)[PubMed]
- Kerppola, T. K.: Design and implementation of bimolecular fluorescence complementation (BiFC) assays for the visualization of protein interactions in living cells. Nat. Protoc., 1, 1278-1286 (2006)[PubMed]
著者プロフィール
慶應義塾大学医学部 教授.
金保 安則(Yasunori Kanaho)
筑波大学大学院人間総合科学研究科 教授.
© 2012 柚崎通介・金保安則 Licensed under CC 表示 2.1 日本