ジストログリカンの機能に必要なLARGEの糖転移活性
稲森啓一郎・吉田-森口貴子・Kevin P. Campbell
(米国Iowa大学Roy J. and Lucille A. Carver College of Medicine,Department of Molecular Physiology and Biophysics)
email:稲森啓一郎,吉田-森口貴子
DOI: 10.7875/first.author.2012.017
Dystroglycan function requires xylosyl- and glucuronyltransferase activities of LARGE.
Kei-ichiro Inamori, Takako Yoshida-Moriguchi, Yuji Hara, Mary E. Anderson, Liping Yu, Kevin P. Campbell
Science, 335, 93-96 (2012)
糖転移酵素様タンパク質LARGEによるαジストログリカンの翻訳後修飾はその細胞外マトリックスリガンドとの結合に必要である.これまで,脳に異常をともなう先天性筋ジストロフィーの患者においてLARGE遺伝子の変異が報告されている.しかし,推定されるLARGEの糖転移活性はいまだ同定されておらず,その詳細な機能については不明であった.この研究では,LARGEがキシロース転移活性とグルクロン酸転移活性の2つの酵素活性をもち,キシロースとグルクロン酸のくり返し単位からなる多糖構造を形成することを明らかにした.さらに,この糖鎖修飾がαジストログリカンにLGドメインをもつ細胞外マトリックスリガンドに対する結合能をあたえることを示した.
ジストログリカンは筋細胞の外部と内部とを連結するジストロフィン-糖タンパク質複合体の重要な構成タンパク質で,細胞の表面に存在するαサブユニットと膜貫通型の構造をとるβサブユニットからなる(図1).ジストログリカンは筋細胞の細胞膜の恒常性の維持,また,中枢神経系においてその構造と機能の維持に重要な役割をもつ.さらには,出血熱をひき起こすラッサウイルスなどある種のアレナウイルスの受容体ともなっている.αジストログリカンは翻訳後修飾により糖鎖の高度な付加をうけており,なかでもO-マンノース型糖鎖が,ラミニンをはじめ,パールカン,アグリン,ニューレキシンなどLGドメインを含む細胞外マトリックスリガンドとの結合に必要である.O-マンノース型糖鎖の生合成の異常はαジストログリカンのリガンド結合能の低下をもたらし,αジストログリカノパチーとよばれる一連の先天性筋ジストロフィー,あるいは,肢帯型筋ジストロフィーをひき起こす1).
糖転移酵素様タンパク質であるLARGE(like-acetylglucosaminyltransferase)を細胞内で過剰に発現させるとαジストログリカンの糖鎖修飾とリガンド結合能が増大する2).さらには,数種類の遺伝的に異なる型の先天性筋ジストロフィーの患者に由来する細胞において,LARGEの過剰な発現がαジストログリカンの糖鎖修飾およびリガンド結合能を回復させることが示されている3).しかし,LARGEの推定される糖転移活性およびLGドメイン結合性糖鎖の構造については不明であった.今回,筆者らは,LARGEの糖転移活性とその産物である糖鎖の構造を明らかにした.さらに,そのキシロースとグルクロン酸のくり返し単位からなる糖鎖がαジストログリカンにリガンド結合能をあたえることを示した.
αジストログリカンのもつO-マンノース型糖鎖は,おもにSiaα2,3-Galβ1,4-GlcNAcβ1,2-Manα1-(Sia:シアル酸,Gal:ガラクトース,GlcNAc:N-アセチルグルコサミン,Man:マンノース)の構造を含むことが知られている4).しかし,グリコシダーゼおよび化学的な処理により骨格筋から精製されたαジストログリカンから,シアル酸,ガラクトース,N-アセチルグルコサミンを除去してもそのリガンド結合能は失われず,かえって増強されることが報告されている5).また,αジストログリカンはO-マンノース型糖鎖のほかにもN-結合型糖鎖とO-結合型(ムチン型)糖鎖を含んでいる.まず,LARGEに依存的な糖鎖修飾について調べるため,LARGEとαジストログリカンをともに過剰発現させたHEK293細胞の培養液よりαジストログリカンを精製し,それに付加されている糖の組成分析を行った.分析にさきだって,精製されたαジストログリカンを各種のグリコシダーゼにより処理することでLGドメイン結合性糖鎖に直接に関与しない糖を除外した.トリメチルシリル化糖誘導体のガスクロマトグラフィーによる分析から,αジストログリカンのもつO-マンノース型糖鎖としてすでに知られている糖にくわえ,新たにキシロースとグルクロン酸が同定された.キシロースとグルクロン酸はプロテオグリカンのもつヘパラン硫酸およびコンドロイチン-デルマタン硫酸グリコサミノグリカンの合成においても重要であるが,グリコサミノグリカンはαジストログリカンのリガンド結合能には必要ではないことが以前の報告6),および,今回の筆者らの結果から示されている.
そこで,αジストログリカンのリガンド結合能にグリコサミノグリカン合成とは別の経路のキシロース付加が必要であるのかどうかを,UDP-キシロース合成酵素であるUXS1を欠損したCHO細胞株を用いて解析した.UDP-キシロースはキシロース転移酵素の酵素反応に必須で,UXS1欠損細胞では基質タンパク質へのキシロースの付加はみられない7).フローサイトメトリーおよびウェスタンブロット法による解析から,UXS1欠損細胞のαジストログリカンはLGドメイン結合性糖鎖を欠いており,UXS1遺伝子を過剰発現させることでその糖鎖修飾は回復することが示された.一方,LARGEの過剰発現ではそのような回復はみられず,これらの結果から,LARGEが作用する基質がキシロースを含んでいるか,あるいは,LARGE自体がキシロース転移酵素であることが示唆された.
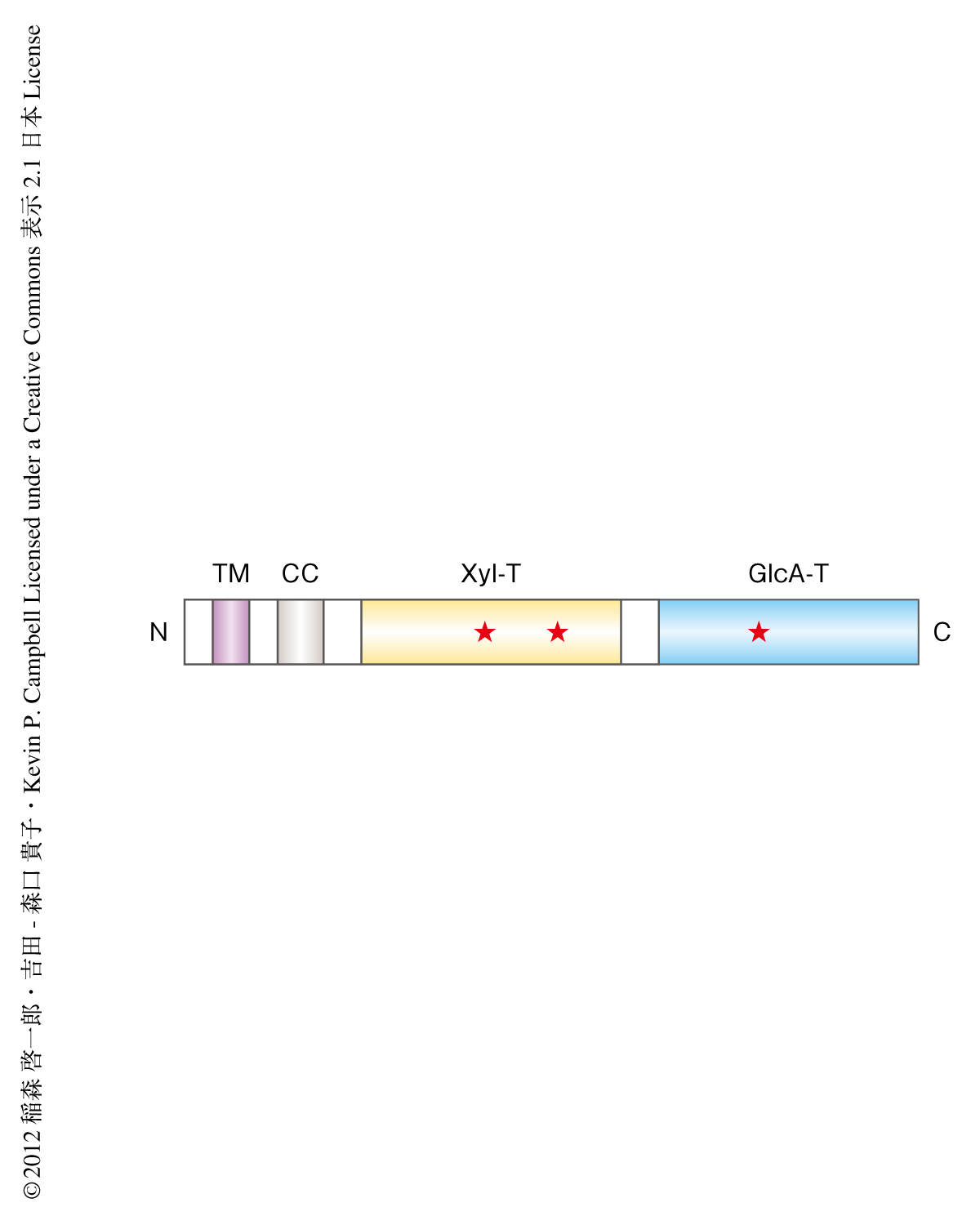
キシロースがグリコシド結合を介し疎水基をもつキシロシドは細胞膜を通過でき,細胞内のキシロースに作用する糖転移酵素を競争的に阻害することが知られている.たとえば,βグリコシド結合をもつβキシロシドは培地に添加するとプロテオグリカンのグリコサミノグリカン鎖の合成を阻害する.これは,グリコサミノグリカンの合成はコアタンパク質の特定のセリン残基にキシロースを付加することで開始されるが,そのβグリコシド結合のキシロースに作用する酵素(ガラクトース転移酵素)が競争的に阻害されるためである.LARGEが2つの異なる糖転移酵素様ドメインからなり(図2),そのひとつがおもにαグリコシド結合でいずれかの糖を転移する糖転移酵素ファミリーと相同性をもつことに着目し,αグリコシド結合をもつαキシロシドがαジストログリカンの糖鎖修飾を阻害するかどうかを調べた.LARGEを過剰発現する細胞の培地にαキシロシドを添加したところ,αジストログリカンのもつLGドメイン結合性糖鎖の減少と,それにともなうコアタンパク質の電気泳動における移動度の変化がみられた.この結果から,αジストログリカンがαグリコシド結合のキシロースをもっており,そこにLARGEが作用するのをαキシロシドが競争的に阻害した可能性が考えられた.
そこで,αキシロシドを酵素反応の受容体基質として用いることでLARGEの糖転移活性の検出を試みた.膜貫通領域を除いて可溶性とした組換えLARGEを発現精製し,さまざまな供与体基質とαキシロシドとともに酵素反応させたのち,高速液体クロマトグラフィー(HPLC)にて酵素反応物を分離し新たな酵素反応物が生成されたかどうかを調べた.すると,UDP-グルクロン酸を供与体基質として用いたときのみ特有のピークが現れ,質量分析によりそれがαキシロシドにグルクロン酸が付加されたものであることが確認された.βキシロシドを用いた場合にはそのようなピークは検出されず,LARGEがαグリコシド結合のキシロースに対しグルクロン酸転移活性をもつことが示された.さきに述べたように,LARGEは2つの糖転移酵素様ドメインをもつことから,LARGEがさらにグルクロン酸を末端にもつ基質にも作用するのではと仮定し,同様に,グルクロン酸がグリコシド結合を介し疎水基をもつグルクロニドを酵素反応の受容体基質に用いて糖転移活性の検出を試みた.その結果,βグリコシド結合をもつβグルクロニドに対してUDP-キシロースを用いたときのみ糖転移活性が検出され,LARGEがβグリコシド結合のグルクロン酸に対しキシロース転移活性をもつことが示された.
多くの糖転移酵素に保存されているDXDモチーフ(Asp-X-Asp,Xは任意のアミノ酸残基)はその糖転移活性に重要であることが知られている.LARGEは3つの保存されたDXDモチーフをもつが,それぞれのDXDモチーフを別のアミノ酸残基に置換した変異体はいずれもαジストログリカンの糖鎖修飾を増強できなくなることが報告されている8).それらの変異体LARGEはいずれかの糖転移活性を失っているのではないかと仮定し,2つの糖転移酵素様ドメインのそれぞれのDXDモチーフをAsn-X-Asnに置換した変異体を用いてグルクロン酸転移活性とキシロース転移活性を比較した(図2).おもしろいことに,1つ目のドメインにおける変異体はグルクロン酸転移活性のみ,2つ目のドメインにおける変異体はキシロース転移活性のみをもっていた.この結果から,LARGEは1つ目のドメインがキシロース転移活性,2つ目のドメインがグルクロン酸転移活性をもつ二元機能酵素であることが示された.
αジストログリカンとLGドメインとの結合には負に荷電した多糖の関与が示唆されている9).そこで,LARGEがαジストログリカンにキシロースと負の荷電をもつグルクロン酸を交互に転移することでLGドメイン結合性糖鎖をつくりうるかどうか調べた.まず,αキシロシドまたはβグルクロニドを受容体基質として用い,UDP-グルクロン酸とUDP-キシロースの共存のもとそれぞれ酵素反応を行い同様にHPLCにて解析したところ,いずれの基質に対してもキシロースとグルクロン酸の交互の転移を示すような多数のピークが検出された.そこでつぎに,この活性がin vitroでの酵素反応においてαジストログリカンにリガンド結合能をあたえるのかどうか検討した.筋ジストロフィーのモデルマウスであるmydマウス10)(LARGE遺伝子に変異をもちαジストログリカンのLGドメイン結合性糖鎖の修飾異常をともなう)の筋肉からαジストログリカンを含む糖タンパク質抽出物を調製し,これを受容体基質とし,膜貫通領域を除いて可溶性とした組換えLARGEとUDP-グルクロン酸およびUDP-キシロースとともに酵素反応を行った.酵素反応物をウェスタンブロット法およびリガンドオーバーレイ法にて解析したところ,in vitroでの酵素反応においてもLARGEのもつ糖転移活性がαジストログリカンにLGドメインをもつ細胞外マトリックスリガンド(ラミニン,アグリン,ニューレキシン)に対する結合能をあたえうることが示された.
さらに,LARGEがつくりだす糖鎖の詳細な構造を知るため,βグルクロニドを受容体基質とし,UDP-グルクロン酸とUDP-キシロースをくわえて酵素反応させたのち得られる多数のピークをそれぞれ分離精製し,質量分析とNMRを用いて構造解析を行った.これにより,LARGEが [-3-Xyl-α1,3-GlcA-β1-](Xyl:キシロース,GlcA:グルクロン酸)の2糖単位のくり返しからなる多糖を合成することが明らかになった.
以上の結果から,LARGEがキシロース転移酵素ドメインとグルクロン酸転移酵素ドメインからなる糖転移酵素で,キシロースとグルクロン酸を交互に転移することでαジストログリカンにリガンド結合能をあたえることが示された.LARGEはリン酸化をうけたO-マンノース型糖鎖を修飾する経路に関与することが示唆されており11),O-マンノース型糖鎖の合成にかかわるほかのタンパク質とともに,LARGEがαジストログリカンの機能的な糖鎖修飾において中心的な役割をはたしていることが示された.
今回の結果は,αジストログリカンの糖鎖修飾とその細胞外マトリックスリガンドとの相互作用の分子機構についてその理解を助け,さらには,LARGEを利用したαジストログリカノパチーの治療法の開発にも役立てられていく可能性が期待できる.また,1つの酵素タンパク質が2つの糖転移活性をもち,2糖単位のくり返しからなる多糖を形成するという点でグリコサミノグリカンの合成とよく類似しており,このたび同定した糖鎖構造が新たなタイプのグリコサミノグリカン様糖鎖であることも糖鎖生物学上とても興味深い.
略歴:2001年 九州大学大学院医学系研究科 修了,同年 大阪大学大学院医学系研究科 博士研究員,2004年 同 特任助手を経て,2006年より米国Iowa大学Roy J. and Lucille A. Carver College of Medicineポストドクトラルフェロー.
研究テーマ:αジストログリカンの糖鎖修飾機構.
吉田-森口貴子(Takako Yoshida-Moriguchi)
米国Iowa大学Roy J. and Lucille A. Carver College of MedicineにてAssociate.
Kevin P. Campbell
米国Iowa大学Roy J. and Lucille A. Carver College of MedicineにてProfessor.
研究室URL:http://www.physiology.uiowa.edu/Campbell/
© 2012 稲森啓一郎・吉田-森口貴子・Kevin P. Campbell Licensed under CC 表示 2.1 日本
(米国Iowa大学Roy J. and Lucille A. Carver College of Medicine,Department of Molecular Physiology and Biophysics)
email:稲森啓一郎,吉田-森口貴子
DOI: 10.7875/first.author.2012.017
Dystroglycan function requires xylosyl- and glucuronyltransferase activities of LARGE.
Kei-ichiro Inamori, Takako Yoshida-Moriguchi, Yuji Hara, Mary E. Anderson, Liping Yu, Kevin P. Campbell
Science, 335, 93-96 (2012)
要 約
糖転移酵素様タンパク質LARGEによるαジストログリカンの翻訳後修飾はその細胞外マトリックスリガンドとの結合に必要である.これまで,脳に異常をともなう先天性筋ジストロフィーの患者においてLARGE遺伝子の変異が報告されている.しかし,推定されるLARGEの糖転移活性はいまだ同定されておらず,その詳細な機能については不明であった.この研究では,LARGEがキシロース転移活性とグルクロン酸転移活性の2つの酵素活性をもち,キシロースとグルクロン酸のくり返し単位からなる多糖構造を形成することを明らかにした.さらに,この糖鎖修飾がαジストログリカンにLGドメインをもつ細胞外マトリックスリガンドに対する結合能をあたえることを示した.
はじめに
ジストログリカンは筋細胞の外部と内部とを連結するジストロフィン-糖タンパク質複合体の重要な構成タンパク質で,細胞の表面に存在するαサブユニットと膜貫通型の構造をとるβサブユニットからなる(図1).ジストログリカンは筋細胞の細胞膜の恒常性の維持,また,中枢神経系においてその構造と機能の維持に重要な役割をもつ.さらには,出血熱をひき起こすラッサウイルスなどある種のアレナウイルスの受容体ともなっている.αジストログリカンは翻訳後修飾により糖鎖の高度な付加をうけており,なかでもO-マンノース型糖鎖が,ラミニンをはじめ,パールカン,アグリン,ニューレキシンなどLGドメインを含む細胞外マトリックスリガンドとの結合に必要である.O-マンノース型糖鎖の生合成の異常はαジストログリカンのリガンド結合能の低下をもたらし,αジストログリカノパチーとよばれる一連の先天性筋ジストロフィー,あるいは,肢帯型筋ジストロフィーをひき起こす1).
糖転移酵素様タンパク質であるLARGE(like-acetylglucosaminyltransferase)を細胞内で過剰に発現させるとαジストログリカンの糖鎖修飾とリガンド結合能が増大する2).さらには,数種類の遺伝的に異なる型の先天性筋ジストロフィーの患者に由来する細胞において,LARGEの過剰な発現がαジストログリカンの糖鎖修飾およびリガンド結合能を回復させることが示されている3).しかし,LARGEの推定される糖転移活性およびLGドメイン結合性糖鎖の構造については不明であった.今回,筆者らは,LARGEの糖転移活性とその産物である糖鎖の構造を明らかにした.さらに,そのキシロースとグルクロン酸のくり返し単位からなる糖鎖がαジストログリカンにリガンド結合能をあたえることを示した.
1.キシロースの付加がαジストログリカンのリガンド結合能に必要である
αジストログリカンのもつO-マンノース型糖鎖は,おもにSiaα2,3-Galβ1,4-GlcNAcβ1,2-Manα1-(Sia:シアル酸,Gal:ガラクトース,GlcNAc:N-アセチルグルコサミン,Man:マンノース)の構造を含むことが知られている4).しかし,グリコシダーゼおよび化学的な処理により骨格筋から精製されたαジストログリカンから,シアル酸,ガラクトース,N-アセチルグルコサミンを除去してもそのリガンド結合能は失われず,かえって増強されることが報告されている5).また,αジストログリカンはO-マンノース型糖鎖のほかにもN-結合型糖鎖とO-結合型(ムチン型)糖鎖を含んでいる.まず,LARGEに依存的な糖鎖修飾について調べるため,LARGEとαジストログリカンをともに過剰発現させたHEK293細胞の培養液よりαジストログリカンを精製し,それに付加されている糖の組成分析を行った.分析にさきだって,精製されたαジストログリカンを各種のグリコシダーゼにより処理することでLGドメイン結合性糖鎖に直接に関与しない糖を除外した.トリメチルシリル化糖誘導体のガスクロマトグラフィーによる分析から,αジストログリカンのもつO-マンノース型糖鎖としてすでに知られている糖にくわえ,新たにキシロースとグルクロン酸が同定された.キシロースとグルクロン酸はプロテオグリカンのもつヘパラン硫酸およびコンドロイチン-デルマタン硫酸グリコサミノグリカンの合成においても重要であるが,グリコサミノグリカンはαジストログリカンのリガンド結合能には必要ではないことが以前の報告6),および,今回の筆者らの結果から示されている.
そこで,αジストログリカンのリガンド結合能にグリコサミノグリカン合成とは別の経路のキシロース付加が必要であるのかどうかを,UDP-キシロース合成酵素であるUXS1を欠損したCHO細胞株を用いて解析した.UDP-キシロースはキシロース転移酵素の酵素反応に必須で,UXS1欠損細胞では基質タンパク質へのキシロースの付加はみられない7).フローサイトメトリーおよびウェスタンブロット法による解析から,UXS1欠損細胞のαジストログリカンはLGドメイン結合性糖鎖を欠いており,UXS1遺伝子を過剰発現させることでその糖鎖修飾は回復することが示された.一方,LARGEの過剰発現ではそのような回復はみられず,これらの結果から,LARGEが作用する基質がキシロースを含んでいるか,あるいは,LARGE自体がキシロース転移酵素であることが示唆された.
2.LARGEはキシロース転移活性とグルクロン酸転移活性をもつ糖転移酵素である
キシロースがグリコシド結合を介し疎水基をもつキシロシドは細胞膜を通過でき,細胞内のキシロースに作用する糖転移酵素を競争的に阻害することが知られている.たとえば,βグリコシド結合をもつβキシロシドは培地に添加するとプロテオグリカンのグリコサミノグリカン鎖の合成を阻害する.これは,グリコサミノグリカンの合成はコアタンパク質の特定のセリン残基にキシロースを付加することで開始されるが,そのβグリコシド結合のキシロースに作用する酵素(ガラクトース転移酵素)が競争的に阻害されるためである.LARGEが2つの異なる糖転移酵素様ドメインからなり(図2),そのひとつがおもにαグリコシド結合でいずれかの糖を転移する糖転移酵素ファミリーと相同性をもつことに着目し,αグリコシド結合をもつαキシロシドがαジストログリカンの糖鎖修飾を阻害するかどうかを調べた.LARGEを過剰発現する細胞の培地にαキシロシドを添加したところ,αジストログリカンのもつLGドメイン結合性糖鎖の減少と,それにともなうコアタンパク質の電気泳動における移動度の変化がみられた.この結果から,αジストログリカンがαグリコシド結合のキシロースをもっており,そこにLARGEが作用するのをαキシロシドが競争的に阻害した可能性が考えられた.
そこで,αキシロシドを酵素反応の受容体基質として用いることでLARGEの糖転移活性の検出を試みた.膜貫通領域を除いて可溶性とした組換えLARGEを発現精製し,さまざまな供与体基質とαキシロシドとともに酵素反応させたのち,高速液体クロマトグラフィー(HPLC)にて酵素反応物を分離し新たな酵素反応物が生成されたかどうかを調べた.すると,UDP-グルクロン酸を供与体基質として用いたときのみ特有のピークが現れ,質量分析によりそれがαキシロシドにグルクロン酸が付加されたものであることが確認された.βキシロシドを用いた場合にはそのようなピークは検出されず,LARGEがαグリコシド結合のキシロースに対しグルクロン酸転移活性をもつことが示された.さきに述べたように,LARGEは2つの糖転移酵素様ドメインをもつことから,LARGEがさらにグルクロン酸を末端にもつ基質にも作用するのではと仮定し,同様に,グルクロン酸がグリコシド結合を介し疎水基をもつグルクロニドを酵素反応の受容体基質に用いて糖転移活性の検出を試みた.その結果,βグリコシド結合をもつβグルクロニドに対してUDP-キシロースを用いたときのみ糖転移活性が検出され,LARGEがβグリコシド結合のグルクロン酸に対しキシロース転移活性をもつことが示された.
3.変異体を用いたLARGEの糖転移活性の解析
多くの糖転移酵素に保存されているDXDモチーフ(Asp-X-Asp,Xは任意のアミノ酸残基)はその糖転移活性に重要であることが知られている.LARGEは3つの保存されたDXDモチーフをもつが,それぞれのDXDモチーフを別のアミノ酸残基に置換した変異体はいずれもαジストログリカンの糖鎖修飾を増強できなくなることが報告されている8).それらの変異体LARGEはいずれかの糖転移活性を失っているのではないかと仮定し,2つの糖転移酵素様ドメインのそれぞれのDXDモチーフをAsn-X-Asnに置換した変異体を用いてグルクロン酸転移活性とキシロース転移活性を比較した(図2).おもしろいことに,1つ目のドメインにおける変異体はグルクロン酸転移活性のみ,2つ目のドメインにおける変異体はキシロース転移活性のみをもっていた.この結果から,LARGEは1つ目のドメインがキシロース転移活性,2つ目のドメインがグルクロン酸転移活性をもつ二元機能酵素であることが示された.
4.LARGEの形成する多糖構造がαジストログリカンにリガンド結合能をあたえる
αジストログリカンとLGドメインとの結合には負に荷電した多糖の関与が示唆されている9).そこで,LARGEがαジストログリカンにキシロースと負の荷電をもつグルクロン酸を交互に転移することでLGドメイン結合性糖鎖をつくりうるかどうか調べた.まず,αキシロシドまたはβグルクロニドを受容体基質として用い,UDP-グルクロン酸とUDP-キシロースの共存のもとそれぞれ酵素反応を行い同様にHPLCにて解析したところ,いずれの基質に対してもキシロースとグルクロン酸の交互の転移を示すような多数のピークが検出された.そこでつぎに,この活性がin vitroでの酵素反応においてαジストログリカンにリガンド結合能をあたえるのかどうか検討した.筋ジストロフィーのモデルマウスであるmydマウス10)(LARGE遺伝子に変異をもちαジストログリカンのLGドメイン結合性糖鎖の修飾異常をともなう)の筋肉からαジストログリカンを含む糖タンパク質抽出物を調製し,これを受容体基質とし,膜貫通領域を除いて可溶性とした組換えLARGEとUDP-グルクロン酸およびUDP-キシロースとともに酵素反応を行った.酵素反応物をウェスタンブロット法およびリガンドオーバーレイ法にて解析したところ,in vitroでの酵素反応においてもLARGEのもつ糖転移活性がαジストログリカンにLGドメインをもつ細胞外マトリックスリガンド(ラミニン,アグリン,ニューレキシン)に対する結合能をあたえうることが示された.
さらに,LARGEがつくりだす糖鎖の詳細な構造を知るため,βグルクロニドを受容体基質とし,UDP-グルクロン酸とUDP-キシロースをくわえて酵素反応させたのち得られる多数のピークをそれぞれ分離精製し,質量分析とNMRを用いて構造解析を行った.これにより,LARGEが [-3-Xyl-α1,3-GlcA-β1-](Xyl:キシロース,GlcA:グルクロン酸)の2糖単位のくり返しからなる多糖を合成することが明らかになった.
以上の結果から,LARGEがキシロース転移酵素ドメインとグルクロン酸転移酵素ドメインからなる糖転移酵素で,キシロースとグルクロン酸を交互に転移することでαジストログリカンにリガンド結合能をあたえることが示された.LARGEはリン酸化をうけたO-マンノース型糖鎖を修飾する経路に関与することが示唆されており11),O-マンノース型糖鎖の合成にかかわるほかのタンパク質とともに,LARGEがαジストログリカンの機能的な糖鎖修飾において中心的な役割をはたしていることが示された.
おわりに
今回の結果は,αジストログリカンの糖鎖修飾とその細胞外マトリックスリガンドとの相互作用の分子機構についてその理解を助け,さらには,LARGEを利用したαジストログリカノパチーの治療法の開発にも役立てられていく可能性が期待できる.また,1つの酵素タンパク質が2つの糖転移活性をもち,2糖単位のくり返しからなる多糖を形成するという点でグリコサミノグリカンの合成とよく類似しており,このたび同定した糖鎖構造が新たなタイプのグリコサミノグリカン様糖鎖であることも糖鎖生物学上とても興味深い.
文 献
- Barresi, R. & Campbell, K. P.: Dystroglycan: from biosynthesis to pathogenesis of human disease. J. Cell Sci., 119, 199-207 (2006)[PubMed]
- Kanagawa, M., Saito, F., Kunz, S. et al.: Molecular recognition by LARGE is essential for expression of functional dystroglycan. Cell, 117, 953-964 (2004)[PubMed]
- Barresi, R., Michele, D. E., Kanagawa, M. et al.: LARGE can functionally bypass α-dystroglycan glycosylation defects in distinct congenital muscular dystrophies. Nat. Med., 10, 696-703 (2004)[PubMed]
- Chiba, A., Matsumura, K., Yamada, H. et al.: Structures of sialylated O-linked oligosaccharides of bovine peripheral nerve α-dystroglycan. The role of a novel O-mannosyl-type oligosaccharide in the binding of α-dystroglycan with laminin. J. Biol. Chem., 272, 2156-2162 (1997)[PubMed]
- Combs, A. C. & Ervasti, J. M.: Enhanced laminin binding by α-dystroglycan after enzymatic deglycosylation. Biochem. J., 390, 303-309 (2005)[PubMed]
- Yamada, H., Chiba, A., Endo, T. et al.: Characterization of dystroglycan-laminin interaction in peripheral nerve. J. Neurochem., 66, 1518-1524 (1996)[PubMed]
- Bakker, H., Oka, T., Ashikov, A. et al.: Functional UDP-xylose transport across the endoplasmic reticulum/Golgi membrane in a Chinese hamster ovary cell mutant defective in UDP-xylose synthase. J. Biol. Chem., 284, 2576-2583 (2009)[PubMed]
- Brockington, M., Torelli, S., Prandini, P. et al.: Localization and functional analysis of the LARGE family of glycosyltransferases: significance for muscular dystrophy. Hum. Mol. Genet., 14, 657-665 (2005)[PubMed]
- Hohenester, E., Tisi, D., Talts, J. F. et al.: The crystal structure of a laminin G-like module reveals the molecular basis of α-dystroglycan binding to laminins, perlecan, and agrin. Mol. Cell, 4, 783-792 (1999)[PubMed]
- Grewal, P. K., Holzfeind, P. J., Bittner, R. E. et al.: Mutant glycosyltransferase and altered glycosylation of α-dystroglycan in the myodystrophy mouse. Nat. Genet., 28, 151-154 (2001)[PubMed]
- Yoshida-Moriguchi, T., Yu, L., Stalnaker, S. H. et al.: O-mannosyl phosphorylation of alpha-dystroglycan is required for laminin binding. Science, 327, 88-92 (2010)[PubMed]
著者プロフィール
略歴:2001年 九州大学大学院医学系研究科 修了,同年 大阪大学大学院医学系研究科 博士研究員,2004年 同 特任助手を経て,2006年より米国Iowa大学Roy J. and Lucille A. Carver College of Medicineポストドクトラルフェロー.
研究テーマ:αジストログリカンの糖鎖修飾機構.
吉田-森口貴子(Takako Yoshida-Moriguchi)
米国Iowa大学Roy J. and Lucille A. Carver College of MedicineにてAssociate.
Kevin P. Campbell
米国Iowa大学Roy J. and Lucille A. Carver College of MedicineにてProfessor.
研究室URL:http://www.physiology.uiowa.edu/Campbell/
© 2012 稲森啓一郎・吉田-森口貴子・Kevin P. Campbell Licensed under CC 表示 2.1 日本