TGFβによる上皮と間充織との相互作用は毛包幹細胞の休眠状態を解除する
押森直木・Elaine Fuchs
(米国Rockefeller大学,Laboratory of Mammalian Cell Biology and Development)
email:押森直木
DOI: 10.7875/first.author.2012.014
Paracrine TGF-βsignaling counterbalances BMP-mediated repression in hair follicle stem cell activation.
Naoki Oshimori, Elaine Fuchs
Cell Stem Cell, 10, 63-75 (2012)
新たな発毛は毛穴の奥に存在する休眠中の毛包幹細胞が,再び細胞分裂を開始し毛包を再生することによりはじまる.毛包幹細胞の休眠状態はBMPなどの抑制性タンパク質により保たれるが,活性化シグナルが抑制の閾値をこえることが引き金となり毛包幹細胞の分裂がはじまるものと考えられている.今回,筆者らは,毛包幹細胞の活性化を担うシグナルと活性化にいたる分子機構の一端を明らかにした.まず,毛包幹細胞に隣接する間充織細胞がTGFβ2を産生し,それを受け取った毛包幹細胞においてTGFβ-Smad2/Smad3シグナルが一過性に活性化することを見い出した.毛包幹細胞においてTGFβ受容体の欠損したマウスでは毛包の再生と発毛に遅れが生じ,逆に,外来性のTGFβ2はin vivoとin vitroの両方で毛包幹細胞の分裂の開始を促進した.毛包幹細胞の遺伝子発現解析の結果,TGFβ-Smad2/Smad3シグナルの重要な下流タンパク質としてTmeff1を同定し,このTmeff1がTGFβによるBMPシグナルの阻害に必要であることが示された.さらに,Tmeff1の発現を抑制したマウスでも発毛に遅れがみられた.したがって,間充織細胞に由来するTGFβ2が毛包幹細胞においてTmeff1の発現を誘導し,BMPによる休眠状態を解くことで毛包の再生がはじまるものと考えられた.
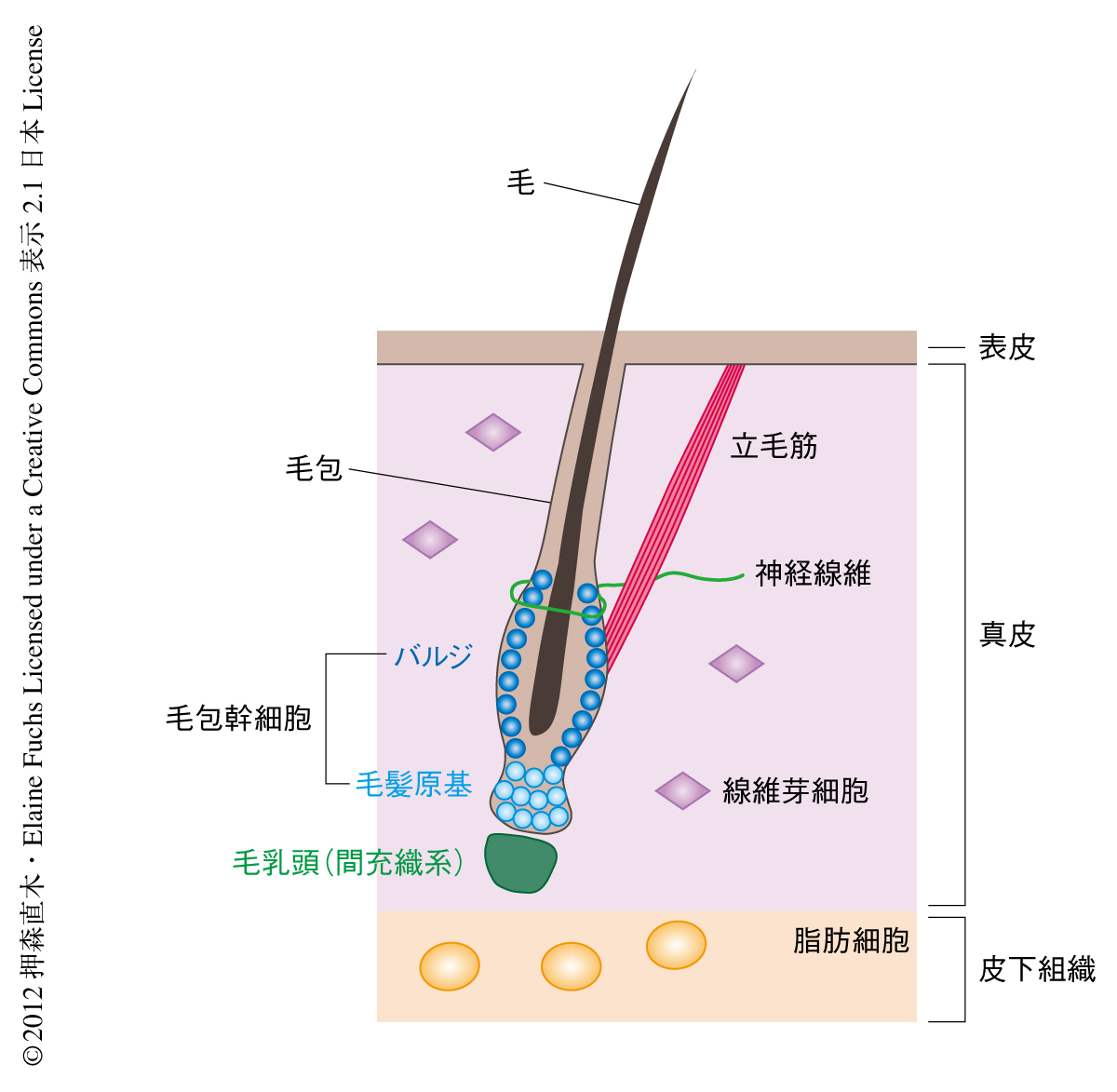
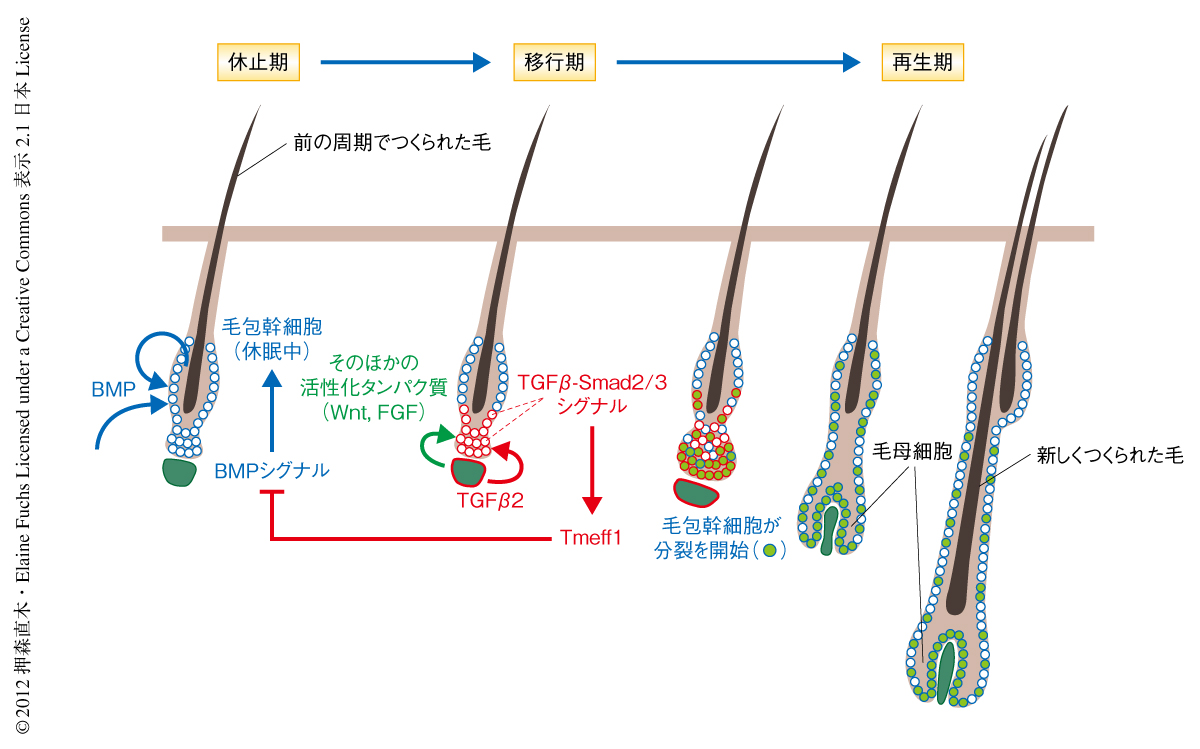
体を構成するそれぞれの組織は固有の幹細胞をもっている.組織の恒常性と再生は幹細胞の活動を調節することで巧妙に制御されている.われわれの皮膚に存在する無数の毛包(毛穴の奥にある毛をつくる微小器官)は生涯をつうじて退縮,休止,再生をくり返し,そのたびに1本の毛をつくりだす1).とくに,その周期が体の全体で同調して起こるマウスの皮膚は組織の再生のしくみを解明するうえでのすぐれた研究モデルである.毛包幹細胞はバルジおよび毛髪原基とよばれる領域に存在する(図1).それらは伸長をおえた毛の根元の部分において立毛筋や神経末端の接する特殊な環境(ニッチ)を構成している.休止期においては皮下の脂肪細胞や線維芽細胞,毛包幹細胞それ自体が産生するBMP(bone morphogenetic protein,骨形成タンパク質)などの抑制性タンパク質により毛包幹細胞の休眠状態は保たれている2,3)(図2).活性化の刺激により休眠中の毛包幹細胞が再び細胞分裂をはじめると毛包が再生され新たな毛がつくられる.活性化タンパク質は毛髪原基の直下に存在する毛乳頭とよばれる間充織細胞の集団がつくりだすと考えられており,実際に,毛乳頭に近い毛髪原基が最初に増殖を開始し,その数日後にバルジの細胞が分裂する4,5).この活性化タンパク質としてはWntやBMP阻害タンパク質が知られているが,生理的な環境における本質的な活性化タンパク質や,それらをつくりだす細胞の種類,そして,毛包幹細胞が活性化にいたるしくみについてはいまだ不明な点が多い.
TGFβ(transforming growth factor-β,トランスフォーミング増殖因子β)は形態形成や組織の恒常性,がん化を制御するシグナルタンパク質である.BMPとTGFβはともにTGFβスーパーファミリーに属し,BMP受容体は下流でSmad1,Smad5,Smad8,TGFβ受容体はSmad2,Smad3をリン酸化することでシグナルを伝達する.リン酸化型Smad1,Smad5,Smad8とリン酸化型Smad2,Smad3は核においてSmad4と別個の転写因子複合体を形成し特異的な遺伝子発現を制御する6).TGFβはさまざまな上皮系の細胞に対し増殖抑制効果を示し,がんの発生を抑える.ところが,がんが形成されるとTGFβはその進行を促進することも知られている7).また,TGFβにはTGFβ1,TGFβ2,TGFβ3の3種類が存在するが,興味深いことに,胎仔期の毛包の形成においては異なる機能が報告され,とくに,TGFβ2は毛包の伸長に必要であることが示唆されている8).このように,TGFβは細胞の種類や性質,組織の環境などにより機能の異なることが多く報告されている.
筆者らは当初,TGFβシグナルがどのように表皮組織の恒常性を維持するかに興味をもっていた.まず,TGFβシグナルがいつどこで活性化するのかを調べるため,胎仔期から生後3カ月までのマウスの皮膚の切片を用意し,抗リン酸化型Smad2抗体による免疫染色を行った.TGFβは組織の恒常性の維持にかかわると考えられているが,意外なことに,表皮においてはめだった活性はみられなかった.ところが,毛包が休止期から再生期へ移行する時期に毛乳頭に接した毛髪原基の細胞でTGFβシグナルの顕著な活性化がみられ,そののち,バルジの細胞にも活性化がみられた(図2).このTGFβシグナルの活性化パターンをおうかたちで,毛乳頭に近い毛髪原基から毛包幹細胞の増殖がはじまり,そののち,バルジの細胞も分裂を開始した.ところが,毛の前駆細胞(毛母細胞)が形成される時期になるとTGFβシグナルの活性は低下した(図2).同様の結果は,TGFβレポーター遺伝子を導入したマウスでも確認された.
つづいて,TGFβの種類とそれを産生する細胞を特定した.蛍光セルソーターを用いてマウスの皮膚から表皮細胞,バルジの細胞,毛髪原基の細胞,毛乳頭の細胞を単離し解析した結果,TGFβ2が毛乳頭の細胞で顕著に発現していた.さらに,移行期の皮膚の切片では毛乳頭の辺縁へのTGFβ2の蓄積と,隣接する毛包幹細胞でのリン酸化型Smad2の局在に顕著な相関がみられた(図2).以上のことから,毛包が休止期から再生期へと移行する生理的な環境において毛乳頭の細胞がTGFβ2を産生し,毛包幹細胞に一過性のTGFβ-Smad2/Smad3シグナルをひき起こすことを見い出した.
TGFβシグナルの生理的な意義を調べる目的で,毛包幹細胞において特異的にTGFβ受容体を欠損したマウスを解析した.正常なマウスに比べ,この変異マウスでは毛包幹細胞の分裂が顕著に遅れることが観察された.さらに,マウスの体毛を刈ることで毛包の再生にともなう新たな発毛への影響を調べた.毛包幹細胞においてTGFβ受容体を欠損したマウスでは毛包の構造や毛それ自体には異常はみられないものの,発毛の開始に大きな遅れが生じた.これらの結果から,TGFβは毛包幹細胞の活性化の時期を制御していることが示唆された.
つづいて,TGFβが休眠状態の毛包幹細胞を活性化しうるかどうかを調べるため,本来はTGFβシグナルが低い時期の毛包の直下に蛍光ビーズとともにTGFβ2を注射した.その結果,ビーズの周辺の毛髪原基の細胞は細胞分裂を開始し早期の体毛伸長も観察された.毛包幹細胞においてTGFβ受容体を欠損したマウスではこのような反応はみられないことから,TGFβ2は実際に毛包幹細胞を活性化させることができるものと考えられた.
BMPは毛包幹細胞の休眠状態を維持する主要なタンパク質であり,毛包の再生がはじまるまえにBMPシグナルは減弱することが知られている2).リン酸化型Smad1,Smad5,Smad8の免疫染色とBMPレポーター遺伝子導入マウスの解析から,再生期の直前の毛包幹細胞ではBMPシグナルの低下が確認された.しかし,毛包幹細胞においてTGFβ受容体を欠損したマウスでは同じ時点で依然として高いBMPシグナルが維持されていることを見い出した.このことは,この変異マウスでみられた毛包の再生の遅れの原因が異常に持続したBMPシグナルにある可能性を示唆した.そこで,強いBMP阻害作用をもつNogginを注射したところ変異マウスの表現型に改善がみられた.したがって,TGFβはBMPシグナルを阻害することで毛包幹細胞を活性化していることが示唆された.
TGFβの効果をより詳細に調べるため,毛包幹細胞の初代培養の実験系を利用した.マウスの皮膚から蛍光セルソーターにより毛包幹細胞を単離し,異なる濃度のTGFβやBMPを含む培地で幹細胞のコロニー形成能を比較した.その結果,低濃度のTGFβにコロニー形成を促進する効果がみられ,BMPによる負の効果を軽減することもできた.このTGFβによる促進効果はTGFβ受容体を欠損した毛包幹細胞ではみられないが,重要なこととして,BMP受容体をもたない毛包幹細胞にも促進効果を示さなかった.このことは,TGFβがBMPシグナルの阻害を介して毛包幹細胞に影響を及ぼすという考えを支持した.
Smad2/Smad3(TGFβシグナル)とSmad1/Smad5/Smad8(BMPシグナル)はともに,核においてSmad4を転写共役因子として用いる.したがって,Smad2あるいはSmad3がSmad4を独占することでBMPシグナルを阻害している可能性が考えられた.しかし,タンパク質合成阻害剤であるシクロヘキシミドの存在下ではTGFβの阻害効果はみられないことや,短時間のTGFβによる刺激ではSmad1,Smad5,Smad8とSmad4との相互作用に影響はみられないことなどからその可能性は低く,むしろ,TGFβ-Smad2/Smad3シグナルの下流の遺伝子発現を介した機構である可能性が考えられた.
TGFβがBMPシグナルを阻害する分子機構を明らかにするため,TGFβシグナルが活性化している時期の毛包幹細胞をマウスの皮膚から単離し,マイクロアレイ法により遺伝子発現の状態を比較した.毛包幹細胞においてTGFβ受容体を欠損したマウスとのあいだで発現に差のみられた遺伝子には細胞内シグナル,細胞分化,細胞増殖にかかわるものがめだっていた.なかでも,BMPシグナルに対し抑制的にはたらくBambi遺伝子,Bmper遺伝子,Tmeff1遺伝子の発現がこの変異マウスで低下していることに着目した.初代培養細胞をTGFβにより刺激したのち,もっとも顕著かつ持続的に発現の上昇を示したのがTmeff1遺伝子9) であった.また,クロマチン免疫沈降実験の結果,Smad2あるいはSmad3がTmeff1遺伝子のプロモーター領域へTGFβシグナルに依存的に結合することが示された.さらに,Tmeff1がTGFβシグナルの生理的な下流タンパク質であることを強く示唆するデータとして,Tmeff1の生体における発現の時期と場所がリン酸化型Smad2と合致していること,外来性のTGFβ2の注射により毛包幹細胞においてTmeff1の発現が誘導されることがあげられた(図2).
つづいて,Tmeff1がBMPシグナルにあたえる影響についてBMPレポーター遺伝子を導入した細胞を用いて解析した.TGFβの存在下ではBMPシグナルの減弱がみられるが,shRNAを用いてTmeff1をノックダウンするとBMPシグナルは有意に回復した.また逆に,Tmeff1の過剰発現はBMPシグナルを強く阻害した.
最後に,毛包の再生過程でのTmeff1の重要性を確かめるため,in uteroレンチウイルス注入法によるin vivo発現抑制実験を行った10).妊娠9.5日のマウス胎仔が浮かぶ羊水に高力価のレンチウイルスを注射することで,Tmeff1 shRNAを表皮細胞に特異的に導入した.Tmeff1 shRNAを導入したマウスにおいてはTmeff1の発現抑制が確認された.さらに,マウスの体毛を刈り発毛の時期を調べるとTmeff1 shRNAを導入したマウスでは有意な遅れが観察された.以上の結果から,Tmeff1はTGFβ-Smad2/Smad3の下流でBMPシグナルの阻害し毛包の再生を促進しているものと考えられた(図2).
今回,筆者らが見い出したTGFβの機能は,上皮系の細胞増殖に負にはたらくという既知の機能とは異なっていた.興味深いことに,同じ表皮に由来する細胞でも,毛包幹細胞とほかの細胞ではTGFβの効果が濃度に依存的に異なっていた.また,毛包幹細胞の休眠状態を維持するBMPシグナルの有無によりTGFβの効果は異なることを見い出した.これまでも,TGFβの効果は細胞の種類や組織内の環境により異なることが報告されているが,筆者らの結果は,毛包幹細胞に特有のシグナルがTGFβの多様な効果を生み出す一因となっていることを示唆しており,今後の研究でその詳細を明らかにしたい.さらに,この研究が明らかにしたような細胞内シグナルの相互作用を理解することは,がんを含めた幹細胞を標的とした治療や,人工的な組織構築,再生医学に重要な意味をもつものと考えている.
略歴:2008年 東京大学大学院理学系研究科 修了,同年より米国Rockefeller大学 博士研究員.
研究テーマ:がんを含めた組織の形態形成と幹細胞の制御.
抱負:体のなかで無数に起こる細胞間コミュニケーションを可視化し,その意味を理解したい.
Elaine Fuchs
米国Rockefeller大学 教授.
研究室URL:http://lab.rockefeller.edu/fuchs/
© 2012 押森直木・Elaine Fuchs Licensed under CC 表示 2.1 日本
(米国Rockefeller大学,Laboratory of Mammalian Cell Biology and Development)
email:押森直木
DOI: 10.7875/first.author.2012.014
Paracrine TGF-βsignaling counterbalances BMP-mediated repression in hair follicle stem cell activation.
Naoki Oshimori, Elaine Fuchs
Cell Stem Cell, 10, 63-75 (2012)
要 約
新たな発毛は毛穴の奥に存在する休眠中の毛包幹細胞が,再び細胞分裂を開始し毛包を再生することによりはじまる.毛包幹細胞の休眠状態はBMPなどの抑制性タンパク質により保たれるが,活性化シグナルが抑制の閾値をこえることが引き金となり毛包幹細胞の分裂がはじまるものと考えられている.今回,筆者らは,毛包幹細胞の活性化を担うシグナルと活性化にいたる分子機構の一端を明らかにした.まず,毛包幹細胞に隣接する間充織細胞がTGFβ2を産生し,それを受け取った毛包幹細胞においてTGFβ-Smad2/Smad3シグナルが一過性に活性化することを見い出した.毛包幹細胞においてTGFβ受容体の欠損したマウスでは毛包の再生と発毛に遅れが生じ,逆に,外来性のTGFβ2はin vivoとin vitroの両方で毛包幹細胞の分裂の開始を促進した.毛包幹細胞の遺伝子発現解析の結果,TGFβ-Smad2/Smad3シグナルの重要な下流タンパク質としてTmeff1を同定し,このTmeff1がTGFβによるBMPシグナルの阻害に必要であることが示された.さらに,Tmeff1の発現を抑制したマウスでも発毛に遅れがみられた.したがって,間充織細胞に由来するTGFβ2が毛包幹細胞においてTmeff1の発現を誘導し,BMPによる休眠状態を解くことで毛包の再生がはじまるものと考えられた.
はじめに
体を構成するそれぞれの組織は固有の幹細胞をもっている.組織の恒常性と再生は幹細胞の活動を調節することで巧妙に制御されている.われわれの皮膚に存在する無数の毛包(毛穴の奥にある毛をつくる微小器官)は生涯をつうじて退縮,休止,再生をくり返し,そのたびに1本の毛をつくりだす1).とくに,その周期が体の全体で同調して起こるマウスの皮膚は組織の再生のしくみを解明するうえでのすぐれた研究モデルである.毛包幹細胞はバルジおよび毛髪原基とよばれる領域に存在する(図1).それらは伸長をおえた毛の根元の部分において立毛筋や神経末端の接する特殊な環境(ニッチ)を構成している.休止期においては皮下の脂肪細胞や線維芽細胞,毛包幹細胞それ自体が産生するBMP(bone morphogenetic protein,骨形成タンパク質)などの抑制性タンパク質により毛包幹細胞の休眠状態は保たれている2,3)(図2).活性化の刺激により休眠中の毛包幹細胞が再び細胞分裂をはじめると毛包が再生され新たな毛がつくられる.活性化タンパク質は毛髪原基の直下に存在する毛乳頭とよばれる間充織細胞の集団がつくりだすと考えられており,実際に,毛乳頭に近い毛髪原基が最初に増殖を開始し,その数日後にバルジの細胞が分裂する4,5).この活性化タンパク質としてはWntやBMP阻害タンパク質が知られているが,生理的な環境における本質的な活性化タンパク質や,それらをつくりだす細胞の種類,そして,毛包幹細胞が活性化にいたるしくみについてはいまだ不明な点が多い.
TGFβ(transforming growth factor-β,トランスフォーミング増殖因子β)は形態形成や組織の恒常性,がん化を制御するシグナルタンパク質である.BMPとTGFβはともにTGFβスーパーファミリーに属し,BMP受容体は下流でSmad1,Smad5,Smad8,TGFβ受容体はSmad2,Smad3をリン酸化することでシグナルを伝達する.リン酸化型Smad1,Smad5,Smad8とリン酸化型Smad2,Smad3は核においてSmad4と別個の転写因子複合体を形成し特異的な遺伝子発現を制御する6).TGFβはさまざまな上皮系の細胞に対し増殖抑制効果を示し,がんの発生を抑える.ところが,がんが形成されるとTGFβはその進行を促進することも知られている7).また,TGFβにはTGFβ1,TGFβ2,TGFβ3の3種類が存在するが,興味深いことに,胎仔期の毛包の形成においては異なる機能が報告され,とくに,TGFβ2は毛包の伸長に必要であることが示唆されている8).このように,TGFβは細胞の種類や性質,組織の環境などにより機能の異なることが多く報告されている.
1.休止期から再生期に毛乳頭は一過性のTGFβシグナルを毛包幹細胞に伝達する
筆者らは当初,TGFβシグナルがどのように表皮組織の恒常性を維持するかに興味をもっていた.まず,TGFβシグナルがいつどこで活性化するのかを調べるため,胎仔期から生後3カ月までのマウスの皮膚の切片を用意し,抗リン酸化型Smad2抗体による免疫染色を行った.TGFβは組織の恒常性の維持にかかわると考えられているが,意外なことに,表皮においてはめだった活性はみられなかった.ところが,毛包が休止期から再生期へ移行する時期に毛乳頭に接した毛髪原基の細胞でTGFβシグナルの顕著な活性化がみられ,そののち,バルジの細胞にも活性化がみられた(図2).このTGFβシグナルの活性化パターンをおうかたちで,毛乳頭に近い毛髪原基から毛包幹細胞の増殖がはじまり,そののち,バルジの細胞も分裂を開始した.ところが,毛の前駆細胞(毛母細胞)が形成される時期になるとTGFβシグナルの活性は低下した(図2).同様の結果は,TGFβレポーター遺伝子を導入したマウスでも確認された.
つづいて,TGFβの種類とそれを産生する細胞を特定した.蛍光セルソーターを用いてマウスの皮膚から表皮細胞,バルジの細胞,毛髪原基の細胞,毛乳頭の細胞を単離し解析した結果,TGFβ2が毛乳頭の細胞で顕著に発現していた.さらに,移行期の皮膚の切片では毛乳頭の辺縁へのTGFβ2の蓄積と,隣接する毛包幹細胞でのリン酸化型Smad2の局在に顕著な相関がみられた(図2).以上のことから,毛包が休止期から再生期へと移行する生理的な環境において毛乳頭の細胞がTGFβ2を産生し,毛包幹細胞に一過性のTGFβ-Smad2/Smad3シグナルをひき起こすことを見い出した.
2.毛包幹細胞においてTGFβ受容体を欠損したマウスでは毛包の再生が遅れる
TGFβシグナルの生理的な意義を調べる目的で,毛包幹細胞において特異的にTGFβ受容体を欠損したマウスを解析した.正常なマウスに比べ,この変異マウスでは毛包幹細胞の分裂が顕著に遅れることが観察された.さらに,マウスの体毛を刈ることで毛包の再生にともなう新たな発毛への影響を調べた.毛包幹細胞においてTGFβ受容体を欠損したマウスでは毛包の構造や毛それ自体には異常はみられないものの,発毛の開始に大きな遅れが生じた.これらの結果から,TGFβは毛包幹細胞の活性化の時期を制御していることが示唆された.
つづいて,TGFβが休眠状態の毛包幹細胞を活性化しうるかどうかを調べるため,本来はTGFβシグナルが低い時期の毛包の直下に蛍光ビーズとともにTGFβ2を注射した.その結果,ビーズの周辺の毛髪原基の細胞は細胞分裂を開始し早期の体毛伸長も観察された.毛包幹細胞においてTGFβ受容体を欠損したマウスではこのような反応はみられないことから,TGFβ2は実際に毛包幹細胞を活性化させることができるものと考えられた.
3.TGFβは抑制性のBMPシグナルを相殺し毛包幹細胞の活性化をひき起こす
BMPは毛包幹細胞の休眠状態を維持する主要なタンパク質であり,毛包の再生がはじまるまえにBMPシグナルは減弱することが知られている2).リン酸化型Smad1,Smad5,Smad8の免疫染色とBMPレポーター遺伝子導入マウスの解析から,再生期の直前の毛包幹細胞ではBMPシグナルの低下が確認された.しかし,毛包幹細胞においてTGFβ受容体を欠損したマウスでは同じ時点で依然として高いBMPシグナルが維持されていることを見い出した.このことは,この変異マウスでみられた毛包の再生の遅れの原因が異常に持続したBMPシグナルにある可能性を示唆した.そこで,強いBMP阻害作用をもつNogginを注射したところ変異マウスの表現型に改善がみられた.したがって,TGFβはBMPシグナルを阻害することで毛包幹細胞を活性化していることが示唆された.
TGFβの効果をより詳細に調べるため,毛包幹細胞の初代培養の実験系を利用した.マウスの皮膚から蛍光セルソーターにより毛包幹細胞を単離し,異なる濃度のTGFβやBMPを含む培地で幹細胞のコロニー形成能を比較した.その結果,低濃度のTGFβにコロニー形成を促進する効果がみられ,BMPによる負の効果を軽減することもできた.このTGFβによる促進効果はTGFβ受容体を欠損した毛包幹細胞ではみられないが,重要なこととして,BMP受容体をもたない毛包幹細胞にも促進効果を示さなかった.このことは,TGFβがBMPシグナルの阻害を介して毛包幹細胞に影響を及ぼすという考えを支持した.
Smad2/Smad3(TGFβシグナル)とSmad1/Smad5/Smad8(BMPシグナル)はともに,核においてSmad4を転写共役因子として用いる.したがって,Smad2あるいはSmad3がSmad4を独占することでBMPシグナルを阻害している可能性が考えられた.しかし,タンパク質合成阻害剤であるシクロヘキシミドの存在下ではTGFβの阻害効果はみられないことや,短時間のTGFβによる刺激ではSmad1,Smad5,Smad8とSmad4との相互作用に影響はみられないことなどからその可能性は低く,むしろ,TGFβ-Smad2/Smad3シグナルの下流の遺伝子発現を介した機構である可能性が考えられた.
4.Tmeff1はTGFβ-Smad2/Smad3シグナルの下流でBMPシグナルを阻害する
TGFβがBMPシグナルを阻害する分子機構を明らかにするため,TGFβシグナルが活性化している時期の毛包幹細胞をマウスの皮膚から単離し,マイクロアレイ法により遺伝子発現の状態を比較した.毛包幹細胞においてTGFβ受容体を欠損したマウスとのあいだで発現に差のみられた遺伝子には細胞内シグナル,細胞分化,細胞増殖にかかわるものがめだっていた.なかでも,BMPシグナルに対し抑制的にはたらくBambi遺伝子,Bmper遺伝子,Tmeff1遺伝子の発現がこの変異マウスで低下していることに着目した.初代培養細胞をTGFβにより刺激したのち,もっとも顕著かつ持続的に発現の上昇を示したのがTmeff1遺伝子9) であった.また,クロマチン免疫沈降実験の結果,Smad2あるいはSmad3がTmeff1遺伝子のプロモーター領域へTGFβシグナルに依存的に結合することが示された.さらに,Tmeff1がTGFβシグナルの生理的な下流タンパク質であることを強く示唆するデータとして,Tmeff1の生体における発現の時期と場所がリン酸化型Smad2と合致していること,外来性のTGFβ2の注射により毛包幹細胞においてTmeff1の発現が誘導されることがあげられた(図2).
つづいて,Tmeff1がBMPシグナルにあたえる影響についてBMPレポーター遺伝子を導入した細胞を用いて解析した.TGFβの存在下ではBMPシグナルの減弱がみられるが,shRNAを用いてTmeff1をノックダウンするとBMPシグナルは有意に回復した.また逆に,Tmeff1の過剰発現はBMPシグナルを強く阻害した.
最後に,毛包の再生過程でのTmeff1の重要性を確かめるため,in uteroレンチウイルス注入法によるin vivo発現抑制実験を行った10).妊娠9.5日のマウス胎仔が浮かぶ羊水に高力価のレンチウイルスを注射することで,Tmeff1 shRNAを表皮細胞に特異的に導入した.Tmeff1 shRNAを導入したマウスにおいてはTmeff1の発現抑制が確認された.さらに,マウスの体毛を刈り発毛の時期を調べるとTmeff1 shRNAを導入したマウスでは有意な遅れが観察された.以上の結果から,Tmeff1はTGFβ-Smad2/Smad3の下流でBMPシグナルの阻害し毛包の再生を促進しているものと考えられた(図2).
おわりに
今回,筆者らが見い出したTGFβの機能は,上皮系の細胞増殖に負にはたらくという既知の機能とは異なっていた.興味深いことに,同じ表皮に由来する細胞でも,毛包幹細胞とほかの細胞ではTGFβの効果が濃度に依存的に異なっていた.また,毛包幹細胞の休眠状態を維持するBMPシグナルの有無によりTGFβの効果は異なることを見い出した.これまでも,TGFβの効果は細胞の種類や組織内の環境により異なることが報告されているが,筆者らの結果は,毛包幹細胞に特有のシグナルがTGFβの多様な効果を生み出す一因となっていることを示唆しており,今後の研究でその詳細を明らかにしたい.さらに,この研究が明らかにしたような細胞内シグナルの相互作用を理解することは,がんを含めた幹細胞を標的とした治療や,人工的な組織構築,再生医学に重要な意味をもつものと考えている.
文 献
- Blanpain, C. & Fuchs, E.: Epidermal homeostasis: a balancing act of stem cells in the skin. Nat. Rev. Mol. Cell Biol., 10, 207-217 (2009)[PubMed]
- Plikus, M. V., Mayer, J. A., de la Cruz, D. et al.: Cyclic dermal BMP signalling regulates stem cell activation during hair regeneration. Nature, 451, 340-344 (2008)[PubMed]
- Hsu, Y. C., Pasolli, H. A. & Fuchs, E.: Dynamics between stem cells, niche, and progeny in the hair follicle. Cell, 144, 92-105 (2011)[PubMed]
- Cotsarelis, G., Sun, T. T. & Lavker, R. M.: Label-retaining cells reside in the bulge area of pilosebaceous unit: implications for follicular stem cells, hair cycle, and skin carcinogenesis. Cell, 61, 1329-1337 (1990)[PubMed]
- Greco, V., Chen, T., Rendl, M. et al.: A two-step mechanism for stem cell activation during hair regeneration. Cell Stem Cell, 4, 155-169 (2009)[PubMed]
- ten Dijke, P. & Arthur, H. M.: Extracellular control of TGFβ signalling in vascular development and disease. Nat. Rev. Mol. Cell Biol., 8, 857-869 (2007)[PubMed]
- Massague, J.: TGFβ in cancer. Cell, 134, 215-230 (2008)[PubMed]
- Foitzik, K., Paus, R., Doetschman, T. et al.: The TGF-β2 isoform is both a required and sufficient inducer of murine hair follicle morphogenesis. Dev. Biol., 212, 278-289 (1999)[PubMed]
- Chang, C., Eggen, B. J., Weinstein, D. C. et al.: Regulation of nodal and BMP signaling by tomoregulin-1 (X7365) through novel mechanisms. Dev. Biol., 255, 1-11 (2003)[PubMed]
- Beronja, S., Livshits, G., Williams, S. et al.: Rapid functional dissection of genetic networks via tissue-specific transduction and RNAi in mouse embryos. Nat. Med., 16, 821-827 (2010)[PubMed]
著者プロフィール
略歴:2008年 東京大学大学院理学系研究科 修了,同年より米国Rockefeller大学 博士研究員.
研究テーマ:がんを含めた組織の形態形成と幹細胞の制御.
抱負:体のなかで無数に起こる細胞間コミュニケーションを可視化し,その意味を理解したい.
Elaine Fuchs
米国Rockefeller大学 教授.
研究室URL:http://lab.rockefeller.edu/fuchs/
© 2012 押森直木・Elaine Fuchs Licensed under CC 表示 2.1 日本