Gタンパク質共役受容体Tre1からのシグナルによりショウジョウバエの神経幹細胞の分裂方向は制御される
吉浦茂樹・松崎文雄
(理化学研究所発生・再生科学総合研究センター 非対称細胞分裂研究グループ)
email:吉浦茂樹,松崎文雄
DOI: 10.7875/first.author.2012.009
Tre1 GPCR signaling orients stem cell divisions in the Drosophila central nervous system.
Shigeki Yoshiura, Nao Ohta, Fumio Matsuzaki
Developmental Cell, 22, 79-91 (2012)
幹細胞の分裂方向の制御は組織の極性や形態の形成に重要な役割をはたす.ショウジョウバエの神経幹細胞は上皮面に対し垂直な方向に非対称分裂を行うことにより上皮と反対側にニューロンを生み出す.この神経幹細胞の一定の方向への分裂により中枢神経組織の成長の方向は規定されているが,その分子機構についてはわかっていない.この論文において,筆者らは,Gタンパク質共役受容体であるTre1が上皮からのシグナルを伝達することにより神経幹細胞の細胞極性の方向を決定し,神経幹細胞の非対称分裂の方向を制御していることを明らかにした.また,Tre1はGタンパク質αサブユニットであるGoαを活性化することで極性タンパク質のひとつであるPinsを神経幹細胞の頂端側にリクルートし,これによりPar複合体の局在の場所を規定することで細胞極性の方向を制御していることを明らかにした.Par複合体はさまざまな細胞において細胞極性を制御していることから,このGタンパク質共役受容体-Pinsシグナルが幹細胞の分裂方向の制御をつうじ,さまざまな組織の極性や形態の形成に重要な役割をはたしているものと考えられる.
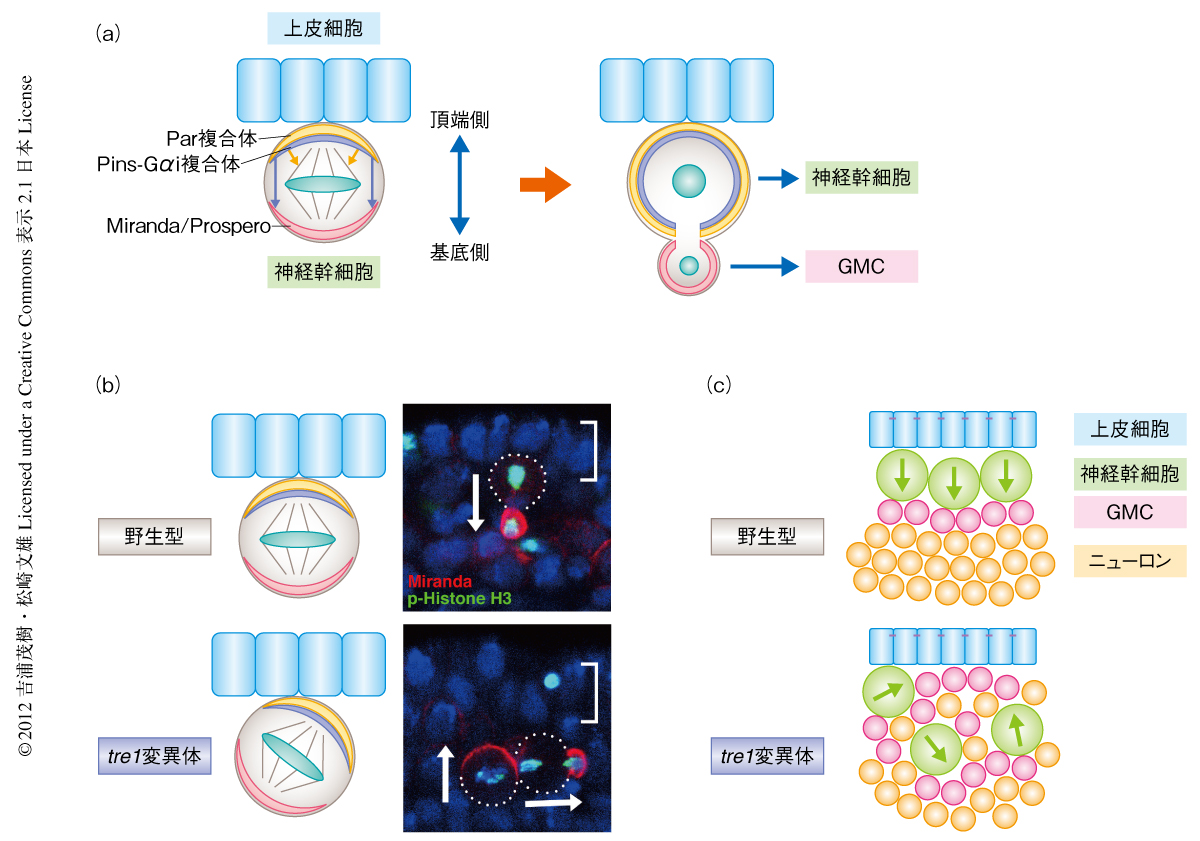
個体の発生において,細胞の分裂や移動,組織の再構築など,細胞のさまざまな挙動が組織の形成に重要な役割をはたす.そして,これら分裂や移動の方向の制御により組織の成長の方向や形態が規定されている.組織幹細胞は組織の形成において細胞の供給源として機能し,その分裂方向の制御により組織の極性や形態の形成が制御されている1,2).ショウジョウバエの神経幹細胞は個体では上皮層のすぐ内側に位置し,非対称分裂により娘細胞である神経幹細胞と,より分化した娘細胞であるGMC(ganglion mother cell)を生み出す(図1a).GMCはいちどだけ分裂することで1組のニューロンを生み出す.神経幹細胞の非対称分裂は神経幹細胞の頂端側に局在する極性タンパク質複合体(Par複合体,および,Pins-Gαi複合体)により制御されている3,4).Par複合体は細胞運命決定タンパク質であるProsperoやそのアダプタータンパク質であるMirandaなどを神経幹細胞の基底側に局在させ,Pins-Gαi複合体はこのPar複合体の極性にそって紡錘体を配向させる.これにより細胞運命決定タンパク質は基底側の娘細胞だけに受け継がれ,この娘細胞は分化してGMCになる.この神経幹細胞の非対称分裂の方向は細胞内での極性タンパク質複合体(Par複合体,あるいは,Pins-Gαi複合体)の局在の場所により決定されるが,その方向は周囲の組織に対し厳密に規定されている.神経幹細胞の細胞極性は必ず上皮面に対し垂直な方向にそって形成され,これにより神経幹細胞は上皮面に対し垂直に分裂し,上皮面とは反対側にGMCを生み出す.この神経幹細胞の一定の方向への分裂により中枢神経系の成長の方向が規定されているものと考えられる.
過去の研究から,ショウジョウバエの神経幹細胞の極性の方向は上皮細胞との相互作用により細胞非自律的に規定されていることが示唆されている5).神経幹細胞を分散培養したとき,神経幹細胞が上皮細胞と接している場合には神経幹細胞はその上皮細胞に対し垂直な分裂をくり返すのに対し,上皮細胞から離れた場合には神経幹細胞の分裂方向はランダムになる.このとき,どちらの場合においても神経幹細胞の極性の形成は正常に起こる.このことから,神経幹細胞の極性は細胞自律的に形成されるが,その方向は上皮との相互作用により細胞非自律的に決定されることが示唆された.しかしながら,その分子機構については不明なままであった.筆者らは,この上皮による細胞非自律的な神経幹細胞の極性方向の制御の分子機構に関して解析を行い,その結果,上皮からのシグナルによりGタンパク質共役受容体であるTre1が活性化し,活性化型となったTre1がGタンパク質αサブユニットであるGoαの活性化をつうじて極性タンパク質複合体のひとつであるPinsを神経幹細胞の頂端側へとリクルートすることにより神経幹細胞の極性の方向が決定されていることを明らかにした.
まず,この細胞非自律的な神経幹細胞の極性方向の制御機構を調べるため,ショウジョウバエの遺伝子欠損系統を用いて神経幹細胞に発現する膜貫通型タンパク質に対するスクリーニングを行った.その結果,tre1遺伝子が候補として得られた.tre1遺伝子はGタンパク質共役受容体をコードしており,ショウジョウバエの胚の中枢神経系で発現していることが知られていた6).Tre1が神経幹細胞の極性方向の制御においてはたす役割を調べるため,tre1変異体を作製し以降の実験に用いた.
さきに述べたように,野生型のショウジョウバエの胚においては神経幹細胞の極性の方向は上皮面に対し必ず垂直に形成されるのに対し,tre1変異体の胚ではこの神経幹細胞の極性方向が異常になることが認められた(図1b).このとき,tre1変異体において神経幹細胞の極性の形成には影響がみられなかったことから,Tre1は上皮からのシグナルに応答して神経幹細胞の極性の方向を規定する新たな分子機構に関与していることが考えられた.また,この表現型が神経系に限局したTre1の発現によりレスキューされることや,Tre1の発現が神経幹細胞にほぼ限局し,神経幹細胞の細胞膜の全周にわたり局在していることから,Tre1は神経幹細胞において細胞自律的に機能していることが示唆された.これらのことから,Tre1が上皮からのシグナルの受容体として機能し,神経幹細胞の極性方向を規定するシグナルを伝達していることが考えられた.
つぎに,ショウジョウバエの神経幹細胞の極性方向の異常が中枢神経系の形態形成にどのような影響を及ぼすのかという点につき解析を行った.野生型のショウジョウバエの胚では神経幹細胞が上皮面に対し必ず垂直に分裂することにより,その娘細胞であるGMCは必ず上皮と反対側に生み出される.このGMCが分裂しニューロンを生み出すことにより,胚の表面から順に,表皮層,神経幹細胞層,GMC層,ニューロン層というように,中枢神経系に層構造を形成することが可能になっている(図1c).tre1変異体においては,神経幹細胞の極性方向の異常によりGMCが異所的に産生され,その娘細胞であるニューロンの産生場所も異常となった.これにより中枢神経系の層構造が形成されず,それぞれの細胞が入り交じった状態になることが明らかになった(図1c).
このニューロンの異所的な産生の影響についてさらに解析を行ったところ,驚くべきことに,発生段階が進むとtre1変異体においてもニューロンの位置が正常にもどっていることが明らかになった.このことから,中枢神経系の発生段階の後期において,ニューロンの位置を補正するなんらかの分子機構の存在が示唆された.このニューロンの位置を補正する分子機構についてさらに解析を行ったところ,tre1変異体においてグリア細胞の機能を欠失させた場合,ニューロンの位置が異常なままであることが明らかになった.野生型の胚においてグリア細胞の機能を欠失させただけではニューロンは正常な位置に配置されることから,Tre1によるニューロンの適切な場所への産生と,そののちのニューロンとグリア細胞とのあいだの相互作用とが,相補的にニューロンの位置を規定し中枢神経系の形態形成の堅牢性を保障しているものと考えられた.
つぎに,Tre1の下流タンパク質の探索を行った.Gタンパク質共役受容体は一般的に三量体Gタンパク質を下流にもつことが知られているので,ショウジョウバエのゲノムにコードされている6つのGタンパク質αサブユニットとTre1との物理的な相互作用をショウジョウバエの培養細胞であるS2細胞を用いて調べた.その結果,Goαが選択的にTre1と相互作用することが明らかになった.Goαは神経幹細胞に発現し,Tre1と同様に,神経幹細胞の細胞膜の全周にわたり局在していることが知られていた.この結果から,Tre1がGoαを活性化することにより上皮からのシグナルを伝達している可能性が考えられた.
そこで,Goαの活性化が神経幹細胞の極性方向の制御においてはたす機能を解析するため,百日咳毒素によるGoαの活性化阻害実験を試みた.百日咳毒素はGタンパク質共役受容体に依存的なGタンパク質αサブユニットの活性化を阻害でき,そのショウジョウバエにおける基質はGoαだけである7).そのため,百日咳毒素をショウジョウバエの胚に発現させることによりGoαの活性化を特異的に阻害することが可能になる.百日咳毒素をショウジョウバエの胚の中枢神経系に発現させGoαの神経幹細胞における活性化を阻害したところ,tre1変異体と同様の表現型がみられることが明らかになった.このことから,神経幹細胞でのGoαの活性化が神経幹細胞の極性方向の制御に必要であることが明らかになった.この結果と,Tre1とGoαとが直接に相互作用できることから,Tre1がGoαの活性化をつうじてシグナルを伝達し,神経幹細胞の極性の方向を制御していることが示唆された.
さらに,Tre1-Goαシグナルがどのようにして極性タンパク質を神経幹細胞の頂端側にリクルートしているのか解析を進めた.極性タンパク質のひとつであるPinsはin vitroではGoαと直接に相互作用できることが知られていたが,その生理的な意味は不明だった8).そこで,この相互作用がTre1-Goαシグナルに関与しているのかどうか調べるため,Tre1がGoαをつうじてPinsをリクルートできるかどうか検証した.S2細胞を用いた誘導極性アッセイ9) の結果,Tre1-GoαシグナルはPinsをリクルートすることができ,この相互作用はGoαに依存的であることがわかった.このことから,Tre1-Goα-Pinsの三者による複合体の形成が可能であること,および,この複合体の形成がGoαに依存的であることが示唆された.
また,in vivoにおいてもGoαとPinsとの相互作用がみられることをショウジョウバエの胚を用いた共免疫沈降の実験により示した.さらに,tre1変異体の胚を用いた共免疫沈降ではこのGoαとPinsとの相互作用がみられなくなることから,in vivoにおいてはGoαとPinsとの相互作用はTre1に依存することが明らかになった.
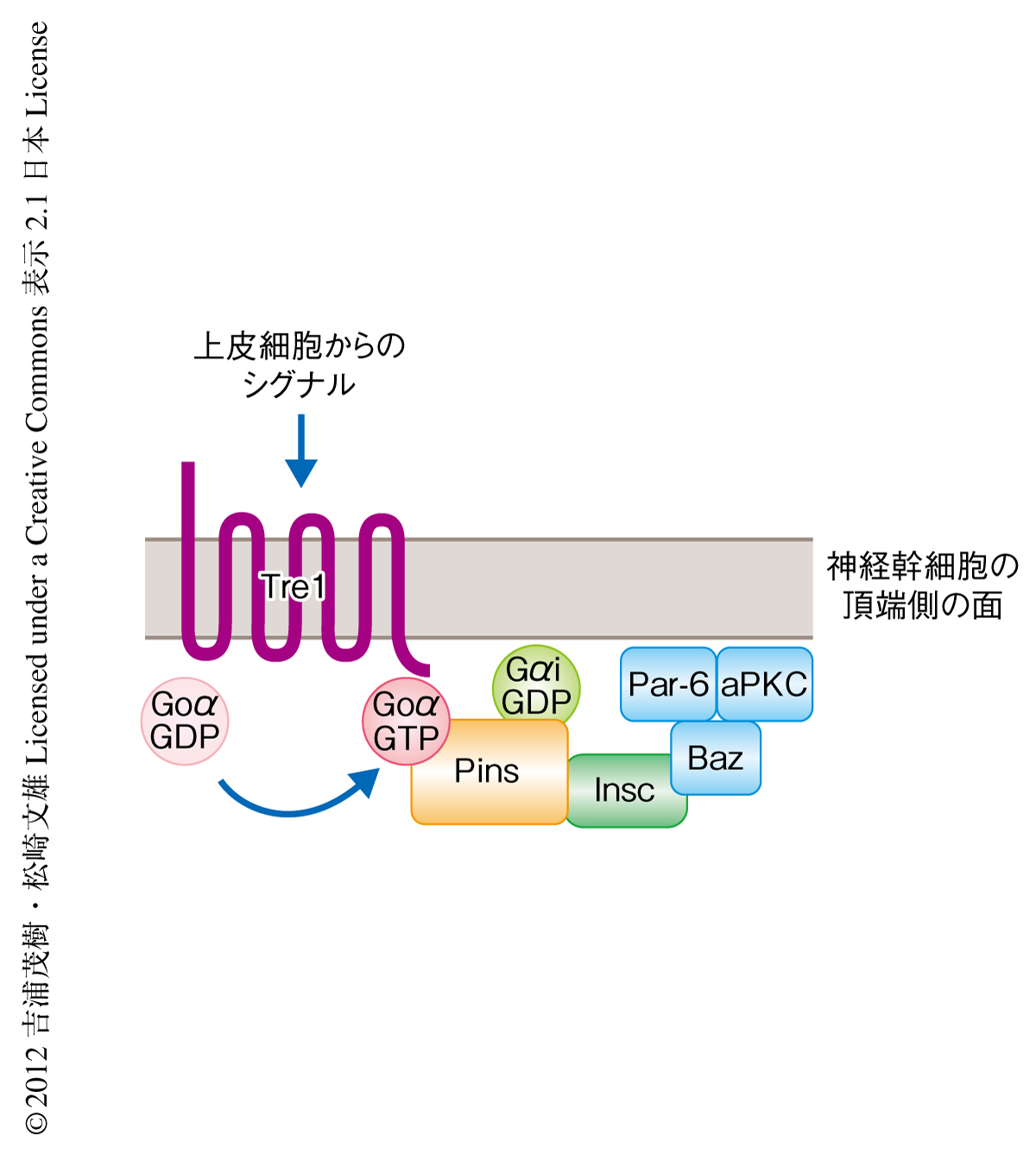
これらの結果,および,Tre1がGoαの活性化をつうじてシグナルを伝達していると考えられることから,Tre1が上皮からのシグナルをうけてGoαを活性化することによりGoαがPinsと相互作用することが可能になり,その結果,Tre1-Goα-Pins三者複合体が神経幹細胞の頂端側で形成され,これにより神経幹細胞の極性方向が決定されているのではないかと考えられた(図2).
この論文において,筆者らは,Gタンパク質共役受容体であるTre1が上皮からのシグナルを受け取ることによりGタンパク質αサブユニットであるGoαを活性化し,活性化したGoαがPinsをリクルートすることで極性タンパク質複合体の局在の場所を規定することにより神経幹細胞の非対称分裂の方向を制御していることを明らかにした.神経幹細胞の極性の形成をつかさどるPar複合体は幹細胞やニューロンなどさまざまな細胞の極性の形成に重要な役割をはたしていることから10),この論文で明らかになったGタンパク質共役受容体-Pinsシグナルがさまざまな組織においてその極性や成長の方向を制御しているのではないかと考えられる.
略歴:2007年 京都大学大学院生命科学研究科博士後期課程 修了,同年より理化学研究所発生・再生科学総合研究センター 研究員.
松崎 文雄(Fumio Matsuzaki)
理化学研究所発生・再生科学総合研究センター グループディレクター.
研究室URL:http://www.cdb.riken.jp/cas/
© 2012 吉浦茂樹・松崎文雄 Licensed under CC 表示 2.1 日本
(理化学研究所発生・再生科学総合研究センター 非対称細胞分裂研究グループ)
email:吉浦茂樹,松崎文雄
DOI: 10.7875/first.author.2012.009
Tre1 GPCR signaling orients stem cell divisions in the Drosophila central nervous system.
Shigeki Yoshiura, Nao Ohta, Fumio Matsuzaki
Developmental Cell, 22, 79-91 (2012)
要 約
幹細胞の分裂方向の制御は組織の極性や形態の形成に重要な役割をはたす.ショウジョウバエの神経幹細胞は上皮面に対し垂直な方向に非対称分裂を行うことにより上皮と反対側にニューロンを生み出す.この神経幹細胞の一定の方向への分裂により中枢神経組織の成長の方向は規定されているが,その分子機構についてはわかっていない.この論文において,筆者らは,Gタンパク質共役受容体であるTre1が上皮からのシグナルを伝達することにより神経幹細胞の細胞極性の方向を決定し,神経幹細胞の非対称分裂の方向を制御していることを明らかにした.また,Tre1はGタンパク質αサブユニットであるGoαを活性化することで極性タンパク質のひとつであるPinsを神経幹細胞の頂端側にリクルートし,これによりPar複合体の局在の場所を規定することで細胞極性の方向を制御していることを明らかにした.Par複合体はさまざまな細胞において細胞極性を制御していることから,このGタンパク質共役受容体-Pinsシグナルが幹細胞の分裂方向の制御をつうじ,さまざまな組織の極性や形態の形成に重要な役割をはたしているものと考えられる.
はじめに
個体の発生において,細胞の分裂や移動,組織の再構築など,細胞のさまざまな挙動が組織の形成に重要な役割をはたす.そして,これら分裂や移動の方向の制御により組織の成長の方向や形態が規定されている.組織幹細胞は組織の形成において細胞の供給源として機能し,その分裂方向の制御により組織の極性や形態の形成が制御されている1,2).ショウジョウバエの神経幹細胞は個体では上皮層のすぐ内側に位置し,非対称分裂により娘細胞である神経幹細胞と,より分化した娘細胞であるGMC(ganglion mother cell)を生み出す(図1a).GMCはいちどだけ分裂することで1組のニューロンを生み出す.神経幹細胞の非対称分裂は神経幹細胞の頂端側に局在する極性タンパク質複合体(Par複合体,および,Pins-Gαi複合体)により制御されている3,4).Par複合体は細胞運命決定タンパク質であるProsperoやそのアダプタータンパク質であるMirandaなどを神経幹細胞の基底側に局在させ,Pins-Gαi複合体はこのPar複合体の極性にそって紡錘体を配向させる.これにより細胞運命決定タンパク質は基底側の娘細胞だけに受け継がれ,この娘細胞は分化してGMCになる.この神経幹細胞の非対称分裂の方向は細胞内での極性タンパク質複合体(Par複合体,あるいは,Pins-Gαi複合体)の局在の場所により決定されるが,その方向は周囲の組織に対し厳密に規定されている.神経幹細胞の細胞極性は必ず上皮面に対し垂直な方向にそって形成され,これにより神経幹細胞は上皮面に対し垂直に分裂し,上皮面とは反対側にGMCを生み出す.この神経幹細胞の一定の方向への分裂により中枢神経系の成長の方向が規定されているものと考えられる.
過去の研究から,ショウジョウバエの神経幹細胞の極性の方向は上皮細胞との相互作用により細胞非自律的に規定されていることが示唆されている5).神経幹細胞を分散培養したとき,神経幹細胞が上皮細胞と接している場合には神経幹細胞はその上皮細胞に対し垂直な分裂をくり返すのに対し,上皮細胞から離れた場合には神経幹細胞の分裂方向はランダムになる.このとき,どちらの場合においても神経幹細胞の極性の形成は正常に起こる.このことから,神経幹細胞の極性は細胞自律的に形成されるが,その方向は上皮との相互作用により細胞非自律的に決定されることが示唆された.しかしながら,その分子機構については不明なままであった.筆者らは,この上皮による細胞非自律的な神経幹細胞の極性方向の制御の分子機構に関して解析を行い,その結果,上皮からのシグナルによりGタンパク質共役受容体であるTre1が活性化し,活性化型となったTre1がGタンパク質αサブユニットであるGoαの活性化をつうじて極性タンパク質複合体のひとつであるPinsを神経幹細胞の頂端側へとリクルートすることにより神経幹細胞の極性の方向が決定されていることを明らかにした.
1.tre1変異体では神経幹細胞の極性の方向が異常になる
まず,この細胞非自律的な神経幹細胞の極性方向の制御機構を調べるため,ショウジョウバエの遺伝子欠損系統を用いて神経幹細胞に発現する膜貫通型タンパク質に対するスクリーニングを行った.その結果,tre1遺伝子が候補として得られた.tre1遺伝子はGタンパク質共役受容体をコードしており,ショウジョウバエの胚の中枢神経系で発現していることが知られていた6).Tre1が神経幹細胞の極性方向の制御においてはたす役割を調べるため,tre1変異体を作製し以降の実験に用いた.
さきに述べたように,野生型のショウジョウバエの胚においては神経幹細胞の極性の方向は上皮面に対し必ず垂直に形成されるのに対し,tre1変異体の胚ではこの神経幹細胞の極性方向が異常になることが認められた(図1b).このとき,tre1変異体において神経幹細胞の極性の形成には影響がみられなかったことから,Tre1は上皮からのシグナルに応答して神経幹細胞の極性の方向を規定する新たな分子機構に関与していることが考えられた.また,この表現型が神経系に限局したTre1の発現によりレスキューされることや,Tre1の発現が神経幹細胞にほぼ限局し,神経幹細胞の細胞膜の全周にわたり局在していることから,Tre1は神経幹細胞において細胞自律的に機能していることが示唆された.これらのことから,Tre1が上皮からのシグナルの受容体として機能し,神経幹細胞の極性方向を規定するシグナルを伝達していることが考えられた.
2.ニューロンの産生場所の異常はニューロンとグリア細胞との相互作用により補償される
つぎに,ショウジョウバエの神経幹細胞の極性方向の異常が中枢神経系の形態形成にどのような影響を及ぼすのかという点につき解析を行った.野生型のショウジョウバエの胚では神経幹細胞が上皮面に対し必ず垂直に分裂することにより,その娘細胞であるGMCは必ず上皮と反対側に生み出される.このGMCが分裂しニューロンを生み出すことにより,胚の表面から順に,表皮層,神経幹細胞層,GMC層,ニューロン層というように,中枢神経系に層構造を形成することが可能になっている(図1c).tre1変異体においては,神経幹細胞の極性方向の異常によりGMCが異所的に産生され,その娘細胞であるニューロンの産生場所も異常となった.これにより中枢神経系の層構造が形成されず,それぞれの細胞が入り交じった状態になることが明らかになった(図1c).
このニューロンの異所的な産生の影響についてさらに解析を行ったところ,驚くべきことに,発生段階が進むとtre1変異体においてもニューロンの位置が正常にもどっていることが明らかになった.このことから,中枢神経系の発生段階の後期において,ニューロンの位置を補正するなんらかの分子機構の存在が示唆された.このニューロンの位置を補正する分子機構についてさらに解析を行ったところ,tre1変異体においてグリア細胞の機能を欠失させた場合,ニューロンの位置が異常なままであることが明らかになった.野生型の胚においてグリア細胞の機能を欠失させただけではニューロンは正常な位置に配置されることから,Tre1によるニューロンの適切な場所への産生と,そののちのニューロンとグリア細胞とのあいだの相互作用とが,相補的にニューロンの位置を規定し中枢神経系の形態形成の堅牢性を保障しているものと考えられた.
3.Tre1はGoαの活性化をつうじてシグナルを伝達する
つぎに,Tre1の下流タンパク質の探索を行った.Gタンパク質共役受容体は一般的に三量体Gタンパク質を下流にもつことが知られているので,ショウジョウバエのゲノムにコードされている6つのGタンパク質αサブユニットとTre1との物理的な相互作用をショウジョウバエの培養細胞であるS2細胞を用いて調べた.その結果,Goαが選択的にTre1と相互作用することが明らかになった.Goαは神経幹細胞に発現し,Tre1と同様に,神経幹細胞の細胞膜の全周にわたり局在していることが知られていた.この結果から,Tre1がGoαを活性化することにより上皮からのシグナルを伝達している可能性が考えられた.
そこで,Goαの活性化が神経幹細胞の極性方向の制御においてはたす機能を解析するため,百日咳毒素によるGoαの活性化阻害実験を試みた.百日咳毒素はGタンパク質共役受容体に依存的なGタンパク質αサブユニットの活性化を阻害でき,そのショウジョウバエにおける基質はGoαだけである7).そのため,百日咳毒素をショウジョウバエの胚に発現させることによりGoαの活性化を特異的に阻害することが可能になる.百日咳毒素をショウジョウバエの胚の中枢神経系に発現させGoαの神経幹細胞における活性化を阻害したところ,tre1変異体と同様の表現型がみられることが明らかになった.このことから,神経幹細胞でのGoαの活性化が神経幹細胞の極性方向の制御に必要であることが明らかになった.この結果と,Tre1とGoαとが直接に相互作用できることから,Tre1がGoαの活性化をつうじてシグナルを伝達し,神経幹細胞の極性の方向を制御していることが示唆された.
4.Tre1-GoαシグナルはGoαの活性化に依存的にPinsをリクルートする
さらに,Tre1-Goαシグナルがどのようにして極性タンパク質を神経幹細胞の頂端側にリクルートしているのか解析を進めた.極性タンパク質のひとつであるPinsはin vitroではGoαと直接に相互作用できることが知られていたが,その生理的な意味は不明だった8).そこで,この相互作用がTre1-Goαシグナルに関与しているのかどうか調べるため,Tre1がGoαをつうじてPinsをリクルートできるかどうか検証した.S2細胞を用いた誘導極性アッセイ9) の結果,Tre1-GoαシグナルはPinsをリクルートすることができ,この相互作用はGoαに依存的であることがわかった.このことから,Tre1-Goα-Pinsの三者による複合体の形成が可能であること,および,この複合体の形成がGoαに依存的であることが示唆された.
また,in vivoにおいてもGoαとPinsとの相互作用がみられることをショウジョウバエの胚を用いた共免疫沈降の実験により示した.さらに,tre1変異体の胚を用いた共免疫沈降ではこのGoαとPinsとの相互作用がみられなくなることから,in vivoにおいてはGoαとPinsとの相互作用はTre1に依存することが明らかになった.
これらの結果,および,Tre1がGoαの活性化をつうじてシグナルを伝達していると考えられることから,Tre1が上皮からのシグナルをうけてGoαを活性化することによりGoαがPinsと相互作用することが可能になり,その結果,Tre1-Goα-Pins三者複合体が神経幹細胞の頂端側で形成され,これにより神経幹細胞の極性方向が決定されているのではないかと考えられた(図2).
おわりに
この論文において,筆者らは,Gタンパク質共役受容体であるTre1が上皮からのシグナルを受け取ることによりGタンパク質αサブユニットであるGoαを活性化し,活性化したGoαがPinsをリクルートすることで極性タンパク質複合体の局在の場所を規定することにより神経幹細胞の非対称分裂の方向を制御していることを明らかにした.神経幹細胞の極性の形成をつかさどるPar複合体は幹細胞やニューロンなどさまざまな細胞の極性の形成に重要な役割をはたしていることから10),この論文で明らかになったGタンパク質共役受容体-Pinsシグナルがさまざまな組織においてその極性や成長の方向を制御しているのではないかと考えられる.
文 献
- Baena-Lopez, L. A., Baonza, A. & Garcia-Bellido, A.: The orientation of cell divisions determines the shape of Drosophila organs. Curr. Biol., 15, 1640-1644 (2005)[PubMed]
- Yamashita, Y. M., Jones, D. L. & Fuller, M. T.: Orientation of asymmetric cell division by the APC tumor suppresser and centrosome. Science, 301, 1547-1550 (2003)[PubMed]
- Knoblich, J. A.: Mechanisms of asymmetric stem cell division. Cell, 132, 583-597 (2008)[PubMed]
- Yu, F., Kuo, C. T. & Jan, Y. N.: Drosophila neuroblast asymmetric cell division: recent advances and implications for stem cell biology. Neuron, 51, 13-20 (2006)[PubMed]
- Siegrist, S. E. & Doe, C. Q.: Extrinsic cues orient the cell division axis in Drosophila embryonic neuroblasts. Development, 133, 529-536 (2006)[PubMed]
- Kunwar, P. S., Starz-Gaiano, M., Bainton, R. J. et al.: Tre1, a G protein-coupled receptor, directs transepithelial migration of Drosophila germ cells. PLoS Biol., 1, E80 (2003)[PubMed]
- Guillen, A., Jallon, J. M., Fehrentz, J. A. et al.: A Go-like protein in Drosophila melanogaster and its expression in memory mutants. EMBO J., 9, 1449-1455 (1990)[PubMed]
- Kopein, D. & Katanaev, V. L.: Drosophila GoLoco-protein Pins is a target of Gαo-mediated G-protein-coupled receptor signaling. Mol. Biol. Cell, 20, 3865-3877 (2009)[PubMed]
- Johnston, C. A., Hirono, K., Prehoda, K. E. et al.: Identification of an Aurora-A/PinsLINKER/Dlg spindle orientation pathway using induced cell polarity in S2 cells. Cell, 138, 1150-1163 (2009)[PubMed]
- Suzuki, A. & Ohno, S.: The PAR-aPKC system: lessons in polarity. J. Cell Sci., 119, 979-987 (2006)[PubMed]
著者プロフィール
略歴:2007年 京都大学大学院生命科学研究科博士後期課程 修了,同年より理化学研究所発生・再生科学総合研究センター 研究員.
松崎 文雄(Fumio Matsuzaki)
理化学研究所発生・再生科学総合研究センター グループディレクター.
研究室URL:http://www.cdb.riken.jp/cas/
© 2012 吉浦茂樹・松崎文雄 Licensed under CC 表示 2.1 日本