細菌の異物排出輸送体の薬物結合構造からペリスタポンプ排出機構を解明
中島良介・山口明人
(大阪大学産業科学研究所 生体情報制御学研究分野)
email:山口明人
DOI: 10.7875/first.author.2012.006
Structures of the multidrug exporter AcrB reveal a proximal multisite drug-binding pocket.
Ryosuke Nakashima, Keisuke Sakurai, Seiji Yamasaki, Kunihiko Nishino, Akihito Yamaguchi
Nature, 480, 565-569 (2011)
大腸菌の主要な異物排出タンパク質であるAcrBと分子量の大きな薬物リファンピシンおよびエリスロマイシンとの結合型の分子構造を決定し,これまで知られていたマルチサイト結合ポケット以外に,もうひとつの近位ポケットがあることを発見した.そして,薬物が排出輸送体のなかを,入口→近位ポケット→遠位ポケット→出口,と順番に輸送されていくペリスタポンプ排出機構を解明した.近位ポケットおよび遠位ポケットはいずれも容量に余裕のあるマルチサイト結合ポケットであり,この2つのポケットの薬物結合スペクトルは異なるため,2つのポケットの存在は薬剤排出スペクトルの拡大に寄与していた.また,AcrBホモ三量体のそれぞれのモノマーのうち,これまでその役割のよくわかっていなかった待機モノマーは近位ポケットの活性化したものであることも明らかになった.
異物排出タンパク質は細胞レベルの生体防御システムであり,細菌からヒトまで,ほとんどすべての生物に備わっている1).異物排出タンパク質がなんらかの原因で高発現すると多剤耐性細菌や多剤耐性がん細胞が生じ,今日の化学療法に大きな困難をつくりだしている2-5).異物排出タンパク質は非常に広範囲の薬物や毒物を排出する能力がある.本来は特定できない異物をタンパク質がどうやって特異的に認識するのかということは,現代生物学の大きな謎のひとつである.高等生物による異物認識としてよく知られているのが免疫システムである.これは,遺伝子断片のシャッフルにより抗体の膨大なバリエーションをつくりだし,個々の抗体は特定の抗原に対して特異的だが抗体システム全体としては膨大な抗原を認識できるというもので,哺乳動物など一部の高等生物だけにかぎられた贅沢なシステムである.一方,異物排出タンパク質は単一のタンパク質により非常に多数の異物を認識できる.どうしてこのようなことが可能なのか,その秘密を探るため,筆者らは,グラム陰性細菌の主要な異物排出タンパク質であるAcrBの構造決定に取り組んだ.2002年,異物排出タンパク質の構造決定に世界ではじめて成功し細胞膜の“掃除機”であることを解明した6).2006年,ミノサイクリンやドキソルビシンなど小分子量の薬物との結合構造の決定に成功し多数の薬剤の認識がマルチサイト結合によるものであることを解明した7).そして今回,複数のマルチサイト結合ポケットが存在することを発見し,多数の薬剤の認識の構造的な基礎について理解を深めるとともに,薬物が複数のポケットを順送りされて輸送されるというペリスタポンプ排出機構を解明した.
AcrBホモ三量体のリファンピシン(分子量823)およびエリスロマイシン(分子量734)との結合構造(PDB ID:3AOA,3AOB,3AOC)は,ミノサイクリン(分子量457)あるいはドキソルビシン(分子量544)との結合構造と大きく異なってはいなかった.AcrBホモ三量体のそれぞれのモノマーの立体構造は互いに異なっており,待機モノマー,結合モノマー,排出モノマーと名づけたものと7),ほぼ同じ構造をとっていた.薬物はAcrBホモ三量体にひとつだけ結合していた.大きく異なっていたのは,薬物が結合しているのは結合モノマーではなく待機モノマーであることであった(図1).筆者らが以前に提出した機能的回転輸送機構によれば7),AcrBホモ三量体のモノマーは,待機モノマー→結合(inside open)モノマー→排出(outside open)モノマー,という構造変化をくり返すことにより薬物を輸送している.このモデルによるとするなら,待機モノマーに結合している薬物がつぎの結合モノマーでは消えているならその薬物は細胞外へと輸送されることは不可能なはずである.
ミノサイクリン結合部位およびドキソルビシン結合部位はAcrBモノマーのペリプラズムに突き出した頭部にあるフェニルアラニン残基に富む領域であったが,リファンピシン結合部位およびエリスロマイシン結合部位は同じ頭部でもそれより薬物の入口に近い部位であったので,新しく発見されたこの結合部位を近位(proximal)ポケット,従来の部位を遠位(distal)ポケットと命名した.この2つのポケットはAcrBモノマーの分子内を頭部下側面の入口から頭頂部の出口まで貫通する分子内基質透過経路の中間に並んでおり,2つのポケットのあいだはPhe617を先端にもつ短いループ構造により仕切られていた.リファンピシンはループの近位ポケット側に収まっていたが,エリスロマイシンはループの下方に部分的に潜り込み遠位ポケット側に接近している位置にあった.そのため,エリスロマイシン結合構造ではループの下端が少しまくれあがっており,基質結合によるタンパク質の誘導適合(induced-fit)のあることを示していた.リファンピシン結合部位とエリスロマイシン結合部位は部分的に重複していたが薬物分子の大部分はタンパク質の異なる残基と相互作用するという典型的なマルチサイト結合であった.すなわち,AcrBモノマーは近位ポケットおよび遠位ポケットの2つのマルチサイト結合ポケットをもつことがわかった.一方のポケットに結合する薬物は他方のポケットには結合せず,これにより薬物結合スペクトルは大きく拡大していた.
待機モノマーに結合するリファンピシンと結合モノマーに結合するミノサイクリンは,同じAcrBホモ三量体のなかで同時に結合できることも構造決定により確かめられた.このことも,近位ポケットおよび遠位ポケットへの結合が拮抗的ではないことを証明していた.
今回,発見された近位ポケットが異物排出輸送の際に実際に機能していることを部位特異変異導入により確認した.まず,近位ポケットにありエリスロマイシンと相互作用しているSer134およびSer135をAlaに変異させると,発現株のエリスロマイシン耐性は失われるがドキソルビシン耐性は変化せず,ドキソルビシン排出輸送活性も正常であった.エリスロマイシンと直接には相互作用していないが大きな側鎖を導入するとエリスロマイシンとの結合を立体障害しそうなSer79,Thr91,Asp681などをそれぞれArgやTrpに変異させても,やはり同様に,ドキソルビシン排出輸送活性を変えることなくエリスロマイシン耐性が失われた.このことは,近位ポケットが実際にエリスロマイシン輸送に重要であることを証明していた.
エリスロマイシンはドキソルビシンとは異なる部位に結合するにもかかわらず,ドキソルビシンの排出輸送はエリスロマイシンにより拮抗阻害された.このことは,エリスロマイシンとドキソルビシンの輸送経路は共通であることを示していた.近位ポケットの変異体ではドキソルビシンの排出輸送はエリスロマイシンにより阻害されなくなっていた.
一方,遠位ポケットにあるPhe610およびPhe628をAlaに置換した場合は,ドキソルビシン排出輸送活性がほとんど失われるのは予想どおりであったが,エリスロマイシン耐性も大きく低下した.これは,遠位ポケットもエリスロマイシンの輸送経路としての役割をはたしていることを示すものと考えられた.
今回,決定した構造によれば,薬物の入口として予想される開口部は,頭部側面に2つと頭部中央にある空洞の3箇所があり,それらの開口部から分子内に伸びるチャネルは近位ポケットにおいて合流することがわかった.このうち,膜貫通部との境に開口したチャネル1,あるいは,頭部サブドメインの割れ目(クレフト)の下部に開口したチャネル2の入口付近の残基を大きな側鎖をもつものに置換すると,立体障害によりエリスロマイシン耐性およびドキソルビシン排出輸送活性がともに低下することがわかった.これは,薬物の取り入れには複数の入口がはたらいており,近位ポケットに結合する薬物と遠位ポケットに結合する薬物はともに同じ入口から取り入れられていることを示していた.
近位ポケットのみに結合し遠位ポケットには結合しないリファンピシンやエリスロマイシンはどうやって排出されているのであろうか.近位ポケットと遠位ポケットとを仕切るPhe617ループの下部にはこの2つのポケットをつなぐチャネルがあった.このチャネルは小分子量の薬物はなんとか通るが大分子量の薬物は通れない.Phe617ループは待機モノマーから結合モノマーへの変換の際に大きくスイングした.Phe617ループの根本にある4個のGlyのうち任意の2つをProに置換してスイングを止めると,エリスロマイシン耐性およびドキソルビシン輸送活性はともに消失した.これは大きな変異であったので,この変異によりAcrBホモ三量体の構造が大きく変化していないかどうか実際に結晶構造解析を行った.その結果,構造に大きな変化はなく,Pro変異体ではPhe617ループが待機モノマーの状態に近い位置で固定されていることがわかった.つまり,薬物の輸送にPhe617ループのスイングが決定的に重要な役割をはたしていた.in vivoでは,エリスロマイシンは待機モノマーの段階で近位ポケットに結合したのち,結合モノマーの段階への変換の途中で,Phe617ループのスイングを含む一連の構造変化により遠位ポケットのほうへ送り込まれると考えられた.Phe617ループのスイング自体がエリスロマイシンを移動させるのかどうかまではわからないが,少なくとも,エリスロマイシンの近位ポケットから遠位ポケットへの移動にはPhe617ループのスイングが必要であった.結晶は静止構造であるのでエリスロマイシンは遠位ポケットには到達できず,結晶中の結合モノマーにはエリスロマイシンがみつからないのだと考えられた.他方,ミノサイクリンやドキソルビシンのような小分子量の薬物は静止状態でもPhe617ループの下部のチャネルを通ることができるため,結晶構造において近位ポケットに結合した状態が同定できた.それでも,in vivoではミノサイクリンやドキソルビシンの遠位ポケットへの移行にPhe671ループのスイングは必要であった.
以上の考察から,エリスロマイシンやリファンピシンなどの大分子量の薬物は待機モノマーの段階でいったん近位ポケットに結合し,待機モノマーから結合モノマーへの変化のなかで遠位ポケットへと送り込まれ,最後に排出モノマーの段階で出口から排出されることがわかった.いったん遠位ポケットに送り込まれた大分子量の薬物はPhe617ループの下部を通って排出されることはできないので,閉鎖状態(occluded state)になっていて必ずしも遠位ポケットに特異的に結合している必要はない.他方,小分子量の薬物は遠位ポケットから近位ポケットへと戻ることができるので,排出されるためには遠位ポケットに特異的に結合し保持される必要がある.いい換えると,近位ポケットと遠位ポケットの薬物結合スペクトルは異なっている.このために,2つのマルチサイト結合ポケットは輸送経路に縦に配列しているにもかかわらず,基質輸送スペクトルの拡大に大きく貢献している.
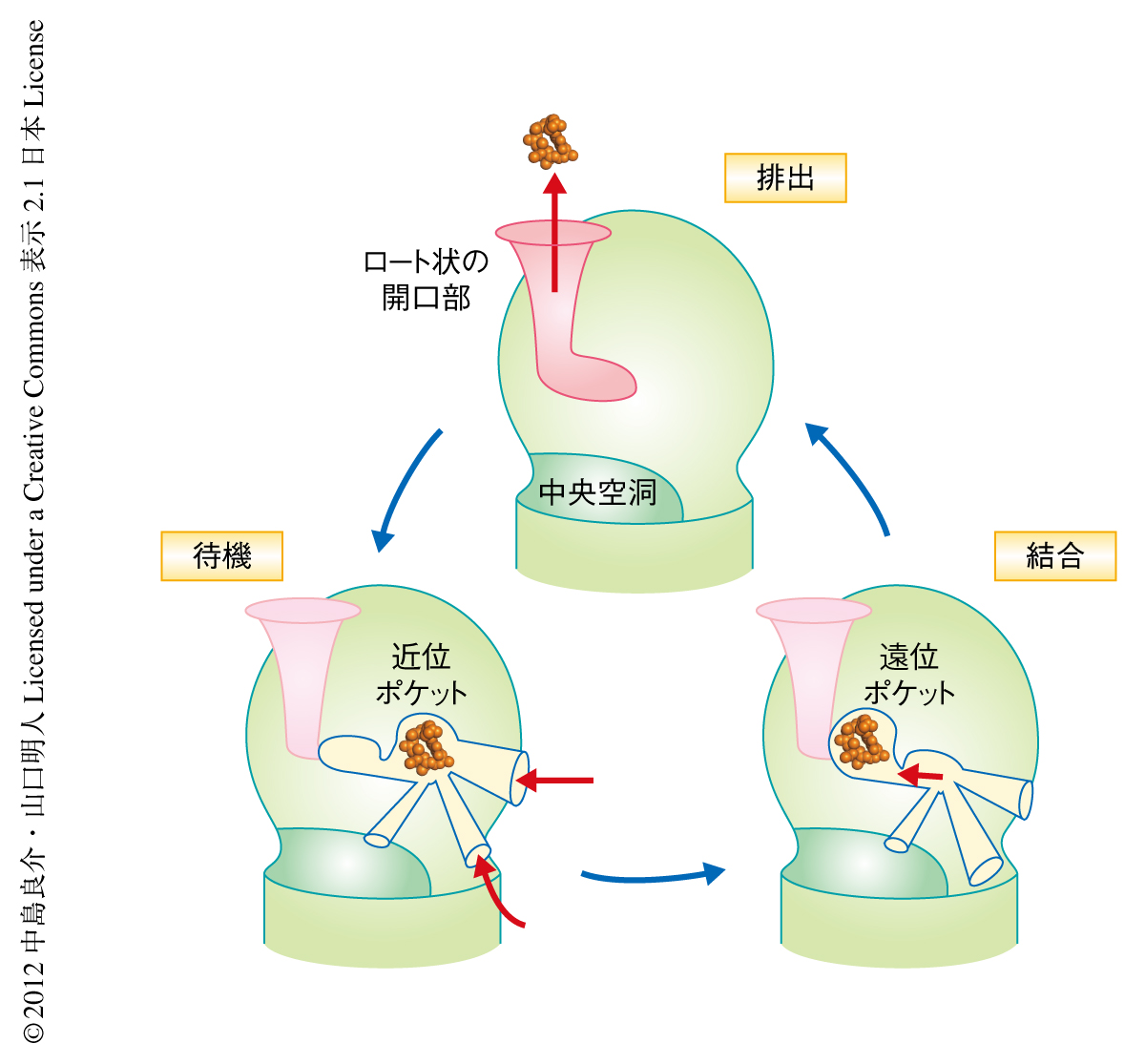
待機モノマーでは近位ポケットが,結合モノマーでは遠位ポケットが活性化しており,排出モノマーでは近位ポケットと遠位ポケットとも縮小して出口が開口する.これにより,近位ポケット(待機モノマー)→遠位ポケット(結合モノマー)→出口(排出モノマー),という薬物の順送り機構(ペリスタポンプ排出機構)が明らかになった(図2).
異物排出タンパク質はペリプラズム頭部と膜貫通部とのあいだの分子側面の開口部から基質を取り入れることにより,特定の輸送体により細胞に取り込まれる有用物質と脂質二重層をとおって侵入する異物とを区別している.さらに,タンパク質の内部の基質輸送経路の途中に複数の結合スペクトルの異なるマルチサイト結合ポケットをもつことにより,きわめて広い基質認識を可能にしている.この研究において,薬物は複数のポケットを順送りにより輸送されるというペリスタポンプ排出機構が明らかになった.薬物結合構造の全体像が明らかになったことにより,多剤耐性感染症を克服する多剤排出タンパク質阻害薬の構造にもとづく創薬も可能になった.
なお,筆者らがこれまでに提唱した機能的回転輸送機構,および,今回のペリスタポンプ排出機構は,基質を結合しないAcrB非対称ホモ三量体構造の解析により支持または示唆されているが8,9),AcrBホモ三量体と基質との結合構造に関しては,生理的には意味がないものと考えられる3回対称構造において報告があるものの10),in vivoでの構造を反映していると考えられる3回対称軸をもたない構造において薬物結合部位の特定に成功しているのは筆者らのグループ以外にはない.
大阪大学産業科学研究所 助教.
山口 明人(Akihito Yamaguchi)
略歴:1977年 東京大学大学院薬学系研究科博士課程 修了,同年 理化学研究所 流動研究員,1978年 千葉大学薬学部 助手(1980年~1981年 米国Yale大学 博士研究員),1983年 同 講師,1986年 同 助教授を経て,1996年より大阪大学産業科学研究所 教授.
関心事:異物排出タンパク質による異物認識排出機構の全貌を明らかにし,臨床的に有効な阻害薬を分子標的創薬すること.
研究室URL:http://www.sanken.osaka-u.ac.jp/labs/cmb/
© 2012 中島良介・山口明人 Licensed under CC 表示 2.1 日本
(大阪大学産業科学研究所 生体情報制御学研究分野)
email:山口明人
DOI: 10.7875/first.author.2012.006
Structures of the multidrug exporter AcrB reveal a proximal multisite drug-binding pocket.
Ryosuke Nakashima, Keisuke Sakurai, Seiji Yamasaki, Kunihiko Nishino, Akihito Yamaguchi
Nature, 480, 565-569 (2011)
要 約
大腸菌の主要な異物排出タンパク質であるAcrBと分子量の大きな薬物リファンピシンおよびエリスロマイシンとの結合型の分子構造を決定し,これまで知られていたマルチサイト結合ポケット以外に,もうひとつの近位ポケットがあることを発見した.そして,薬物が排出輸送体のなかを,入口→近位ポケット→遠位ポケット→出口,と順番に輸送されていくペリスタポンプ排出機構を解明した.近位ポケットおよび遠位ポケットはいずれも容量に余裕のあるマルチサイト結合ポケットであり,この2つのポケットの薬物結合スペクトルは異なるため,2つのポケットの存在は薬剤排出スペクトルの拡大に寄与していた.また,AcrBホモ三量体のそれぞれのモノマーのうち,これまでその役割のよくわかっていなかった待機モノマーは近位ポケットの活性化したものであることも明らかになった.
はじめに
異物排出タンパク質は細胞レベルの生体防御システムであり,細菌からヒトまで,ほとんどすべての生物に備わっている1).異物排出タンパク質がなんらかの原因で高発現すると多剤耐性細菌や多剤耐性がん細胞が生じ,今日の化学療法に大きな困難をつくりだしている2-5).異物排出タンパク質は非常に広範囲の薬物や毒物を排出する能力がある.本来は特定できない異物をタンパク質がどうやって特異的に認識するのかということは,現代生物学の大きな謎のひとつである.高等生物による異物認識としてよく知られているのが免疫システムである.これは,遺伝子断片のシャッフルにより抗体の膨大なバリエーションをつくりだし,個々の抗体は特定の抗原に対して特異的だが抗体システム全体としては膨大な抗原を認識できるというもので,哺乳動物など一部の高等生物だけにかぎられた贅沢なシステムである.一方,異物排出タンパク質は単一のタンパク質により非常に多数の異物を認識できる.どうしてこのようなことが可能なのか,その秘密を探るため,筆者らは,グラム陰性細菌の主要な異物排出タンパク質であるAcrBの構造決定に取り組んだ.2002年,異物排出タンパク質の構造決定に世界ではじめて成功し細胞膜の“掃除機”であることを解明した6).2006年,ミノサイクリンやドキソルビシンなど小分子量の薬物との結合構造の決定に成功し多数の薬剤の認識がマルチサイト結合によるものであることを解明した7).そして今回,複数のマルチサイト結合ポケットが存在することを発見し,多数の薬剤の認識の構造的な基礎について理解を深めるとともに,薬物が複数のポケットを順送りされて輸送されるというペリスタポンプ排出機構を解明した.
1.AcrBホモ三量体のリファンピシンおよびエリスロマイシンとの結合構造
AcrBホモ三量体のリファンピシン(分子量823)およびエリスロマイシン(分子量734)との結合構造(PDB ID:3AOA,3AOB,3AOC)は,ミノサイクリン(分子量457)あるいはドキソルビシン(分子量544)との結合構造と大きく異なってはいなかった.AcrBホモ三量体のそれぞれのモノマーの立体構造は互いに異なっており,待機モノマー,結合モノマー,排出モノマーと名づけたものと7),ほぼ同じ構造をとっていた.薬物はAcrBホモ三量体にひとつだけ結合していた.大きく異なっていたのは,薬物が結合しているのは結合モノマーではなく待機モノマーであることであった(図1).筆者らが以前に提出した機能的回転輸送機構によれば7),AcrBホモ三量体のモノマーは,待機モノマー→結合(inside open)モノマー→排出(outside open)モノマー,という構造変化をくり返すことにより薬物を輸送している.このモデルによるとするなら,待機モノマーに結合している薬物がつぎの結合モノマーでは消えているならその薬物は細胞外へと輸送されることは不可能なはずである.
ミノサイクリン結合部位およびドキソルビシン結合部位はAcrBモノマーのペリプラズムに突き出した頭部にあるフェニルアラニン残基に富む領域であったが,リファンピシン結合部位およびエリスロマイシン結合部位は同じ頭部でもそれより薬物の入口に近い部位であったので,新しく発見されたこの結合部位を近位(proximal)ポケット,従来の部位を遠位(distal)ポケットと命名した.この2つのポケットはAcrBモノマーの分子内を頭部下側面の入口から頭頂部の出口まで貫通する分子内基質透過経路の中間に並んでおり,2つのポケットのあいだはPhe617を先端にもつ短いループ構造により仕切られていた.リファンピシンはループの近位ポケット側に収まっていたが,エリスロマイシンはループの下方に部分的に潜り込み遠位ポケット側に接近している位置にあった.そのため,エリスロマイシン結合構造ではループの下端が少しまくれあがっており,基質結合によるタンパク質の誘導適合(induced-fit)のあることを示していた.リファンピシン結合部位とエリスロマイシン結合部位は部分的に重複していたが薬物分子の大部分はタンパク質の異なる残基と相互作用するという典型的なマルチサイト結合であった.すなわち,AcrBモノマーは近位ポケットおよび遠位ポケットの2つのマルチサイト結合ポケットをもつことがわかった.一方のポケットに結合する薬物は他方のポケットには結合せず,これにより薬物結合スペクトルは大きく拡大していた.
待機モノマーに結合するリファンピシンと結合モノマーに結合するミノサイクリンは,同じAcrBホモ三量体のなかで同時に結合できることも構造決定により確かめられた.このことも,近位ポケットおよび遠位ポケットへの結合が拮抗的ではないことを証明していた.
2.近位ポケットがin vivoにおいて実際に機能していることの証明
今回,発見された近位ポケットが異物排出輸送の際に実際に機能していることを部位特異変異導入により確認した.まず,近位ポケットにありエリスロマイシンと相互作用しているSer134およびSer135をAlaに変異させると,発現株のエリスロマイシン耐性は失われるがドキソルビシン耐性は変化せず,ドキソルビシン排出輸送活性も正常であった.エリスロマイシンと直接には相互作用していないが大きな側鎖を導入するとエリスロマイシンとの結合を立体障害しそうなSer79,Thr91,Asp681などをそれぞれArgやTrpに変異させても,やはり同様に,ドキソルビシン排出輸送活性を変えることなくエリスロマイシン耐性が失われた.このことは,近位ポケットが実際にエリスロマイシン輸送に重要であることを証明していた.
エリスロマイシンはドキソルビシンとは異なる部位に結合するにもかかわらず,ドキソルビシンの排出輸送はエリスロマイシンにより拮抗阻害された.このことは,エリスロマイシンとドキソルビシンの輸送経路は共通であることを示していた.近位ポケットの変異体ではドキソルビシンの排出輸送はエリスロマイシンにより阻害されなくなっていた.
一方,遠位ポケットにあるPhe610およびPhe628をAlaに置換した場合は,ドキソルビシン排出輸送活性がほとんど失われるのは予想どおりであったが,エリスロマイシン耐性も大きく低下した.これは,遠位ポケットもエリスロマイシンの輸送経路としての役割をはたしていることを示すものと考えられた.
今回,決定した構造によれば,薬物の入口として予想される開口部は,頭部側面に2つと頭部中央にある空洞の3箇所があり,それらの開口部から分子内に伸びるチャネルは近位ポケットにおいて合流することがわかった.このうち,膜貫通部との境に開口したチャネル1,あるいは,頭部サブドメインの割れ目(クレフト)の下部に開口したチャネル2の入口付近の残基を大きな側鎖をもつものに置換すると,立体障害によりエリスロマイシン耐性およびドキソルビシン排出輸送活性がともに低下することがわかった.これは,薬物の取り入れには複数の入口がはたらいており,近位ポケットに結合する薬物と遠位ポケットに結合する薬物はともに同じ入口から取り入れられていることを示していた.
3.ペリスタポンプ排出機構
近位ポケットのみに結合し遠位ポケットには結合しないリファンピシンやエリスロマイシンはどうやって排出されているのであろうか.近位ポケットと遠位ポケットとを仕切るPhe617ループの下部にはこの2つのポケットをつなぐチャネルがあった.このチャネルは小分子量の薬物はなんとか通るが大分子量の薬物は通れない.Phe617ループは待機モノマーから結合モノマーへの変換の際に大きくスイングした.Phe617ループの根本にある4個のGlyのうち任意の2つをProに置換してスイングを止めると,エリスロマイシン耐性およびドキソルビシン輸送活性はともに消失した.これは大きな変異であったので,この変異によりAcrBホモ三量体の構造が大きく変化していないかどうか実際に結晶構造解析を行った.その結果,構造に大きな変化はなく,Pro変異体ではPhe617ループが待機モノマーの状態に近い位置で固定されていることがわかった.つまり,薬物の輸送にPhe617ループのスイングが決定的に重要な役割をはたしていた.in vivoでは,エリスロマイシンは待機モノマーの段階で近位ポケットに結合したのち,結合モノマーの段階への変換の途中で,Phe617ループのスイングを含む一連の構造変化により遠位ポケットのほうへ送り込まれると考えられた.Phe617ループのスイング自体がエリスロマイシンを移動させるのかどうかまではわからないが,少なくとも,エリスロマイシンの近位ポケットから遠位ポケットへの移動にはPhe617ループのスイングが必要であった.結晶は静止構造であるのでエリスロマイシンは遠位ポケットには到達できず,結晶中の結合モノマーにはエリスロマイシンがみつからないのだと考えられた.他方,ミノサイクリンやドキソルビシンのような小分子量の薬物は静止状態でもPhe617ループの下部のチャネルを通ることができるため,結晶構造において近位ポケットに結合した状態が同定できた.それでも,in vivoではミノサイクリンやドキソルビシンの遠位ポケットへの移行にPhe671ループのスイングは必要であった.
以上の考察から,エリスロマイシンやリファンピシンなどの大分子量の薬物は待機モノマーの段階でいったん近位ポケットに結合し,待機モノマーから結合モノマーへの変化のなかで遠位ポケットへと送り込まれ,最後に排出モノマーの段階で出口から排出されることがわかった.いったん遠位ポケットに送り込まれた大分子量の薬物はPhe617ループの下部を通って排出されることはできないので,閉鎖状態(occluded state)になっていて必ずしも遠位ポケットに特異的に結合している必要はない.他方,小分子量の薬物は遠位ポケットから近位ポケットへと戻ることができるので,排出されるためには遠位ポケットに特異的に結合し保持される必要がある.いい換えると,近位ポケットと遠位ポケットの薬物結合スペクトルは異なっている.このために,2つのマルチサイト結合ポケットは輸送経路に縦に配列しているにもかかわらず,基質輸送スペクトルの拡大に大きく貢献している.
待機モノマーでは近位ポケットが,結合モノマーでは遠位ポケットが活性化しており,排出モノマーでは近位ポケットと遠位ポケットとも縮小して出口が開口する.これにより,近位ポケット(待機モノマー)→遠位ポケット(結合モノマー)→出口(排出モノマー),という薬物の順送り機構(ペリスタポンプ排出機構)が明らかになった(図2).
おわりに
異物排出タンパク質はペリプラズム頭部と膜貫通部とのあいだの分子側面の開口部から基質を取り入れることにより,特定の輸送体により細胞に取り込まれる有用物質と脂質二重層をとおって侵入する異物とを区別している.さらに,タンパク質の内部の基質輸送経路の途中に複数の結合スペクトルの異なるマルチサイト結合ポケットをもつことにより,きわめて広い基質認識を可能にしている.この研究において,薬物は複数のポケットを順送りにより輸送されるというペリスタポンプ排出機構が明らかになった.薬物結合構造の全体像が明らかになったことにより,多剤耐性感染症を克服する多剤排出タンパク質阻害薬の構造にもとづく創薬も可能になった.
なお,筆者らがこれまでに提唱した機能的回転輸送機構,および,今回のペリスタポンプ排出機構は,基質を結合しないAcrB非対称ホモ三量体構造の解析により支持または示唆されているが8,9),AcrBホモ三量体と基質との結合構造に関しては,生理的には意味がないものと考えられる3回対称構造において報告があるものの10),in vivoでの構造を反映していると考えられる3回対称軸をもたない構造において薬物結合部位の特定に成功しているのは筆者らのグループ以外にはない.
文 献
- Paulsen, I. T., Nguyen, L., Sliwinski, M. K. et al.: Microbial genome analyses: comparative transport capabilities in eighteen prokaryotes. J. Mol. Biol., 301, 75-100 (2000)[PubMed]
- Ma, D., Cook, D. N., Hearst, J. E. et al.: Efflux pumps and drug resistance in Gram-negative bacteria. Trends Microbiol., 2, 489-493 (1994)[PubMed]
- Okusu, H., Ma, D. & Nikaido, H.: AcrAB efflux pump plays a major role in the antibiotic resistance phenotype of Escherichia coli multiple-antibiotic-resistance (Mar) mutants. J. Bacteriol., 178, 306-308 (1996)[PubMed]
- Poole, K.: Multidrug efflux pumps and antimicrobial resistance in Pseudomonas aeruginosa and related organisms. J. Mol. Microbiol. Biotechnol., 3, 255-264 (2001)[PubMed]
- Nishino, K., Latifi, T. & Groisman E. A.: Virulence and drug resistance roles of multidrug efflux systems of Salmonera enterica serovar Typhimurium. Mol. Microbiol., 59, 126-141 (2006)[PubMed]
- Murakami, S., Nakashima, R., Yamashita, E. et al.: Crystal structure of bacterial multidrug efflux transporter AcrB. Nature, 419, 587-593 (2002)[PubMed]
- Murakami, S., Nakashima, R., Yamashita, E. et al.: Crystal structures of a multidrug transporter reveal a functionally rotating mechanism. Nature, 443, 173-179 (2006)[PubMed]
- Seeger, M. A., Schiefner, A., Eicher, T. et al.: Structural asymmetry of AcrB trimer suggests a peristaltic pump mechanism. Science, 313, 1295-1298 (2006)[PubMed]
- Seeger, M. A., von Ballmoos, C., Eicher, T. et al.: Engineered disulfide bonds support the functional rotation mechanism of multidrug efflux pump AcrB. Nat. Struct. Mol. Biol., 15, 199-205 (2008)[PubMed]
- Yu, E. W., Aires, J. R., McDermott, G. et al.: A periplasmic drug-binding site of the AcrB multidrug efflux pump: a crystallographic and site-directed mutagenesis study. J. Bacteriol., 187, 6804-6815 (2005)[PubMed]
著者プロフィール
大阪大学産業科学研究所 助教.
山口 明人(Akihito Yamaguchi)
略歴:1977年 東京大学大学院薬学系研究科博士課程 修了,同年 理化学研究所 流動研究員,1978年 千葉大学薬学部 助手(1980年~1981年 米国Yale大学 博士研究員),1983年 同 講師,1986年 同 助教授を経て,1996年より大阪大学産業科学研究所 教授.
関心事:異物排出タンパク質による異物認識排出機構の全貌を明らかにし,臨床的に有効な阻害薬を分子標的創薬すること.
研究室URL:http://www.sanken.osaka-u.ac.jp/labs/cmb/
© 2012 中島良介・山口明人 Licensed under CC 表示 2.1 日本