異なるニッチに存在する腸管上皮幹細胞のあいだの相互関連
武田憲文・Jonathan A. Epstein
(米国Pennsylvania大学Perelman School of Medicine,Department of Cell and Developmental Biology)
email:武田憲文
DOI: 10.7875/first.author.2011.173
Interconversion between intestinal stem cell populations in distinct niches.
Norifumi Takeda, Rajan Jain, Matthew R. LeBoeuf, Qiaohong Wang, Min Min Lu, Jonathan A. Epstein
Science, 334, 1420-1424 (2011)
近年,腸管上皮幹細胞が存在する場所(ニッチ)とその性格の相違が議論されている.Paneth細胞の直上に位置し陰窩の底から約4番目の細胞に該当する+4幹細胞は,細胞分裂周期が遅くDNAへの標識を長く保持する能力をもっている.一方,Paneth細胞のあいだに位置するCBC幹細胞は,細胞分裂周期が速くDNAへの標識を長く保持する能力をもたない.この2つの幹細胞はともにすべての腸管分化細胞を供給できるが,そのあいだの関連性については十分には知られていない.筆者らは,+4幹細胞においてHopx遺伝子が発現しており,Hopx幹細胞とCBC幹細胞とが互いに相互関連し変換しうることを見い出した.
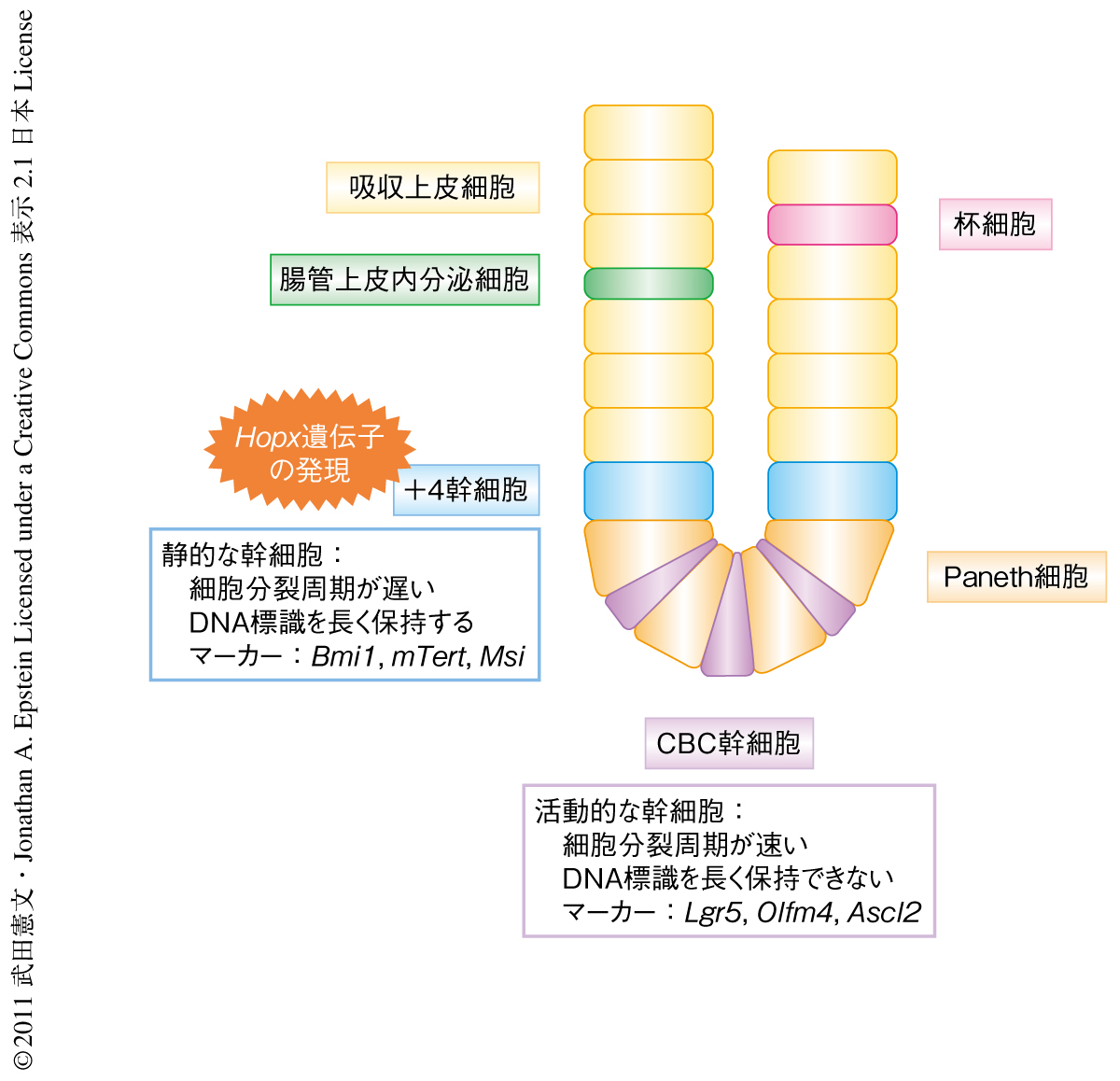
小腸の腸管上皮細胞は数日で入れ替わっており,これらは腸管上皮幹細胞の自己複製と分化細胞への分化および増殖により維持されている.腸管上皮幹細胞は陰窩に存在しており,Paneth細胞の直上に位置し陰窩の底から約4番目の細胞に該当する“+4幹細胞”と,Paneth細胞のあいだにはさまれて存在する“CBC幹細胞(CBC:crypt base columnar,陰窩底部円柱)”の2つの幹細胞が報告されている(図1).+4幹細胞は細胞分裂周期が遅く,DNAへの標識を長く保持する能力があり,Bmi1遺伝子1) やmTert遺伝子2) などを発現する.一方,CBC幹細胞は細胞分裂周期が速く,DNAへの標識を長く保持する能力をもたず,Lgr5遺伝子を発現する3).これらのマーカー遺伝子を利用した遺伝学的な細胞系譜の追跡実験により,この2つの幹細胞がいずれもすべての腸管分化細胞(吸収上皮細胞,杯細胞,腸管上皮内分泌細胞,Paneth細胞)に分化および増殖することは報告されてきたが,両者の関係性は十分には知られていなかった.最近,ジフテリア毒素を用いてLgr5遺伝子を発現する細胞を特異的に破壊するモデルマウスが報告されたが,その腸管の構造には大きな変化は認められず,+4幹細胞から派生した細胞によりCBC細胞は置き換えられ,それらの細胞がLgr5遺伝子を発現することが報告された4).
従来,さまざまな組織幹細胞において静的および活動的な2種類の幹細胞が相互関連し変換しうる可能性が想定されてきたが,これを支持する十分な実験的データはなかった5).筆者らは,Hopx(homeodomain only protein x)遺伝子が+4細胞に発現しており,細胞系譜の追跡実験によりHopx幹細胞とLgr5幹細胞とが互いに相互関連し変換しうることを見い出した.
HOPXはホメオドメインと相同性の高いアミノ酸配列をもつがDNA結合領域を欠いた低分子のタンパク質であり,心臓や神経幹細胞における研究がさかんであった6).Hopx遺伝子座にLacZ遺伝子をノックインしたマウス(Hopx-LacZノックインマウス)を用いた検討から,Hopx遺伝子はすべての小腸においてPaneth細胞の直上の+4細胞に強く発現しており,BrdUを用いたDNA標識実験ではDNAへの標識を長く保持する細胞の86%がLacZ陽性であった.Hopx遺伝子を発現する細胞の細胞系譜を追跡するため,タモキシフェンに依存性のCreリコンビナーゼによる遺伝子組換えを可能にする遺伝子改変マウスを作製し,loxP配列における組換えによりLacZ遺伝子を発現するレポーターマウスと交配し,タモキシフェンの投与ののち13カ月まで観察した結果,Hopx遺伝子の発現細胞に由来する細胞がすべての腸管分化細胞に認められた.腸管上皮細胞は数日で入れ替わるため,Hopx遺伝子の発現細胞に由来する細胞が長期にわたり存在することは,Hopx遺伝子が腸管幹細胞に発現していることを意味していた.
さらに,この遺伝子改変マウスにタモキシフェンを単回投与したのち18時間(Hopx遺伝子をもっとも強く発現した細胞が標識される時間帯)において観察したところ,Hopx遺伝子を発現する細胞の70%以上は陰窩の底から4~5番目に存在していた.タモキシフェンの投与によりLgr5遺伝子を発現した細胞が標識される遺伝子改変マウスを用いて同様の検討を行ったところ,タモキシフェンを単回投与したのち18時間においてLgr5遺伝子を発現する細胞はPaneth細胞のあいだのCBC細胞に存在した.これら2系統の遺伝子改変マウスにタモキシフェンを5日間にわたり連続投与し,Hopx遺伝子の発現細胞あるいはLgr5遺伝子の発現細胞に由来する細胞が存在する陰窩におけるLacZの発現様式を観察したところ,ほぼすべてのCBC細胞およびPaneth細胞が標識されるまでの期間は,Hopx遺伝子について約9カ月,Lgr5遺伝子について約6カ月であった.これらの結果は,Hopx幹細胞とLgr5幹細胞とは異なる幹細胞種であり,Hopx幹細胞は+4細胞であり細胞分裂周期が遅く,Lgr5幹細胞はCBC細胞であり細胞分裂が速いことを,あらためて支持する結果であった(図1).
単離した陰窩をin vitroで培養し腸管様の細胞組織体を形成させる方法7-9) を用いてHopx-LacZノックインマウスの陰窩を培養したところ,LacZ陽性およびLacZ陰性の細胞組織体が形成された.LacZ陽性の細胞組織体は培養ののち2日で70%,14日目までには95%に達したが,LacZ陰性の細胞組織体の存在はHopx幹細胞以外の幹細胞が細胞組織体の形成に関与していることを示唆した.たとえば,Hopx-LacZノックインLgr5-GFPノックインマウスの陰窩培養ではLacZ陰性の細胞組織体がLgr5遺伝子の発現細胞に由来することを示すGFPを発現しており,Lgr5幹細胞とHopx幹細胞とが異なる幹細胞種として機能していることが示唆された.
LacZ陽性の細胞組織体におけるLacZの発現様式を観察したところ,単離の直後のHopx遺伝子の発現細胞はin vivoと同様にPaneth細胞の直上に位置していた.in vitroでのLacZの発現は数日間にわたり認められ,このあいだにLacZ陽性の細胞(この場合,Hopx遺伝子の発現細胞に由来する細胞を意味する)は,Paneth細胞のあいだや絨毛構造に相当する部分にも広がった.さらに,タモキシフェンの投与によりHopx遺伝子の発現した細胞が標識される遺伝子改変マウスの陰窩を培養しタモキシフェンを短時間投与して観察したところ,最初のLacZ陽性の細胞(Hopx遺伝子の発現細胞)はin vivoと同様にPaneth細胞の直上に位置し,のちのLacZ陽性の細胞(Hopx遺伝子の発現細胞に由来する細胞)は一塊となり陰窩および絨毛構造の部分(すべての腸管分化細胞)に広がった.これらのin vitro培養系の結果は,腸管幹細胞はin vivoと同様にHopx遺伝子を発現していることを意味した.
Hopx幹細胞とLgr5幹細胞との関連性を検討するため,タモキシフェンの投与によりHopx遺伝子の発現した細胞が標識される遺伝子改変マウスにタモキシフェンを単回投与したのち,経時的に組織学的な検討を行ったところ,Hopx遺伝子の発現細胞は投与から18時間のちには陰窩の底から4~5番目に位置していたが,27時間のち,36時間のち,48時間のち,67時間のちにはCBC細胞やほかの腸管分化細胞にも広がって認められた.この18時間のちおよび48時間のちのLacZ陽性の細胞から+4細胞およびCBC細胞をレーザーキャプチャーマイクロダイセクション法により採取しmRNAの発現をRT-PCR法により解析したところ,前者はHopx遺伝子,Bmi1遺伝子,mTert遺伝子,後者はLgr5遺伝子を多く発現していた.つぎに,Hopx-LacZノックインLgr5-GFPノックインマウスの陰窩を単離し培養したところ,培養から数日のちのLacZ陽性の細胞(この場合,LacZの発現は数日間にわたり認められるためHopx遺伝子の発現細胞に由来する細胞が含まれる)は,Lgr5遺伝子の発現細胞に由来することを示すGFPを発現していた.
さらに,タモキシフェンの投与ののちloxP配列における組換えによりGFPを発現するレポーターマウスを,タモキシフェンに依存性のCreリコンビナーゼによる遺伝子組換えを可能にする遺伝子改変マウスと交配し,タモキシフェンの投与から18時間のち,2日のち,4日のちのGFP陽性の細胞をセルソーターにより単離し解析した.GFP陽性の細胞は4日のちには13.1%まで漸増し,これら単離された細胞のmRNAの発現をRT-PCR法により解析したところ,+4幹細胞のマーカーであるHopx遺伝子,Bmi1遺伝子,Msi1遺伝子,mTert遺伝子の発現は18時間のちに単離した細胞に多く含まれ,2日のちおよび4日のちに単離した細胞ではその発現の割合が低下していた.一方,CBC幹細胞のマーカーであるLgr5遺伝子,Olfm4遺伝子,Ascl2遺伝子や,ほかの分化細胞のマーカーであるAlpi遺伝子,Lyz1遺伝子,Muc2遺伝子は,2日のちおよび4日のちに単離した細胞においてその発現が漸増した.さきの組織学的な検討と照合すると,18時間のちに単離した細胞にはHopx遺伝子の発現細胞,2日のちおよび4日のちに単離した細胞にはHopx遺伝子の発現細胞に由来する細胞が含まれ,さらに,Hopx遺伝子の発現細胞に由来する細胞がLgr5幹細胞マーカーを発現したことが示唆された.
18時間のちおよび4日のちに単離したGFP陽性の細胞を,発育効率を高めることが示されているWnt3A(100 ng/ml)投与のもと単細胞培養したところ,18時間のちに単離した細胞は細胞組織体の形成能がきわめて低かったのに対し,4日のちに単離した細胞の細胞組織体の形成速度はLgr5幹細胞と同等であった.このことは,Hopx幹細胞は現状のin vitroでの培養条件では依然として静的な性格をもつため増殖しにくく,また,Hopx遺伝子の発現細胞に由来する細胞にはLgr5幹細胞のような活動的な細胞が含まれることを示唆した.
Hopx-LacZノックインLgr5-GFPノックインマウスからLgr5幹細胞を単離して培養し,Hopx遺伝子の発現細胞に由来することを示すLacZの発現を経時的に観察したところ,培養3日目ではすべての細胞組織体においてLacZ陰性であったが,7日目では20%以上,21日目ではすべての細胞組織体がLacZ陽性になった.
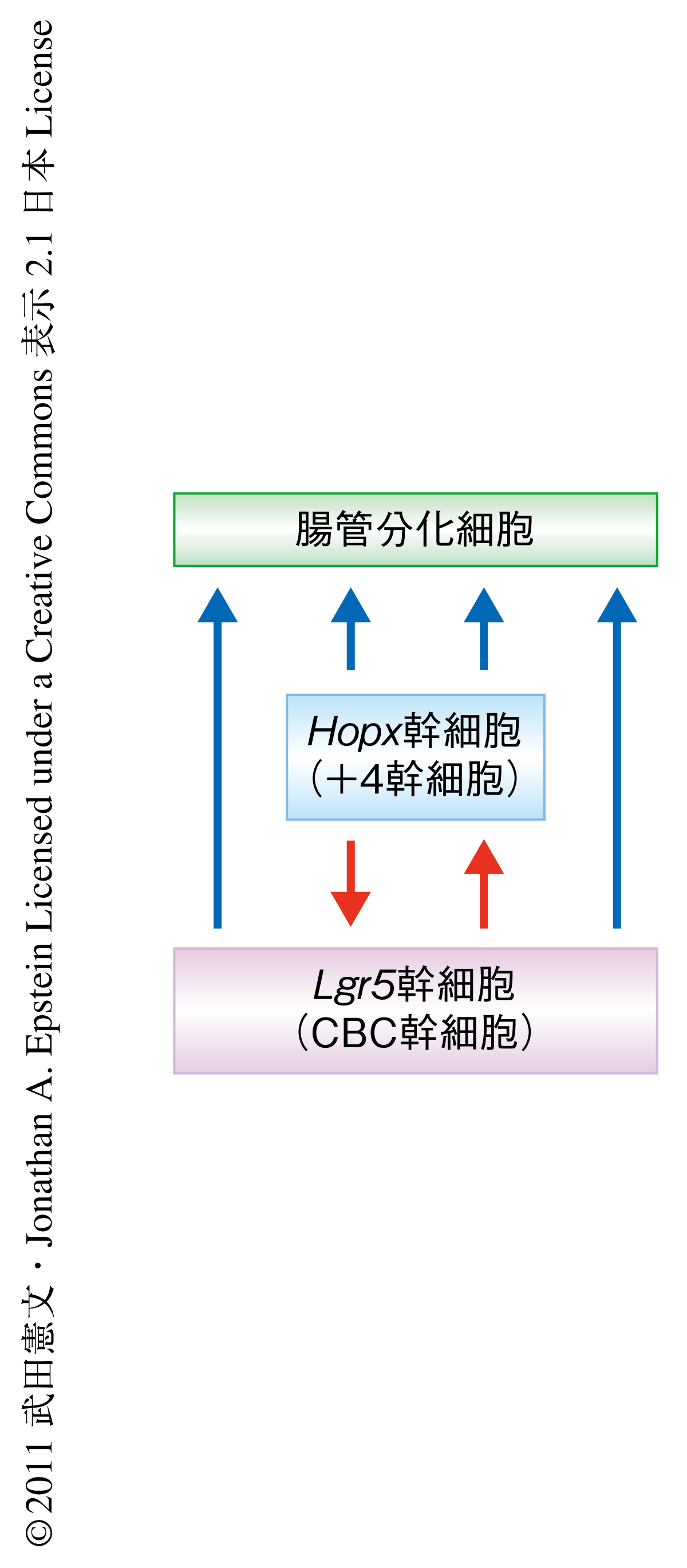
つぎに,タモキシフェンの投与によりLgr5遺伝子を発現した細胞においてloxP配列における組換えを可能にするLgr5-GFP-ERCreノックインマウスとHopx-LacZノックインマウスを交配し,さらに,タモキシフェンの投与ののちloxP配列における組換えによりGFPを発現するレポーターマウスと交配して,タモキシフェンの投与ののち5カ月の組織を観察したところ,Lgr5遺伝子の発現細胞に由来する細胞が陰窩の底から4番目の位置において,Hopx遺伝子の発現細胞に由来することを示すLacZを発現していた.さらに,Hopx-LacZノックインLgr5-GFP-ERCreノックインマウスを,タモキシフェンの投与ののちloxP配列における組換えによりtdTomatoを発現するレポーターマウスと交配し,タモキシフェンの投与ののちにその陰窩を軽めに解離させ(レポータータンパク質および機能を保持するため),tdTomato陽性の細胞(Lgr5遺伝子の発現細胞に由来する細胞)とLacZ陽性の細胞(Hopx遺伝子の発現細胞)とを観察したところ,それらの共陽性の細胞は投与ののち18時間には認められなかったが,投与ののち5日および10日の陰窩にはまれながら存在していた.これらは,Lgr5幹細胞に由来する細胞がHopx遺伝子を発現する+4細胞になりうることを示唆していた(図2).
この論文では,従来,想定されてきた異なる腸管幹細胞ニッチのあいだでの相互関連性5) について検証・報告した.+4幹細胞とCBC幹細胞とは互いに相互関連し変換しうる.こうした概念は腸管のみならずほかの臓器幹細胞でも想定されており,さまざまな臓器生理学および幹細胞学領域への発展寄与および応用が期待される.
略歴:2006年 東京大学大学院医学系研究科より博士 取得,2007年 東京大学医療知識基盤プロジェクト 特任助教,2009年 東京大学医学部附属病院 助教を経て,2010年より米国Pennsylvania大学Perelman School of Medicine研究員.
研究テーマ:分子心臓病学,腸管上皮幹細胞.
Jonathan A. Epstein
米国Pennsylvania大学Perelman School of Medicine教授.
© 2011 武田憲文・Jonathan A. Epstein Licensed under CC 表示 2.1 日本
(米国Pennsylvania大学Perelman School of Medicine,Department of Cell and Developmental Biology)
email:武田憲文
DOI: 10.7875/first.author.2011.173
Interconversion between intestinal stem cell populations in distinct niches.
Norifumi Takeda, Rajan Jain, Matthew R. LeBoeuf, Qiaohong Wang, Min Min Lu, Jonathan A. Epstein
Science, 334, 1420-1424 (2011)
要 約
近年,腸管上皮幹細胞が存在する場所(ニッチ)とその性格の相違が議論されている.Paneth細胞の直上に位置し陰窩の底から約4番目の細胞に該当する+4幹細胞は,細胞分裂周期が遅くDNAへの標識を長く保持する能力をもっている.一方,Paneth細胞のあいだに位置するCBC幹細胞は,細胞分裂周期が速くDNAへの標識を長く保持する能力をもたない.この2つの幹細胞はともにすべての腸管分化細胞を供給できるが,そのあいだの関連性については十分には知られていない.筆者らは,+4幹細胞においてHopx遺伝子が発現しており,Hopx幹細胞とCBC幹細胞とが互いに相互関連し変換しうることを見い出した.
はじめに
小腸の腸管上皮細胞は数日で入れ替わっており,これらは腸管上皮幹細胞の自己複製と分化細胞への分化および増殖により維持されている.腸管上皮幹細胞は陰窩に存在しており,Paneth細胞の直上に位置し陰窩の底から約4番目の細胞に該当する“+4幹細胞”と,Paneth細胞のあいだにはさまれて存在する“CBC幹細胞(CBC:crypt base columnar,陰窩底部円柱)”の2つの幹細胞が報告されている(図1).+4幹細胞は細胞分裂周期が遅く,DNAへの標識を長く保持する能力があり,Bmi1遺伝子1) やmTert遺伝子2) などを発現する.一方,CBC幹細胞は細胞分裂周期が速く,DNAへの標識を長く保持する能力をもたず,Lgr5遺伝子を発現する3).これらのマーカー遺伝子を利用した遺伝学的な細胞系譜の追跡実験により,この2つの幹細胞がいずれもすべての腸管分化細胞(吸収上皮細胞,杯細胞,腸管上皮内分泌細胞,Paneth細胞)に分化および増殖することは報告されてきたが,両者の関係性は十分には知られていなかった.最近,ジフテリア毒素を用いてLgr5遺伝子を発現する細胞を特異的に破壊するモデルマウスが報告されたが,その腸管の構造には大きな変化は認められず,+4幹細胞から派生した細胞によりCBC細胞は置き換えられ,それらの細胞がLgr5遺伝子を発現することが報告された4).
従来,さまざまな組織幹細胞において静的および活動的な2種類の幹細胞が相互関連し変換しうる可能性が想定されてきたが,これを支持する十分な実験的データはなかった5).筆者らは,Hopx(homeodomain only protein x)遺伝子が+4細胞に発現しており,細胞系譜の追跡実験によりHopx幹細胞とLgr5幹細胞とが互いに相互関連し変換しうることを見い出した.
1.Hopx遺伝子は+4幹細胞のマーカーである
HOPXはホメオドメインと相同性の高いアミノ酸配列をもつがDNA結合領域を欠いた低分子のタンパク質であり,心臓や神経幹細胞における研究がさかんであった6).Hopx遺伝子座にLacZ遺伝子をノックインしたマウス(Hopx-LacZノックインマウス)を用いた検討から,Hopx遺伝子はすべての小腸においてPaneth細胞の直上の+4細胞に強く発現しており,BrdUを用いたDNA標識実験ではDNAへの標識を長く保持する細胞の86%がLacZ陽性であった.Hopx遺伝子を発現する細胞の細胞系譜を追跡するため,タモキシフェンに依存性のCreリコンビナーゼによる遺伝子組換えを可能にする遺伝子改変マウスを作製し,loxP配列における組換えによりLacZ遺伝子を発現するレポーターマウスと交配し,タモキシフェンの投与ののち13カ月まで観察した結果,Hopx遺伝子の発現細胞に由来する細胞がすべての腸管分化細胞に認められた.腸管上皮細胞は数日で入れ替わるため,Hopx遺伝子の発現細胞に由来する細胞が長期にわたり存在することは,Hopx遺伝子が腸管幹細胞に発現していることを意味していた.
さらに,この遺伝子改変マウスにタモキシフェンを単回投与したのち18時間(Hopx遺伝子をもっとも強く発現した細胞が標識される時間帯)において観察したところ,Hopx遺伝子を発現する細胞の70%以上は陰窩の底から4~5番目に存在していた.タモキシフェンの投与によりLgr5遺伝子を発現した細胞が標識される遺伝子改変マウスを用いて同様の検討を行ったところ,タモキシフェンを単回投与したのち18時間においてLgr5遺伝子を発現する細胞はPaneth細胞のあいだのCBC細胞に存在した.これら2系統の遺伝子改変マウスにタモキシフェンを5日間にわたり連続投与し,Hopx遺伝子の発現細胞あるいはLgr5遺伝子の発現細胞に由来する細胞が存在する陰窩におけるLacZの発現様式を観察したところ,ほぼすべてのCBC細胞およびPaneth細胞が標識されるまでの期間は,Hopx遺伝子について約9カ月,Lgr5遺伝子について約6カ月であった.これらの結果は,Hopx幹細胞とLgr5幹細胞とは異なる幹細胞種であり,Hopx幹細胞は+4細胞であり細胞分裂周期が遅く,Lgr5幹細胞はCBC細胞であり細胞分裂が速いことを,あらためて支持する結果であった(図1).
2.in vitroでの陰窩の培養系におけるHopx幹細胞の観察
単離した陰窩をin vitroで培養し腸管様の細胞組織体を形成させる方法7-9) を用いてHopx-LacZノックインマウスの陰窩を培養したところ,LacZ陽性およびLacZ陰性の細胞組織体が形成された.LacZ陽性の細胞組織体は培養ののち2日で70%,14日目までには95%に達したが,LacZ陰性の細胞組織体の存在はHopx幹細胞以外の幹細胞が細胞組織体の形成に関与していることを示唆した.たとえば,Hopx-LacZノックインLgr5-GFPノックインマウスの陰窩培養ではLacZ陰性の細胞組織体がLgr5遺伝子の発現細胞に由来することを示すGFPを発現しており,Lgr5幹細胞とHopx幹細胞とが異なる幹細胞種として機能していることが示唆された.
LacZ陽性の細胞組織体におけるLacZの発現様式を観察したところ,単離の直後のHopx遺伝子の発現細胞はin vivoと同様にPaneth細胞の直上に位置していた.in vitroでのLacZの発現は数日間にわたり認められ,このあいだにLacZ陽性の細胞(この場合,Hopx遺伝子の発現細胞に由来する細胞を意味する)は,Paneth細胞のあいだや絨毛構造に相当する部分にも広がった.さらに,タモキシフェンの投与によりHopx遺伝子の発現した細胞が標識される遺伝子改変マウスの陰窩を培養しタモキシフェンを短時間投与して観察したところ,最初のLacZ陽性の細胞(Hopx遺伝子の発現細胞)はin vivoと同様にPaneth細胞の直上に位置し,のちのLacZ陽性の細胞(Hopx遺伝子の発現細胞に由来する細胞)は一塊となり陰窩および絨毛構造の部分(すべての腸管分化細胞)に広がった.これらのin vitro培養系の結果は,腸管幹細胞はin vivoと同様にHopx遺伝子を発現していることを意味した.
3.Hopx遺伝子の発現細胞に由来する細胞はLgr5幹細胞マーカーを発現する
Hopx幹細胞とLgr5幹細胞との関連性を検討するため,タモキシフェンの投与によりHopx遺伝子の発現した細胞が標識される遺伝子改変マウスにタモキシフェンを単回投与したのち,経時的に組織学的な検討を行ったところ,Hopx遺伝子の発現細胞は投与から18時間のちには陰窩の底から4~5番目に位置していたが,27時間のち,36時間のち,48時間のち,67時間のちにはCBC細胞やほかの腸管分化細胞にも広がって認められた.この18時間のちおよび48時間のちのLacZ陽性の細胞から+4細胞およびCBC細胞をレーザーキャプチャーマイクロダイセクション法により採取しmRNAの発現をRT-PCR法により解析したところ,前者はHopx遺伝子,Bmi1遺伝子,mTert遺伝子,後者はLgr5遺伝子を多く発現していた.つぎに,Hopx-LacZノックインLgr5-GFPノックインマウスの陰窩を単離し培養したところ,培養から数日のちのLacZ陽性の細胞(この場合,LacZの発現は数日間にわたり認められるためHopx遺伝子の発現細胞に由来する細胞が含まれる)は,Lgr5遺伝子の発現細胞に由来することを示すGFPを発現していた.
さらに,タモキシフェンの投与ののちloxP配列における組換えによりGFPを発現するレポーターマウスを,タモキシフェンに依存性のCreリコンビナーゼによる遺伝子組換えを可能にする遺伝子改変マウスと交配し,タモキシフェンの投与から18時間のち,2日のち,4日のちのGFP陽性の細胞をセルソーターにより単離し解析した.GFP陽性の細胞は4日のちには13.1%まで漸増し,これら単離された細胞のmRNAの発現をRT-PCR法により解析したところ,+4幹細胞のマーカーであるHopx遺伝子,Bmi1遺伝子,Msi1遺伝子,mTert遺伝子の発現は18時間のちに単離した細胞に多く含まれ,2日のちおよび4日のちに単離した細胞ではその発現の割合が低下していた.一方,CBC幹細胞のマーカーであるLgr5遺伝子,Olfm4遺伝子,Ascl2遺伝子や,ほかの分化細胞のマーカーであるAlpi遺伝子,Lyz1遺伝子,Muc2遺伝子は,2日のちおよび4日のちに単離した細胞においてその発現が漸増した.さきの組織学的な検討と照合すると,18時間のちに単離した細胞にはHopx遺伝子の発現細胞,2日のちおよび4日のちに単離した細胞にはHopx遺伝子の発現細胞に由来する細胞が含まれ,さらに,Hopx遺伝子の発現細胞に由来する細胞がLgr5幹細胞マーカーを発現したことが示唆された.
18時間のちおよび4日のちに単離したGFP陽性の細胞を,発育効率を高めることが示されているWnt3A(100 ng/ml)投与のもと単細胞培養したところ,18時間のちに単離した細胞は細胞組織体の形成能がきわめて低かったのに対し,4日のちに単離した細胞の細胞組織体の形成速度はLgr5幹細胞と同等であった.このことは,Hopx幹細胞は現状のin vitroでの培養条件では依然として静的な性格をもつため増殖しにくく,また,Hopx遺伝子の発現細胞に由来する細胞にはLgr5幹細胞のような活動的な細胞が含まれることを示唆した.
4.Lgr5遺伝子の発現細胞に由来する細胞はHopx遺伝子を発現する
Hopx-LacZノックインLgr5-GFPノックインマウスからLgr5幹細胞を単離して培養し,Hopx遺伝子の発現細胞に由来することを示すLacZの発現を経時的に観察したところ,培養3日目ではすべての細胞組織体においてLacZ陰性であったが,7日目では20%以上,21日目ではすべての細胞組織体がLacZ陽性になった.
つぎに,タモキシフェンの投与によりLgr5遺伝子を発現した細胞においてloxP配列における組換えを可能にするLgr5-GFP-ERCreノックインマウスとHopx-LacZノックインマウスを交配し,さらに,タモキシフェンの投与ののちloxP配列における組換えによりGFPを発現するレポーターマウスと交配して,タモキシフェンの投与ののち5カ月の組織を観察したところ,Lgr5遺伝子の発現細胞に由来する細胞が陰窩の底から4番目の位置において,Hopx遺伝子の発現細胞に由来することを示すLacZを発現していた.さらに,Hopx-LacZノックインLgr5-GFP-ERCreノックインマウスを,タモキシフェンの投与ののちloxP配列における組換えによりtdTomatoを発現するレポーターマウスと交配し,タモキシフェンの投与ののちにその陰窩を軽めに解離させ(レポータータンパク質および機能を保持するため),tdTomato陽性の細胞(Lgr5遺伝子の発現細胞に由来する細胞)とLacZ陽性の細胞(Hopx遺伝子の発現細胞)とを観察したところ,それらの共陽性の細胞は投与ののち18時間には認められなかったが,投与ののち5日および10日の陰窩にはまれながら存在していた.これらは,Lgr5幹細胞に由来する細胞がHopx遺伝子を発現する+4細胞になりうることを示唆していた(図2).
おわりに
この論文では,従来,想定されてきた異なる腸管幹細胞ニッチのあいだでの相互関連性5) について検証・報告した.+4幹細胞とCBC幹細胞とは互いに相互関連し変換しうる.こうした概念は腸管のみならずほかの臓器幹細胞でも想定されており,さまざまな臓器生理学および幹細胞学領域への発展寄与および応用が期待される.
文 献
- Sangiorgi, E. & Capecchi, M. R.: Bmi1 is expressed in vivo in intestinal stem cells. Nat. Genet., 40, 915-920 (2008)[PubMed]
- Breault, D. T., Min, I. M., Carlone, D. L. et al.: Generation of mTert-GFP mice as a model to identify and study tissue progenitor cells. Proc. Natl. Acad. Sci. USA, 105, 10420-10425 (2008)[PubMed]
- Barker, N., van Es, J. H., Kuipers, J. et al.: Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature, 449, 1003-1007 (2007)[PubMed]
- Tian, H., Biehs, B., Warming, S. et al.: A reserve stem cell population in small intestine renders Lgr5-positive cells dispensable. Nature, 478, 255-259 (2011)[PubMed]
- Li, L. & Clevers, H.: Coexistence of quiescent and active adult stem cells in mammals. Science, 327, 542-545 (2010)[PubMed]
- Chen, F., Kook, H., Milewski, R. et al.: Hop is an unusual homeobox gene that modulates cardiac development. Cell, 110, 713-723 (2002)[PubMed]
- Sato, T., Vries, R. G., Snippert, H. J. et al.: Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature, 459, 262-265 (2009)[PubMed]
- Sato, T., van Es, J. H., Snippert, H. J. et al.: Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature, 469, 415-418 (2011)[PubMed] [新着論文レビュー]
- Jung, P., Sato, T., Merlos-Suarez, A. et al.: Isolation and in vitro expansion of human colonic stem cells. Nat. Med., 17, 1225-1227 (2011)[PubMed]
著者プロフィール
略歴:2006年 東京大学大学院医学系研究科より博士 取得,2007年 東京大学医療知識基盤プロジェクト 特任助教,2009年 東京大学医学部附属病院 助教を経て,2010年より米国Pennsylvania大学Perelman School of Medicine研究員.
研究テーマ:分子心臓病学,腸管上皮幹細胞.
Jonathan A. Epstein
米国Pennsylvania大学Perelman School of Medicine教授.
© 2011 武田憲文・Jonathan A. Epstein Licensed under CC 表示 2.1 日本