福山型筋ジストロフィーにおけるSVA型レトロトランスポゾンの挿入による異常なエキソントラッピングとそのアンチセンス療法
谷口 (池田) 真理子・小林千浩・戸田達史
(神戸大学大学院医学研究科 分子脳科学分野/神経内科学分野)
email:谷口 (池田) 真理子,小林千浩,戸田達史
DOI: 10.7875/first.author.2011.171
Pathogenic exon-trapping by SVA retrotransposon and rescue in Fukuyama muscular dystrophy.
Mariko Taniguchi-Ikeda, Kazuhiro Kobayashi, Motoi Kanagawa, Chih-chieh Yu, Kouhei Mori, Tetsuya Oda, Atsushi Kuga, Hiroki Kurahashi, Hasan O. Akman, Salvatore DiMauro, Ryuji Kaji, Toshifumi Yokota, Shin’ichi Takeda, Tatsushi Toda
Nature, 478, 127-131 (2011)
福山型筋ジストロフィーはわが国に多い常染色体劣性の神経・筋疾患であり,いまだ治療法はない.ほとんどの患者は疾患責任遺伝子であるfukutin遺伝子の3’側非翻訳領域にSVA型レトロトランスポゾンの挿入をもつが,その発症機序は不明であった.今回,筆者らは,福山型筋ジストロフィーがSVA型レトロトランスポゾンの挿入により誘導されるスプライシング異常症であることを証明した.そして,スプライシングを制御する治療が有効と考え,この異常なスプライシングを阻止するアンチセンスオリゴヌクレオチドを設計し,患者に由来する細胞に導入,また,疾患モデルマウスに対し局所注射ならびに全身投与を行った.その結果,患者に由来する細胞において正常なFukutinの発現が回復し,また,疾患モデルマウスにおいても正常なFukutinの発現,および,αジストログリカンの糖鎖修飾とラミニン結合能の回復が確認された.さらに,同様のSVA型レトロトランスポゾンの挿入変異をもつ2つの疾患において,そのエキソントラッピング機能による異常なスプライシングを観察した.また,ヒトに特異的なSVA型レトロトランスポゾンによるエキソントラッピングに由来する転写産物を脳において同定した.以上より,SVA型レトロトランスポゾンのもつエキソントラッピング機能はヒトの疾患や進化に関与しており,また,福山型筋ジストロフィーに対し初の根治療法の可能性が示唆された.
福山型筋ジストロフィー(Fukuyama-type congenital muscular dystrophy:FCMD,MIM253800)はわが国に特有の疾患であり,先天性筋ジストロフィー,II型滑脳症,眼奇形の3症状を示す常染色体劣性の遺伝疾患である1).わが国で2番目に多い小児の筋疾患で,10代のうちに死にいたる重篤な疾患だが,いまだ治療法がない.福山型筋ジストロフィーの疾患責任遺伝子であるfukutin遺伝子は,1998年にポジショナルクローニング法により同定された2,3).ほとんどの患者はfukutin遺伝子の3’側非翻訳領域に動く遺伝子である約3 kbのSVA型レトロトランスポゾン(SVA:Sine-VNTR-Alu)の挿入変異を認める3).この変異は約100世代まえに日本人祖先のひとりに生じたもので,日本人の88人に1人が保因者で約3万の出生に1人の割合で発症する4).患者の骨格筋には細胞膜と基底膜をつなぐ糖タンパク質αジストログリカンのO-マンノース型糖鎖修飾に欠損があり,この糖鎖を介する細胞膜と基底膜とのあいだの結合が破綻するため重度の筋ジストロフィーが発症する5).類縁疾患のmuscle-eye-brain病,Walker-Warburg症候群などにおいてもαジストログリカンのO-マンノース型糖転移酵素における遺伝子異常がつぎつぎと同定され,αジストログリカノパチーと総称される新しい疾患概念が確立されている6).
fukutin遺伝子の産物であるFukutinはゴルジ体に局在し,既知の糖転移酵素とのアミノ酸配列相同性によりαジストログリカンの糖鎖修飾に関与する糖転移酵素ではないかと考えられているが,その機能を含め未知な点が多い.福山型筋ジストロフィーの発症機序については,SVA型レトロトランスポゾンの挿入変異が3’側非翻訳領域にあることでfukutin mRNAが不安定化し分解される,あるいは,SVA型レトロトランスポゾンのもつくり返し配列の影響でfukutin遺伝子の周辺がDNAメチル化やヒストン脱アセチル化などエピジェネティックな不活性化をうけ発現抑制や転写伸長障害が起こる,などと考えられてきたが,SVA型レトロトランスポゾンの配列にはグアニンおよびシトシンが豊富なため解析がむずかしく疾患機序は未解明のままであった.最近,SVA型レトロトランスポゾンが遺伝子の内部に挿入されることで選択的スプライシングや早期終止コドンの出現をひき起こし,遺伝子の機能に多様性をあたえ生物の進化,選択,多様性,あるいは,疾患の発症に関与している可能性が報告されている7).
fukutin遺伝子は10個のエキソンと長い3’側非翻訳領域をもつ.過去のデータでは,ノーザンハイブリダイゼーション法では患者のfukutin mRNAは検出されなかった3).今回,福山型筋ジストロフィーの病態を解析するため,fukutin遺伝子のそれぞれのエキソン,SVA型レトロトランスポゾンの挿入の周辺領域,および,3’側非翻訳領域の全域にわたり患者のリンパ球におけるfukutin遺伝子の発現について定量RT-PCR法による解析を行い,再度検証して健常人と比較した.その結果,fukutin遺伝子の5’側翻訳領域および3’側非翻訳領域のうちSVA型レトロトランスポゾンの挿入より3’側の領域の遺伝子発現は健常人と患者とのあいだでほとんど違いのない一方,その配列にはさまれる領域における遺伝子発現が患者において激減していた.よって,患者のmRNAでは翻訳領域およびSVA型レトロトランスポゾンの挿入のあいだのどこかで異常スプライシングが起こっているのではないかと考えた.
そこで,遺伝子発現の激減している配列をはさむ領域にPCRプライマーを設計し,健常人および患者のfukutin遺伝子cDNAを鋳型としてlong-PCRを行った.このlong-PCRはSVA型レトロトランスポゾンの配列にはグアニンやシトシンが多く,また,くり返し配列も多いため非常にむずかしくさまざまな条件設定が必要であったが,予想どおり,患者において特異的に正常より短い転写産物を検出できた.この短い転写産物は患者の脳および骨格筋においても検出された.
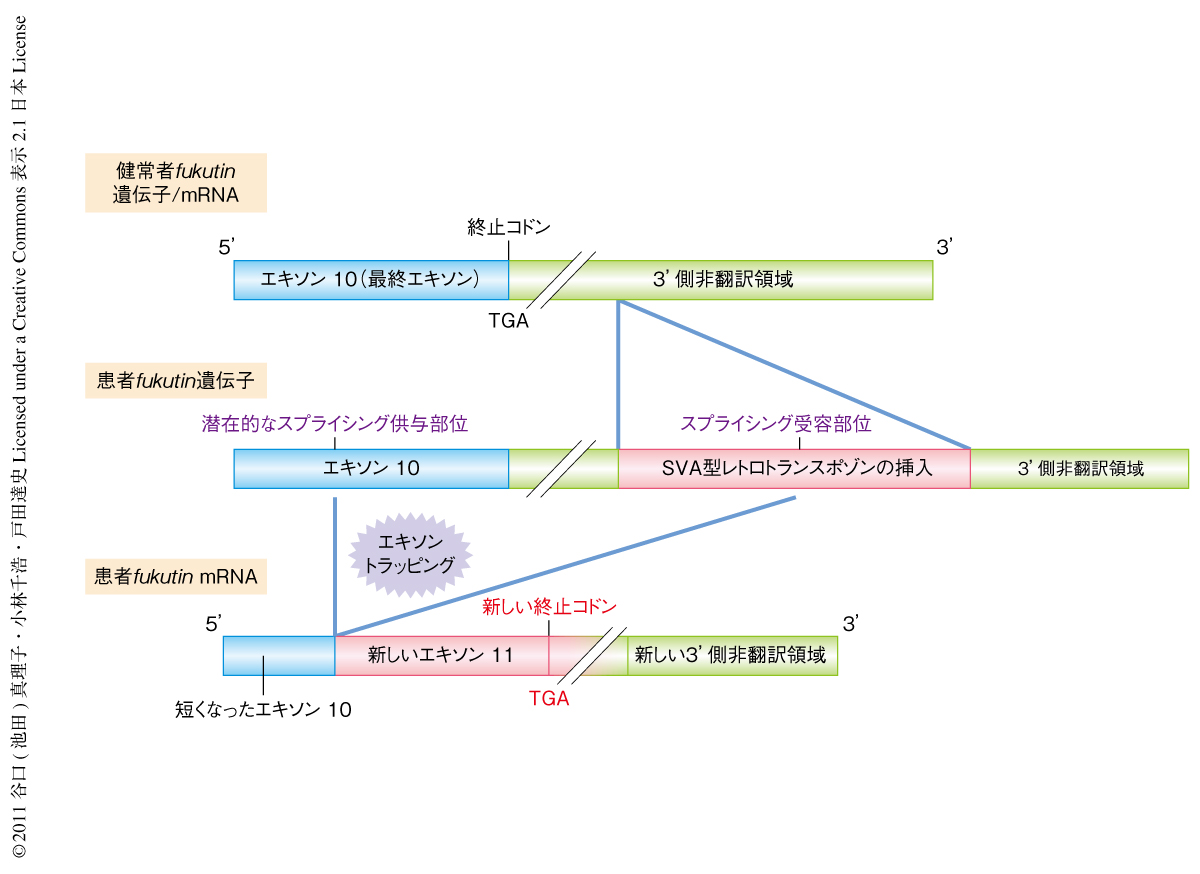
この転写産物の塩基配列を直接シークエンス法により確認したところ,患者において特異的にfukutin mRNAが異常なスプライシングをうけていた.この異常スプライシングはSVA型レトロトランスポゾンの配列に存在する強力なスプライシング受容部位が翻訳領域の最終エキソンにある潜在的なスプライシング供与部位を新たに活性化すること(エキソントラッピング)が原因となっていた(図1).そして,このスプライシングはfukutin mRNAの最終エキソンで起こっていたためナンセンス変異依存性mRNA分解機構(nonsense-mediated mRNA decay:NMD)によるmRNA分解をうけず,全体の発現量は低下していなかった.
以前,ノーザンハイブリダイゼーションを用いた実験でfukutin mRNAの検出できなかった理由としては,異常スプライシングをうけた患者のfukutin mRNAはグアニンやシトシンが多いSVA型レトロトランスポゾンに由来する転写産物を含むため高次構造が変化していた,あるいは,異常なスプライシングに由来するfukutin mRNAの泳動度がmRNAの大部分をしめるリボソームRNAのそれとほぼ一致するためハイブリダイゼーションが阻害され検出されなかった,などが考えられた.よって,ハイブリダイゼーションに競合するリボソームRNAを全RNAより除去し,電気泳動の際のRNAの変性条件を厳しく設定した.これらが効を奏して正常に比べ短い転写産物を検出することができたのであった.
この異常なスプライシングに由来するFukutinは,新しいエキソン11に存在するSVA型レトロトランスポゾンに由来する配列を含み,新しい終止コドンまで約552アミノ酸残基からなるものと予想された.内在性のFukutinは微量でありこれまで検出することはできなかったが,今回,免疫沈降法およびウェスタンブロット法を用いることではじめて内在性Fukutinの検出に成功した.この方法により,患者のリンパ芽球より異常なスプライシングに由来するFukutinを調べたところ,予想どおり,552アミノ酸残基の分子量に一致する62.3 kDaの位置にFukutinを検出した.これらの異常なスプライシングに由来するFukutinは健常人のリンパ芽球,患者の脳,そして,疾患マウスモデルの脳および骨格筋組織においても検出することができた.
この異常なスプライシングに由来する塩基配列をもつコンストラクトを作製しHeLa細胞へ導入して強制発現させたところ,Fukutinの局在が正常においてみられるゴルジ体から小胞体へと変化していた.よって,福山型筋ジストロフィーではFukutinの局在が変化することが疾患の発症につながっていると示唆された.以上のことより,福山型筋ジストロフィーはSVA型レトロトランスポゾンのエキソントラップ機能がもたらすスプライシング異常症であることが証明された.
SVA型レトロトランスポゾンの挿入を認めるほかの遺伝性疾患においてもこのSVA型レトロトランスポゾンのもつエキソントラッピング機能が疾患の発症に関与しているのか検討した.常染色体劣性の遺伝性高コレステロール血症において,原因遺伝子LDLRAP1のイントロン1に約2.6 kbのセンス鎖のSVA型レトロトランスポゾンが挿入されているケースが報告されている8).また,中性脂肪蓄積ミオパチーにおいても,原因遺伝子PNPLA2のエキソン3に約1.9 kbのセンス鎖のSVA型レトロトランスポゾンの挿入を認めるケースが報告されている9).これら2つの疾患の患者に由来する転写産物を調べたところ,福山型筋ジストロフィーと同様にSVA型レトロトランスポゾンによるエキソントラッピングが起こっていたが,これらの転写産物はナンセンス変異依存性mRNA分解機構を阻害することにより検出が可能となった.また,チンパンジーにはないヒトに特異的なSVA型レトロトランスポゾンの挿入を認める新規の遺伝子(AB627340)において,エキソントラッピングに由来する転写産物をヒト脳において同定した.この新規の遺伝子の機能は未知であるがその転写産物はノンコーディングRNAであり,なんらかの機能をもつのではないかと考えている.
SVA型レトロトランスポゾンは進化的にもっとも新しいレトロトランスポゾンであり,霊長類に特異的である10).そして,ゲノムにおいて進化とともにその数が増し,ヒトには約2700コピーが存在するといわれている.SVA型レトロトランスポゾンはエキソントラッピングによりヒトの脳においてさらに新たな機能を獲得し,進化や高次脳機能の獲得に関与しているかもしれない.よって,エキソントラッピングはヒトの進化,多様性,疾患に関与している可能性があり非常に興味深い結果であった.
筆者らはすでに,健常人型および患者型のfukutin遺伝子をマウスのfukutin遺伝子に導入したノックインモデルマウス系を構築している11).このモデルマウスはマウスfukutin遺伝子のエキソン9の3’側にヒトfukutin遺伝子のエキソン10から3’側非翻訳領域につづく配列をもつため,患者と同じスプライシング異常を呈することが骨格筋,脳のほか,肝臓,腎臓において確認された.
そこで,この異常なスプライシングをひき起こすスプライシング標的配列として,スプライシング受容部位,スプライシング活性化部位,スプライシング供与部位に対しスプライシングを制御するようなアンチセンスオリゴヌクレオチドをmRNA前駆体において結合させ,異常スプライシングを阻止し正常なスプライシングを行わせるという治療法が有効ではないかと考えた(図2).これらの標的配列に対し2’-O-メチルRNAを用いて25塩基長のアンチセンスオリゴヌクレオチドを網羅的に設計し,ノックインモデルマウスに由来するES細胞系,患者に由来する初代筋芽細胞系,患者に由来する初代線維芽細胞系,患者に由来するリンパ芽球系など,さまざまな細胞系に投与しその効果を検討した.その結果,スプライシングが正常となりかつ正常なfukutin mRNAをもっとも効率よく回復させたのは,スプライシング受容部位,スプライシング供与部位,スプライシング活性化部位に設計した3種類のアンチセンスオリゴヌクレオチドのカクテル投与(AEDカクテル投与)であった.
この結果をもとに,AEDカクテル投与が疾患モデルマウスおよび患者に由来する細胞系において治療効果を発揮するかどうか検討を行った.まず,疾患モデルマウスの前脛骨筋へのAEDカクテルの局所注射を行ったところ,終止コドンまで達する正常なfukutin mRNAが約30%にまで回復した.また,患者に由来するリンパ芽球にAEDカクテルをエレクトロポレーション法により導入したところ60%以上の回復をみた.これらの試料における正常Fukutinの回復を検討したところ,AEDカクテル投与群において正常なFukutinが検出された.また,疾患モデルマウスの前脛骨筋においてO-マンノース型糖鎖の回復をウェスタンブロット法により確認したところ,糖鎖の回復を示唆する分子量の増加がみられた.疾患モデルマウスに尾静脈を経由してAEDカクテルを全身投与したところ局所注射と同様にO-マンノース型糖鎖の回復がみられた.最後に,患者に由来する筋芽細胞を使いAEDカクテル投与によるラミニンクラスタリングアッセイを行った.患者に由来する初代筋芽細胞では筋管でのαジストログリカンの発現は激減している.しかし,AEDカクテル投与により,患者に由来する筋管には蛍光免疫染色により正常においてみられる程度のαジストログリカンの糖鎖が検出され,同様に,正常と同じ程度に回復した典型的なラミニンクラスタリングが観察され,ラミニン結合能の回復が確認された.これらの結果は,AEDカクテル投与により福山型筋ジストロフィーが機能的にも回復する可能性を示唆した.
アンチセンスオリゴヌクレオチドによりスプライシングの制御を標的とした治療法としては,現在,もっとも頻度の高い筋ジストロフィーであるデュシャンヌ型筋ジストロフィーに対するエキソンスキップ療法が国際治験第III相をむかえており,アンチセンスオリゴヌクレオチドはもっとも実用に近い治療薬剤として注目されている12).この治療法はわが国すべての福山型筋ジストロフィー患者を対象に同一の方法で行えるものであり,根本的な分子標的治療への道を開くものである.今後,医療応用の実現にむけ毒性試験などさらなる検討をしていきたいと考えている.
わが国では,毎年100名弱の福山型筋ジストロフィー患者が出生し,1000名から2000名弱の患者が存在する.患児は高度の精神および運動発達の遅延をともない,生涯にわたり歩行が困難で全面的な介護を必要する悲惨な疾患であるが,有効な治療法はない.わが国で報告され疾患責任遺伝子が発見された疾患であり,治療法の確立はわれわれ日本の責務である.今後は,ヒトへの臨床治験にむけ,核酸化合物の至適化,薬物投与量の調整,投与量の検討,毒性試験などを行い一日も早く臨床治験を実現させたい.また,SVA型レトロトランスポゾンの挿入により同様の機序でひき起こされる疾患(遺伝性高コレステロール血症,中性脂肪蓄積症)や,この機序がヒトの進化,多様性,疾患を生み出す機能の解明に関しても興味深いデータが得られたので,この研究が今後のレトロトランスポゾンやRNAの研究に貢献できればと考えている.
略歴:2006年 大阪大学大学院医学系研究科博士課程 修了,2011年より神戸大学大学院医学研究科 特命助教.
研究テーマ:福山型筋ジストロフィーの治療,レトロトランスポゾンと進化,高次脳機能の獲得.
関心事:福山型筋ジストロフィーに対するアンチセンス療法の臨床治験を一日も早く実現させ,患者さんへの治療を開始したい.
小林 千浩(Kazuhiro Kobayashi)
略歴:1998年 東京大学大学院医学系研究科博士課程 修了,同年 東京大学医科学研究所 特別研究員,2000年 大阪大学大学院医学系研究科 助手,2004年 英国Oxford大学 リサーチサイエンティスト,2006年 大阪大学大学院医学系研究科 助教を経て,2009年より神戸大学大学院医学研究科 准教授.
戸田 達史(Tatsushi Toda)
神戸大学大学院医学研究科 教授.
研究室URL:http://www.med.kobe-u.ac.jp/clgene/
© 2011 谷口 (池田) 真理子・小林千浩・戸田達史 Licensed under CC 表示 2.1 日本
(神戸大学大学院医学研究科 分子脳科学分野/神経内科学分野)
email:谷口 (池田) 真理子,小林千浩,戸田達史
DOI: 10.7875/first.author.2011.171
Pathogenic exon-trapping by SVA retrotransposon and rescue in Fukuyama muscular dystrophy.
Mariko Taniguchi-Ikeda, Kazuhiro Kobayashi, Motoi Kanagawa, Chih-chieh Yu, Kouhei Mori, Tetsuya Oda, Atsushi Kuga, Hiroki Kurahashi, Hasan O. Akman, Salvatore DiMauro, Ryuji Kaji, Toshifumi Yokota, Shin’ichi Takeda, Tatsushi Toda
Nature, 478, 127-131 (2011)
要 約
福山型筋ジストロフィーはわが国に多い常染色体劣性の神経・筋疾患であり,いまだ治療法はない.ほとんどの患者は疾患責任遺伝子であるfukutin遺伝子の3’側非翻訳領域にSVA型レトロトランスポゾンの挿入をもつが,その発症機序は不明であった.今回,筆者らは,福山型筋ジストロフィーがSVA型レトロトランスポゾンの挿入により誘導されるスプライシング異常症であることを証明した.そして,スプライシングを制御する治療が有効と考え,この異常なスプライシングを阻止するアンチセンスオリゴヌクレオチドを設計し,患者に由来する細胞に導入,また,疾患モデルマウスに対し局所注射ならびに全身投与を行った.その結果,患者に由来する細胞において正常なFukutinの発現が回復し,また,疾患モデルマウスにおいても正常なFukutinの発現,および,αジストログリカンの糖鎖修飾とラミニン結合能の回復が確認された.さらに,同様のSVA型レトロトランスポゾンの挿入変異をもつ2つの疾患において,そのエキソントラッピング機能による異常なスプライシングを観察した.また,ヒトに特異的なSVA型レトロトランスポゾンによるエキソントラッピングに由来する転写産物を脳において同定した.以上より,SVA型レトロトランスポゾンのもつエキソントラッピング機能はヒトの疾患や進化に関与しており,また,福山型筋ジストロフィーに対し初の根治療法の可能性が示唆された.
はじめに
福山型筋ジストロフィー(Fukuyama-type congenital muscular dystrophy:FCMD,MIM253800)はわが国に特有の疾患であり,先天性筋ジストロフィー,II型滑脳症,眼奇形の3症状を示す常染色体劣性の遺伝疾患である1).わが国で2番目に多い小児の筋疾患で,10代のうちに死にいたる重篤な疾患だが,いまだ治療法がない.福山型筋ジストロフィーの疾患責任遺伝子であるfukutin遺伝子は,1998年にポジショナルクローニング法により同定された2,3).ほとんどの患者はfukutin遺伝子の3’側非翻訳領域に動く遺伝子である約3 kbのSVA型レトロトランスポゾン(SVA:Sine-VNTR-Alu)の挿入変異を認める3).この変異は約100世代まえに日本人祖先のひとりに生じたもので,日本人の88人に1人が保因者で約3万の出生に1人の割合で発症する4).患者の骨格筋には細胞膜と基底膜をつなぐ糖タンパク質αジストログリカンのO-マンノース型糖鎖修飾に欠損があり,この糖鎖を介する細胞膜と基底膜とのあいだの結合が破綻するため重度の筋ジストロフィーが発症する5).類縁疾患のmuscle-eye-brain病,Walker-Warburg症候群などにおいてもαジストログリカンのO-マンノース型糖転移酵素における遺伝子異常がつぎつぎと同定され,αジストログリカノパチーと総称される新しい疾患概念が確立されている6).
fukutin遺伝子の産物であるFukutinはゴルジ体に局在し,既知の糖転移酵素とのアミノ酸配列相同性によりαジストログリカンの糖鎖修飾に関与する糖転移酵素ではないかと考えられているが,その機能を含め未知な点が多い.福山型筋ジストロフィーの発症機序については,SVA型レトロトランスポゾンの挿入変異が3’側非翻訳領域にあることでfukutin mRNAが不安定化し分解される,あるいは,SVA型レトロトランスポゾンのもつくり返し配列の影響でfukutin遺伝子の周辺がDNAメチル化やヒストン脱アセチル化などエピジェネティックな不活性化をうけ発現抑制や転写伸長障害が起こる,などと考えられてきたが,SVA型レトロトランスポゾンの配列にはグアニンおよびシトシンが豊富なため解析がむずかしく疾患機序は未解明のままであった.最近,SVA型レトロトランスポゾンが遺伝子の内部に挿入されることで選択的スプライシングや早期終止コドンの出現をひき起こし,遺伝子の機能に多様性をあたえ生物の進化,選択,多様性,あるいは,疾患の発症に関与している可能性が報告されている7).
1.福山型筋ジストロフィーはSVA型レトロトランスポゾンのエキソントラッピング機能がひき起こすスプライシング異常症である
fukutin遺伝子は10個のエキソンと長い3’側非翻訳領域をもつ.過去のデータでは,ノーザンハイブリダイゼーション法では患者のfukutin mRNAは検出されなかった3).今回,福山型筋ジストロフィーの病態を解析するため,fukutin遺伝子のそれぞれのエキソン,SVA型レトロトランスポゾンの挿入の周辺領域,および,3’側非翻訳領域の全域にわたり患者のリンパ球におけるfukutin遺伝子の発現について定量RT-PCR法による解析を行い,再度検証して健常人と比較した.その結果,fukutin遺伝子の5’側翻訳領域および3’側非翻訳領域のうちSVA型レトロトランスポゾンの挿入より3’側の領域の遺伝子発現は健常人と患者とのあいだでほとんど違いのない一方,その配列にはさまれる領域における遺伝子発現が患者において激減していた.よって,患者のmRNAでは翻訳領域およびSVA型レトロトランスポゾンの挿入のあいだのどこかで異常スプライシングが起こっているのではないかと考えた.
そこで,遺伝子発現の激減している配列をはさむ領域にPCRプライマーを設計し,健常人および患者のfukutin遺伝子cDNAを鋳型としてlong-PCRを行った.このlong-PCRはSVA型レトロトランスポゾンの配列にはグアニンやシトシンが多く,また,くり返し配列も多いため非常にむずかしくさまざまな条件設定が必要であったが,予想どおり,患者において特異的に正常より短い転写産物を検出できた.この短い転写産物は患者の脳および骨格筋においても検出された.
この転写産物の塩基配列を直接シークエンス法により確認したところ,患者において特異的にfukutin mRNAが異常なスプライシングをうけていた.この異常スプライシングはSVA型レトロトランスポゾンの配列に存在する強力なスプライシング受容部位が翻訳領域の最終エキソンにある潜在的なスプライシング供与部位を新たに活性化すること(エキソントラッピング)が原因となっていた(図1).そして,このスプライシングはfukutin mRNAの最終エキソンで起こっていたためナンセンス変異依存性mRNA分解機構(nonsense-mediated mRNA decay:NMD)によるmRNA分解をうけず,全体の発現量は低下していなかった.
以前,ノーザンハイブリダイゼーションを用いた実験でfukutin mRNAの検出できなかった理由としては,異常スプライシングをうけた患者のfukutin mRNAはグアニンやシトシンが多いSVA型レトロトランスポゾンに由来する転写産物を含むため高次構造が変化していた,あるいは,異常なスプライシングに由来するfukutin mRNAの泳動度がmRNAの大部分をしめるリボソームRNAのそれとほぼ一致するためハイブリダイゼーションが阻害され検出されなかった,などが考えられた.よって,ハイブリダイゼーションに競合するリボソームRNAを全RNAより除去し,電気泳動の際のRNAの変性条件を厳しく設定した.これらが効を奏して正常に比べ短い転写産物を検出することができたのであった.
2.福山型筋ジストロフィー患者のFukutinはゴルジ体から小胞体へ局在が変化する
この異常なスプライシングに由来するFukutinは,新しいエキソン11に存在するSVA型レトロトランスポゾンに由来する配列を含み,新しい終止コドンまで約552アミノ酸残基からなるものと予想された.内在性のFukutinは微量でありこれまで検出することはできなかったが,今回,免疫沈降法およびウェスタンブロット法を用いることではじめて内在性Fukutinの検出に成功した.この方法により,患者のリンパ芽球より異常なスプライシングに由来するFukutinを調べたところ,予想どおり,552アミノ酸残基の分子量に一致する62.3 kDaの位置にFukutinを検出した.これらの異常なスプライシングに由来するFukutinは健常人のリンパ芽球,患者の脳,そして,疾患マウスモデルの脳および骨格筋組織においても検出することができた.
この異常なスプライシングに由来する塩基配列をもつコンストラクトを作製しHeLa細胞へ導入して強制発現させたところ,Fukutinの局在が正常においてみられるゴルジ体から小胞体へと変化していた.よって,福山型筋ジストロフィーではFukutinの局在が変化することが疾患の発症につながっていると示唆された.以上のことより,福山型筋ジストロフィーはSVA型レトロトランスポゾンのエキソントラップ機能がもたらすスプライシング異常症であることが証明された.
3.SVA型レトロトランスポゾンに由来するエキソントラッピングはヒトの進化,選択,多様性,疾患の発症に関与している可能性がある
SVA型レトロトランスポゾンの挿入を認めるほかの遺伝性疾患においてもこのSVA型レトロトランスポゾンのもつエキソントラッピング機能が疾患の発症に関与しているのか検討した.常染色体劣性の遺伝性高コレステロール血症において,原因遺伝子LDLRAP1のイントロン1に約2.6 kbのセンス鎖のSVA型レトロトランスポゾンが挿入されているケースが報告されている8).また,中性脂肪蓄積ミオパチーにおいても,原因遺伝子PNPLA2のエキソン3に約1.9 kbのセンス鎖のSVA型レトロトランスポゾンの挿入を認めるケースが報告されている9).これら2つの疾患の患者に由来する転写産物を調べたところ,福山型筋ジストロフィーと同様にSVA型レトロトランスポゾンによるエキソントラッピングが起こっていたが,これらの転写産物はナンセンス変異依存性mRNA分解機構を阻害することにより検出が可能となった.また,チンパンジーにはないヒトに特異的なSVA型レトロトランスポゾンの挿入を認める新規の遺伝子(AB627340)において,エキソントラッピングに由来する転写産物をヒト脳において同定した.この新規の遺伝子の機能は未知であるがその転写産物はノンコーディングRNAであり,なんらかの機能をもつのではないかと考えている.
SVA型レトロトランスポゾンは進化的にもっとも新しいレトロトランスポゾンであり,霊長類に特異的である10).そして,ゲノムにおいて進化とともにその数が増し,ヒトには約2700コピーが存在するといわれている.SVA型レトロトランスポゾンはエキソントラッピングによりヒトの脳においてさらに新たな機能を獲得し,進化や高次脳機能の獲得に関与しているかもしれない.よって,エキソントラッピングはヒトの進化,多様性,疾患に関与している可能性があり非常に興味深い結果であった.
4.福山型筋ジストロフィーにおけるスプライシングの異常を制御するアンチセンスオリゴヌクレオチドの設計
筆者らはすでに,健常人型および患者型のfukutin遺伝子をマウスのfukutin遺伝子に導入したノックインモデルマウス系を構築している11).このモデルマウスはマウスfukutin遺伝子のエキソン9の3’側にヒトfukutin遺伝子のエキソン10から3’側非翻訳領域につづく配列をもつため,患者と同じスプライシング異常を呈することが骨格筋,脳のほか,肝臓,腎臓において確認された.
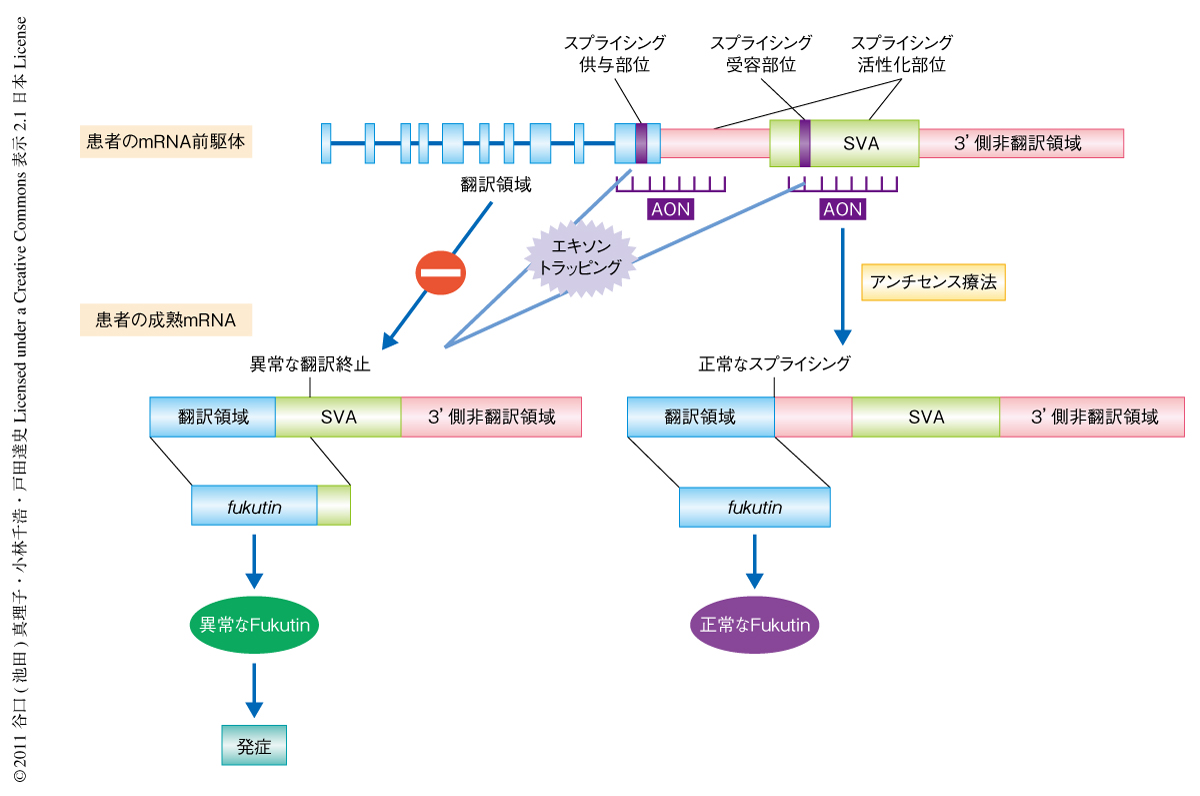
そこで,この異常なスプライシングをひき起こすスプライシング標的配列として,スプライシング受容部位,スプライシング活性化部位,スプライシング供与部位に対しスプライシングを制御するようなアンチセンスオリゴヌクレオチドをmRNA前駆体において結合させ,異常スプライシングを阻止し正常なスプライシングを行わせるという治療法が有効ではないかと考えた(図2).これらの標的配列に対し2’-O-メチルRNAを用いて25塩基長のアンチセンスオリゴヌクレオチドを網羅的に設計し,ノックインモデルマウスに由来するES細胞系,患者に由来する初代筋芽細胞系,患者に由来する初代線維芽細胞系,患者に由来するリンパ芽球系など,さまざまな細胞系に投与しその効果を検討した.その結果,スプライシングが正常となりかつ正常なfukutin mRNAをもっとも効率よく回復させたのは,スプライシング受容部位,スプライシング供与部位,スプライシング活性化部位に設計した3種類のアンチセンスオリゴヌクレオチドのカクテル投与(AEDカクテル投与)であった.
5.アンチセンスオリゴヌクレオチドによる福山型筋ジストロフィーのモデルマウスの治療効果
この結果をもとに,AEDカクテル投与が疾患モデルマウスおよび患者に由来する細胞系において治療効果を発揮するかどうか検討を行った.まず,疾患モデルマウスの前脛骨筋へのAEDカクテルの局所注射を行ったところ,終止コドンまで達する正常なfukutin mRNAが約30%にまで回復した.また,患者に由来するリンパ芽球にAEDカクテルをエレクトロポレーション法により導入したところ60%以上の回復をみた.これらの試料における正常Fukutinの回復を検討したところ,AEDカクテル投与群において正常なFukutinが検出された.また,疾患モデルマウスの前脛骨筋においてO-マンノース型糖鎖の回復をウェスタンブロット法により確認したところ,糖鎖の回復を示唆する分子量の増加がみられた.疾患モデルマウスに尾静脈を経由してAEDカクテルを全身投与したところ局所注射と同様にO-マンノース型糖鎖の回復がみられた.最後に,患者に由来する筋芽細胞を使いAEDカクテル投与によるラミニンクラスタリングアッセイを行った.患者に由来する初代筋芽細胞では筋管でのαジストログリカンの発現は激減している.しかし,AEDカクテル投与により,患者に由来する筋管には蛍光免疫染色により正常においてみられる程度のαジストログリカンの糖鎖が検出され,同様に,正常と同じ程度に回復した典型的なラミニンクラスタリングが観察され,ラミニン結合能の回復が確認された.これらの結果は,AEDカクテル投与により福山型筋ジストロフィーが機能的にも回復する可能性を示唆した.
アンチセンスオリゴヌクレオチドによりスプライシングの制御を標的とした治療法としては,現在,もっとも頻度の高い筋ジストロフィーであるデュシャンヌ型筋ジストロフィーに対するエキソンスキップ療法が国際治験第III相をむかえており,アンチセンスオリゴヌクレオチドはもっとも実用に近い治療薬剤として注目されている12).この治療法はわが国すべての福山型筋ジストロフィー患者を対象に同一の方法で行えるものであり,根本的な分子標的治療への道を開くものである.今後,医療応用の実現にむけ毒性試験などさらなる検討をしていきたいと考えている.
おわりに
わが国では,毎年100名弱の福山型筋ジストロフィー患者が出生し,1000名から2000名弱の患者が存在する.患児は高度の精神および運動発達の遅延をともない,生涯にわたり歩行が困難で全面的な介護を必要する悲惨な疾患であるが,有効な治療法はない.わが国で報告され疾患責任遺伝子が発見された疾患であり,治療法の確立はわれわれ日本の責務である.今後は,ヒトへの臨床治験にむけ,核酸化合物の至適化,薬物投与量の調整,投与量の検討,毒性試験などを行い一日も早く臨床治験を実現させたい.また,SVA型レトロトランスポゾンの挿入により同様の機序でひき起こされる疾患(遺伝性高コレステロール血症,中性脂肪蓄積症)や,この機序がヒトの進化,多様性,疾患を生み出す機能の解明に関しても興味深いデータが得られたので,この研究が今後のレトロトランスポゾンやRNAの研究に貢献できればと考えている.
文 献
- Fukuyama, Y., Osawa, M. & Suzuki, H.: Congenital progressive muscular dystrophy of the Fukuyama type: clinical, genetic and pathological considerations. Brain Dev., 3, 1-29 (1981)[PubMed]
- Toda, T., Segawa, M., Nomura, Y. et al.: Localization of a gene for Fukuyama type congenital muscular dystrophy to chromosome 9q31-33. Nat. Genet., 5, 283-286 (1993)[PubMed]
- Kobayashi, K., Nakahori, Y., Miyake, M. et al.: An ancient retrotransposal insertion causes Fukuyama-type congenital muscular dystrophy. Nature, 394, 388-392 (1998)[PubMed]
- Watanabe, M., Kobayashi, K., Jin, F. et al.: Founder SVA retrotransposal insertion in Fukuyama-type congenital muscular dystrophy and its origin in Japanese and Northeast Asian populations. Am. J. Med. Genet. A, 138, 344-348 (2005)[PubMed]
- Michele, D. E., Barresi, R., Kanagawa, M. et al.: Post-translational disruption of dystroglycan-ligand interactions in congenital muscular dystrophies. Nature, 418, 417-422 (2002)[PubMed]
- Barresi, R. & Campbell, K. P.: Dystroglycan: from biosynthesis to pathogenesis of human disease. J. Cell Sci., 119, 199-207 (2006)[PubMed]
- Hancks, D. C., Ewing, A. D., Chen, J. E. et al.: Exon-trapping mediated by the human retrotransposon SVA. Genome Res., 19, 1983-1991 (2009)[PubMed]
- Wilund, K. R., Yi, M., Campagna, F. et al.: Molecular mechanisms of autosomal recessive hypercholesterolemia. Hum. Mol. Genet., 11, 3019-3030 (2002)[PubMed]
- Akman, H. O., Davidzon, G., Tanji, K. et al.: Neutral lipid storage disease with subclinical myopathy due to a retrotransposal insertion in the PNPLA2 gene. Neuromuscl. Disord., 20, 397-402 (2010)[PubMed]
- Cordaux, R. & Batzer, M. A.: The impact of retrotransposons on human genome evolution. Nat. Rev. Genet., 10, 691-703 (2009)[PubMed]
- Kanagawa, M., Nishimoto, A., Chiyonobu, T. et al.: Residual laminin-binding activity and enhanced dystroglycan glycosylation by LARGE in novel model mice to dystroglycanopathy. Hum. Mol. Genet., 18, 621-631 (2009)[PubMed]
- Cirak. S., Arechavala-Gomeza, V., Guglieri, M. et al.: Exon skipping and dystrophin restoration in patients with Duchenne muscular dystrophy after systemic phosphorodiamidate morpholino oligomer treatment: an open-label, phase 2, dose-escalation study. Lancet, 378, 595-605 (2011)[PubMed]
著者プロフィール
略歴:2006年 大阪大学大学院医学系研究科博士課程 修了,2011年より神戸大学大学院医学研究科 特命助教.
研究テーマ:福山型筋ジストロフィーの治療,レトロトランスポゾンと進化,高次脳機能の獲得.
関心事:福山型筋ジストロフィーに対するアンチセンス療法の臨床治験を一日も早く実現させ,患者さんへの治療を開始したい.
小林 千浩(Kazuhiro Kobayashi)
略歴:1998年 東京大学大学院医学系研究科博士課程 修了,同年 東京大学医科学研究所 特別研究員,2000年 大阪大学大学院医学系研究科 助手,2004年 英国Oxford大学 リサーチサイエンティスト,2006年 大阪大学大学院医学系研究科 助教を経て,2009年より神戸大学大学院医学研究科 准教授.
戸田 達史(Tatsushi Toda)
神戸大学大学院医学研究科 教授.
研究室URL:http://www.med.kobe-u.ac.jp/clgene/
© 2011 谷口 (池田) 真理子・小林千浩・戸田達史 Licensed under CC 表示 2.1 日本