破骨細胞はセマフォリン4Dを介して骨の形成を抑制する
根岸-古賀貴子・高柳 広
(東京医科歯科大学大学院医歯学総合研究科 分子情報伝達学)
email:根岸-古賀貴子,高柳 広
DOI: 10.7875/first.author.2011.168
Suppression of bone formation by osteoclastic expression of semaphorin 4D.
Takako Negishi-Koga, Masahiro Shinohara, Noriko Komatsu, Haruhiko Bito, Tatsuhiko Kodama, Roland H Friedel, Hiroshi Takayanagi
Nature Medicine, 17, 1473-1480 (2011)
現在,骨粗鬆症に対する薬剤は骨吸収を抑制するものが中心であり,骨形成を促進する効果をもつものはほとんどない.したがって,骨形成の制御因子を同定することが急務である.この研究では,破骨細胞が神経軸索のガイダンスタンパク質として知られるセマフォリン4Dを産生し骨形成を強力に抑制することを見い出した.セマフォリン4Dは骨芽細胞に発現する受容体であるプレキシンB1に結合すると低分子量GTPaseであるRhoAを活性化し,骨芽細胞の分化に必要なIGF-1シグナルを阻害して分化を抑制すると同時に,骨芽細胞の運動能を制御して骨形成を抑制する.セマフォリン4DノックアウトマウスやプレキシンB1ノックアウトマウス,さらに,骨芽細胞に特異的に優位抑制型RhoAを発現するマウスは骨形成が亢進して骨硬化症を呈した.また,抗セマフォリン4D抗体を用いて骨粗鬆症モデルマウスの骨量減少を回復させることにも成功した.セマフォリン4Dは骨形成の促進剤の開発において新しい分子標的となるだろう.
骨粗鬆症や関節リウマチは罹患率の非常に高い疾患であり,骨折や骨破壊などにより運動機能が損なわれ生活の質が著しく低下する.超高齢化社会をまえにして,骨粗鬆症,関節リウマチ,がんによる骨の破壊に対する治療法の開発は重要な課題である.これまで,骨粗鬆症の治療としては骨吸収を標的とした方法が主流であったが,骨を形成する骨芽細胞に直接的に作用して骨形成を促進させることが,より効果的な治療法だと考えられる.また,関節リウマチやがんにみられる骨病変に対して,骨を修復あるいは再生させるような治療法はない.
骨組織は,古くなった骨を破骨細胞が吸収し,そののち,骨芽細胞が骨吸収部位を新しい骨で完全に埋めることにより再構築される1).この過程は骨リモデリングとよばれ,生涯にわたりくり返されて骨組織は健全な骨量と骨質を維持する2).骨リモデリングは破骨細胞や骨芽細胞といったさまざまな細胞の相互作用により厳密に制御されており,とくに,吸収した骨と同量の骨を形成するために,骨吸収が骨形成を促進する分子機構である共役機構が存在する3-6).TGFβやIGFなど骨基質に多量に存在するサイトカインは,骨吸収により放出されると骨芽細胞の骨形成を促進する共役タンパク質として機能することが知られてきた3,6).最近では,破骨細胞と骨芽細胞との細胞間相互作用による制御も新たな共役機構として注目されるようになってきた5).
骨リモデリングの最初の段階において,破骨細胞が古くなった骨を完全に除去するため骨形成は骨吸収が完了するまで抑制されなければならないと考えられるが,そのような破骨細胞による骨形成の抑制機構は不明であった.この研究では,破骨細胞が産生する骨形成の抑制タンパク質としてセマフォリン4Dを同定してその分子機構を解明し,また,抗セマフォリン4D抗体を用いたマウス骨粗鬆症に対する骨形成の促進治療に成功した.
神経軸索のガイダンスタンパク質のひとつエフリンB2とその受容体EphB4が破骨細胞と骨芽細胞との細胞間相互作用にはたらく共役タンパク質として注目をあびているが,筆者らは,骨リモデリングに関与する神経軸索のガイダンスタンパク質を探索する過程で,セマフォリンファミリーに属するタンパク質のひとつセマフォリン4Dが7,8),破骨細胞に特異的に非常に高いレベルで発現することを見い出した.
セマフォリン4Dのノックアウトマウスは破骨細胞の分化や骨吸収に異常はみられず,骨芽細胞数と骨形成の増加による顕著な骨量の増加を示した.セマフォリン4Dノックアウトマウスより得た骨髄細胞を野生型マウスに移植すると骨量は増加し,逆に,野生型マウスより得た骨髄細胞をセマフォリン4Dノックアウトマウスに移植すると骨量は野生型マウスと同じ程度にまで低下した.破骨細胞は移植した骨髄細胞に由来するため,セマフォリン4Dノックアウトマウスの骨量の増加は破骨細胞の欠陥に起因し,破骨細胞の産生するセマフォリン4Dは骨形成を抑制することが示唆された.
セマフォリン4Dの細胞外領域と免疫グロブリンG1のFc領域とを融合させた可溶性のFc-セマフォリン4D融合タンパク質を作製し,これによりマウスの頭蓋冠に由来する骨芽細胞の骨形成に対するセマフォリン4Dの効果を検討した.その結果,骨芽細胞の初期分化マーカーであるアルカリホスファターゼの活性や後期分化マーカーであるオステオカルシンやI型コラーゲンの遺伝子発現,さらには,成熟した骨芽細胞の骨形成はFc-セマフォリン4D融合タンパク質により有意に抑制された.
セマフォリン4Dは膜貫通型のほか,タンパク質分解をうけて細胞膜から遊離した分泌型としても存在する.セマフォリン4Dは破骨細胞ではおもに膜貫通型として発現していたが,一部は分泌型として産生されていた.そこで,破骨細胞そのもの,または,破骨細胞の培養上清を骨芽細胞の培養系に添加して骨形成能を検討した.野生型マウスの破骨細胞とその培養上清は骨形成に影響をあたえなかったが,セマフォリン4Dノックアウトマウスの破骨細胞とその培養上清はどちらも骨形成を亢進させた.これは,破骨細胞は骨形成を正にも負にも制御しているが,セマフォリン4Dを欠損することで抑制作用が減少し骨形成の促進効果が観察されたものと考えられた.つまり,破骨細胞はセマフォリン4Dを産生して骨形成を抑制することが証明された.
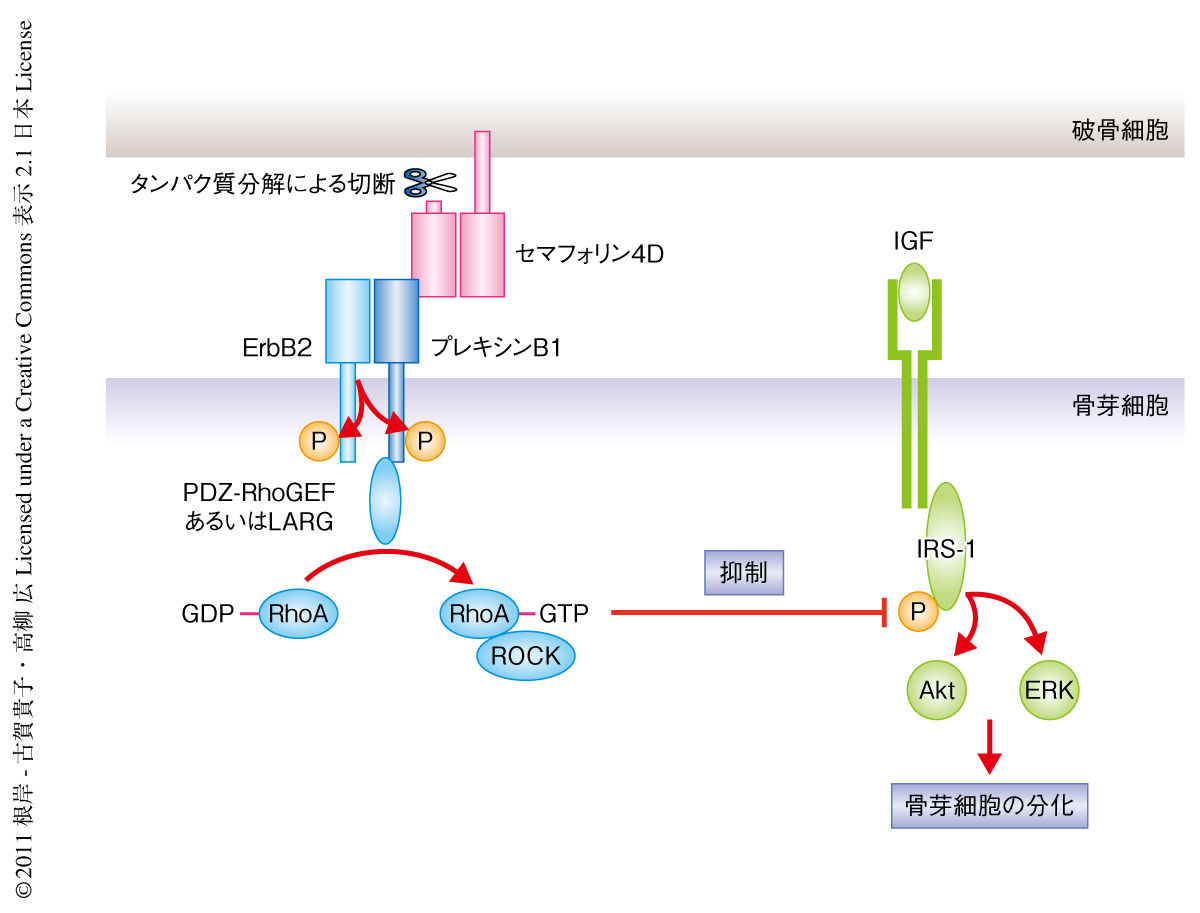
セマフォリン4Dはリンパ系細胞ではCD72,非リンパ系細胞ではB型プレキシン(プレキシンB1~プレキシンB3)により認識される7,8).骨芽細胞では細胞分化にともないプレキシンB1の発現が増強した.プレキシンB1はErbB2やMetといった受容体型チロシンキナーゼと会合し,プレキシンB1がセマフォリン4Dを認識すると受容体型チロシンキナーゼが活性化して自己リン酸化するとともに,プレキシンB1をリン酸化し細胞内にシグナルが伝達される8).骨芽細胞ではセマフォリン4Dの刺激によりErbB2が自己リン酸化され,つづいてErbB2の活性化に依存してプレキシンB1がリン酸化された.
プレキシンB1のノックアウトマウスはセマフォリン4Dノックアウトマウスと同様の骨量の増加を呈した.プレキシンB1ノックアウトマウスの骨芽細胞における骨形成はFc-セマフォリン4D融合タンパク質では抑制されず,また,野生型マウスの骨芽細胞におけるFc-セマフォリン4D融合タンパク質による骨形成の抑制効果は抗プレキシンB1抗体により阻害されたことから,プレキシンB1は骨芽細胞においてセマフォリン4Dを認識する受容体として機能していることが示唆された.
セマフォリン-プレキシンシグナルはRhoファミリーGTPaseを介したアクチン細胞骨格の再編成をへて細胞形態や細胞運動を制御する8).セマフォリン4Dにより刺激した野生型マウスの骨芽細胞ではGTP結合型(活性化型)RhoAが増加し,プレキシンB1ノックアウトマウスの骨芽細胞やErbB2阻害剤で処理した細胞ではセマフォリン4Dの刺激による活性化型RhoAの増加は抑制された.セマフォリン4DはRacの活性化には影響しなかった.プレキシンB1はその細胞内領域にR-Rasを特異的に活性化するGAPドメインをもち,また,細胞内領域にあるC末端側にRhoAに対する一部のグアニンヌクレオチド交換因子(guanine nucleotide exchange factor:GEF)が結合するPDZドメインをもつ.そこで,R-Rasとの相互作用に必要なアルギニン残基をアラニン残基に置換したプレキシンB1変異体と,RhoAに特異的なGEFとの相互作用に必要なPDZドメインを欠失したプレキシンB1変異体を作製して,セマフォリン4D-プレキシンB1シグナルへの影響を検討した.プレキシンB1あるいはR-Rasと相互作用しないプレキシンB1変異体をレトロウイルスを用いてプレキシンB1ノックアウトマウスに由来する骨芽細胞に導入するとセマフォリン4DによるRhoAの活性化と骨芽細胞の抑制効果は回復したが,PDZドメインを欠失したプレキシンB1変異体を導入してもこれらは回復しなかった.プレキシンB1のPDZドメインに結合することが知られるPDZ-RhoGEFやLARGは骨芽細胞においてもプレキシンB1と相互作用した.また,RhoAのエフェクタータンパク質であるROCKの阻害剤であるY-27632やRKIで処理した骨芽細胞の骨形成はセマフォリン4Dにより抑制されなかった.これらのことから,セマフォリン4D-プレキシンB1シグナルはRhoAを活性化して骨形成を抑制することが示唆された.
RhoAの骨芽細胞における生理的な役割を明らかにするため,骨芽細胞に特異的に優位抑制型RhoAを発現するマウスを作製した.この優位抑制型RhoA発現マウスはセマフォリン4DノックアウトマウスやプレキシンB1ノックアウトマウスと同様に骨芽細胞による骨形成が亢進して骨量の増加を呈した.また,Fc-セマフォリン4D融合タンパク質はこの優位抑制型RhoA発現マウスに由来する骨芽細胞の骨形成を抑制しなかった.これまで,骨形成におけるRhoAの寄与についてin vitroでの知見はいくつか報告されていたが,この研究により,はじめて個体レベルでのRhoAの重要性が証明された.
セマフォリン4D-プレキシンB1-RhoAシグナルはどのように骨形成を抑制するのかという疑問があがった.RhoA-ROCK経路は胚発生においてIRS-1におけるチロシンリン酸化を低下させてIGF-1シグナルを抑制する9).このIGF-1シグナルは骨芽細胞に必須の分化シグナルである.セマフォリン4Dで刺激した骨芽細胞ではIRS-1のチロシンリン酸化とその下流で機能するAktやErkの活性化が低下していた.また,アデノウイルスを用いて恒常的活性化型RhoAを導入した骨芽細胞ではIGF-1の刺激によるIRS-1のチロシンリン酸化が低下し,一方,優位抑制型RhoAを導入した骨芽細胞やROCK阻害剤で処理した骨芽細胞ではIRS-1のチロシンリン酸化は亢進していた.以上より,セマフォリン4DはRhoAを活性化してIGF-1シグナルを阻害することにより骨芽細胞の分化を抑制していることがわかった(図1).
また,セマフォリン4Dの刺激により骨芽細胞の細胞間接着に関与するカドヘリン11の発現が低下し,ボイデンチャンバーアッセイにより細胞の運動性の増強していることがわかった.骨芽細胞の運動性がどのように骨代謝に寄与するのか,骨組織の切片を骨芽細胞マーカータンパク質であるオステオカルシンの抗体を用いて免疫染色した.野生型マウスの骨表面では破骨細胞の近傍に骨芽細胞が観察されることはほとんどない.それに対して,セマフォリン4DノックアウトマウスやプレキシンB1ノックアウトマウス,骨芽細胞に特異的に優位抑制型RhoAを発現するマウスでは破骨細胞の近くに存在する多数の骨芽細胞が観察され,セマフォリン4Dは骨芽細胞の適切な局在に必要であることが示唆された.これらの結果を統合して考えると,破骨細胞は古い骨を吸収しおえるまでセマフォリン4Dを産生して骨芽細胞を骨吸収部位から隔離するとともに,骨吸収部位に侵入してきた骨芽細胞の前駆細胞の分化を抑制しているものと推察された.
骨量減少性疾患の治療法としてセマフォリン4Dを抑制することが有効であるかどうか,卵巣摘出術によるマウス骨粗鬆症モデルを用いて検討した.卵巣摘出後から8週間にわたり週に1回,抗セマフォリン4D抗体を投与する予防実験と,卵巣摘出から6週間後のすでに骨粗鬆症を発症したマウスに3週間にわたり3日に1回,抗セマフォリン4D抗体を投与する治療実験を行った.両方の実験において,抗セマフォリン4D抗体は破骨細胞の骨吸収に影響をあたえることなく骨形成を亢進させ骨粗鬆症マウスの骨量を増加させた.また,抗セマフォリン4D抗体はヒトに由来する骨芽細胞による骨形成に対しても抑制効果をもつことが明らかになり,セマフォリン4D-プレキシンB1シグナルを遮断することが骨形成を促進させる新しい治療法として有望であることが示された.
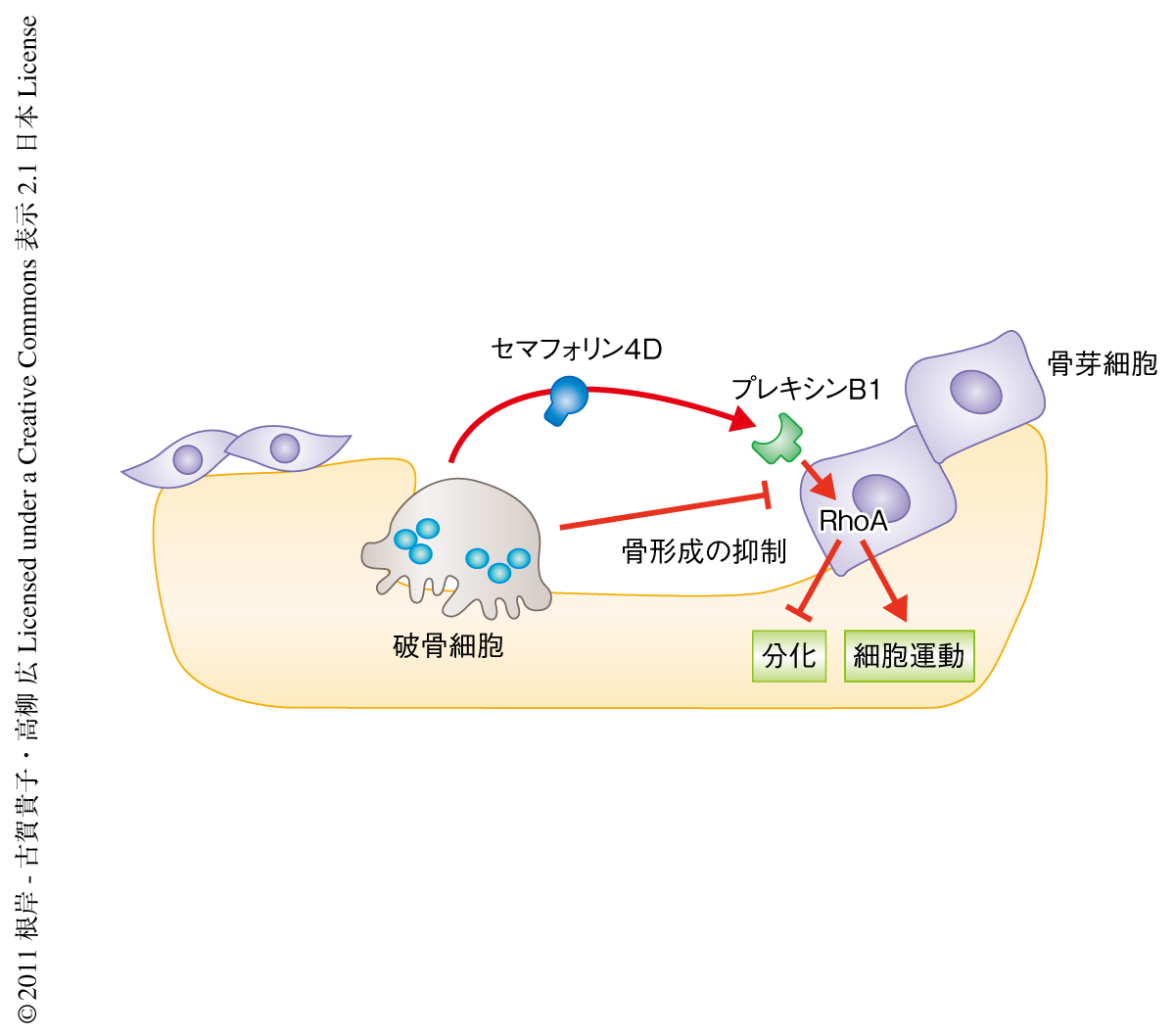
骨リモデリングは,破骨細胞による骨吸収を開始するステージ(骨吸収期),骨吸収が終了し骨芽細胞による骨形成へと移行するステージ(移行期),新生骨を形成するステージ(骨形成期),の3つのステージから成り立つと考えられる5).骨吸収期では,骨吸収部位への骨芽細胞のリクルートや骨形成は骨吸収が終了するまで抑制されていなければならない.破骨細胞の産生するセマフォリン4Dは,このステージにおいて骨芽細胞の分化や骨吸収部位へのリクルートを抑制するタンパク質として機能しているものと考えられた(図2).移行期において,骨吸収が骨形成を開始させる共役機構が骨リモデリングの中心的な制御機構としてとらえられてきたが,共役が解離すべき骨吸収期においては,セマフォリン4Dのようなタンパク質が骨リモデリングにおいて重要な役割をはたすものと考えられた.
セマフォリン4Dはアミノ酸配列の類似性からセマフォリンファミリーに分類されるが,活性化T細胞に発現してB細胞や樹状細胞の活性化を制御するなど,免疫応答をつかさどる免疫セマフォリンとしてはじめて単離されたタンパク質である7).また最近では,一部のがん細胞にも発現することが明らかになってきた10).これらの細胞が産生するセマフォリン4Dは骨形成を抑制している可能性がある.したがって,自己免疫疾患である関節リウマチやがんによる骨破壊に対しても,セマフォリン4D-プレキシンB1シグナルを遮断する方法が骨形成の促進治療として有効である可能性が高い.現在,骨形成の促進剤として唯一使用されている副甲状腺ホルモン製剤のほか,抗Sost抗体が新たな骨形成の促進剤として開発されているが,骨粗鬆症,関節リウマチ,がんによる骨破壊に対する骨形成の治療法の開発においてセマフォリン4D-プレキシンB1-RhoAシグナルは有力な分子標的となるであろう.
略歴:2002年 東京大学大学院農学生命科学研究科 修了,同年 東京大学大学院医学系研究科 博士研究員,2003年 東京医科歯科大学大学院医歯学総合研究科 博士研究員を経て,2007年より同 特任助教(現 客員助教).
研究テーマ:骨と全身組織との相互作用ネットワークの解明.
高柳 広(Hiroshi Takayanagi)
東京医科歯科大学大学院医歯学総合研究科 教授
研究室URL:http://homepage.mac.com/osteoimmunology/
© 2011 根岸-古賀貴子・高柳 広 Licensed under CC 表示 2.1 日本
(東京医科歯科大学大学院医歯学総合研究科 分子情報伝達学)
email:根岸-古賀貴子,高柳 広
DOI: 10.7875/first.author.2011.168
Suppression of bone formation by osteoclastic expression of semaphorin 4D.
Takako Negishi-Koga, Masahiro Shinohara, Noriko Komatsu, Haruhiko Bito, Tatsuhiko Kodama, Roland H Friedel, Hiroshi Takayanagi
Nature Medicine, 17, 1473-1480 (2011)
要 約
現在,骨粗鬆症に対する薬剤は骨吸収を抑制するものが中心であり,骨形成を促進する効果をもつものはほとんどない.したがって,骨形成の制御因子を同定することが急務である.この研究では,破骨細胞が神経軸索のガイダンスタンパク質として知られるセマフォリン4Dを産生し骨形成を強力に抑制することを見い出した.セマフォリン4Dは骨芽細胞に発現する受容体であるプレキシンB1に結合すると低分子量GTPaseであるRhoAを活性化し,骨芽細胞の分化に必要なIGF-1シグナルを阻害して分化を抑制すると同時に,骨芽細胞の運動能を制御して骨形成を抑制する.セマフォリン4DノックアウトマウスやプレキシンB1ノックアウトマウス,さらに,骨芽細胞に特異的に優位抑制型RhoAを発現するマウスは骨形成が亢進して骨硬化症を呈した.また,抗セマフォリン4D抗体を用いて骨粗鬆症モデルマウスの骨量減少を回復させることにも成功した.セマフォリン4Dは骨形成の促進剤の開発において新しい分子標的となるだろう.
はじめに
骨粗鬆症や関節リウマチは罹患率の非常に高い疾患であり,骨折や骨破壊などにより運動機能が損なわれ生活の質が著しく低下する.超高齢化社会をまえにして,骨粗鬆症,関節リウマチ,がんによる骨の破壊に対する治療法の開発は重要な課題である.これまで,骨粗鬆症の治療としては骨吸収を標的とした方法が主流であったが,骨を形成する骨芽細胞に直接的に作用して骨形成を促進させることが,より効果的な治療法だと考えられる.また,関節リウマチやがんにみられる骨病変に対して,骨を修復あるいは再生させるような治療法はない.
骨組織は,古くなった骨を破骨細胞が吸収し,そののち,骨芽細胞が骨吸収部位を新しい骨で完全に埋めることにより再構築される1).この過程は骨リモデリングとよばれ,生涯にわたりくり返されて骨組織は健全な骨量と骨質を維持する2).骨リモデリングは破骨細胞や骨芽細胞といったさまざまな細胞の相互作用により厳密に制御されており,とくに,吸収した骨と同量の骨を形成するために,骨吸収が骨形成を促進する分子機構である共役機構が存在する3-6).TGFβやIGFなど骨基質に多量に存在するサイトカインは,骨吸収により放出されると骨芽細胞の骨形成を促進する共役タンパク質として機能することが知られてきた3,6).最近では,破骨細胞と骨芽細胞との細胞間相互作用による制御も新たな共役機構として注目されるようになってきた5).
骨リモデリングの最初の段階において,破骨細胞が古くなった骨を完全に除去するため骨形成は骨吸収が完了するまで抑制されなければならないと考えられるが,そのような破骨細胞による骨形成の抑制機構は不明であった.この研究では,破骨細胞が産生する骨形成の抑制タンパク質としてセマフォリン4Dを同定してその分子機構を解明し,また,抗セマフォリン4D抗体を用いたマウス骨粗鬆症に対する骨形成の促進治療に成功した.
1.破骨細胞が産生するセマフォリン4Dは骨の形成を抑制する
神経軸索のガイダンスタンパク質のひとつエフリンB2とその受容体EphB4が破骨細胞と骨芽細胞との細胞間相互作用にはたらく共役タンパク質として注目をあびているが,筆者らは,骨リモデリングに関与する神経軸索のガイダンスタンパク質を探索する過程で,セマフォリンファミリーに属するタンパク質のひとつセマフォリン4Dが7,8),破骨細胞に特異的に非常に高いレベルで発現することを見い出した.
セマフォリン4Dのノックアウトマウスは破骨細胞の分化や骨吸収に異常はみられず,骨芽細胞数と骨形成の増加による顕著な骨量の増加を示した.セマフォリン4Dノックアウトマウスより得た骨髄細胞を野生型マウスに移植すると骨量は増加し,逆に,野生型マウスより得た骨髄細胞をセマフォリン4Dノックアウトマウスに移植すると骨量は野生型マウスと同じ程度にまで低下した.破骨細胞は移植した骨髄細胞に由来するため,セマフォリン4Dノックアウトマウスの骨量の増加は破骨細胞の欠陥に起因し,破骨細胞の産生するセマフォリン4Dは骨形成を抑制することが示唆された.
セマフォリン4Dの細胞外領域と免疫グロブリンG1のFc領域とを融合させた可溶性のFc-セマフォリン4D融合タンパク質を作製し,これによりマウスの頭蓋冠に由来する骨芽細胞の骨形成に対するセマフォリン4Dの効果を検討した.その結果,骨芽細胞の初期分化マーカーであるアルカリホスファターゼの活性や後期分化マーカーであるオステオカルシンやI型コラーゲンの遺伝子発現,さらには,成熟した骨芽細胞の骨形成はFc-セマフォリン4D融合タンパク質により有意に抑制された.
セマフォリン4Dは膜貫通型のほか,タンパク質分解をうけて細胞膜から遊離した分泌型としても存在する.セマフォリン4Dは破骨細胞ではおもに膜貫通型として発現していたが,一部は分泌型として産生されていた.そこで,破骨細胞そのもの,または,破骨細胞の培養上清を骨芽細胞の培養系に添加して骨形成能を検討した.野生型マウスの破骨細胞とその培養上清は骨形成に影響をあたえなかったが,セマフォリン4Dノックアウトマウスの破骨細胞とその培養上清はどちらも骨形成を亢進させた.これは,破骨細胞は骨形成を正にも負にも制御しているが,セマフォリン4Dを欠損することで抑制作用が減少し骨形成の促進効果が観察されたものと考えられた.つまり,破骨細胞はセマフォリン4Dを産生して骨形成を抑制することが証明された.
2.プレキシンB1はセマフォリン4Dを認識して骨の形成を抑制する
セマフォリン4Dはリンパ系細胞ではCD72,非リンパ系細胞ではB型プレキシン(プレキシンB1~プレキシンB3)により認識される7,8).骨芽細胞では細胞分化にともないプレキシンB1の発現が増強した.プレキシンB1はErbB2やMetといった受容体型チロシンキナーゼと会合し,プレキシンB1がセマフォリン4Dを認識すると受容体型チロシンキナーゼが活性化して自己リン酸化するとともに,プレキシンB1をリン酸化し細胞内にシグナルが伝達される8).骨芽細胞ではセマフォリン4Dの刺激によりErbB2が自己リン酸化され,つづいてErbB2の活性化に依存してプレキシンB1がリン酸化された.
プレキシンB1のノックアウトマウスはセマフォリン4Dノックアウトマウスと同様の骨量の増加を呈した.プレキシンB1ノックアウトマウスの骨芽細胞における骨形成はFc-セマフォリン4D融合タンパク質では抑制されず,また,野生型マウスの骨芽細胞におけるFc-セマフォリン4D融合タンパク質による骨形成の抑制効果は抗プレキシンB1抗体により阻害されたことから,プレキシンB1は骨芽細胞においてセマフォリン4Dを認識する受容体として機能していることが示唆された.
3.RhoAは骨芽細胞におけるセマフォリン4D-プレキシンB1シグナルを制御する
セマフォリン-プレキシンシグナルはRhoファミリーGTPaseを介したアクチン細胞骨格の再編成をへて細胞形態や細胞運動を制御する8).セマフォリン4Dにより刺激した野生型マウスの骨芽細胞ではGTP結合型(活性化型)RhoAが増加し,プレキシンB1ノックアウトマウスの骨芽細胞やErbB2阻害剤で処理した細胞ではセマフォリン4Dの刺激による活性化型RhoAの増加は抑制された.セマフォリン4DはRacの活性化には影響しなかった.プレキシンB1はその細胞内領域にR-Rasを特異的に活性化するGAPドメインをもち,また,細胞内領域にあるC末端側にRhoAに対する一部のグアニンヌクレオチド交換因子(guanine nucleotide exchange factor:GEF)が結合するPDZドメインをもつ.そこで,R-Rasとの相互作用に必要なアルギニン残基をアラニン残基に置換したプレキシンB1変異体と,RhoAに特異的なGEFとの相互作用に必要なPDZドメインを欠失したプレキシンB1変異体を作製して,セマフォリン4D-プレキシンB1シグナルへの影響を検討した.プレキシンB1あるいはR-Rasと相互作用しないプレキシンB1変異体をレトロウイルスを用いてプレキシンB1ノックアウトマウスに由来する骨芽細胞に導入するとセマフォリン4DによるRhoAの活性化と骨芽細胞の抑制効果は回復したが,PDZドメインを欠失したプレキシンB1変異体を導入してもこれらは回復しなかった.プレキシンB1のPDZドメインに結合することが知られるPDZ-RhoGEFやLARGは骨芽細胞においてもプレキシンB1と相互作用した.また,RhoAのエフェクタータンパク質であるROCKの阻害剤であるY-27632やRKIで処理した骨芽細胞の骨形成はセマフォリン4Dにより抑制されなかった.これらのことから,セマフォリン4D-プレキシンB1シグナルはRhoAを活性化して骨形成を抑制することが示唆された.
RhoAの骨芽細胞における生理的な役割を明らかにするため,骨芽細胞に特異的に優位抑制型RhoAを発現するマウスを作製した.この優位抑制型RhoA発現マウスはセマフォリン4DノックアウトマウスやプレキシンB1ノックアウトマウスと同様に骨芽細胞による骨形成が亢進して骨量の増加を呈した.また,Fc-セマフォリン4D融合タンパク質はこの優位抑制型RhoA発現マウスに由来する骨芽細胞の骨形成を抑制しなかった.これまで,骨形成におけるRhoAの寄与についてin vitroでの知見はいくつか報告されていたが,この研究により,はじめて個体レベルでのRhoAの重要性が証明された.
4.セマフォリン4DはRhoAを介して骨芽細胞の分化と細胞運動を制御する
セマフォリン4D-プレキシンB1-RhoAシグナルはどのように骨形成を抑制するのかという疑問があがった.RhoA-ROCK経路は胚発生においてIRS-1におけるチロシンリン酸化を低下させてIGF-1シグナルを抑制する9).このIGF-1シグナルは骨芽細胞に必須の分化シグナルである.セマフォリン4Dで刺激した骨芽細胞ではIRS-1のチロシンリン酸化とその下流で機能するAktやErkの活性化が低下していた.また,アデノウイルスを用いて恒常的活性化型RhoAを導入した骨芽細胞ではIGF-1の刺激によるIRS-1のチロシンリン酸化が低下し,一方,優位抑制型RhoAを導入した骨芽細胞やROCK阻害剤で処理した骨芽細胞ではIRS-1のチロシンリン酸化は亢進していた.以上より,セマフォリン4DはRhoAを活性化してIGF-1シグナルを阻害することにより骨芽細胞の分化を抑制していることがわかった(図1).
また,セマフォリン4Dの刺激により骨芽細胞の細胞間接着に関与するカドヘリン11の発現が低下し,ボイデンチャンバーアッセイにより細胞の運動性の増強していることがわかった.骨芽細胞の運動性がどのように骨代謝に寄与するのか,骨組織の切片を骨芽細胞マーカータンパク質であるオステオカルシンの抗体を用いて免疫染色した.野生型マウスの骨表面では破骨細胞の近傍に骨芽細胞が観察されることはほとんどない.それに対して,セマフォリン4DノックアウトマウスやプレキシンB1ノックアウトマウス,骨芽細胞に特異的に優位抑制型RhoAを発現するマウスでは破骨細胞の近くに存在する多数の骨芽細胞が観察され,セマフォリン4Dは骨芽細胞の適切な局在に必要であることが示唆された.これらの結果を統合して考えると,破骨細胞は古い骨を吸収しおえるまでセマフォリン4Dを産生して骨芽細胞を骨吸収部位から隔離するとともに,骨吸収部位に侵入してきた骨芽細胞の前駆細胞の分化を抑制しているものと推察された.
5.骨粗鬆症に対する抗セマフォリン4D抗体の治療効果
骨量減少性疾患の治療法としてセマフォリン4Dを抑制することが有効であるかどうか,卵巣摘出術によるマウス骨粗鬆症モデルを用いて検討した.卵巣摘出後から8週間にわたり週に1回,抗セマフォリン4D抗体を投与する予防実験と,卵巣摘出から6週間後のすでに骨粗鬆症を発症したマウスに3週間にわたり3日に1回,抗セマフォリン4D抗体を投与する治療実験を行った.両方の実験において,抗セマフォリン4D抗体は破骨細胞の骨吸収に影響をあたえることなく骨形成を亢進させ骨粗鬆症マウスの骨量を増加させた.また,抗セマフォリン4D抗体はヒトに由来する骨芽細胞による骨形成に対しても抑制効果をもつことが明らかになり,セマフォリン4D-プレキシンB1シグナルを遮断することが骨形成を促進させる新しい治療法として有望であることが示された.
おわりに
骨リモデリングは,破骨細胞による骨吸収を開始するステージ(骨吸収期),骨吸収が終了し骨芽細胞による骨形成へと移行するステージ(移行期),新生骨を形成するステージ(骨形成期),の3つのステージから成り立つと考えられる5).骨吸収期では,骨吸収部位への骨芽細胞のリクルートや骨形成は骨吸収が終了するまで抑制されていなければならない.破骨細胞の産生するセマフォリン4Dは,このステージにおいて骨芽細胞の分化や骨吸収部位へのリクルートを抑制するタンパク質として機能しているものと考えられた(図2).移行期において,骨吸収が骨形成を開始させる共役機構が骨リモデリングの中心的な制御機構としてとらえられてきたが,共役が解離すべき骨吸収期においては,セマフォリン4Dのようなタンパク質が骨リモデリングにおいて重要な役割をはたすものと考えられた.
セマフォリン4Dはアミノ酸配列の類似性からセマフォリンファミリーに分類されるが,活性化T細胞に発現してB細胞や樹状細胞の活性化を制御するなど,免疫応答をつかさどる免疫セマフォリンとしてはじめて単離されたタンパク質である7).また最近では,一部のがん細胞にも発現することが明らかになってきた10).これらの細胞が産生するセマフォリン4Dは骨形成を抑制している可能性がある.したがって,自己免疫疾患である関節リウマチやがんによる骨破壊に対しても,セマフォリン4D-プレキシンB1シグナルを遮断する方法が骨形成の促進治療として有効である可能性が高い.現在,骨形成の促進剤として唯一使用されている副甲状腺ホルモン製剤のほか,抗Sost抗体が新たな骨形成の促進剤として開発されているが,骨粗鬆症,関節リウマチ,がんによる骨破壊に対する骨形成の治療法の開発においてセマフォリン4D-プレキシンB1-RhoAシグナルは有力な分子標的となるであろう.
文 献
- Hattner, R., Epker, B. N. & Frost, H. M.: Suggested sequential mode of control of changes in cell behaviour in adult bone remodeling. Nature, 206, 489-490 (1965)[PubMed]
- Takayanagi, H.: Osteoimmunology: shared mechanisms and crosstalk between the immune and bone systems. Nat. Rev. Immunol., 7, 292-304 (2007)[PubMed]
- Hayden, J. M., Mohan, S. & Baylink, D. J.: The insulin-like growth factor system and the coupling of formation to resorption. Bone, 17, 93S-98S (1995)[PubMed]
- Martin, T. J. & Sims, N. A.: Osteoclast-derived activity in the coupling of bone formation to resorption. Trends Mol. Med., 11, 76-81 (2005)[PubMed]
- Matsuo, K. & Irie, N.: Osteoclast-osteoblast communication. Arch. Biochem. Biophys., 473, 201-209 (2008)[PubMed]
- Tang, Y., Wu, X., Lei, W. et al.: TGF-β1-induced migration of bone mesenchymal stem cells couples bone resorption with formation. Nat. Med., 15, 757-765 (2009)[PubMed]
- Suzuki, K., Kumanogoh, A. & Kikutani, H.: Semaphorins and their receptors in immune cell interactions. Nat. Immunol., 9, 17-23 (2008)[PubMed]
- Kruger, R. P., Aurandt, J. & Guan, K. L.: Semaphorins command cells to move. Nat. Rev. Mol. Cell Biol., 6, 789-800 (2005)[PubMed]
- Sordella, R., Classon, M., Hu, K. Q. et al.: Modulation of CREB activity the Rho GTPase regulates cell and organism size during mouse embryonic development. Dev. Cell, 2, 553-565 (2002)[PubMed]
- Ch'ng, E. S. & Kumanogoh, A.: Role of Sema4D and Plexin-B1 in tumor progression. Mol. Cancer, 21, 251 (2010)[PubMed]
著者プロフィール
略歴:2002年 東京大学大学院農学生命科学研究科 修了,同年 東京大学大学院医学系研究科 博士研究員,2003年 東京医科歯科大学大学院医歯学総合研究科 博士研究員を経て,2007年より同 特任助教(現 客員助教).
研究テーマ:骨と全身組織との相互作用ネットワークの解明.
高柳 広(Hiroshi Takayanagi)
東京医科歯科大学大学院医歯学総合研究科 教授
研究室URL:http://homepage.mac.com/osteoimmunology/
© 2011 根岸-古賀貴子・高柳 広 Licensed under CC 表示 2.1 日本