新規の鉄-硫黄クラスターが生み出すヒドロゲナーゼの酸素耐性機構
庄村康人・樋口芳樹
(兵庫県立大学大学院生命理学研究科 生体物質構造学I分野)
email:庄村康人,樋口芳樹
DOI: 10.7875/first.author.2011.162
Structural basis for a [4Fe-3S] cluster in the oxygen-tolerant membrane-bound [NiFe]-hydrogenase.
Yasuhito Shomura, Ki-Seok Yoon, Hirofumi Nishihara, Yoshiki Higuchi
Nature, 479, 253-256 (2011)
[NiFe]ヒドロゲナーゼのうち酸素耐性能をもつことが知られている膜結合型ヒドロゲナーゼのX線結晶構造解析を行った.その結果,3個ある鉄-硫黄クラスターのうち触媒反応中心であるNi-Fe活性部位のもっとも近くに位置する鉄-硫黄クラスターは,従来まで知られていた[4Fe-4S]-4Cys型ではなく,新規の構造である[4Fe-3S]-6Cys型であることがわかった.これまでに研究されていた標準型ヒドロゲナーゼは好気条件におかれるとO2が活性部位に結合しその活性が失われることが知られていた.構造解析の結果,酸素耐性能をもつ膜結合型ヒドロゲナーゼは,O2にさらされたとき,[4Fe-3S]-6Cys型の鉄-硫黄クラスターにおいて特徴的な構造変化が起こることを見い出した.さらに,この構造変化により鉄-硫黄クラスターはNi-Fe活性部位に電子を1個余分にあたえ,酸素による不活性化をまぬがれていることを見い出した.今回の研究成果は,酸素によるヒドロゲナーゼの機能の損傷を克服するのに重要な知見であり,水素をエネルギーとして利用するための,酸素に安定な水素合成化学触媒や新規の燃料電池の開発研究への応用が期待される.
水素と酸素の反応をエネルギーとして利用しても最終的には水を生成するだけでCO2や有害物質を発生することはない.そのため,水素は究極のクリーンエネルギーとして研究および開発が急がれてきた.水素を分解して電力をとりだす燃料電池は,すでに19世紀なかばにはその原型が考案されていた.地球に酸素が少なくまだ還元状態であったころには,水素をエネルギー源として生育する微生物が繁栄していた.これらの微生物では,ヒドロゲナーゼ(水素酸化還元酵素)とよばれる酵素を利用して生命活動に必要なエネルギーを得ており,また,余剰なエネルギーを水素として大気中に放出していた.このように,ヒドロゲナーゼは H2 ↔ 2H+ + 2e- という単純な化学反応を触媒する1).
ヒドロゲナーゼは,1930年代に発見されて以降,さまざまな視点から研究が進められてきており,燃料電池の陰電極側の触媒や水素合成触媒としての応用が期待されてきた.しかし,ヒドロゲナーゼは一般的に嫌気的な条件において機能するものが多く,これまでもっともよく研究されてきた“標準型”とよばれるヒドロゲナーゼは微量の酸素により簡単に不活性化されるという大きな欠点があった2).しかし,最近,多くの微生物から見い出されつつある“膜結合型”とよばれるヒドロゲナーゼは,大気あるいはそれ以上の高濃度の酸素の存在においても触媒能を失わない酸素耐性型であることがわかってきた3-5).そこで,その酸素耐性機構を模倣し新規の合成化学触媒を開発することに大きな期待がよせられていた.
水素をエネルギー源として生育する好気性水素酸化細菌から膜結合型[NiFe]ヒドロゲナーゼを効率よく抽出する方法を確立した5).さらに,このタンパク質の結晶化条件の検討を行い,高分解能での構造決定を可能とする良質な結晶を再現性よく得ることに成功した6).
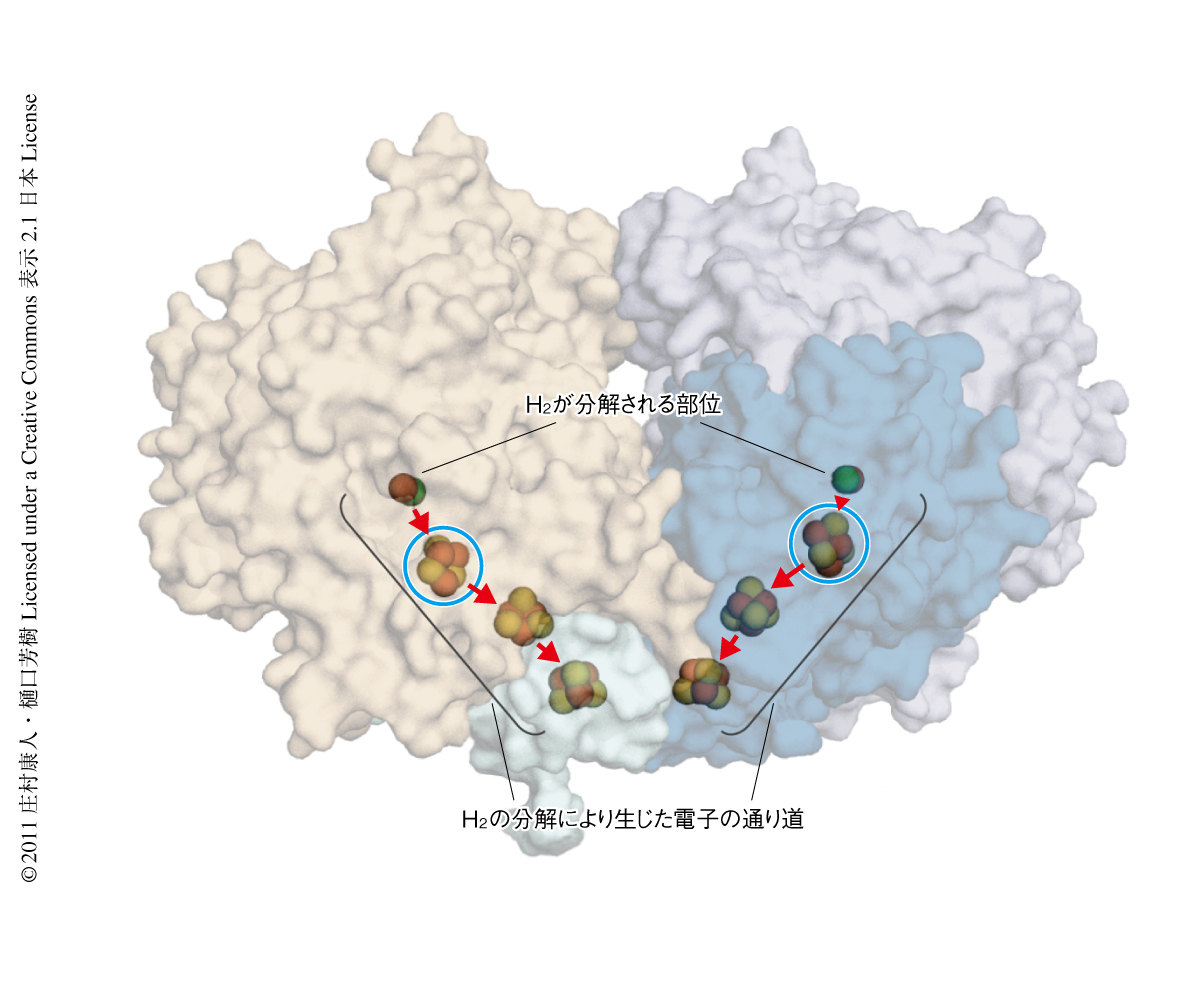
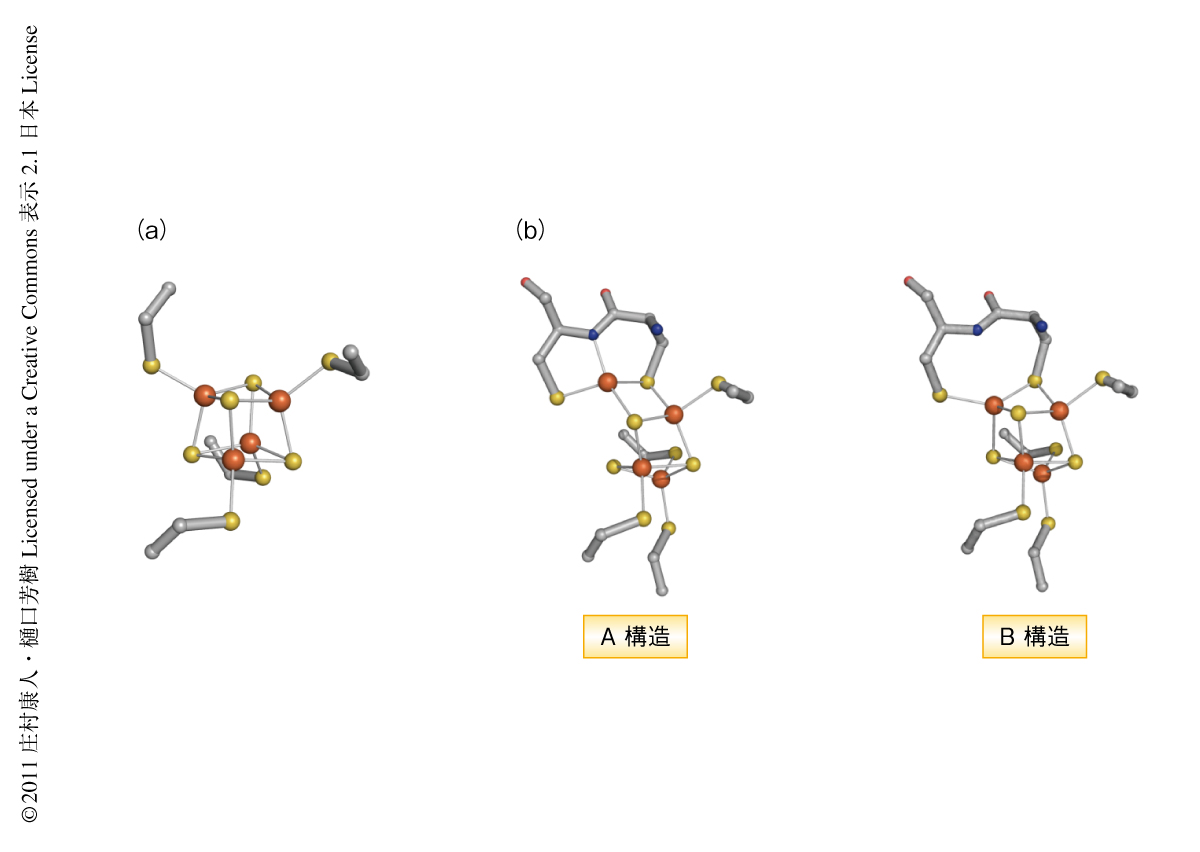
この結晶を用いて大型放射光施設SPring-8においてX線回折実験を行い,酸化された状態(PDB ID:3AYZ)および水素で還元された状態(PDB ID:3AYX)の結晶構造を決定した(図1).[NiFe]ヒドロゲナーゼの全体構造や,反応を触媒するNi-Fe活性部位の構造,電子伝達を担う3つの鉄-硫黄クラスターの配置などは,これまでに研究されてきた標準型ヒドロゲナーゼとほとんど同じであった.しかし,3個の鉄-硫黄クラスターのうちNi-Fe活性部位にもっとも近いものが,これまでに知られていた[4Fe-4S]-4Cys型のものではなく,[4Fe-3S]-6Cys型の新規の構造をもつことを見い出した(図2).つまり,標準型ヒドロゲナーゼの鉄-硫黄クラスターの[4Fe-4S]部分の1つの硫黄原子が失われ,その代わり,2つのシステイン残基がくわわり,合計6つのシステイン残基により[4Fe-3S]部分がタンパク質においてささえられていた.さらに,このヒドロゲナーゼの結晶に酸素より効率のよい酸化剤をくわえ酸化したところ,この[4Fe-3S]-6Cys型の鉄-硫黄クラスターの構造が変化することを見い出した(PDB ID:3AYY).このとき,鉄-硫黄クラスターの1つの鉄原子が動き,Fe-S結合が1つ失われ,その代わり,鉄原子はタンパク質のペプチド主鎖の窒素原子(脱プロトンしている)と新たな結合をつくっていた(図2).この構造変化はH2を分解する反応の起こるNi-Fe活性部位から少し離れており,H2から発生した電子が移動する経路の途中で起こっていた.H2が分解される場所はタンパク質の奥深い内部にあり(図1),標準型ヒドロゲナーゼではそこにO2が結合することにより機能が損なわれると考えられてきた.今回,観測されたこの膜結合型ヒドロゲナーゼの構造変化を考慮すれば,結合したO2がすみやかに水に分解されるという説をうまく説明することができ,この現象は膜結合型ヒドロゲナーゼが酸素のある環境でも機能する“しくみ”と深く関係していると考えられた.
2011年になり,異なる細菌から得られた酸素耐性能をもつ膜結合型[NiFe]ヒドロゲナーゼについて,分光学的な解析(電子スピン共鳴法,フーリエ変換赤外分光法,メスバウアー効果),電気化学的な解析,および,変異体の解析の結果があいついで発表された7,8).それらによると,これらの酸素耐性能をもつヒドロゲナーゼではNi-Fe活性部位にもっとも近い鉄-硫黄クラスターがこれまでに知られているクラスターとは異なる性質を示すことが確認された.[4Fe-4S]-4Cys型など通常の鉄-硫黄クラスターは電子を流すことが機能の本質であるため,電子を受け取った状態と電子を失った状態の2つの酸化還元状態のみをもつことが知られている.酸素耐性能をもつヒドロゲナーゼの3個の鉄-硫黄クラスターのうちのひとつは3つの酸化還元状態を示し,それがこのヒドロゲナーゼの酸素耐性と密接にかかわっていることが示唆された.これらの挙動は,これまで知られていた[4Fe-4S]-4Cys型の鉄-硫黄クラスターの構造にもとづいて説明することは困難であった.しかし,今回,見い出した構造結果にもとづくことで,これらすべての研究結果をうまく説明することが可能になった.
今回,同定した[4Fe-3S]-6Cys型の鉄-硫黄クラスターは,ヒドロゲナーゼがH2の分解を触媒しているあいだは通常の[4Fe-4S]-4Cys型の鉄-硫黄クラスターと同様に2つの酸化還元状態を行き来して電子の流れを制御する.ヒドロゲナーゼが酸素にさらされるとO2がNi-Fe活性部位に結合し,これにより標準型ヒドロゲナーゼは不活性な状態となる.しかし,膜結合型ヒドロゲナーゼにおいては[4Fe-3S]-6Cys型の鉄-硫黄クラスターが構造変化を起こし,Ni-Fe活性部位に電子をわたすことによりNi-Fe活性部位に結合したO2はすみやかに分解されると考えることができた.鉄-硫黄クラスターの構造変化は脱プロトンをともない,これにより活性部位に電子をわたすこと(3つの酸化還元状態をとること)が可能になるものと考えられた.これは,生体高分子にみられる電子伝達体としてはきわめてまれな例といえた.酸素耐性については,H2をヒドロゲナーゼの内部のNi-Fe活性部位まで誘導するトンネルが小さいことが重要ではないか,とする報告もある9,10).しかし,今回の結晶解析の結果から,Ni-Fe活性部位そのもののかたちや,H2がヒドロゲナーゼの表面から内部のNi-Fe活性部位まで入り込む経路のかたちや大きさについては,酸素により不活性化する標準型ヒドロゲナーゼの構造と比べてほとんど違いがみられなかった.したがって,膜結合型ヒドロゲナーゼの酸素耐性はこの鉄-硫黄クラスターの構造変化が深く関係していると結論づけることができた.
今回の結果は,酵素において電子伝達体としてのみはたらくと考えられていた鉄-硫黄クラスターが,酸化還元に依存的な構造変化をともなうことにより酵素の機能をまもるための役割も担っていることを明らかにした.また,結晶構造にもとづいた膜結合型[NiFe]ヒドロゲナーゼの酸素耐性機構の詳細なモデルを世界ではじめて提唱した.
ヒドロゲナーゼが触媒する水素分解や水素合成の分子機構についてはいまだ不明な点が多いが,その巧妙な“しくみ”の理解は,より効率的な水素エネルギーの利用に関する研究および開発に重要な情報を提供する.とくに,今回の研究成果は,ヒドロゲナーゼの酸素による機能の損失を克服するため重要な知見であるとともに,この情報をもとにした新たな合成触媒などの開発へとつながり,水素をエネルギーとして利用するための研究のブレークスルーとなることが期待される.
略歴:2003年 京都大学大学院理学研究科 修了,同年 ドイツMax Planck Institute of Biochemistry博士研究員を経て,2005年より兵庫県立大学大学院生命理学研究科 助教.
研究テーマ:金属タンパク質とその生合成の過程の構造生物学,分子シャペロンによるタンパク質高次構造の形成機構の解明.
関心事:金属クラスターの構築原理.
樋口 芳樹(Higuchi Yoshiki)
兵庫県立大学大学院生命理学研究科 教授.
研究室URL:http://www.sci.u-hyogo.ac.jp/life/biophys1/index-j.html
© 2011 庄村康人・樋口芳樹 Licensed under CC 表示 2.1 日本
(兵庫県立大学大学院生命理学研究科 生体物質構造学I分野)
email:庄村康人,樋口芳樹
DOI: 10.7875/first.author.2011.162
Structural basis for a [4Fe-3S] cluster in the oxygen-tolerant membrane-bound [NiFe]-hydrogenase.
Yasuhito Shomura, Ki-Seok Yoon, Hirofumi Nishihara, Yoshiki Higuchi
Nature, 479, 253-256 (2011)
要 約
[NiFe]ヒドロゲナーゼのうち酸素耐性能をもつことが知られている膜結合型ヒドロゲナーゼのX線結晶構造解析を行った.その結果,3個ある鉄-硫黄クラスターのうち触媒反応中心であるNi-Fe活性部位のもっとも近くに位置する鉄-硫黄クラスターは,従来まで知られていた[4Fe-4S]-4Cys型ではなく,新規の構造である[4Fe-3S]-6Cys型であることがわかった.これまでに研究されていた標準型ヒドロゲナーゼは好気条件におかれるとO2が活性部位に結合しその活性が失われることが知られていた.構造解析の結果,酸素耐性能をもつ膜結合型ヒドロゲナーゼは,O2にさらされたとき,[4Fe-3S]-6Cys型の鉄-硫黄クラスターにおいて特徴的な構造変化が起こることを見い出した.さらに,この構造変化により鉄-硫黄クラスターはNi-Fe活性部位に電子を1個余分にあたえ,酸素による不活性化をまぬがれていることを見い出した.今回の研究成果は,酸素によるヒドロゲナーゼの機能の損傷を克服するのに重要な知見であり,水素をエネルギーとして利用するための,酸素に安定な水素合成化学触媒や新規の燃料電池の開発研究への応用が期待される.
はじめに
水素と酸素の反応をエネルギーとして利用しても最終的には水を生成するだけでCO2や有害物質を発生することはない.そのため,水素は究極のクリーンエネルギーとして研究および開発が急がれてきた.水素を分解して電力をとりだす燃料電池は,すでに19世紀なかばにはその原型が考案されていた.地球に酸素が少なくまだ還元状態であったころには,水素をエネルギー源として生育する微生物が繁栄していた.これらの微生物では,ヒドロゲナーゼ(水素酸化還元酵素)とよばれる酵素を利用して生命活動に必要なエネルギーを得ており,また,余剰なエネルギーを水素として大気中に放出していた.このように,ヒドロゲナーゼは H2 ↔ 2H+ + 2e- という単純な化学反応を触媒する1).
ヒドロゲナーゼは,1930年代に発見されて以降,さまざまな視点から研究が進められてきており,燃料電池の陰電極側の触媒や水素合成触媒としての応用が期待されてきた.しかし,ヒドロゲナーゼは一般的に嫌気的な条件において機能するものが多く,これまでもっともよく研究されてきた“標準型”とよばれるヒドロゲナーゼは微量の酸素により簡単に不活性化されるという大きな欠点があった2).しかし,最近,多くの微生物から見い出されつつある“膜結合型”とよばれるヒドロゲナーゼは,大気あるいはそれ以上の高濃度の酸素の存在においても触媒能を失わない酸素耐性型であることがわかってきた3-5).そこで,その酸素耐性機構を模倣し新規の合成化学触媒を開発することに大きな期待がよせられていた.
1.膜結合型ヒドロゲナーゼの結晶構造
水素をエネルギー源として生育する好気性水素酸化細菌から膜結合型[NiFe]ヒドロゲナーゼを効率よく抽出する方法を確立した5).さらに,このタンパク質の結晶化条件の検討を行い,高分解能での構造決定を可能とする良質な結晶を再現性よく得ることに成功した6).
この結晶を用いて大型放射光施設SPring-8においてX線回折実験を行い,酸化された状態(PDB ID:3AYZ)および水素で還元された状態(PDB ID:3AYX)の結晶構造を決定した(図1).[NiFe]ヒドロゲナーゼの全体構造や,反応を触媒するNi-Fe活性部位の構造,電子伝達を担う3つの鉄-硫黄クラスターの配置などは,これまでに研究されてきた標準型ヒドロゲナーゼとほとんど同じであった.しかし,3個の鉄-硫黄クラスターのうちNi-Fe活性部位にもっとも近いものが,これまでに知られていた[4Fe-4S]-4Cys型のものではなく,[4Fe-3S]-6Cys型の新規の構造をもつことを見い出した(図2).つまり,標準型ヒドロゲナーゼの鉄-硫黄クラスターの[4Fe-4S]部分の1つの硫黄原子が失われ,その代わり,2つのシステイン残基がくわわり,合計6つのシステイン残基により[4Fe-3S]部分がタンパク質においてささえられていた.さらに,このヒドロゲナーゼの結晶に酸素より効率のよい酸化剤をくわえ酸化したところ,この[4Fe-3S]-6Cys型の鉄-硫黄クラスターの構造が変化することを見い出した(PDB ID:3AYY).このとき,鉄-硫黄クラスターの1つの鉄原子が動き,Fe-S結合が1つ失われ,その代わり,鉄原子はタンパク質のペプチド主鎖の窒素原子(脱プロトンしている)と新たな結合をつくっていた(図2).この構造変化はH2を分解する反応の起こるNi-Fe活性部位から少し離れており,H2から発生した電子が移動する経路の途中で起こっていた.H2が分解される場所はタンパク質の奥深い内部にあり(図1),標準型ヒドロゲナーゼではそこにO2が結合することにより機能が損なわれると考えられてきた.今回,観測されたこの膜結合型ヒドロゲナーゼの構造変化を考慮すれば,結合したO2がすみやかに水に分解されるという説をうまく説明することができ,この現象は膜結合型ヒドロゲナーゼが酸素のある環境でも機能する“しくみ”と深く関係していると考えられた.
2.膜結合型ヒドロゲナーゼの鉄-硫黄クラスターの構造変化
2011年になり,異なる細菌から得られた酸素耐性能をもつ膜結合型[NiFe]ヒドロゲナーゼについて,分光学的な解析(電子スピン共鳴法,フーリエ変換赤外分光法,メスバウアー効果),電気化学的な解析,および,変異体の解析の結果があいついで発表された7,8).それらによると,これらの酸素耐性能をもつヒドロゲナーゼではNi-Fe活性部位にもっとも近い鉄-硫黄クラスターがこれまでに知られているクラスターとは異なる性質を示すことが確認された.[4Fe-4S]-4Cys型など通常の鉄-硫黄クラスターは電子を流すことが機能の本質であるため,電子を受け取った状態と電子を失った状態の2つの酸化還元状態のみをもつことが知られている.酸素耐性能をもつヒドロゲナーゼの3個の鉄-硫黄クラスターのうちのひとつは3つの酸化還元状態を示し,それがこのヒドロゲナーゼの酸素耐性と密接にかかわっていることが示唆された.これらの挙動は,これまで知られていた[4Fe-4S]-4Cys型の鉄-硫黄クラスターの構造にもとづいて説明することは困難であった.しかし,今回,見い出した構造結果にもとづくことで,これらすべての研究結果をうまく説明することが可能になった.
今回,同定した[4Fe-3S]-6Cys型の鉄-硫黄クラスターは,ヒドロゲナーゼがH2の分解を触媒しているあいだは通常の[4Fe-4S]-4Cys型の鉄-硫黄クラスターと同様に2つの酸化還元状態を行き来して電子の流れを制御する.ヒドロゲナーゼが酸素にさらされるとO2がNi-Fe活性部位に結合し,これにより標準型ヒドロゲナーゼは不活性な状態となる.しかし,膜結合型ヒドロゲナーゼにおいては[4Fe-3S]-6Cys型の鉄-硫黄クラスターが構造変化を起こし,Ni-Fe活性部位に電子をわたすことによりNi-Fe活性部位に結合したO2はすみやかに分解されると考えることができた.鉄-硫黄クラスターの構造変化は脱プロトンをともない,これにより活性部位に電子をわたすこと(3つの酸化還元状態をとること)が可能になるものと考えられた.これは,生体高分子にみられる電子伝達体としてはきわめてまれな例といえた.酸素耐性については,H2をヒドロゲナーゼの内部のNi-Fe活性部位まで誘導するトンネルが小さいことが重要ではないか,とする報告もある9,10).しかし,今回の結晶解析の結果から,Ni-Fe活性部位そのもののかたちや,H2がヒドロゲナーゼの表面から内部のNi-Fe活性部位まで入り込む経路のかたちや大きさについては,酸素により不活性化する標準型ヒドロゲナーゼの構造と比べてほとんど違いがみられなかった.したがって,膜結合型ヒドロゲナーゼの酸素耐性はこの鉄-硫黄クラスターの構造変化が深く関係していると結論づけることができた.
今回の結果は,酵素において電子伝達体としてのみはたらくと考えられていた鉄-硫黄クラスターが,酸化還元に依存的な構造変化をともなうことにより酵素の機能をまもるための役割も担っていることを明らかにした.また,結晶構造にもとづいた膜結合型[NiFe]ヒドロゲナーゼの酸素耐性機構の詳細なモデルを世界ではじめて提唱した.
おわりに
ヒドロゲナーゼが触媒する水素分解や水素合成の分子機構についてはいまだ不明な点が多いが,その巧妙な“しくみ”の理解は,より効率的な水素エネルギーの利用に関する研究および開発に重要な情報を提供する.とくに,今回の研究成果は,ヒドロゲナーゼの酸素による機能の損失を克服するため重要な知見であるとともに,この情報をもとにした新たな合成触媒などの開発へとつながり,水素をエネルギーとして利用するための研究のブレークスルーとなることが期待される.
文 献
- Vignais, P. M. & Billoud, B.: Occurrence, classification, and biological function of hydrogenases: an overview. Chem. Rev., 107, 4206-4072 (2007)[PubMed]
- Ogata, H., Lubitz, W. & Higuchi, Y.: [NiFe] hydrogenases: structural and spectroscopic studies of the reaction mechanism. Dalton Trans., 7577-7587 (2009)[PubMed]
- Brugna-Guiral, M., Tron, P., Nitschke, W. et al.: [NiFe] hydrogenases from the hyperthermophilic bacterium Aquifex aeolicus: properties, function, and phylogenetics. Extremophiles, 7, 145-157 (2003)[PubMed]
- Van der Linden, E., Burgdorf, T., Bernhard, M. et al.: The soluble [NiFe]-hydrogenase from Ralstonia eutropha contains four cyanides in its active site, one of which is responsible for the insensitivity towards oxygen. J. Biol. Inorg. Chem., 9, 616-626 (2004)[PubMed]
- Yoon, K. -S., Fukuda, K., Fujisawa, K. et al.: Purification and characterization of a highly thermostable, oxygen-resistant, respiratory [NiFe]-hydrogenase from a marine, aerobic hydrogen-oxidizing bacterium Hydrogenovibrio marinus. Int. J. Hydrogen Energy, 36, 7081-7088 (2011)
- Shomura, Y., Hagiya, K., Yoon, K. -S. et al.: Crystallization and preliminary X-ray diffraction analysis of membrane-bound respiratory [NiFe] hydrogenase from Hydrogenovibrio marinus. Acta. Crystallogr. Sect. F Struct. Biol. Cryst. Commun., 67, 827-829 (2011)[PubMed]
- Pandelia, M. E., Fourmond, V., Tron-Infossi, P. et al.: Membrane-bound hydrogenase I from the hyperthermophilic bacterium Aquifex aeolicus: enzyme activation, redox intermediates and oxygen tolerance. J. Am. Chem. Soc., 132, 6991-7004 (2010)[PubMed]
- Goris, T., Wait, A. F., Saggu, M. et al.: A unique iron-sulfur cluster is crucial for oxygen tolerance of a [NiFe]-hydrogenase. Nat. Chem. Biol., 7, 310-318 (2011)[PubMed]
- Marques, M. C., Coelho, R., De Lacey, A. L. et al.: The three-dimensional structure of [NiFeSe] hydrogenase from Desulfovibrio vulgaris Hildenborough: a hydrogenase without a bridging ligand in the active site in its oxidised, "as-isolated" state. J. Mol. Biol., 396, 893-907 (2010)[PubMed]
- Buhrke, T., Lenz, O., Krauss, N. et al.: Oxygen tolerance of the H2-sensing [NiFe] hydrogenase from Ralstonia eutropha H16 is based on limited access of oxygen to the active site. J. Biol. Chem., 280, 23791-23796 (2005)[PubMed]
著者プロフィール
略歴:2003年 京都大学大学院理学研究科 修了,同年 ドイツMax Planck Institute of Biochemistry博士研究員を経て,2005年より兵庫県立大学大学院生命理学研究科 助教.
研究テーマ:金属タンパク質とその生合成の過程の構造生物学,分子シャペロンによるタンパク質高次構造の形成機構の解明.
関心事:金属クラスターの構築原理.
樋口 芳樹(Higuchi Yoshiki)
兵庫県立大学大学院生命理学研究科 教授.
研究室URL:http://www.sci.u-hyogo.ac.jp/life/biophys1/index-j.html
© 2011 庄村康人・樋口芳樹 Licensed under CC 表示 2.1 日本