miRNAの生合成におけるショウジョウバエDicer-1の基質認識機構
包 明久・泊 幸秀
(東京大学分子細胞生物学研究所 RNA機能研究分野)
email:包 明久,泊 幸秀
DOI: 10.7875/first.author.2011.158
Recognition of the pre-miRNA structure by Drosophila Dicer-1.
Akihisa Tsutsumi, Tomoko Kawamata, Natsuko Izumi, Hervé Seitz, Yukihide Tomari
Nature Structural & Molecular Biology, 18, 1153-1158 (2011)
miRNAとsiRNAはその生合成の過程においてRNaseIIIファミリータンパク質であるDicerによる切断をうける.ショウジョウバエには2つのDicer,Dicer-1とDicer-2が存在し,それぞれmiRNAとsiRNAの産生にかかわる.今回,筆者らは,Dicer-1がmiRNA前駆体のみを特異的に切断するしくみを明らかにした.すべてのmiRNA前駆体はヘアピン型の構造をとるが,Dicer-1はその両方の末端にあたる3’突出末端構造と一本鎖RNA構造とを認識し,これらのあいだの距離を測ることでmiRNA前駆体と結合していた.一本鎖RNA構造の認識はこれまで機能が未知であったDicer-1のN末端に存在するヘリカーゼドメインが行っていることが示唆された.一方,ヒトのDICER1ではこのような厳密な構造の認識は行われていなかった.
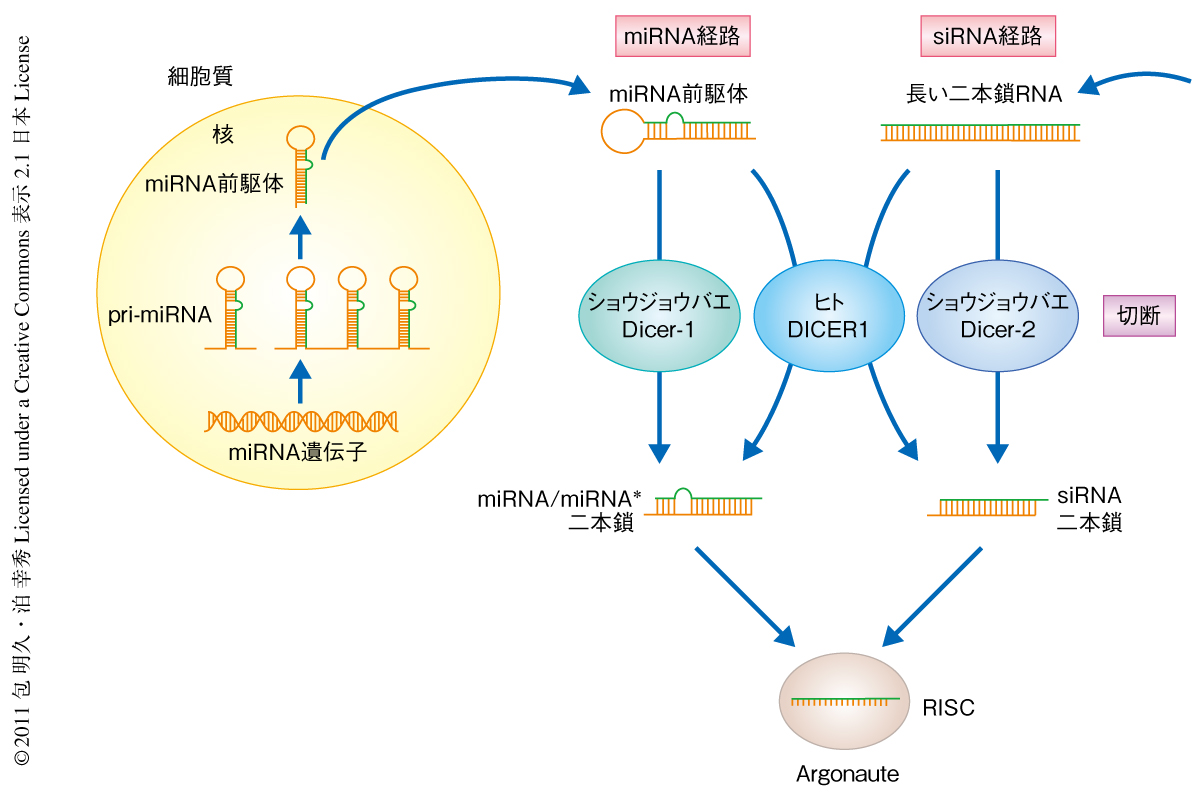
microRNA(miRNA)やsmall interfering RNA(siRNA)といったタンパク質をコードしない低分子RNA(small RNA)は,複数のタンパク質と複合体をつくりその配列を指標としてmRNAの不安定化や翻訳抑制あるいは切断を行うことが知られている.これら低分子RNAの生合成にはDicerとよばれるRNaseIIIファミリータンパク質が重要な役割を担っている.miRNAの生合成の過程では,miRNAを含む一次転写産物(pri-miRNA)からDroshaとよばれるRNaseIIIファミリータンパク質によりヘアピン型の構造をもつmiRNA前駆体(pre-miRNA)が切り出されて細胞質に輸送される.つづいて,miRNA前駆体はDicerにより切断をうけmiRNA/miRNA*とよばれる短い二本鎖RNAとなる.一方,siRNAはウイルス感染や遺伝子導入などに起因する外来性の長い二本鎖RNAを前駆体とする.この長い二本鎖RNAもmiRNA前駆体と同様にDicerによる切断をうけ短い二本鎖RNAが切り出される1)(図1).
ヒトやマウスなどの哺乳類や線虫では1つのDicerがどちらの前駆体も認識し切断するが2),ショウジョウバエをはじめとする昆虫は2つのDicerパラログ,Dicer-1とDicer-2をもち,Dicer-1がmiRNA前駆体を,Dicer-2が長い二本鎖RNAを,それぞれ特異的に切断する3).最近,Dicer-2の基質認識に関する報告があり,無機リン酸やパートナータンパク質R2D2によりmiRNA前駆体の誤切断が抑制されていること,Dicer-2はヘリカーゼドメインのはたらきによりATPの加水分解をともなって長い二本鎖RNAのうえを移動しこれを22塩基の長さに切断していくことなどが示唆された4).しかし,Dicer-1の基質認識機構やそのヘリカーゼドメインのはたらきについては不明なままであった.これまで報告されているmiRNA前駆体はすべて二本鎖状のステム部分と一本鎖状のループ部分からなるヘアピン型の構造をもっているが,その一方で,miRNA前駆体のあいだで保存された配列は存在しない.したがって,Dicer-1はmiRNA前駆体の構造的な特徴を認識しているものと考えられる.この研究では,組換えDicer-1を用いたin vitroでの基質切断アッセイと,基質との直接の結合を測定するゲルシフトアッセイにより,Dicer-1の認識するRNAの構造的な特徴およびDicer-1の基質認識におけるヘリカーゼドメインの役割を明らかにした.
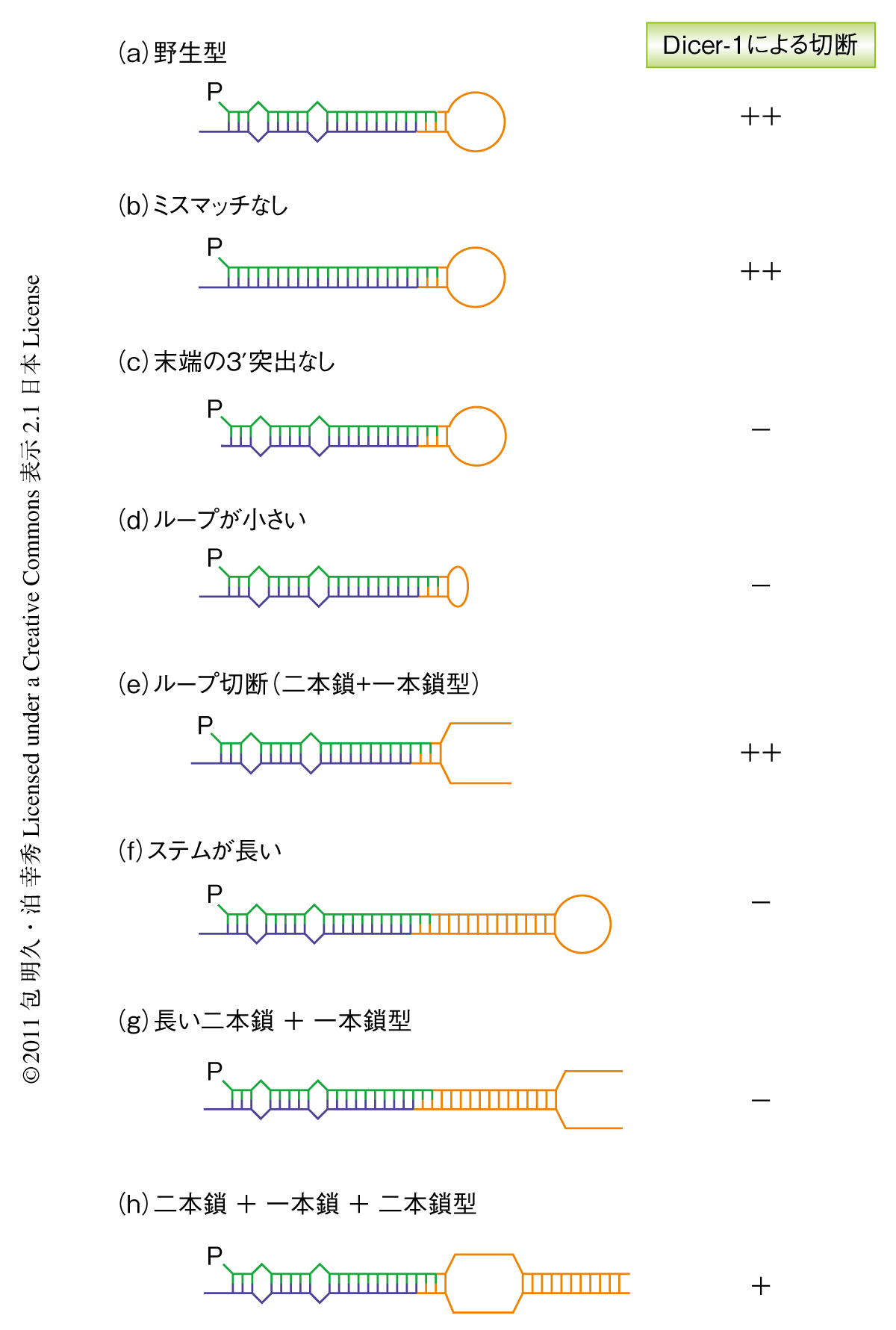
miRNA前駆体のもつ構造的な特徴のうち,どれがDicer-1による認識に必要であるかを調べるため,精製した組換えDicer-1と合成した基質RNAを用いてin vitro基質切断アッセイを行った.miRNA前駆体のもつ構造的な特徴としては,さきに述べたステム構造とループ構造のほか,3’末端が5’末端に対し2塩基だけ突出した3’突出末端構造とよばれる構造と,ステム構造に存在する2個程度のミスマッチがあげられる(図2a).これらのうち,ステム構造のミスマッチの有無はDicer-1による切断活性に影響をあたえなかった(図2b).miRNA/miRNA*二本鎖のミスマッチはDicerによる切断のあとArgonauteに取り込まれ一本鎖となる過程で重要な役割をもつが5),Dicer-1による切断の段階では意味をもたないのであろう.一方,3’突出末端構造のない基質はDicer-1による切断をほとんどうけなかったことから,Dicer-1によるこの構造の認識が重要であることが示唆された(図2c).また,ループ構造の部分が小さくなるにしたがいDicer-1による切断活性が大幅に減少したことから,Dicer-1はループ構造の一本鎖RNA領域を認識していることが明らかになった(図2d).さらに,このループ構造を中央で切断した“二本鎖+一本鎖”型のY字型の基質もヘアピン型の基質と同じ程度に切断をうけた(図2e).くわえて,このY字型の基質も一本鎖の部分が短くなると切断されにくくなるというヘアピン型の基質と同様の傾向を示した.
これらの結果から,Dicer-1は基質RNAの両端の構造である3’突出末端構造とループ構造とを認識していることが示された.とくに,ループ構造はある程度以上の長さの一本鎖RNAがその位置に存在することが重要であり必ずしもループ構造をとる必要はないものと考えられた.
基質RNAの二本鎖RNA部分に着目して実験を進めたところ,ヘアピン型あるいは“二本鎖+一本鎖”型のどちらの基質でも,ステム構造(二本鎖の部分)を長くするにしたがいDicer-1による切断をうけにくくなることが観察された(図2 f, g).ここから,Dicer-1は基質の3’突出末端構造から一本鎖RNA領域までの距離を測っていることが示唆された.これを確認するため,“長い二本鎖+一本鎖”型の基質と,同じ長さの“二本鎖+一本鎖+二本鎖”型の基質を作製し切断活性を比較した(図2 g, h).すると,3’突出末端構造と一本鎖RNA領域との距離がより近い“二本鎖+一本鎖+二本鎖”型の基質のほうがDicer-1に切断されやすいことがわかり,仮説を支持する結果となった.
つぎに,切断活性のない組換えDicer-1変異体を用いたゲルシフトアッセイにより基質RNAとDicer-1との結合能を評価した.切断活性の低いループ構造の小さい基質およびステム構造の長い基質では,野生型の基質に比べてDicer-1との結合能が低下していた.よって,異常な構造をもつ基質におけるDicer-1の切断活性の低下は切断反応そのものによる影響ではなく,おもに基質RNAとの結合能の低下によることが示唆された.
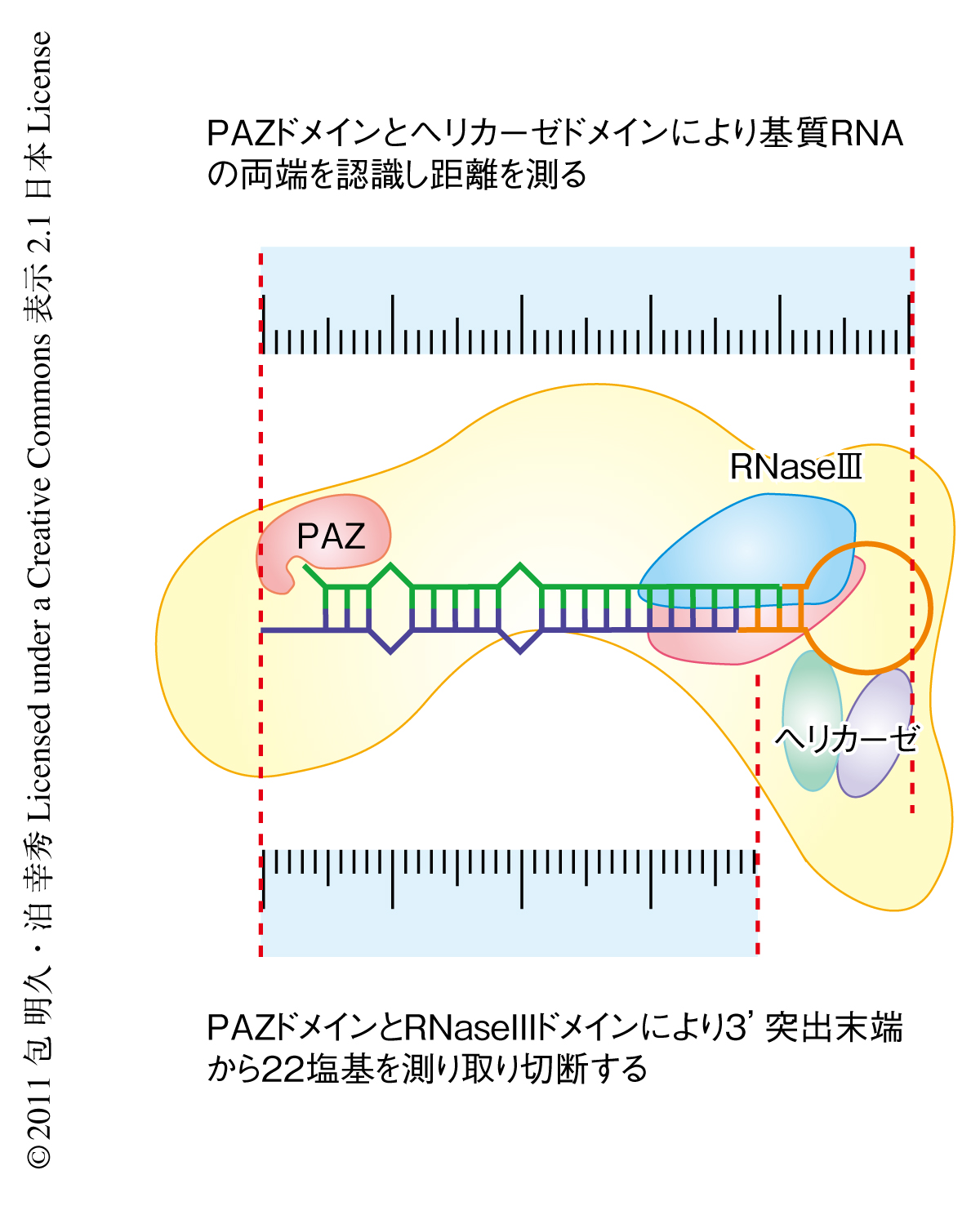
以上から,Dicer-1は基質の3’突出末端構造からループ構造までの長さを測り,これらが適切な距離にあるときにのみ基質と結合し切断する,というモデルが考えられた.鞭毛虫Giardia intestinalisに由来するDicerは結晶構造が解かれており,PAZドメインにより基質の3’突出末端構造と結合し,ここからRNaseIIIドメインまでの距離を定規のように使って切断産物の長さを決定していることが報告されている6).この研究で用いたすべての基質RNAにおいてDicer-1による切断産物の長さに変化はなかったことから,ショウジョウバエのDicer-1も同じ定規としてのはたらきをもっているものと考えられた.さらに,ショウジョウバエのDicer-1にはもうひとつの定規,すなわち3’突出末端構造からループ構造までの距離を測るはたらきがあり,これにより切断すべき正しい基質とのみ結合しこれを切断しているものと考えられた.
では,Dicer-1はどの部分で基質RNAのループ構造を認識しているのだろうか? さきに述べたGiardiaに由来するDicerは,DUF283ドメイン,PAZドメイン,RNaseIIIドメインという,いわばDicerとしての“核”となるドメインしかもっていない特殊なDicerである.通常のDicerはこれらにくわえ,N末端側にヘリカーゼドメイン,C末端側に二本鎖RNA結合ドメインをもつ.DicerのヘリカーゼドメインはRIG-Iとよばれるヘリカーゼと配列の類似性が高い.RIG-Iは二本鎖RNAと結合しそのうえをATPを消費しながら移動するトランスロカーゼ様の性質をもつ7).ショウジョウバエDicer-2のヘリカーゼドメインはヒトDICER1やショウジョウバエDicer-1と比べRIG-Iとの類似性が高く,実際に,Dicer-2はヘリカーゼドメインによりATPを消費しながら長い二本鎖RNAのうえを移動することが示唆されている4).一方,Dicer-1のヘリカーゼドメインはRIG-Iとの類似性が低く,ATPの加水分解を行うモチーフなどいくつかの重要なモチーフが保存されていない.
そこで,この特徴的な配列の保存性の低いヘリカーゼドメインにより,miRNA前駆体のみを排他的に認識するというDicer-1の独特な基質特異性がもたらされているのではないかと考え,ヘリカーゼドメインを欠損した組換えDicer-1変異体を作製した.これを用いてin vitro基質切断アッセイを行ったところ,野生型の基質に対する切断活性がステム構造の長い基質やループ構造の小さい基質に対するものと同じ程度にまで低下していた.さらに,ゲルシフトアッセイにより野生型の基質に対する結合能も著しく低下していることが確認された.これらの結果は,Dicer-1が切断するべき基質とそうでない基質とを見分ける能力を失ったことを意味していた.よって,Dicer-1は特徴的なヘリカーゼドメインにより基質RNAのループ構造を認識しており,この認識により基質との結合能をひき上げ,結果的に切断活性を上昇させているものと結論づけた.
ヒトのDICER1は長い二本鎖RNAとmiRNA前駆体のどちらも切断することが知られている.また,その切断反応にATPを必要としない8).ここから予想されるように,ヒトDICER1を用いたin vitro基質切断アッセイではループ構造の小さな基質やステム構造の長い基質なども一定の効率で切断した.ヒトDICER1のヘリカーゼドメインとRIG-Iとの配列の類似性は,ショウジョウバエのDicer-2よりも低くDicer-1よりも高い.ATP依存的に二本鎖RNAを効率よく切断するDicer-2と,ATP非依存的にmiRNA前駆体のみを切断するDicer-1の中間ともいえるヒトDICER1の性質は,このようなヘリカーゼドメインの配列により説明できるのではないかと考えている.
この研究において,筆者らは,ショウジョウバエDicer-1によるmiRNA前駆体の切断が以下の2つのステップで起こると考えた(図3).まず,PAZドメインとヘリカーゼドメインとの距離を利用した分子定規により基質RNAの3’突出末端構造からループ構造までの距離を測り,この距離が適切であるときにのみ基質と結合する.つづいて,PAZドメインとRNaseIIIドメインとの距離を用いた分子定規により一定の長さのRNAを切り出す.しかし,ヘリカーゼドメインは一本鎖RNA領域を認識することでどのようにしてDicer-1と基質との結合を安定化させているのか,たとえば,Dicer-1のコンフォメーションの変化をともなっているのか,といった点については不明なままである.また,ショウジョウバエDicer-2,ヒトDICER1,ショウジョウバエDicer-1の性質とヘリカーゼドメインの配列との関係のように,Dicerの基質特異性はヘリカーゼドメインのアミノ酸配列や機能により決定されていると考えており,この点からも,ヘリカーゼドメインの機能と構造についてのより詳細な解明が必要であるといえる.
略歴:東京大学大学院新領域創成科学研究科博士課程 在学中.
研究テーマ:small RNAの生合成の機構.
関心事:生命現象を1分子のレベルで記述していきたい.と,子育て.
泊 幸秀(Yukihide Tomari)
東京大学分子細胞生物学研究所 准教授
© 2011 包 明久・泊 幸秀 Licensed under CC 表示 2.1 日本
(東京大学分子細胞生物学研究所 RNA機能研究分野)
email:包 明久,泊 幸秀
DOI: 10.7875/first.author.2011.158
Recognition of the pre-miRNA structure by Drosophila Dicer-1.
Akihisa Tsutsumi, Tomoko Kawamata, Natsuko Izumi, Hervé Seitz, Yukihide Tomari
Nature Structural & Molecular Biology, 18, 1153-1158 (2011)
要 約
miRNAとsiRNAはその生合成の過程においてRNaseIIIファミリータンパク質であるDicerによる切断をうける.ショウジョウバエには2つのDicer,Dicer-1とDicer-2が存在し,それぞれmiRNAとsiRNAの産生にかかわる.今回,筆者らは,Dicer-1がmiRNA前駆体のみを特異的に切断するしくみを明らかにした.すべてのmiRNA前駆体はヘアピン型の構造をとるが,Dicer-1はその両方の末端にあたる3’突出末端構造と一本鎖RNA構造とを認識し,これらのあいだの距離を測ることでmiRNA前駆体と結合していた.一本鎖RNA構造の認識はこれまで機能が未知であったDicer-1のN末端に存在するヘリカーゼドメインが行っていることが示唆された.一方,ヒトのDICER1ではこのような厳密な構造の認識は行われていなかった.
はじめに
microRNA(miRNA)やsmall interfering RNA(siRNA)といったタンパク質をコードしない低分子RNA(small RNA)は,複数のタンパク質と複合体をつくりその配列を指標としてmRNAの不安定化や翻訳抑制あるいは切断を行うことが知られている.これら低分子RNAの生合成にはDicerとよばれるRNaseIIIファミリータンパク質が重要な役割を担っている.miRNAの生合成の過程では,miRNAを含む一次転写産物(pri-miRNA)からDroshaとよばれるRNaseIIIファミリータンパク質によりヘアピン型の構造をもつmiRNA前駆体(pre-miRNA)が切り出されて細胞質に輸送される.つづいて,miRNA前駆体はDicerにより切断をうけmiRNA/miRNA*とよばれる短い二本鎖RNAとなる.一方,siRNAはウイルス感染や遺伝子導入などに起因する外来性の長い二本鎖RNAを前駆体とする.この長い二本鎖RNAもmiRNA前駆体と同様にDicerによる切断をうけ短い二本鎖RNAが切り出される1)(図1).
ヒトやマウスなどの哺乳類や線虫では1つのDicerがどちらの前駆体も認識し切断するが2),ショウジョウバエをはじめとする昆虫は2つのDicerパラログ,Dicer-1とDicer-2をもち,Dicer-1がmiRNA前駆体を,Dicer-2が長い二本鎖RNAを,それぞれ特異的に切断する3).最近,Dicer-2の基質認識に関する報告があり,無機リン酸やパートナータンパク質R2D2によりmiRNA前駆体の誤切断が抑制されていること,Dicer-2はヘリカーゼドメインのはたらきによりATPの加水分解をともなって長い二本鎖RNAのうえを移動しこれを22塩基の長さに切断していくことなどが示唆された4).しかし,Dicer-1の基質認識機構やそのヘリカーゼドメインのはたらきについては不明なままであった.これまで報告されているmiRNA前駆体はすべて二本鎖状のステム部分と一本鎖状のループ部分からなるヘアピン型の構造をもっているが,その一方で,miRNA前駆体のあいだで保存された配列は存在しない.したがって,Dicer-1はmiRNA前駆体の構造的な特徴を認識しているものと考えられる.この研究では,組換えDicer-1を用いたin vitroでの基質切断アッセイと,基質との直接の結合を測定するゲルシフトアッセイにより,Dicer-1の認識するRNAの構造的な特徴およびDicer-1の基質認識におけるヘリカーゼドメインの役割を明らかにした.
1.Dicer-1は基質RNAの両端の構造を認識している
miRNA前駆体のもつ構造的な特徴のうち,どれがDicer-1による認識に必要であるかを調べるため,精製した組換えDicer-1と合成した基質RNAを用いてin vitro基質切断アッセイを行った.miRNA前駆体のもつ構造的な特徴としては,さきに述べたステム構造とループ構造のほか,3’末端が5’末端に対し2塩基だけ突出した3’突出末端構造とよばれる構造と,ステム構造に存在する2個程度のミスマッチがあげられる(図2a).これらのうち,ステム構造のミスマッチの有無はDicer-1による切断活性に影響をあたえなかった(図2b).miRNA/miRNA*二本鎖のミスマッチはDicerによる切断のあとArgonauteに取り込まれ一本鎖となる過程で重要な役割をもつが5),Dicer-1による切断の段階では意味をもたないのであろう.一方,3’突出末端構造のない基質はDicer-1による切断をほとんどうけなかったことから,Dicer-1によるこの構造の認識が重要であることが示唆された(図2c).また,ループ構造の部分が小さくなるにしたがいDicer-1による切断活性が大幅に減少したことから,Dicer-1はループ構造の一本鎖RNA領域を認識していることが明らかになった(図2d).さらに,このループ構造を中央で切断した“二本鎖+一本鎖”型のY字型の基質もヘアピン型の基質と同じ程度に切断をうけた(図2e).くわえて,このY字型の基質も一本鎖の部分が短くなると切断されにくくなるというヘアピン型の基質と同様の傾向を示した.
これらの結果から,Dicer-1は基質RNAの両端の構造である3’突出末端構造とループ構造とを認識していることが示された.とくに,ループ構造はある程度以上の長さの一本鎖RNAがその位置に存在することが重要であり必ずしもループ構造をとる必要はないものと考えられた.
2.Dicer-1は基質RNAの3’突出末端構造からループ構造までの距離を測っている
基質RNAの二本鎖RNA部分に着目して実験を進めたところ,ヘアピン型あるいは“二本鎖+一本鎖”型のどちらの基質でも,ステム構造(二本鎖の部分)を長くするにしたがいDicer-1による切断をうけにくくなることが観察された(図2 f, g).ここから,Dicer-1は基質の3’突出末端構造から一本鎖RNA領域までの距離を測っていることが示唆された.これを確認するため,“長い二本鎖+一本鎖”型の基質と,同じ長さの“二本鎖+一本鎖+二本鎖”型の基質を作製し切断活性を比較した(図2 g, h).すると,3’突出末端構造と一本鎖RNA領域との距離がより近い“二本鎖+一本鎖+二本鎖”型の基質のほうがDicer-1に切断されやすいことがわかり,仮説を支持する結果となった.
つぎに,切断活性のない組換えDicer-1変異体を用いたゲルシフトアッセイにより基質RNAとDicer-1との結合能を評価した.切断活性の低いループ構造の小さい基質およびステム構造の長い基質では,野生型の基質に比べてDicer-1との結合能が低下していた.よって,異常な構造をもつ基質におけるDicer-1の切断活性の低下は切断反応そのものによる影響ではなく,おもに基質RNAとの結合能の低下によることが示唆された.
以上から,Dicer-1は基質の3’突出末端構造からループ構造までの長さを測り,これらが適切な距離にあるときにのみ基質と結合し切断する,というモデルが考えられた.鞭毛虫Giardia intestinalisに由来するDicerは結晶構造が解かれており,PAZドメインにより基質の3’突出末端構造と結合し,ここからRNaseIIIドメインまでの距離を定規のように使って切断産物の長さを決定していることが報告されている6).この研究で用いたすべての基質RNAにおいてDicer-1による切断産物の長さに変化はなかったことから,ショウジョウバエのDicer-1も同じ定規としてのはたらきをもっているものと考えられた.さらに,ショウジョウバエのDicer-1にはもうひとつの定規,すなわち3’突出末端構造からループ構造までの距離を測るはたらきがあり,これにより切断すべき正しい基質とのみ結合しこれを切断しているものと考えられた.
3.基質RNAの一本鎖領域の認識にはDicer-1のヘリカーゼドメインが重要である
では,Dicer-1はどの部分で基質RNAのループ構造を認識しているのだろうか? さきに述べたGiardiaに由来するDicerは,DUF283ドメイン,PAZドメイン,RNaseIIIドメインという,いわばDicerとしての“核”となるドメインしかもっていない特殊なDicerである.通常のDicerはこれらにくわえ,N末端側にヘリカーゼドメイン,C末端側に二本鎖RNA結合ドメインをもつ.DicerのヘリカーゼドメインはRIG-Iとよばれるヘリカーゼと配列の類似性が高い.RIG-Iは二本鎖RNAと結合しそのうえをATPを消費しながら移動するトランスロカーゼ様の性質をもつ7).ショウジョウバエDicer-2のヘリカーゼドメインはヒトDICER1やショウジョウバエDicer-1と比べRIG-Iとの類似性が高く,実際に,Dicer-2はヘリカーゼドメインによりATPを消費しながら長い二本鎖RNAのうえを移動することが示唆されている4).一方,Dicer-1のヘリカーゼドメインはRIG-Iとの類似性が低く,ATPの加水分解を行うモチーフなどいくつかの重要なモチーフが保存されていない.
そこで,この特徴的な配列の保存性の低いヘリカーゼドメインにより,miRNA前駆体のみを排他的に認識するというDicer-1の独特な基質特異性がもたらされているのではないかと考え,ヘリカーゼドメインを欠損した組換えDicer-1変異体を作製した.これを用いてin vitro基質切断アッセイを行ったところ,野生型の基質に対する切断活性がステム構造の長い基質やループ構造の小さい基質に対するものと同じ程度にまで低下していた.さらに,ゲルシフトアッセイにより野生型の基質に対する結合能も著しく低下していることが確認された.これらの結果は,Dicer-1が切断するべき基質とそうでない基質とを見分ける能力を失ったことを意味していた.よって,Dicer-1は特徴的なヘリカーゼドメインにより基質RNAのループ構造を認識しており,この認識により基質との結合能をひき上げ,結果的に切断活性を上昇させているものと結論づけた.
4.ヒトDICER1は厳密な基質特異性をもたない
ヒトのDICER1は長い二本鎖RNAとmiRNA前駆体のどちらも切断することが知られている.また,その切断反応にATPを必要としない8).ここから予想されるように,ヒトDICER1を用いたin vitro基質切断アッセイではループ構造の小さな基質やステム構造の長い基質なども一定の効率で切断した.ヒトDICER1のヘリカーゼドメインとRIG-Iとの配列の類似性は,ショウジョウバエのDicer-2よりも低くDicer-1よりも高い.ATP依存的に二本鎖RNAを効率よく切断するDicer-2と,ATP非依存的にmiRNA前駆体のみを切断するDicer-1の中間ともいえるヒトDICER1の性質は,このようなヘリカーゼドメインの配列により説明できるのではないかと考えている.
おわりに
この研究において,筆者らは,ショウジョウバエDicer-1によるmiRNA前駆体の切断が以下の2つのステップで起こると考えた(図3).まず,PAZドメインとヘリカーゼドメインとの距離を利用した分子定規により基質RNAの3’突出末端構造からループ構造までの距離を測り,この距離が適切であるときにのみ基質と結合する.つづいて,PAZドメインとRNaseIIIドメインとの距離を用いた分子定規により一定の長さのRNAを切り出す.しかし,ヘリカーゼドメインは一本鎖RNA領域を認識することでどのようにしてDicer-1と基質との結合を安定化させているのか,たとえば,Dicer-1のコンフォメーションの変化をともなっているのか,といった点については不明なままである.また,ショウジョウバエDicer-2,ヒトDICER1,ショウジョウバエDicer-1の性質とヘリカーゼドメインの配列との関係のように,Dicerの基質特異性はヘリカーゼドメインのアミノ酸配列や機能により決定されていると考えており,この点からも,ヘリカーゼドメインの機能と構造についてのより詳細な解明が必要であるといえる.
文 献
- Carthew, R. W. & Sontheimer, E. J.: Origins and mechanisms of miRNAs and siRNAs. Cell, 136, 642-655 (2009)[PubMed]
- Provost, P., Dishart, D., Doucet, J. et al.: Ribonuclease activity and RNA binding of recombinant human Dicer. EMBO J., 21, 5864-5874 (2002)[PubMed]
- Lee, Y. S., Nakahara, K., Pham, J. W. et al.: Distinct roles for Drosophila Dicer-1 and Dicer-2 in the siRNA/miRNA silencing pathways. Cell, 117, 69-81 (2004)[PubMed]
- Cenik, E. S., Fukunaga, R., Lu, G. et al.: Phosphate and R2D2 restrict the substrate specificity of Dicer-2, an ATP-driven ribonuclease. Mol. Cell, 42, 172-184 (2011)[PubMed] [新着論文レビュー]
- Kawamata, T, Seitz, H. & Tomari, Y.: ATP-dependent human RISC assembly pathways. Nat. Struct. Mol. Biol., 17, 17-23 (2009)[PubMed]
- Macrae, I. J., Zhou, K., Li, F. et al.: Structural basis for double-stranded RNA processing by Dicer. Science, 311, 195-198 (2006)[PubMed]
- Myong, S., Cui, S., Cornish, P. V. et al.: Cytosolic viral sensor RIG-I is a 5’-triphosphate-dependent translocase on double-stranded RNA. Science, 323, 1070-1074 (2009)[PubMed]
- Zhang, H., Kolb, F. A., Brondani, V. et al.: Human Dicer preferentially cleaves dsRNAs at their termini without a requirement for ATP. EMBO J., 21, 5875-5885 (2002)[PubMed]
著者プロフィール
略歴:東京大学大学院新領域創成科学研究科博士課程 在学中.
研究テーマ:small RNAの生合成の機構.
関心事:生命現象を1分子のレベルで記述していきたい.と,子育て.
泊 幸秀(Yukihide Tomari)
東京大学分子細胞生物学研究所 准教授
© 2011 包 明久・泊 幸秀 Licensed under CC 表示 2.1 日本