中枢神経系に特異的に発現するmiRNA-124aはニューロンの成熟に必須である
佐貫理佳子・古川貴久
(大阪バイオサイエンス研究所 発生生物学部門)
email:古川貴久
DOI: 10.7875/first.author.2011.155
miR-124a is required for hippocampal axogenesis and retinal cone survival through Lhx2 suppression.
Rikako Sanuki, Akishi Onishi, Chieko Koike, Rieko Muramatsu, Satoshi Watanabe, Yuki Muranishi, Shoichi Irie, Shinji Uneo, Toshiyuki Koyasu, Ryosuke Matsui, Yoan Chérasse, Yoshihiro Urade, Dai Watanabe, Mineo Kondo, Toshihide Yamashita, Takahisa Furukawa
Nature Neuroscience, 14, 1125-1134 (2011)
miR-124aは中枢神経系においてもっとも多く発現しているマイクロRNAである.以前からその機能が注目されていたが,実際の生体における機能に関しては相反する報告があり明確には解明されていなかった.miR-124aはゲノムの3カ所の異なる領域にコードされている.筆者らは,生体におけるmiR-124aの機能を解明するため,miR-124a発現においてもっとも重要な領域であるmiR-124a-1をコードする遺伝子を欠損させたマウスを作製した.このマウスでは網膜の錐体視細胞と海馬歯状回の顆粒細胞においてmiR-124aの発現が消失したため,この2つの領域でmiR-124aの機能評価を行った.その結果,miR-124aはニューロンの誕生よりも,その標的遺伝子であるLhx2遺伝子の発現を抑制することによりニューロンの成熟と維持に機能していることが明らかになった.
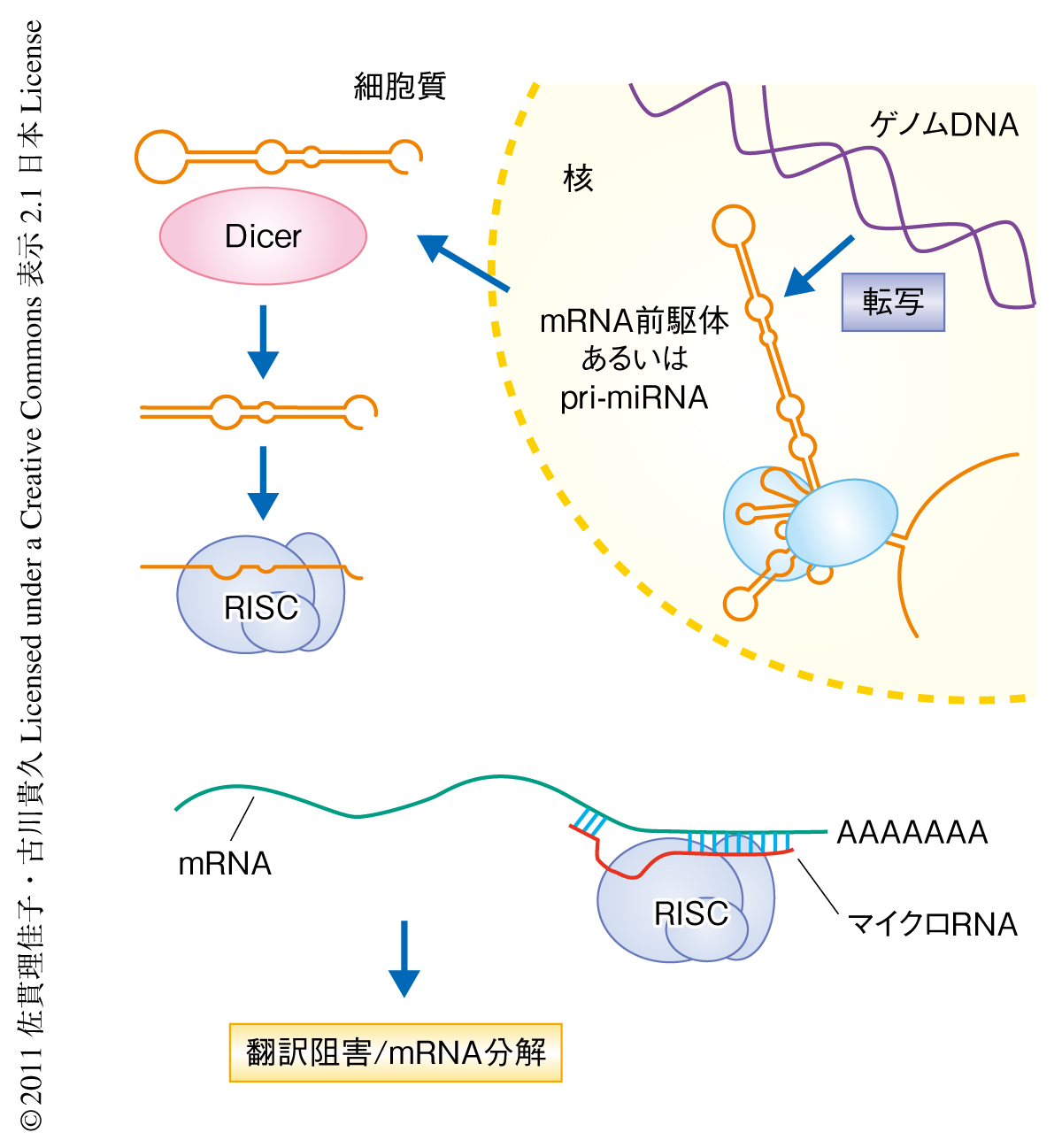
マイクロRNAはゲノムDNAにコードされる遺伝情報のひとつであり,このようなRNAはプライマリーマイクロRNA(pri-miRNA)とよばれる.そして,スプライシングの過程においてヘアピン構造からなるマイクロRNA前駆体(pre-miRNA)がつくられる.そののち,マイクロRNA前駆体は核外へと輸送され,さらなる切り出しが行われて成熟した18~25塩基のRNAからなるマイクロRNAとなる.マイクロRNAにはともに機能するタンパク質複合体があり,それらとRISC(RNA-induced silencing complex)という複合体を形成する.標的とするmRNAにマイクロRNAが相補的に結合すると,その標的mRNAにおいて翻訳の阻害あるいはmRNAの分解が起こることで遺伝子発現が抑制される(図1).
マイクロRNAはさまざまな生物に存在することが確認されており,2011年4月の時点で,ウイルスや細菌からヒトまでの153生物種において19,724種類が登録されている.現時点で,ヒトにおいては約600種類のマイクロRNAの発現が予想され,そのうち500をこえるマイクロRNAが前頭前野などの脳部位で発現している可能性のあることが報告されている1,2).これらのマイクロRNAのなかで,miR-124aは脳の全体でもっとも高発現しているマイクロRNAであり3),中枢神経系において特異的に高く発現している.そのため,以前から注目されてきたが,生体での機能,とくにニューロンへの初期運命の決定に関しては相反する報告があり4,5),マウスの遺伝学的な手法を用いた生体での機能の解明が期待されていた.
ヒトおよびマウスではmiR-124aはゲノムの3カ所にコードされており,それぞれ,miR-124a-1,miR-124a-2,miR-124a-3とよばれる.それぞれのpri-miRNAの発現量についてリアルタイムPCR法を用いて調べた.その結果,網膜や海馬,大脳皮質ではpri-miR-124a-1の発現量がもっとも多く,つづいてpri-miR-124a-2が発現しており,pri-miR-124a-3はほとんど発現していないことが明らかになった.通常,マイクロRNAはmRNAのイントロンに存在している場合が多いが,miR-124a-1はほかのマイクロRNAとは異なり,タンパク質をコードしないRNAの遺伝子であるRncr3(retinal non-coding RNA 3)のエキソンにコードされており,Rncr3 RNAがpri-miR-124a-1として存在する.また,ヒトにおいてRncr3遺伝子は第8染色体短腕(8p23.1)に存在し,その領域の欠損あるいは重複による精神疾患との関連が報告されている6).これらのことから,生体におけるmiR-124aの機能を調べるためRncr3遺伝子を欠損させたマウスを作製した.このRncr3ノックアウトマウスではすべての中枢神経系においてmiR-124aの発現が30%から40%にまで減少しており,miR-124a-2やmiR-124a-3をコードする遺伝子よりもmiR-124a-1をコードするRncr3遺伝子のほうがmiR-124aの発現にとり重要な領域であることが示された.
つぎに,生体のどの領域を対象とすればmiR-124aの機能解析が行えるかを調べるため,in situハイブリダイゼーション法によりRncr3ノックアウトマウスにおけるmiR-124aの神経組織での発現パターンを野生型マウスと比較した.胎生15.5日目の網膜と生後6日目の脳切片を用いて調べた結果,網膜では明所視力と色覚をつかさどる錐体視細胞において,脳では記憶の入り口となる海馬歯状回の顆粒細胞において,miR-124aの発現が消失していることが明らかになった.
つぎに,miR-124aの発現が消失したRncr3ノックアウトマウスの網膜の錐体視細胞と海馬歯状回の顆粒細胞に対して表現型の解析を行った.錐体視細胞への細胞運命の決定がほぼ終了する胎生17.5日目の網膜を用いて錐体視細胞のマーカーであるTRβ2により免疫染色を行ったところ,錐体視細胞の数は野生型マウスとRncr3ノックアウトマウスとを比較しても変化はなかった.しかし,成体の網膜を用いて錐体視細胞のマーカーであるSオプシンとMオプシンにより免疫染色を行うと,Rncr3ノックアウトマウスにおいて錐体視細胞の数が顕著に減少していることが明らかになった.また,網膜電位図の測定でも,Rncr3ノックアウトマウスでは錐体視細胞に由来する振幅が野生型マウスと比べて減少していた.生後3日目の網膜を用いてTUNEL解析と活性型カスパーゼ3による免疫染色を行いアポトーシスの誘導について調べたところ,成熟の過程で錐体視細胞がアポトーシスを起こして脱落していることが見い出された.
さらに,海馬歯状回においては,ニューロンを染色するNissl染色法により顆粒細胞は正常に誕生していることが明らかになった.顆粒細胞からは海馬のCA3領域へむかって軸索(苔状線維)が伸長しCA3領域を構成するピラミダル細胞とシナプスを形成するが,通常,このシナプスは海馬の透明層で形成される.顆粒細胞から伸長する苔状線維の軸索終末をTimm染色法で可視化したところ,Rncr3ノックアウトマウスでは苔状線維が透明層で停止せずCA3領域にまで異常に侵入していることが明らかになった.以上のことから,miR-124aはニューロンの誕生よりも,むしろ,その成熟と維持に必須であることが見い出された.
Rncr3ノックアウトマウスの表現型はmiR-124aの標的遺伝子において制御不良が発生したことより生じたものと考え,神経領域そのものの形成に必須な転写因子についてその3’側非翻訳領域を調べた.すると,転写因子LHX2をコードするLhx2遺伝子がmiR-124aに対する標的配列をもち,さらに,その配列は種のあいだで高く保存されていた.LHX2の発現部位をRncr3遺伝子の発現部位と比較すると,その発現パターンは相互に排他的であった.Lhx2遺伝子の3’側非翻訳領域を遺伝子クローニングしてレポーター遺伝子の3’側非翻訳領域に挿入し,miR-124aと共発現させることでin vitroレポーター解析を行った.その結果,miR-124aはLhx2遺伝子を標的とすることが明らかになった.そこで,実際の生体においてもmiR-124aがLhx2遺伝子を標的としているかどうか調べるため,Rncr3ノックアウトマウスの網膜の錐体視細胞と海馬歯状回の顆粒細胞においてLHX2の制御不良についてその免疫染色により検討した.その結果,この2つの細胞においてはLHX2の発現が異常につづいていることが観察された.したがって,実際の生体においてmiR-124aはLhx2遺伝子を標的とすることが示唆された.
さらに,miR-124aの標的となる3’側非翻訳領域をもつ野生型Lhx2遺伝子,あるいは,この3’側非翻訳領域を改変してmiR-124aの標的とならないようにした変異Lhx2遺伝子を生後0日目のマウスの網膜にエレクトロポレーション法により過剰発現し,生後4日目において観察した.その結果,変異Lhx2遺伝子を発現させた網膜では野生型Lhx2遺伝子を発現させた網膜に比べてアポトーシスを起こすニューロンの数が多く観察された.また,Lhx2遺伝子を強制発現させた海馬歯状回の顆粒細胞は対照に比べその軸索が長く伸長した.したがって,Lhx2遺伝子の過剰発現によりRncr3ノックアウトマウスの表現型を模倣できることが示された.
Rncr3ノックアウトマウスにおいて起こる網膜の錐体視細胞の脱落と海馬歯状回の顆粒細胞における苔状線維の異常な伸長がmiR-124aの欠損によることを証明するため,miR-124aを錐体視細胞や顆粒細胞において発現させることのできるトランスジェニックマウスを作製した.このトランスジェニックマウスとRncr3ノックアウトマウスとを掛け合わせることによりRncr3ノックアウトマウスにおいてmiR-124aの発現を補った.その結果,網膜では錐体視細胞の脱落が回復し,海馬歯状回の顆粒細胞における苔状線維の異常な伸長についても同様に回復がみられた.
さらに,Rncr3ノックアウトマウスにおいてLhx2遺伝子をノックダウンしてその表現型が回復するかどうか検討した.アポトーシスが起こるまえの生後0日目のRncr3ノックアウトマウスの網膜の錐体視細胞にLhx2遺伝子に対するshRNAを発現させたところ,Lhx2遺伝子のノックダウンによりRncr3ノックアウトマウスにおける錐体視細胞の脱落が有意に回復した.また,Rncr3ノックアウトマウスの海馬歯状回の顆粒細胞の初代培養細胞は野生型に比べ軸索を長く伸長させる細胞が多く存在したが,Lhx2遺伝子のノックダウンにより野生型の細胞と同じレベルにまで回復した.この結果から,Rncr3ノックアウトマウスの表現型はおもにLhx2遺伝子の発現異常によることが示された.
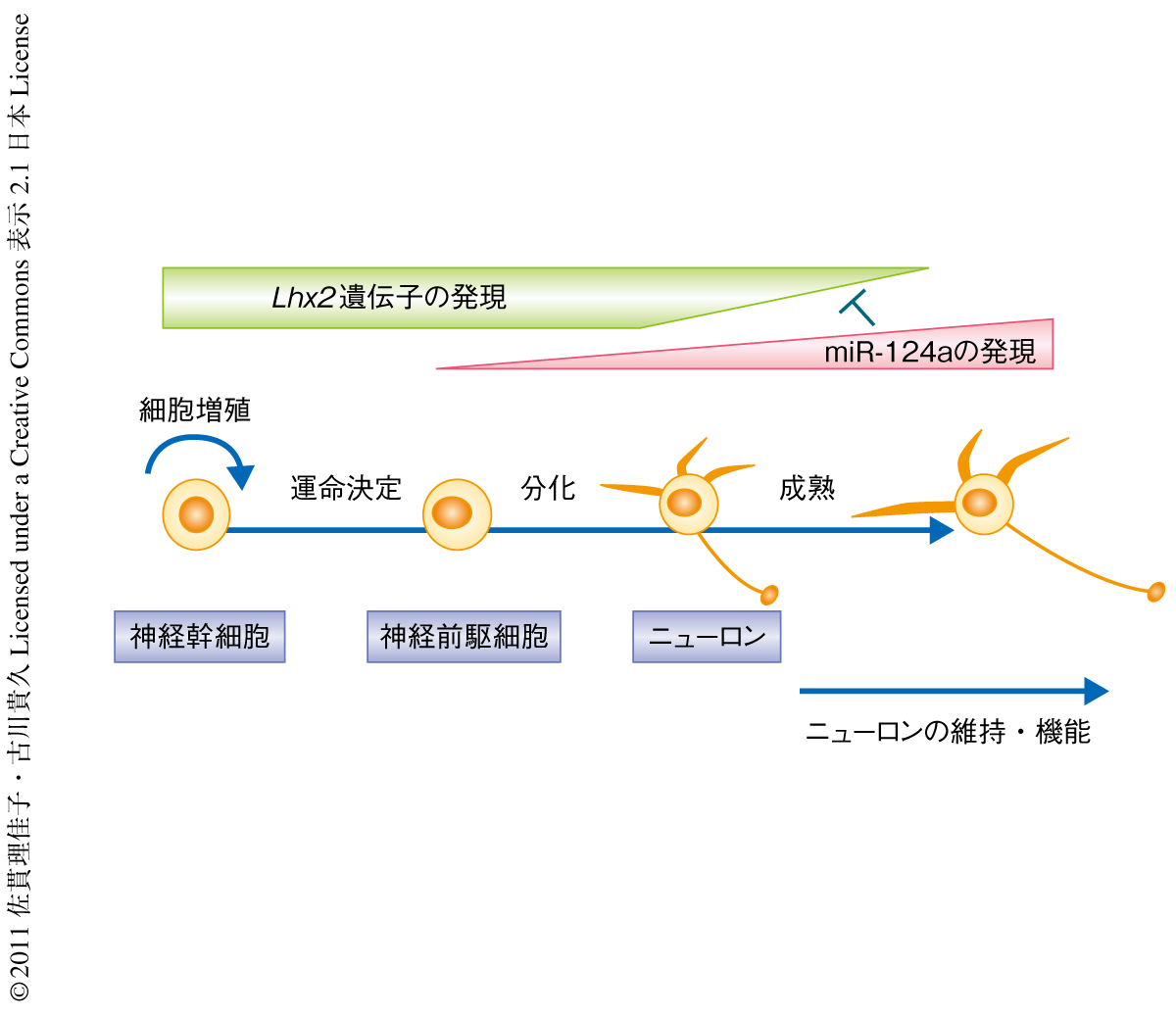
筆者らは,Rncr3遺伝子を欠損させることにより網膜の錐体視細胞と海馬歯状回の顆粒細胞においてmiR-124a欠損のモデル解析を行った.その結果,生体においてはmiR-124aはニューロンの誕生よりむしろニューロンの維持と成熟にLhx2遺伝子の発現抑制を介し寄与していることが明らかになった(図2).一般に,マイクロRNAには多くの標的遺伝子が存在し,siRNAと比べて比較的ルーズなRNA干渉作用を示す.また,mRNAもその3’側非翻訳領域に多くのマイクロRNA標的配列をもつ.これまでmiR-124aの機能について相反する結果が存在したのは,培養細胞での結果を基本とした考えが生体における機能にも適応されたからではないかと考えられる.そのため,miR-124aの機能についてはニューロンの誕生との関連が注力されてきた.しかし,培養細胞を用いた実験系では,生体ではほかの遺伝子制御機構により発現が調節されるべき遺伝子もmiR-124aの標的遺伝子として観察されてしまう可能性が高い.最近,miR-124aを含む複数の因子を用いることにより,ヒト線維芽細胞からニューロンへ直接的な転換を誘導できることが示された.miR-124aがニューロンをin vitroで誘導するのに有用なマイクロRNAであることは興味深い7,8).しかし筆者らの結果から,生体ではmiR-124aはニューロンの成熟や生存においてきわめて本質的な機能をもつことが明らかになった.また,miR-124aの発現は成熟したのちのニューロンにおいてより強く観察できる.したがって,分化し成熟したニューロンの機能そのものに関与している可能性が高く,生体でのmiR-124aの機能についてはさらなる謎が残されている.脳や網膜におけるmiR-124aのさらなる機能解明が多くの重要な知見をもたらすものと期待される.
略歴:2010年 京都大学大学院医学研究科 修了,科学技術振興事業機構CRESTプロジェクト 特別研究員を経て,2011年より大阪バイオサイエンス研究所 研究員.
研究テーマ:網膜を中枢神経系のモデルとした,神経系の発生とシナプス形成の機構の一般則の解明.
古川 貴久(Takahisa Furukawa)
大阪バイオサイエンス研究所 部長.
研究室URL:http://www.obi.or.jp/dept4/index.html
© 2011 佐貫理佳子・古川貴久 Licensed under CC 表示 2.1 日本
(大阪バイオサイエンス研究所 発生生物学部門)
email:古川貴久
DOI: 10.7875/first.author.2011.155
miR-124a is required for hippocampal axogenesis and retinal cone survival through Lhx2 suppression.
Rikako Sanuki, Akishi Onishi, Chieko Koike, Rieko Muramatsu, Satoshi Watanabe, Yuki Muranishi, Shoichi Irie, Shinji Uneo, Toshiyuki Koyasu, Ryosuke Matsui, Yoan Chérasse, Yoshihiro Urade, Dai Watanabe, Mineo Kondo, Toshihide Yamashita, Takahisa Furukawa
Nature Neuroscience, 14, 1125-1134 (2011)
要 約
miR-124aは中枢神経系においてもっとも多く発現しているマイクロRNAである.以前からその機能が注目されていたが,実際の生体における機能に関しては相反する報告があり明確には解明されていなかった.miR-124aはゲノムの3カ所の異なる領域にコードされている.筆者らは,生体におけるmiR-124aの機能を解明するため,miR-124a発現においてもっとも重要な領域であるmiR-124a-1をコードする遺伝子を欠損させたマウスを作製した.このマウスでは網膜の錐体視細胞と海馬歯状回の顆粒細胞においてmiR-124aの発現が消失したため,この2つの領域でmiR-124aの機能評価を行った.その結果,miR-124aはニューロンの誕生よりも,その標的遺伝子であるLhx2遺伝子の発現を抑制することによりニューロンの成熟と維持に機能していることが明らかになった.
はじめに
マイクロRNAはゲノムDNAにコードされる遺伝情報のひとつであり,このようなRNAはプライマリーマイクロRNA(pri-miRNA)とよばれる.そして,スプライシングの過程においてヘアピン構造からなるマイクロRNA前駆体(pre-miRNA)がつくられる.そののち,マイクロRNA前駆体は核外へと輸送され,さらなる切り出しが行われて成熟した18~25塩基のRNAからなるマイクロRNAとなる.マイクロRNAにはともに機能するタンパク質複合体があり,それらとRISC(RNA-induced silencing complex)という複合体を形成する.標的とするmRNAにマイクロRNAが相補的に結合すると,その標的mRNAにおいて翻訳の阻害あるいはmRNAの分解が起こることで遺伝子発現が抑制される(図1).
マイクロRNAはさまざまな生物に存在することが確認されており,2011年4月の時点で,ウイルスや細菌からヒトまでの153生物種において19,724種類が登録されている.現時点で,ヒトにおいては約600種類のマイクロRNAの発現が予想され,そのうち500をこえるマイクロRNAが前頭前野などの脳部位で発現している可能性のあることが報告されている1,2).これらのマイクロRNAのなかで,miR-124aは脳の全体でもっとも高発現しているマイクロRNAであり3),中枢神経系において特異的に高く発現している.そのため,以前から注目されてきたが,生体での機能,とくにニューロンへの初期運命の決定に関しては相反する報告があり4,5),マウスの遺伝学的な手法を用いた生体での機能の解明が期待されていた.
1.miR-124a-1をコードする遺伝子を欠損したマウスでは網膜の錐体視細胞と海馬歯状回の顆粒細胞においてmiR-124aの発現が消失する
ヒトおよびマウスではmiR-124aはゲノムの3カ所にコードされており,それぞれ,miR-124a-1,miR-124a-2,miR-124a-3とよばれる.それぞれのpri-miRNAの発現量についてリアルタイムPCR法を用いて調べた.その結果,網膜や海馬,大脳皮質ではpri-miR-124a-1の発現量がもっとも多く,つづいてpri-miR-124a-2が発現しており,pri-miR-124a-3はほとんど発現していないことが明らかになった.通常,マイクロRNAはmRNAのイントロンに存在している場合が多いが,miR-124a-1はほかのマイクロRNAとは異なり,タンパク質をコードしないRNAの遺伝子であるRncr3(retinal non-coding RNA 3)のエキソンにコードされており,Rncr3 RNAがpri-miR-124a-1として存在する.また,ヒトにおいてRncr3遺伝子は第8染色体短腕(8p23.1)に存在し,その領域の欠損あるいは重複による精神疾患との関連が報告されている6).これらのことから,生体におけるmiR-124aの機能を調べるためRncr3遺伝子を欠損させたマウスを作製した.このRncr3ノックアウトマウスではすべての中枢神経系においてmiR-124aの発現が30%から40%にまで減少しており,miR-124a-2やmiR-124a-3をコードする遺伝子よりもmiR-124a-1をコードするRncr3遺伝子のほうがmiR-124aの発現にとり重要な領域であることが示された.
つぎに,生体のどの領域を対象とすればmiR-124aの機能解析が行えるかを調べるため,in situハイブリダイゼーション法によりRncr3ノックアウトマウスにおけるmiR-124aの神経組織での発現パターンを野生型マウスと比較した.胎生15.5日目の網膜と生後6日目の脳切片を用いて調べた結果,網膜では明所視力と色覚をつかさどる錐体視細胞において,脳では記憶の入り口となる海馬歯状回の顆粒細胞において,miR-124aの発現が消失していることが明らかになった.
2.miR-124aはニューロンの維持と成熟に関与する
つぎに,miR-124aの発現が消失したRncr3ノックアウトマウスの網膜の錐体視細胞と海馬歯状回の顆粒細胞に対して表現型の解析を行った.錐体視細胞への細胞運命の決定がほぼ終了する胎生17.5日目の網膜を用いて錐体視細胞のマーカーであるTRβ2により免疫染色を行ったところ,錐体視細胞の数は野生型マウスとRncr3ノックアウトマウスとを比較しても変化はなかった.しかし,成体の網膜を用いて錐体視細胞のマーカーであるSオプシンとMオプシンにより免疫染色を行うと,Rncr3ノックアウトマウスにおいて錐体視細胞の数が顕著に減少していることが明らかになった.また,網膜電位図の測定でも,Rncr3ノックアウトマウスでは錐体視細胞に由来する振幅が野生型マウスと比べて減少していた.生後3日目の網膜を用いてTUNEL解析と活性型カスパーゼ3による免疫染色を行いアポトーシスの誘導について調べたところ,成熟の過程で錐体視細胞がアポトーシスを起こして脱落していることが見い出された.
さらに,海馬歯状回においては,ニューロンを染色するNissl染色法により顆粒細胞は正常に誕生していることが明らかになった.顆粒細胞からは海馬のCA3領域へむかって軸索(苔状線維)が伸長しCA3領域を構成するピラミダル細胞とシナプスを形成するが,通常,このシナプスは海馬の透明層で形成される.顆粒細胞から伸長する苔状線維の軸索終末をTimm染色法で可視化したところ,Rncr3ノックアウトマウスでは苔状線維が透明層で停止せずCA3領域にまで異常に侵入していることが明らかになった.以上のことから,miR-124aはニューロンの誕生よりも,むしろ,その成熟と維持に必須であることが見い出された.
3.miR-124aはLhx2遺伝子を標的とする
Rncr3ノックアウトマウスの表現型はmiR-124aの標的遺伝子において制御不良が発生したことより生じたものと考え,神経領域そのものの形成に必須な転写因子についてその3’側非翻訳領域を調べた.すると,転写因子LHX2をコードするLhx2遺伝子がmiR-124aに対する標的配列をもち,さらに,その配列は種のあいだで高く保存されていた.LHX2の発現部位をRncr3遺伝子の発現部位と比較すると,その発現パターンは相互に排他的であった.Lhx2遺伝子の3’側非翻訳領域を遺伝子クローニングしてレポーター遺伝子の3’側非翻訳領域に挿入し,miR-124aと共発現させることでin vitroレポーター解析を行った.その結果,miR-124aはLhx2遺伝子を標的とすることが明らかになった.そこで,実際の生体においてもmiR-124aがLhx2遺伝子を標的としているかどうか調べるため,Rncr3ノックアウトマウスの網膜の錐体視細胞と海馬歯状回の顆粒細胞においてLHX2の制御不良についてその免疫染色により検討した.その結果,この2つの細胞においてはLHX2の発現が異常につづいていることが観察された.したがって,実際の生体においてmiR-124aはLhx2遺伝子を標的とすることが示唆された.
さらに,miR-124aの標的となる3’側非翻訳領域をもつ野生型Lhx2遺伝子,あるいは,この3’側非翻訳領域を改変してmiR-124aの標的とならないようにした変異Lhx2遺伝子を生後0日目のマウスの網膜にエレクトロポレーション法により過剰発現し,生後4日目において観察した.その結果,変異Lhx2遺伝子を発現させた網膜では野生型Lhx2遺伝子を発現させた網膜に比べてアポトーシスを起こすニューロンの数が多く観察された.また,Lhx2遺伝子を強制発現させた海馬歯状回の顆粒細胞は対照に比べその軸索が長く伸長した.したがって,Lhx2遺伝子の過剰発現によりRncr3ノックアウトマウスの表現型を模倣できることが示された.
4.Rncr3ノックアウトマウスの表現型はmiR-124aの強制発現あるいはLhx2遺伝子のノックダウンによりレスキューされる
Rncr3ノックアウトマウスにおいて起こる網膜の錐体視細胞の脱落と海馬歯状回の顆粒細胞における苔状線維の異常な伸長がmiR-124aの欠損によることを証明するため,miR-124aを錐体視細胞や顆粒細胞において発現させることのできるトランスジェニックマウスを作製した.このトランスジェニックマウスとRncr3ノックアウトマウスとを掛け合わせることによりRncr3ノックアウトマウスにおいてmiR-124aの発現を補った.その結果,網膜では錐体視細胞の脱落が回復し,海馬歯状回の顆粒細胞における苔状線維の異常な伸長についても同様に回復がみられた.
さらに,Rncr3ノックアウトマウスにおいてLhx2遺伝子をノックダウンしてその表現型が回復するかどうか検討した.アポトーシスが起こるまえの生後0日目のRncr3ノックアウトマウスの網膜の錐体視細胞にLhx2遺伝子に対するshRNAを発現させたところ,Lhx2遺伝子のノックダウンによりRncr3ノックアウトマウスにおける錐体視細胞の脱落が有意に回復した.また,Rncr3ノックアウトマウスの海馬歯状回の顆粒細胞の初代培養細胞は野生型に比べ軸索を長く伸長させる細胞が多く存在したが,Lhx2遺伝子のノックダウンにより野生型の細胞と同じレベルにまで回復した.この結果から,Rncr3ノックアウトマウスの表現型はおもにLhx2遺伝子の発現異常によることが示された.
おわりに
筆者らは,Rncr3遺伝子を欠損させることにより網膜の錐体視細胞と海馬歯状回の顆粒細胞においてmiR-124a欠損のモデル解析を行った.その結果,生体においてはmiR-124aはニューロンの誕生よりむしろニューロンの維持と成熟にLhx2遺伝子の発現抑制を介し寄与していることが明らかになった(図2).一般に,マイクロRNAには多くの標的遺伝子が存在し,siRNAと比べて比較的ルーズなRNA干渉作用を示す.また,mRNAもその3’側非翻訳領域に多くのマイクロRNA標的配列をもつ.これまでmiR-124aの機能について相反する結果が存在したのは,培養細胞での結果を基本とした考えが生体における機能にも適応されたからではないかと考えられる.そのため,miR-124aの機能についてはニューロンの誕生との関連が注力されてきた.しかし,培養細胞を用いた実験系では,生体ではほかの遺伝子制御機構により発現が調節されるべき遺伝子もmiR-124aの標的遺伝子として観察されてしまう可能性が高い.最近,miR-124aを含む複数の因子を用いることにより,ヒト線維芽細胞からニューロンへ直接的な転換を誘導できることが示された.miR-124aがニューロンをin vitroで誘導するのに有用なマイクロRNAであることは興味深い7,8).しかし筆者らの結果から,生体ではmiR-124aはニューロンの成熟や生存においてきわめて本質的な機能をもつことが明らかになった.また,miR-124aの発現は成熟したのちのニューロンにおいてより強く観察できる.したがって,分化し成熟したニューロンの機能そのものに関与している可能性が高く,生体でのmiR-124aの機能についてはさらなる謎が残されている.脳や網膜におけるmiR-124aのさらなる機能解明が多くの重要な知見をもたらすものと期待される.
文 献
- Somel, M., Guo, S., Fu, N. et al.: MicroRNA, mRNA, and protein expression link development and aging in human and macaque brain. Genome Res., 20, 1207-1218 (2010)[PubMed]
- Berezikov, E., Thuemmler, F., van Laake, L. W. et al.: Diversity of microRNAs in human and chimpanzee brain. Nat. Genet., 38, 1375-1377 (2006)[PubMed]
- Lagos-Quintana, M., Rauhut, R., Yalcin, A. et al.: Identification of tissue-specific microRNAs from mouse. Curr. Biol., 12, 735-739 (2002)[PubMed]
- Visvanathan, J., Lee, S., Lee, B. et al.: The microRNA miR-124 antagonizes the anti-neural REST/SCP1 pathway during embryonic CNS development. Genes Dev., 21, 744-749 (2007)[PubMed]
- Cao, X., Pfaff, S. L. & Gage, F. H.: A functional study of miR-124 in the developing neural tube. Genes Dev., 21, 531-536 (2007)[PubMed]
- Tabares-Seisdedos, R. & Rubenstein, J. L.: Chromosome 8p as a potential hub for developmental neuropsychiatric disorders: implications for schizophrenia, autism and cancer. Mol. Psychiatry, 14, 563-589 (2009)[PubMed]
- Ambasudhan, R., Talantova, M., Coleman, R. et al.: Direct reprogramming of adult human fibroblasts to functional neurons under defined conditions. Cell Stem Cell, 9, 113-118 (2011)[PubMed]
- Jo, D. H., Kim, J. H., Park, W. Y. et al.: Differential profiles of microRNAs in retinoblastoma cell lines of different proliferation and adherence patterns. J. Pediatr. Hematol. Oncol., 33, 529-533 (2011)[PubMed]
著者プロフィール
略歴:2010年 京都大学大学院医学研究科 修了,科学技術振興事業機構CRESTプロジェクト 特別研究員を経て,2011年より大阪バイオサイエンス研究所 研究員.
研究テーマ:網膜を中枢神経系のモデルとした,神経系の発生とシナプス形成の機構の一般則の解明.
古川 貴久(Takahisa Furukawa)
大阪バイオサイエンス研究所 部長.
研究室URL:http://www.obi.or.jp/dept4/index.html
© 2011 佐貫理佳子・古川貴久 Licensed under CC 表示 2.1 日本