インバリアントナチュラルキラーT細胞による病原性のグラム陽性細菌のもつ糖脂質の認識
金城 雄樹
(国立感染症研究所 生物活性物質部第三室)
email:金城雄樹
DOI: 10.7875/first.author.2011.152
Invariant natural killer T cells recognize glycolipids from pathogenic Gram-positive bacteria.
Yuki Kinjo, Petr Illarionov, José Luis Vela, Bo Pei, Enrico Girardi, Xiangming Li, Yali Li, Masakazu Imamura, Yukihiro Kaneko, Akiko Okawara, Yoshitsugu Miyazaki, Anaximandro Gómez-Velasco, Paul Rogers, Samira Dahesh, Satoshi Uchiyama, Archana Khurana, Kazuyoshi Kawahara, Hasan Yesilkaya, Peter W. Andrew, Chi-Huey Wong, Kazuyoshi Kawakami, Victor Nizet, Gurdyal S. Besra, Moriya Tsuji, Dirk M. Zajonc, Mitchell Kronenberg
Nature Immunology, 12, 966-974 (2011)
インバリアントT細胞受容体を発現するナチュラルキラーT細胞はインバリアントナチュラルキラーT細胞とよばれ,CD1dにより提示された糖脂質を抗原として認識する.インバリアントT細胞受容体は進化の過程で保存されてきたが,その理由については明らかになっていない.今回の研究において,筆者らは,市中肺炎のおもな起炎細菌である肺炎球菌,および,新生児の敗血症や髄膜炎のおもな起炎細菌であるB群連鎖球菌のもつ糖脂質をインバリアントナチュラルキラーT細胞が認識することを明らかにした.インバリアントナチュラルキラーT細胞の活性化および肺炎球菌の排除においてはCD1dを介した反応が必要であった.また,肺炎球菌のもつ糖脂質への反応には哺乳類では検出されることのまれな脂肪酸であるバクセン酸の存在が重要であることがわかった.さらに,X線結晶構造解析によりCD1dに結合した肺炎球菌のもつ糖脂質がどのようにインバリアントT細胞受容体に提示されるかを明らかにした.この研究により,ナチュラルキラーT細胞のもつインバリアントT細胞受容体が臨床においてきわめて重要な複数の細菌を認識することが明らかになった.
ナチュラルキラーT細胞はほかの多くのT細胞とは異なる特徴をもっている.多くのT細胞はペプチドを抗原として認識するのに対し,ナチュラルキラーT細胞はMHCクラスI様タンパク質であるCD1dに提示された糖脂質を抗原として認識する1,2).さらに,通常のT細胞は多様な抗原に応答するため多様なT細胞受容体を発現しているのに対し,多くのナチュラルキラーT細胞はインバリアントな(多様性に乏しい)T細胞受容体を発現していることからインバリアントナチュラルキラーT細胞とよばれる2).重要な点は,げっ歯類と霊長類のインバリアントナチュラルキラーT細胞は同じ抗原を認識し,その反応性が種をこえて保存されていることである.そのことから,インバリアントナチュラルキラーT細胞による糖脂質の認識は重要な機能をもつものと考えられる.
多くの先行研究により,インバリアントナチュラルキラーT細胞はさまざまな病原性微生物に対する反応に関与することが示されている2).ある種の微生物や菌体成分に対しては,微生物のもつ糖脂質ではなく炎症性サイトカインや自己抗原により活性化されるものと考えられている3).その一方で最近,インバリアントナチュラルキラーT細胞は特定の細菌(Sphingomonas属細菌やBorrelia属細菌など)の糖脂質を認識することが明らかになった4-6).これまで,インバリアントナチュラルキラーT細胞の抗原としては合成化合物であるαガラクトシルセラミドおよびその類似化合物が用いられ1,2),生理的な抗原についてはほとんど明らかになっていなかった.そのため,特定の細菌のもつ糖脂質を認識するという知見は重要である.しかしながら,これまでに抗原をもつことが明らかになった細菌はどれも致死性の感染症を起こさないことから,哺乳類の進化の過程でインバリアントT細胞受容体が保存されてきたことの要因とは考えにくい.筆者らは,インバリアントT細胞受容体が保存されてきたのは致死性の感染症を起こす特定の微生物を認識するためであろうと考えた.そこで,世界中でもっとも頻度の高い致死性の細菌感染のひとつを起こす肺炎球菌(Streptococcus pneumoniae)に着目した.肺炎球菌は小児や高齢者において肺炎,菌血症や髄膜炎を起こす主要な起炎細菌であり,生後1カ月から5歳までの小児の死因の約10%は肺炎球菌の感染によると推定されている7).これまでに筆者らは,インバリアントナチュラルキラーT細胞を欠損したマウスでは肺炎球菌性の肺炎モデルにおいて細菌の排除が障害されており,肺における細菌数の増加および生存率の低下を認めることを報告した8).その機序として,ナチュラルキラーT細胞を含む白血球が産生するサイトカインであるインターフェロンγにより,好中球の遊走に関与するケモカインの産生増加が起こり好中球の集積を増強することが示唆された8,9).しかし,肺炎球菌の感染においてナチュラルキラーT細胞が実際にインターフェロンγを産生するのかどうか,また,その機序については明らかになっていない.今回,筆者らは,肺炎球菌の感染におけるインバリアントナチュラルキラーT細胞によるサイトカイン産生の解析,および,肺炎球菌のもつ糖脂質をインバリアントT細胞受容体が認識するかどうかについて解析を行った.
まず,肺炎球菌の感染ののち早期(6~13時間後)において肺や脾臓から白血球を精製し,インバリアントナチュラルキラーT細胞を特異的に検出する試薬を用いてサイトカインの産生を調べた.その結果,インバリアントナチュラルキラーT細胞はインターフェロンγを産生することが明らかになった.このサイトカインの産生が抗原として糖脂質を提示するCD1dを介した反応によるものであるかどうかを調べるため,インバリアントT細胞受容体とCD1dとの結合を阻害する抗CD1d抗体を投与したところインターフェロンγ産生の著明な低下を認めた.また,肺炎球菌に感染したマウスからナチュラルキラーT細胞にCD1dを介して抗原を提示する主要な抗原提示細胞である樹状細胞を精製し,インバリアントナチュラルキラーT細胞から得たT細胞受容体の刺激によりインターロイキン2を産生するハイブリドーマと培養したところ,インターロイキン2の産生が認められた.この結果,肺炎球菌の感染により樹状細胞がインバリアントT細胞受容体を刺激する抗原を提示することが明らかになった.さらに,抗CD1d抗体の投与により肺における細菌数の増加を認めたことより,CD1dを介したインバリアントナチュラルキラーT細胞の活性化が肺炎球菌の排除に重要であることが示された.
グラム陽性細菌である肺炎球菌およびB群連鎖球菌(Group B Streptococcus)の破砕物が,インバリアントナチュラルキラーT細胞から得たインターロイキン2を産生するハイブリドーマを刺激するかどうかを検討したところ,どちらの細菌もナチュラルキラーT細胞を刺激する成分をもつことが示唆された.しかし,グラム陰性細菌である大腸菌やサルモネラ菌の破砕物では明らかな刺激活性を認めなかった.このことより,肺炎球菌やB群連鎖球菌はインバリアントナチュラルキラーT細胞の抗原をもつ可能性があると考えられた.
そこで,肺炎球菌のもつ糖脂質がインバリアントナチュラルキラーT細胞の抗原であるかどうかを調べるため糖脂質の抽出を行ったところ,主要な構成成分として2つの糖脂質が精製された.ひとつは単糖型でありグルコース(Glc)がジアシルグリセロール(DAG)にαアノマー結合をしていることからSPN-Glc-DAGと名づけた.もうひとつは二糖型でガラクトース(Gal)とグルコースがジアシルグリセロールに結合しておりSPN-Gal-Glc-DAGと名づけた.興味深いことに,ジアシルグリセロールのもつ脂肪酸のひとつは哺乳類の細胞では検出することのまれなバクセン酸であった.また,B群連鎖球菌も肺炎球菌とほぼ同一の糖脂質をもっていることがわかった.
精製された肺炎球菌のもつ糖脂質がインバリアントナチュラルキラーT細胞を活性化するかどうかを調べるため,まず,インバリアントナチュラルキラーT細胞から得たインターロイキン2を産生するハイブリドーマを用いて解析を行った.ナチュラルキラーT細胞の抗原提示細胞として汎用されるCD1d陽性のマウスBリンパ腫細胞に対し,肺炎球菌のもつ糖脂質をともに培養することで抗原を取り込ませ,取り込まれていない抗原を除去したのち,このハイブリドーマと培養したところ,インターロイキン2の産生が認められた.CD1d陰性のBリンパ腫細胞を用いた場合にはインターロイキン2の産生を認めなかったことより,このハイブリドーマはCD1dに提示された肺炎球菌のもつ糖脂質を認識しているものと考えられた.さらに,CD1dをコーティングしたウェルに肺炎球菌のもつ糖脂質を添加しこのハイブリドーマを培養したところインターロイキン2の産生を認めた.以上の結果から,肺炎球菌のもつ糖脂質はCD1dに結合してインバリアントT細胞受容体を刺激するものと考えられた.
つぎに,肺炎球菌のもつ糖脂質が生体においてインバリアントナチュラルキラーT細胞を活性化するかどうかを調べるため,骨髄に由来する樹状細胞に肺炎球菌のもつ糖脂質を取り込ませ,これをマウスに接種して解析を行った.接種の14時間後に肝臓や脾臓から白血球を精製しインバリアントナチュラルキラーT細胞の活性化およびサイトカインの産生を調べたところ,肺炎球菌のもつ糖脂質は単糖型の糖脂質SPN-Glc-DAGも二糖型の糖脂質SPN-Gal-Glc-DAGもインバリアントナチュラルキラーT細胞を活性化し,活性化の指標となる細胞表面のCD25やCD69の発現増加を誘導した.とくに,単糖型の糖脂質SPN-Glc-DAGはインバリアントナチュラルキラーT細胞の刺激活性が強く,細胞内にインターフェロンγなどのサイトカインを認める細胞を多く検出した.また,Toll様受容体を介する刺激における細胞内シグナル伝達に必須であるMyD88あるいはTRIFを欠損したマウスやインターロイキン12を欠損したマウスを用いた場合においても,肺炎球菌のもつ糖脂質によるインバリアントナチュラルキラーT細胞の活性化を認めた.以上の結果から,肺炎球菌のもつ糖脂質は生体においてサイトカインなどによる間接的な経路ではなく,インバリアントT細胞受容体を直接に刺激することでナチュラルキラーT細胞を活性化しているものと考えられた.
肺炎球菌のもつ糖脂質の構造解析から糖と結合する主要な脂肪酸はパルミチン酸とバクセン酸であることがわかった.しかし,構造解析ではそれぞれの脂肪酸がどの部位に結合しているか確定するのは困難である.そこで,脂肪酸の構造の異なる数種類の単糖型の糖脂質SPN-Glc-DAGを合成し,インバリアントナチュラルキラーT細胞から得たインターロイキン2を産生するハイブリドーマの刺激活性を調べたところ,パルミチン酸とバクセン酸が結合した化合物(図1)のみが活性を示した.興味深いことに,パルミチン酸とバクセン酸の位置を置き換えた化合物では活性を認めなかった.さらに,バクセン酸と同じ長さで不飽和結合の部位の異なるオレイン酸を含む化合物でも活性を認めなかった.また,生体においても同様に,この化合物のみがインバリアントナチュラルキラーT細胞を活性化した.さらに,ヒトのインバリアントナチュラルキラーT細胞を用いて肺炎球菌のもつ糖脂質に対する反応性を調べたところ,マウスのインバリアントナチュラルキラーT細胞と同様の反応を示した.以上の結果から,肺炎球菌のもつ糖脂質は哺乳類では検出することがまれな脂肪酸であるバクセン酸をもっており,この脂肪酸がインバリアントナチュラルキラーT細胞への抗原性にも重要であることが明らかになった.肺炎球菌のもつ糖脂質に対するインバリアントナチュラルキラーT細胞の反応性はマウスのみならずヒトでも保存されていることから,インバリアントナチュラルキラーT細胞が肺炎球菌に対する反応に重要な役割を担うことが示唆された.
肺炎球菌のもつ糖脂質が実際にどのようにしてCD1dに結合しているのかを明らかにするため,肺炎球菌のもつ糖脂質とCD1dとの複合体のX線結晶構造解析を行った.CD1dには深くて狭い2つのポケット(A’ポケットおよびF’ポケット)があり,疎水性の脂質が結合するのにふさわしい構造になっている10).バクセン酸およびパルミチン酸はそれぞれA’ポケットおよびF’ポケットに入り,CD1dの抗原結合部位の中心部からグルコースが露出しT細胞受容体と結合できるようになっていた.これまでに,αガラクトシルセラミドおよびその類似化合物を用いた検討により,糖鎖としてはガラクトースのほうがグルコースよりもナチュラルキラーT細胞の刺激活性の強いことが報告されている.グルコースをもつ糖脂質がナチュラルキラーT細胞の刺激活性をもつのはどうしてだろうか? その理由を明らかにするには,T細胞受容体,抗原,CD1dの三者からなる複合体のX線結晶構造解析や,複数の合成化合物を用いた生化学的あるいは免疫学的な解析が必要である.しかし,今回の糖脂質とCD1dとの複合体のX線結晶構造解析から,糖脂質のグルコースのもつ4位の水酸基がT細胞受容体との結合に適した位置に存在していることが考えられた.仮に,肺炎球菌のもつ糖脂質がガラクトースをもっていた場合,その4位の水酸基の位置は異なりT細胞受容体との結合には不適となることが推察された.スフィンゴ型の糖脂質であるαガラクトシルセラミドとは異なり,グリセロール型である肺炎球菌のもつ糖脂質の場合,グルコースをもつほうが抗原として適していることが推察された.
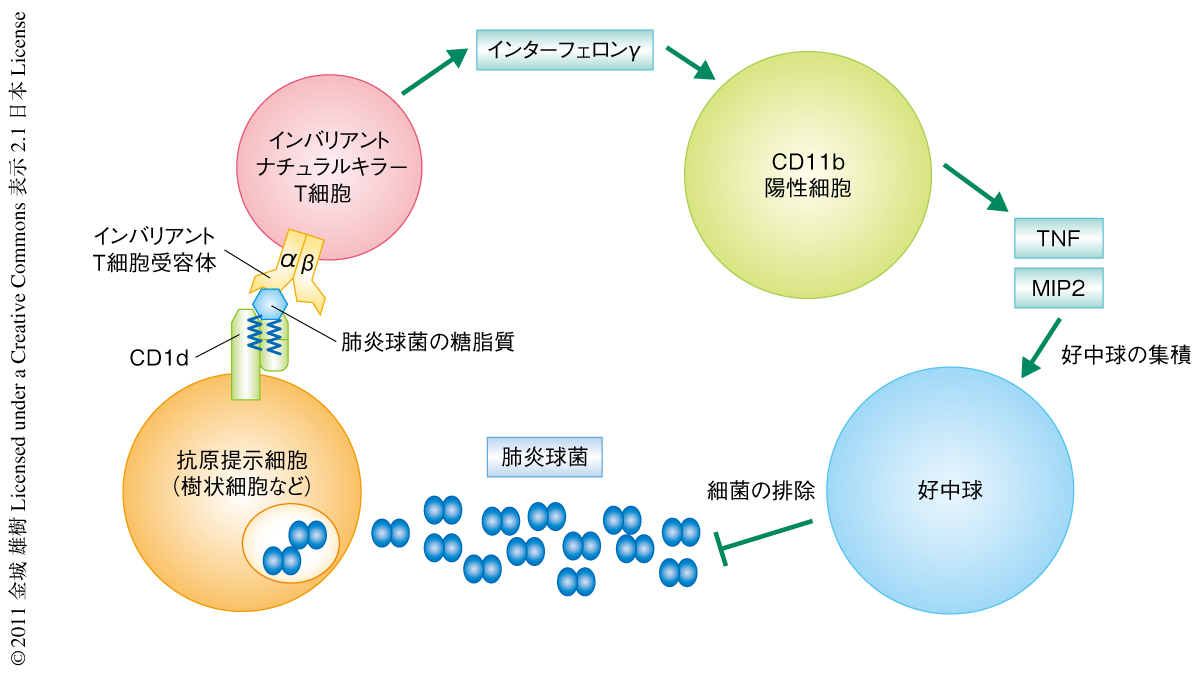
この研究では,世界のいたるところで重篤な感染症を起こしているグラム陽性細菌である肺炎球菌およびB群連鎖球菌の糖脂質をインバリアントナチュラルキラーT細胞が認識することを明らかにした.インバリアントナチュラルキラーT細胞による肺炎球菌の排除促進において想定される機序を示す(図2).その反応性はマウスのみならずヒトでも保存されていることから重要な機能であると考えられ,ナチュラルキラーT細胞がインバリアントT細胞受容体をもつことの有用性が示された.しかし,さまざまな菌体成分をもつ細菌に対する免疫応答は複雑であり,さらなる研究が必要である.今後,肺炎球菌に対する免疫応答がより詳細に解明され,それらの知見をもとにした肺炎球菌の感染の予防法や治療法の開発につながることを期待したい.
略歴:2003年 琉球大学大学院医学研究科 修了,同年 米国La Jolla Institute for Allergy and Immunology博士研究員,2006年 同 リサーチサイエンティストを経て,2009年より国立感染症研究所 室長.
研究テーマ:細菌(肺炎球菌)および真菌の認識機構の解明,自然免疫の活性化を応用した細菌および真菌の感染の予防法および治療法の開発.
抱負:研究室のメンバーをもっと増やして,感染免疫の斬新な知見をどんどん見い出していきたい.
© 2011 金城 雄樹 Licensed under CC 表示 2.1 日本
(国立感染症研究所 生物活性物質部第三室)
email:金城雄樹
DOI: 10.7875/first.author.2011.152
Invariant natural killer T cells recognize glycolipids from pathogenic Gram-positive bacteria.
Yuki Kinjo, Petr Illarionov, José Luis Vela, Bo Pei, Enrico Girardi, Xiangming Li, Yali Li, Masakazu Imamura, Yukihiro Kaneko, Akiko Okawara, Yoshitsugu Miyazaki, Anaximandro Gómez-Velasco, Paul Rogers, Samira Dahesh, Satoshi Uchiyama, Archana Khurana, Kazuyoshi Kawahara, Hasan Yesilkaya, Peter W. Andrew, Chi-Huey Wong, Kazuyoshi Kawakami, Victor Nizet, Gurdyal S. Besra, Moriya Tsuji, Dirk M. Zajonc, Mitchell Kronenberg
Nature Immunology, 12, 966-974 (2011)
要 約
インバリアントT細胞受容体を発現するナチュラルキラーT細胞はインバリアントナチュラルキラーT細胞とよばれ,CD1dにより提示された糖脂質を抗原として認識する.インバリアントT細胞受容体は進化の過程で保存されてきたが,その理由については明らかになっていない.今回の研究において,筆者らは,市中肺炎のおもな起炎細菌である肺炎球菌,および,新生児の敗血症や髄膜炎のおもな起炎細菌であるB群連鎖球菌のもつ糖脂質をインバリアントナチュラルキラーT細胞が認識することを明らかにした.インバリアントナチュラルキラーT細胞の活性化および肺炎球菌の排除においてはCD1dを介した反応が必要であった.また,肺炎球菌のもつ糖脂質への反応には哺乳類では検出されることのまれな脂肪酸であるバクセン酸の存在が重要であることがわかった.さらに,X線結晶構造解析によりCD1dに結合した肺炎球菌のもつ糖脂質がどのようにインバリアントT細胞受容体に提示されるかを明らかにした.この研究により,ナチュラルキラーT細胞のもつインバリアントT細胞受容体が臨床においてきわめて重要な複数の細菌を認識することが明らかになった.
はじめに
ナチュラルキラーT細胞はほかの多くのT細胞とは異なる特徴をもっている.多くのT細胞はペプチドを抗原として認識するのに対し,ナチュラルキラーT細胞はMHCクラスI様タンパク質であるCD1dに提示された糖脂質を抗原として認識する1,2).さらに,通常のT細胞は多様な抗原に応答するため多様なT細胞受容体を発現しているのに対し,多くのナチュラルキラーT細胞はインバリアントな(多様性に乏しい)T細胞受容体を発現していることからインバリアントナチュラルキラーT細胞とよばれる2).重要な点は,げっ歯類と霊長類のインバリアントナチュラルキラーT細胞は同じ抗原を認識し,その反応性が種をこえて保存されていることである.そのことから,インバリアントナチュラルキラーT細胞による糖脂質の認識は重要な機能をもつものと考えられる.
多くの先行研究により,インバリアントナチュラルキラーT細胞はさまざまな病原性微生物に対する反応に関与することが示されている2).ある種の微生物や菌体成分に対しては,微生物のもつ糖脂質ではなく炎症性サイトカインや自己抗原により活性化されるものと考えられている3).その一方で最近,インバリアントナチュラルキラーT細胞は特定の細菌(Sphingomonas属細菌やBorrelia属細菌など)の糖脂質を認識することが明らかになった4-6).これまで,インバリアントナチュラルキラーT細胞の抗原としては合成化合物であるαガラクトシルセラミドおよびその類似化合物が用いられ1,2),生理的な抗原についてはほとんど明らかになっていなかった.そのため,特定の細菌のもつ糖脂質を認識するという知見は重要である.しかしながら,これまでに抗原をもつことが明らかになった細菌はどれも致死性の感染症を起こさないことから,哺乳類の進化の過程でインバリアントT細胞受容体が保存されてきたことの要因とは考えにくい.筆者らは,インバリアントT細胞受容体が保存されてきたのは致死性の感染症を起こす特定の微生物を認識するためであろうと考えた.そこで,世界中でもっとも頻度の高い致死性の細菌感染のひとつを起こす肺炎球菌(Streptococcus pneumoniae)に着目した.肺炎球菌は小児や高齢者において肺炎,菌血症や髄膜炎を起こす主要な起炎細菌であり,生後1カ月から5歳までの小児の死因の約10%は肺炎球菌の感染によると推定されている7).これまでに筆者らは,インバリアントナチュラルキラーT細胞を欠損したマウスでは肺炎球菌性の肺炎モデルにおいて細菌の排除が障害されており,肺における細菌数の増加および生存率の低下を認めることを報告した8).その機序として,ナチュラルキラーT細胞を含む白血球が産生するサイトカインであるインターフェロンγにより,好中球の遊走に関与するケモカインの産生増加が起こり好中球の集積を増強することが示唆された8,9).しかし,肺炎球菌の感染においてナチュラルキラーT細胞が実際にインターフェロンγを産生するのかどうか,また,その機序については明らかになっていない.今回,筆者らは,肺炎球菌の感染におけるインバリアントナチュラルキラーT細胞によるサイトカイン産生の解析,および,肺炎球菌のもつ糖脂質をインバリアントT細胞受容体が認識するかどうかについて解析を行った.
1.肺炎球菌の感染におけるインバリアントナチュラルキラーT細胞によるインターフェロンγの産生
まず,肺炎球菌の感染ののち早期(6~13時間後)において肺や脾臓から白血球を精製し,インバリアントナチュラルキラーT細胞を特異的に検出する試薬を用いてサイトカインの産生を調べた.その結果,インバリアントナチュラルキラーT細胞はインターフェロンγを産生することが明らかになった.このサイトカインの産生が抗原として糖脂質を提示するCD1dを介した反応によるものであるかどうかを調べるため,インバリアントT細胞受容体とCD1dとの結合を阻害する抗CD1d抗体を投与したところインターフェロンγ産生の著明な低下を認めた.また,肺炎球菌に感染したマウスからナチュラルキラーT細胞にCD1dを介して抗原を提示する主要な抗原提示細胞である樹状細胞を精製し,インバリアントナチュラルキラーT細胞から得たT細胞受容体の刺激によりインターロイキン2を産生するハイブリドーマと培養したところ,インターロイキン2の産生が認められた.この結果,肺炎球菌の感染により樹状細胞がインバリアントT細胞受容体を刺激する抗原を提示することが明らかになった.さらに,抗CD1d抗体の投与により肺における細菌数の増加を認めたことより,CD1dを介したインバリアントナチュラルキラーT細胞の活性化が肺炎球菌の排除に重要であることが示された.
2.肺炎球菌およびB群連鎖球菌のもつ糖脂質の構造
グラム陽性細菌である肺炎球菌およびB群連鎖球菌(Group B Streptococcus)の破砕物が,インバリアントナチュラルキラーT細胞から得たインターロイキン2を産生するハイブリドーマを刺激するかどうかを検討したところ,どちらの細菌もナチュラルキラーT細胞を刺激する成分をもつことが示唆された.しかし,グラム陰性細菌である大腸菌やサルモネラ菌の破砕物では明らかな刺激活性を認めなかった.このことより,肺炎球菌やB群連鎖球菌はインバリアントナチュラルキラーT細胞の抗原をもつ可能性があると考えられた.
そこで,肺炎球菌のもつ糖脂質がインバリアントナチュラルキラーT細胞の抗原であるかどうかを調べるため糖脂質の抽出を行ったところ,主要な構成成分として2つの糖脂質が精製された.ひとつは単糖型でありグルコース(Glc)がジアシルグリセロール(DAG)にαアノマー結合をしていることからSPN-Glc-DAGと名づけた.もうひとつは二糖型でガラクトース(Gal)とグルコースがジアシルグリセロールに結合しておりSPN-Gal-Glc-DAGと名づけた.興味深いことに,ジアシルグリセロールのもつ脂肪酸のひとつは哺乳類の細胞では検出することのまれなバクセン酸であった.また,B群連鎖球菌も肺炎球菌とほぼ同一の糖脂質をもっていることがわかった.
3.肺炎球菌のもつ糖脂質によるインバリアントナチュラルキラーT細胞の活性化
精製された肺炎球菌のもつ糖脂質がインバリアントナチュラルキラーT細胞を活性化するかどうかを調べるため,まず,インバリアントナチュラルキラーT細胞から得たインターロイキン2を産生するハイブリドーマを用いて解析を行った.ナチュラルキラーT細胞の抗原提示細胞として汎用されるCD1d陽性のマウスBリンパ腫細胞に対し,肺炎球菌のもつ糖脂質をともに培養することで抗原を取り込ませ,取り込まれていない抗原を除去したのち,このハイブリドーマと培養したところ,インターロイキン2の産生が認められた.CD1d陰性のBリンパ腫細胞を用いた場合にはインターロイキン2の産生を認めなかったことより,このハイブリドーマはCD1dに提示された肺炎球菌のもつ糖脂質を認識しているものと考えられた.さらに,CD1dをコーティングしたウェルに肺炎球菌のもつ糖脂質を添加しこのハイブリドーマを培養したところインターロイキン2の産生を認めた.以上の結果から,肺炎球菌のもつ糖脂質はCD1dに結合してインバリアントT細胞受容体を刺激するものと考えられた.
つぎに,肺炎球菌のもつ糖脂質が生体においてインバリアントナチュラルキラーT細胞を活性化するかどうかを調べるため,骨髄に由来する樹状細胞に肺炎球菌のもつ糖脂質を取り込ませ,これをマウスに接種して解析を行った.接種の14時間後に肝臓や脾臓から白血球を精製しインバリアントナチュラルキラーT細胞の活性化およびサイトカインの産生を調べたところ,肺炎球菌のもつ糖脂質は単糖型の糖脂質SPN-Glc-DAGも二糖型の糖脂質SPN-Gal-Glc-DAGもインバリアントナチュラルキラーT細胞を活性化し,活性化の指標となる細胞表面のCD25やCD69の発現増加を誘導した.とくに,単糖型の糖脂質SPN-Glc-DAGはインバリアントナチュラルキラーT細胞の刺激活性が強く,細胞内にインターフェロンγなどのサイトカインを認める細胞を多く検出した.また,Toll様受容体を介する刺激における細胞内シグナル伝達に必須であるMyD88あるいはTRIFを欠損したマウスやインターロイキン12を欠損したマウスを用いた場合においても,肺炎球菌のもつ糖脂質によるインバリアントナチュラルキラーT細胞の活性化を認めた.以上の結果から,肺炎球菌のもつ糖脂質は生体においてサイトカインなどによる間接的な経路ではなく,インバリアントT細胞受容体を直接に刺激することでナチュラルキラーT細胞を活性化しているものと考えられた.
4.肺炎球菌のもつ糖脂質の構造の同定
肺炎球菌のもつ糖脂質の構造解析から糖と結合する主要な脂肪酸はパルミチン酸とバクセン酸であることがわかった.しかし,構造解析ではそれぞれの脂肪酸がどの部位に結合しているか確定するのは困難である.そこで,脂肪酸の構造の異なる数種類の単糖型の糖脂質SPN-Glc-DAGを合成し,インバリアントナチュラルキラーT細胞から得たインターロイキン2を産生するハイブリドーマの刺激活性を調べたところ,パルミチン酸とバクセン酸が結合した化合物(図1)のみが活性を示した.興味深いことに,パルミチン酸とバクセン酸の位置を置き換えた化合物では活性を認めなかった.さらに,バクセン酸と同じ長さで不飽和結合の部位の異なるオレイン酸を含む化合物でも活性を認めなかった.また,生体においても同様に,この化合物のみがインバリアントナチュラルキラーT細胞を活性化した.さらに,ヒトのインバリアントナチュラルキラーT細胞を用いて肺炎球菌のもつ糖脂質に対する反応性を調べたところ,マウスのインバリアントナチュラルキラーT細胞と同様の反応を示した.以上の結果から,肺炎球菌のもつ糖脂質は哺乳類では検出することがまれな脂肪酸であるバクセン酸をもっており,この脂肪酸がインバリアントナチュラルキラーT細胞への抗原性にも重要であることが明らかになった.肺炎球菌のもつ糖脂質に対するインバリアントナチュラルキラーT細胞の反応性はマウスのみならずヒトでも保存されていることから,インバリアントナチュラルキラーT細胞が肺炎球菌に対する反応に重要な役割を担うことが示唆された.
5.肺炎球菌のもつ糖脂質とCD1dの結合様式
肺炎球菌のもつ糖脂質が実際にどのようにしてCD1dに結合しているのかを明らかにするため,肺炎球菌のもつ糖脂質とCD1dとの複合体のX線結晶構造解析を行った.CD1dには深くて狭い2つのポケット(A’ポケットおよびF’ポケット)があり,疎水性の脂質が結合するのにふさわしい構造になっている10).バクセン酸およびパルミチン酸はそれぞれA’ポケットおよびF’ポケットに入り,CD1dの抗原結合部位の中心部からグルコースが露出しT細胞受容体と結合できるようになっていた.これまでに,αガラクトシルセラミドおよびその類似化合物を用いた検討により,糖鎖としてはガラクトースのほうがグルコースよりもナチュラルキラーT細胞の刺激活性の強いことが報告されている.グルコースをもつ糖脂質がナチュラルキラーT細胞の刺激活性をもつのはどうしてだろうか? その理由を明らかにするには,T細胞受容体,抗原,CD1dの三者からなる複合体のX線結晶構造解析や,複数の合成化合物を用いた生化学的あるいは免疫学的な解析が必要である.しかし,今回の糖脂質とCD1dとの複合体のX線結晶構造解析から,糖脂質のグルコースのもつ4位の水酸基がT細胞受容体との結合に適した位置に存在していることが考えられた.仮に,肺炎球菌のもつ糖脂質がガラクトースをもっていた場合,その4位の水酸基の位置は異なりT細胞受容体との結合には不適となることが推察された.スフィンゴ型の糖脂質であるαガラクトシルセラミドとは異なり,グリセロール型である肺炎球菌のもつ糖脂質の場合,グルコースをもつほうが抗原として適していることが推察された.
おわりに
この研究では,世界のいたるところで重篤な感染症を起こしているグラム陽性細菌である肺炎球菌およびB群連鎖球菌の糖脂質をインバリアントナチュラルキラーT細胞が認識することを明らかにした.インバリアントナチュラルキラーT細胞による肺炎球菌の排除促進において想定される機序を示す(図2).その反応性はマウスのみならずヒトでも保存されていることから重要な機能であると考えられ,ナチュラルキラーT細胞がインバリアントT細胞受容体をもつことの有用性が示された.しかし,さまざまな菌体成分をもつ細菌に対する免疫応答は複雑であり,さらなる研究が必要である.今後,肺炎球菌に対する免疫応答がより詳細に解明され,それらの知見をもとにした肺炎球菌の感染の予防法や治療法の開発につながることを期待したい.
文 献
- Taniguchi, M., Harada, M., Kojo, S. et al.: The regulatory role of Vα14 NKT cells in innate and acquired immune response. Annu. Rev. Immunol., 21, 483-513 (2003)[PubMed]
- Kinjo, Y. Ueno, K.: iNKT cells in microbial immunity: recognition of microbial glycolipids. Microbiol. Immunol., 55, 472-482 (2011)[PubMed]
- Brigl, M., Bry, L., Kent, S. C. et al.: Mechanism of CD1d-restricted natural killer T cell activation during microbial infection. Nat. Immunol., 4, 1230-1237 (2003)[PubMed]
- Kinjo, Y., Wu, D., Kim, G. et al.: Recognition of bacterial glycosphingolipids by natural killer T cells. Nature, 434, 520-525 (2005)[PubMed]
- Mattner, J., Debord, K. L., Ismail, N. et al.: Exogenous and endogenous glycolipid antigens activate NKT cells during microbial infections. Nature, 434, 525-529 (2005)[PubMed]
- Kinjo, Y., Tupin, E., Wu, D. et al.: Natural killer T cells recognize diacylglycerol antigens from pathogenic bacteria. Nat. Immunol., 7, 978-986 (2006)[PubMed]
- O'Brien, K. L., Wolfson, L. J., Watt, J. P. et al.: Burden of disease caused by Streptococcus pneumoniae in children younger than 5 years: global estimates. Lancet, 374, 893-902 (2009)[PubMed]
- Kawakami, K., Yamamoto, N., Kinjo, Y. et al.: Critical role of Vα14+ natural killer T cells in the innate phase of host protection against Streptococcus pneumoniae infection. Eur. J. Immunol., 33, 3322-3330 (2003)[PubMed]
- Nakamatsu, M., Yamamoto, N., Hatta, M. et al.: Role of interferon-γ in Vα14+ natural killer T cell-mediated host defense against Streptococcus pneumoniae infection in murine lungs. Microbes Infect., 9, 364-374 (2007)[PubMed]
- Zajonc, D. M. & Kronenberg, M.: CD1 mediated T cell recognition of glycolipids. Curr. Opin. Struct. Biol., 17, 521-529 (2007)[PubMed]
著者プロフィール
略歴:2003年 琉球大学大学院医学研究科 修了,同年 米国La Jolla Institute for Allergy and Immunology博士研究員,2006年 同 リサーチサイエンティストを経て,2009年より国立感染症研究所 室長.
研究テーマ:細菌(肺炎球菌)および真菌の認識機構の解明,自然免疫の活性化を応用した細菌および真菌の感染の予防法および治療法の開発.
抱負:研究室のメンバーをもっと増やして,感染免疫の斬新な知見をどんどん見い出していきたい.
© 2011 金城 雄樹 Licensed under CC 表示 2.1 日本