14-3-3タンパク質はフロリゲンの細胞内における受容体としてはたらく
田岡健一郎1・大木 出2・辻 寛之1・児嶋長次郎3・島本 功1
(奈良先端科学技術大学院大学バイオサイエンス研究科 1植物分子遺伝学研究室,2生体高分子構造学研究室,3大阪大学蛋白質研究所 機能構造計測学研究室)
email:田岡健一郎
DOI: 10.7875/first.author.2011.141
14-3-3 proteins act as intracellular receptors for rice Hd3a florigen.
Ken-ichiro Taoka*, Izuru Ohki*, Hiroyuki Tsuji*, Kyoko Furuita, Kokoro Hayashi, Tomoko Yanase, Midori Yamaguchi, Chika Nakashima, Yekti Asih Purwestri, Shojiro Tamaki, Yuka Ogaki, Chihiro Shimada, Atsushi Nakagawa, Chojiro Kojima, Ko Shimamoto (* These authors contributed equally to this work.)
Nature, 476, 332-335 (2011)
花芽の形成を誘導する植物ホルモンとして70年以上まえに提唱された“フロリゲン”の分子的な実体は,最近になりようやく,高等植物で広く保存されているFT遺伝子にコードされるタンパク質であることが明らかにされた.しかしながら,フロリゲンが花成の誘導にはたす正確な役割は不明なままである.今回,筆者らは,FTのホモログであるイネのフロリゲンHd3aが,茎頂の細胞において14-3-3タンパク質と結合することを明らかにした.形成された複合体は核へと移動し,そこでさらに転写因子OsFD1と結合した.こうして形成された3つのタンパク質からなる“フロリゲン活性化複合体”が,イネの花芽形成遺伝子であるOsMADS15遺伝子の転写をひき起こすことが明らかになった.さらに,このフロリゲン活性化複合体の結晶構造を2.4Åの分解能で決定した.これらの知見は,茎頂細胞の14-3-3タンパク質が細胞内においてフロリゲン受容体としてはたらいていることを示していた.
多くの植物は1年の決まった時期に花を咲かせ子孫を残す.この開花制御には日長が重要な役割をはたしている.1937年,日長刺激に応答して葉でつくられた物質が茎頂に運ばれて花芽形成を誘導するとの考えが提唱され,そのような物質は花成ホルモン“フロリゲン”と名づけられた.以後70年以上のあいだ,フロリゲンの存在を支持する多くの実験結果が報告されたが,フロリゲンの実体は謎のままであった.しかし近年になって,シロイヌナズナのFTおよびそのホモログであるイネのHd3aがフロリゲンの分子的な実体であることが明らかにされた1,2).FTと相互作用するタンパク質として,シロイヌナズナのFDが報告されている3,4).FDはbZip型の転写因子であり,FTとFDの両者の過剰発現により花芽形成遺伝子のひとつであるAP1遺伝子の発現が誘導される.しかし,フロリゲンがどのような分子機構でその下流の標的遺伝子の発現を制御しているのかは不明であった.その制御機構を明らかにするため,筆者らは,酵母ツーハイブリッドスクリーニングによりHd3aと相互作用する複数のタンパク質を同定し,それらの詳細な相互作用解析を行った.
フロリゲンによる花成誘導の分子機構を理解するため,イネのcDNAライブラリーを用いた酵母ツーハイブリッド法によりHd3aと相互作用するタンパク質の探索を行った.その結果,GF14c(イネ14-3-3タンパク質),OsKANADI1(シロイヌナズナKANADIのイネホモログ),OsBIP116b(シロイヌナズナWAVE DAMPENED2のイネホモログ)が得られた.また,データベース検索から得られたOsFD1(シロイヌナズナFDのイネホモログ)も酵母においてHd3aと相互作用した.GF14cを除く3つの相互作用タンパク質のC末端には共通してSAPモチーフ(Ser-Ala-Pro)が見い出された.この配列はすでに報告されていたFDにおけるFTとの相互作用モチーフ(Thr-Ala-Pro)と類似していた3).いずれのHd3a相互作用タンパク質においても,SAPモチーフのAlaの置換により酵母におけるHd3aとの相互作用は失われた.一方,in vitroでの相互作用実験では,Hd3aとGF14cとのあいだの相互作用は検出されたが,Hd3aとOsFD1との相互作用は検出できなかった.これらの実験結果と,SAPモチーフと14-3-3タンパク質認識配列との類似性,さらにGF14cにはSAPモチーフがないことから,つぎのような仮説をたてた.すなわち,Hd3aとその相互作用タンパク質は14-3-3タンパク質を介し間接的に相互作用していると考えたのである.酵母において観察されたHd3aとその相互作用タンパク質とのあいだの結合は,酵母のもつ内在性の14-3-3タンパク質を介した間接的なものであると説明できる.そこで,OsFD1とGF14cとの相互作用を調べたところ,両者はin vitroにおいて相互作用した.さらに変異解析により,SAPモチーフにあるSerのリン酸化が両者の相互作用において重要であることが示唆された.Hd3aとGF14cとの植物細胞における相互作用は,イネの茎頂細胞の抽出液を用いた共免疫沈殿解析から確かめられた.
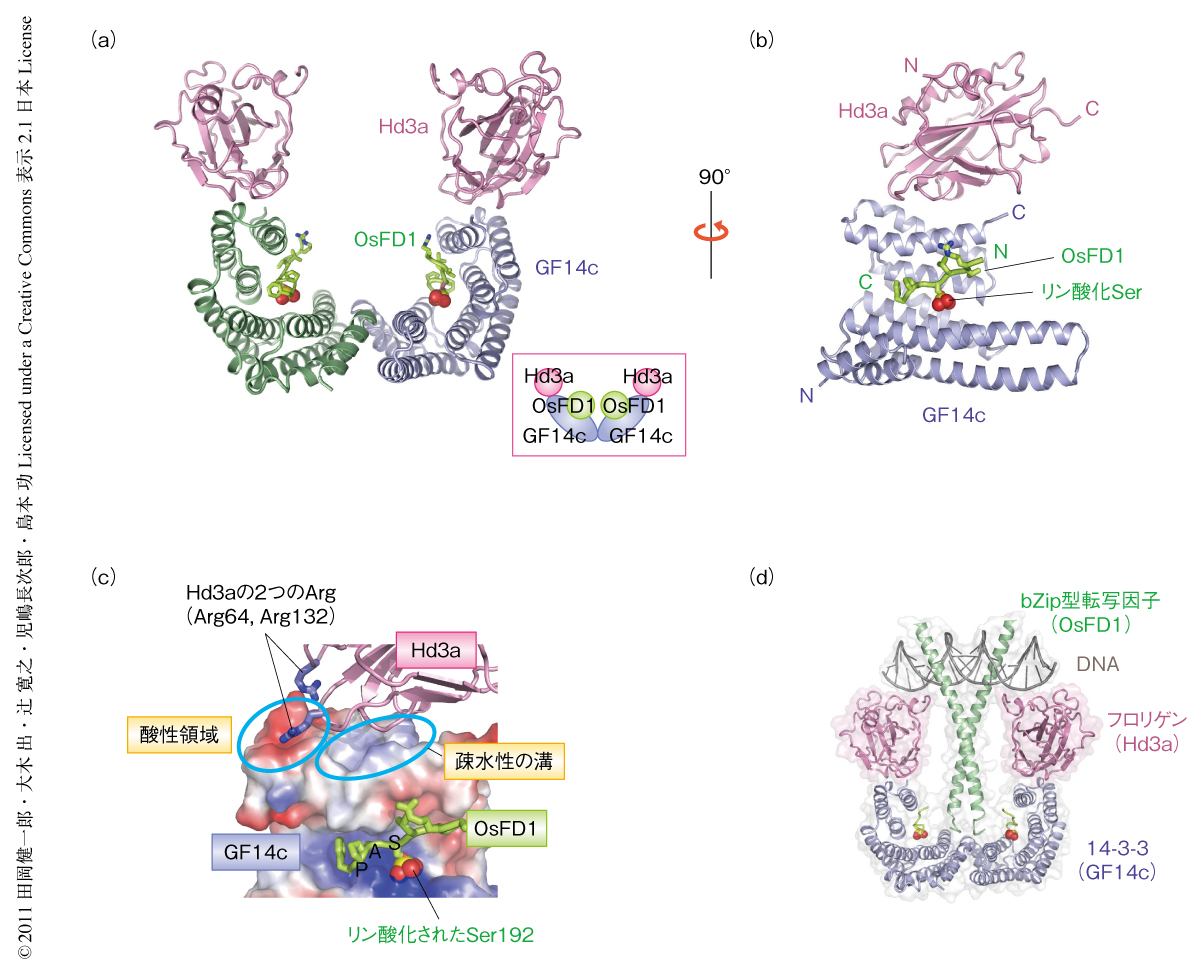
Hd3a,GF14c,OsFD1の三者の相互作用の詳細を調べるため,この三者からなるタンパク質複合体の立体構造解析を行い,結晶構造を2.4Å分解能で決定することに成功した(PDB ID:3AXY).結晶化にあたって,OsFD1としては,酵母ツーハイブリッド実験より判明していたGF14cとの結合に必要十分なリン酸化されたSer192を含むC末端の9アミノ酸残基からなる断片を用いた.得られた複合体の構造において,Hd3a,GF14c,OsFD1のそれぞれ2分子ずつからなるW字型のヘテロ六量体が形成されており(図1a),二量体を形成したGF14cのW字型構造の底にあるくぼみにリン酸化されたOsFD1がはまり込み,その上側にHd3aが1分子ずつ左右対称に離れて結合していた(図1b).Hd3aとOsFD1とのあいだに直接的な相互作用はみられず,このことはHd3aとOsFD1はGF14cに対し独立に結合するという酵母ツーハイブリッド実験の結果と一致していた.GSTプルダウンアッセイにおいてもGF14cが存在する場合のみHd3aとOsFD1との結合がみられたことから,14-3-3タンパク質であるGF14cはフロリゲンであるHd3aと転写因子OsFD1とを結びつける役割をはたし,これら三者からなる複合体がフロリゲンシグナル伝達の本体であると考えられた.そこで,この三者複合体をフロリゲン転写活性化複合体(florigen activation complex:FAC)と名づけた.
14-3-3タンパク質はリン酸化されたアミノ酸を認識するドメインとして知られているが5),GF14cとHd3aとの相互作用はリン酸化に非依存的であり,それらとはかなり異なる結合様式をみせていた.GF14cとHd3aとの相互作用においては,Hd3aのループ領域に存在する2つの突き出た塩基性アミノ酸残基(Arg64およびArg132)がGF14cの上部にある酸性のくぼみに錨のようにはまり込み,さらに,Hd3a本体はGF14cのC末端ヘリックスのあいだにある疎水性の溝と広く相互作用していた(図1c).一方,リン酸化されたOsFD1とGF14cとの相互作用は,これまで多く報告されている14-3-3タンパク質とリン酸化ペプチドとの結合様式に類似していた5).OsFD1のリン酸化されたSer192がGF14cの塩基性のリン酸化ペプチド結合ポケットにはまり込み,さらにSAPモチーフ全体も認識されていた(図1c).一般に立体構造解析では相互作用しているアミノ酸残基がもれなくすべてわかるため,点変異による解析などと比較して,種間での相互作用の保存性を正確に見積もることのできる点が大きな利点のひとつである.そこで,イネのフロリゲン活性化複合体において観察された相互作用にかかわるアミノ酸残基の保存性をほかの植物種とのあいだで比較したところ,Hd3aとGF14cとのあいだおよびGF14cとOsFD1とのあいだとも高等植物においてアミノ酸残基は高度に保存されており,これらのあいだの相互作用がイネと同様に存在する可能性が示唆された.また,シロイヌナズナやトマトにおいてフロリゲンと14-3-3タンパク質とが実際に相互作用することが報告されている6,7).これらのことより,フロリゲン,14-3-3タンパク質,転写因子の相互作用は,植物全般に共通して存在する花成誘導経路であると考えられた.
bZip型転写因子としてOsFD1を含むフロリゲン転写活性化複合体は,細胞においては花芽形成遺伝子であるOsMADS15遺伝子(シロイヌナズナAP1遺伝子のイネホモログ)のプロモーター領域に結合して転写を活性化しているものと考えられる8).しかし,得られた結晶構造はDNAを含んでいないため,プロモーターにおいてこのフロリゲン転写活性化複合体が形成されているのかどうかは不明であった.そのため,シロイヌナズナのAP1遺伝子プロモーターのCボックスDNA(GACGTC)を用いて,フロリゲン転写活性化複合体とDNAとの結合をゲルシフトアッセイにより調べた.その結果,DNAに対しOsFD1,GF14c,Hd3aを順にくわえていくとDNAの段階的なシフトがみられ,プロモーターにおいて安定なフロリゲン転写活性化複合体が形成されることが判明した.このフロリゲン転写活性化複合体とDNAとの複合体におけるHd3aの位置づけを確認するため,フロリゲン転写活性化複合体とDNAとの複合体のモデル構造を,報告されている動物のbZip型転写因子とDNAとの複合体の構造をもとに作製した(図1d).このモデルにおいてHd3aはGF14cとOsFD1をDNAに安定に保持するよう位置し,この配置がHd3aによる転写活性化や花成誘導に関係しているものと予想された.
Hd3a,GF14b,OsFD1の細胞内における局在を観察したところ,Hd3aは核と細胞質に,GF14bはほとんどが細胞質に,OsFD1は核にのみ局在しており,複合体を形成するはずの三者の局在はそれぞれ異なっていることがわかった.そこで,Hd3a-GF14b複合体の形成を2分子蛍光相補(bimolecular fluorescence complementation:BiFC)法により検討したところ,この複合体はGF14bの存在する細胞質で形成されていることがわかった.しかし,OsFD1の核への局在とはオーバーラップしていないため,この複合体を結びつける分子機構の存在することが考えられた.そこで,Hd3a-GF14b複合体の存在下において,さらにOsFD1を共発現させる実験を行った.その結果,Hd3a-GF14b複合体は細胞質から核へとその局在を変え,Hd3a,GF14b,OsFD1の三者が核に集合することが観察された.このことから,Hd3aは最初に細胞質においてHd3a-GF14b複合体を形成したのち,核へと移行してOsFD1と相互作用しているものと考えられた.
フロリゲン転写活性化複合体の形成をさらに検証するため,2分子蛍光相補法と蛍光エネルギー共鳴移動(fluorescence resonance energy transfer:FRET)/蛍光寿命イメージング法(fluorescence lifetime imaging microscopy:FLIM)とを組み合わせたバイオイメージング実験を行った.この実験では,蛍光タンパク質であるCFPとVenusとが近接すると蛍光エネルギーの移動が生じCFPの蛍光寿命が短縮するという現象を利用する.すなわち,Hd3a-GF14b複合体を2分子蛍光相補法により再構成してVenusで可視化し,さらに,CFPにより標識したOsFD1を共発現させると,三者が相互作用していればCFPとVenusとのあいだが近接してCFPの蛍光寿命は短縮することが期待される.蛍光寿命の測定実験を行ったところ,Hd3a-GF14b複合体とCFP標識OsFD1とが共存したときだけCFPの蛍光寿命の短縮が観察された.このことから,細胞内においてもフロリゲン転写活性化複合体がダイナミックな細胞内での局在の変化をともない形成されていることが強く示唆された.
シロイヌナズナのAP1遺伝子の転写はFTとFDに依存的である4).イネでは,Hd3a遺伝子をRNAi法によりノックダウンするとOsMADS15遺伝子(シロイヌナズナAP1遺伝子のイネホモログ)の発現量が減少する.そこで,Hd3a,14-3-3タンパク質,OsFD1の三者の相互作用がOsMADS15遺伝子の活性化にかかわっているかどうかをイネのプロトプラストにおける一過的な発現実験により調べた.OsMADS15 mRNA量はHd3aの発現ベクターおよびOsFD1の発現ベクターがともに導入された場合にのみ上昇した.しかし,14-3-3タンパク質との相互作用を欠損した変異型Hd3a,あるいは,14-3-3タンパク質との相互作用を欠損した変異型OsFD1を発現させた場合にはOsMADS15遺伝子の発現上昇はほとんど観察されなかった.さらに,Hd3aとの結合が認められた4種類のイネ14-3-3タンパク質のアイソフォームの発現を一過的なRNAi法により同時にノックダウンした場合もOsMADS15 mRNA量は減少した.以上の実験結果は,フロリゲン転写活性化複合体の形成がその下流の標的遺伝子の活性化に必須であることを示唆していた.
さらに,多数の形質転換イネを用いた実験から,フロリゲン転写活性化複合体の形成が花芽の形成に必要であることが明らかになった.Hd3aは葉の維管束で発現することから,維管束に特異的に強い活性をもつrolC遺伝子プロモーターによりHd3aを発現させたところ,形質転換イネの花成は顕著に促進された.このとき,Hd3aに14-3-3タンパク質との相互作用を欠損する変異を導入すると,実験した4種類の変異すべてにおいて花成の促進機能が失われることがわかった.すなわち,Hd3aが開花の促進能を発揮するためには14-3-3タンパク質との相互作用が必須であることがいえた.また,RNAi法によりOsFD1の発現をノックダウンしたところ,シロイヌナズナfd変異体やトウモロコシdlf1変異体と同様に,花成は遅延することがわかった3,4,9).OsFD1の過剰発現は花成に影響をあたえなかったが,OsFD1にリン酸化を模倣する変異を導入して14-3-3タンパク質との恒常的な結合が可能となるようにしたところ花成を促進できるようになった.このことは,OsFD1のリン酸化がフロリゲン転写活性化複合体の形成を促進することを示唆していた.
この研究の結果から,14-3-3タンパク質はフロリゲンの細胞内における受容体として機能するものと考えられた.フロリゲンは葉で合成されたのち茎頂まで長距離移動する.茎頂の細胞に到達したのち,細胞質においてフロリゲン受容体である14-3-3タンパク質に受容されフロリゲン-14-3-3タンパク質複合体を形成する.この複合体は核へと移動し,転写因子とともにさらに高次の複合体であるフロリゲン転写活性化複合体を構築して花芽形成遺伝子の発現をスタートさせるのである(図2).また最近,フロリゲンは花成のみならず植物の発生の多様な局面を制御していることが明らかにされつつある10,11).フロリゲン転写活性化複合体の形成モデルはこの多機能性を説明できるとも考えられる.14-3-3タンパク質は多数の転写因子との結合が可能であるから,フロリゲンが14-3-3タンパク質に受容されたのち,フロリゲン転写活性化複合体において構成する転写因子を変化させることで多様な機能を発揮できるという仮説である.したがって,これらの分子機構をふまえてフロリゲン転写活性化複合体の形成と機能とを制御すれば,将来的に作物の生産において重要な形質の改良にも貢献できるであろう.
奈良先端科学技術大学院大学バイオサイエンス研究科 助教.
研究テーマ:フロリゲンによる花成の分子機構の解明.
抱負:フロリゲンの基礎研究を発展させて“フロリゲン農業”へと展開させたい.
大木 出(Izuru Ohki)
奈良先端科学技術大学院大学バイオサイエンス研究科 助教.
研究テーマ:真核生物における転写制御機構の生化学および構造生物学.
抱負:X線結晶構造解析とNMR法とを駆使し,分子レベルの視点から開花の新たな制御機構を解明していきたい.また,フロリゲンを改良して自在に花を咲かせる技術を開発したい.
辻 寛之(Hiroyuki Tsuji)
奈良先端科学技術大学院大学バイオサイエンス研究科 助教.
研究テーマ:フロリゲンが花を咲かせる分子機構の解明,植物の成長相転換の全体像を理解する.
抱負:いろいろな切り口から植物科学,さらには,生命科学の基本的な問題を解明したい.理想的な作物の開発に直結する基礎研究を展開したい.
児嶋 長次郎(Chojiro Kojima)
大阪大学蛋白質研究所 准教授.
島本 功(Ko Shimamoto)
奈良先端科学技術大学院大学バイオサイエンス研究科 教授.
© 2011 田岡健一郎・大木 出・辻 寛之・児嶋長次郎・島本 功 Licensed under CC 表示 2.1 日本
(奈良先端科学技術大学院大学バイオサイエンス研究科 1植物分子遺伝学研究室,2生体高分子構造学研究室,3大阪大学蛋白質研究所 機能構造計測学研究室)
email:田岡健一郎
DOI: 10.7875/first.author.2011.141
14-3-3 proteins act as intracellular receptors for rice Hd3a florigen.
Ken-ichiro Taoka*, Izuru Ohki*, Hiroyuki Tsuji*, Kyoko Furuita, Kokoro Hayashi, Tomoko Yanase, Midori Yamaguchi, Chika Nakashima, Yekti Asih Purwestri, Shojiro Tamaki, Yuka Ogaki, Chihiro Shimada, Atsushi Nakagawa, Chojiro Kojima, Ko Shimamoto (* These authors contributed equally to this work.)
Nature, 476, 332-335 (2011)
要 約
花芽の形成を誘導する植物ホルモンとして70年以上まえに提唱された“フロリゲン”の分子的な実体は,最近になりようやく,高等植物で広く保存されているFT遺伝子にコードされるタンパク質であることが明らかにされた.しかしながら,フロリゲンが花成の誘導にはたす正確な役割は不明なままである.今回,筆者らは,FTのホモログであるイネのフロリゲンHd3aが,茎頂の細胞において14-3-3タンパク質と結合することを明らかにした.形成された複合体は核へと移動し,そこでさらに転写因子OsFD1と結合した.こうして形成された3つのタンパク質からなる“フロリゲン活性化複合体”が,イネの花芽形成遺伝子であるOsMADS15遺伝子の転写をひき起こすことが明らかになった.さらに,このフロリゲン活性化複合体の結晶構造を2.4Åの分解能で決定した.これらの知見は,茎頂細胞の14-3-3タンパク質が細胞内においてフロリゲン受容体としてはたらいていることを示していた.
はじめに
多くの植物は1年の決まった時期に花を咲かせ子孫を残す.この開花制御には日長が重要な役割をはたしている.1937年,日長刺激に応答して葉でつくられた物質が茎頂に運ばれて花芽形成を誘導するとの考えが提唱され,そのような物質は花成ホルモン“フロリゲン”と名づけられた.以後70年以上のあいだ,フロリゲンの存在を支持する多くの実験結果が報告されたが,フロリゲンの実体は謎のままであった.しかし近年になって,シロイヌナズナのFTおよびそのホモログであるイネのHd3aがフロリゲンの分子的な実体であることが明らかにされた1,2).FTと相互作用するタンパク質として,シロイヌナズナのFDが報告されている3,4).FDはbZip型の転写因子であり,FTとFDの両者の過剰発現により花芽形成遺伝子のひとつであるAP1遺伝子の発現が誘導される.しかし,フロリゲンがどのような分子機構でその下流の標的遺伝子の発現を制御しているのかは不明であった.その制御機構を明らかにするため,筆者らは,酵母ツーハイブリッドスクリーニングによりHd3aと相互作用する複数のタンパク質を同定し,それらの詳細な相互作用解析を行った.
1.Hd3a,GF14c,OsFD1の三者のタンパク質のあいだの相互作用
フロリゲンによる花成誘導の分子機構を理解するため,イネのcDNAライブラリーを用いた酵母ツーハイブリッド法によりHd3aと相互作用するタンパク質の探索を行った.その結果,GF14c(イネ14-3-3タンパク質),OsKANADI1(シロイヌナズナKANADIのイネホモログ),OsBIP116b(シロイヌナズナWAVE DAMPENED2のイネホモログ)が得られた.また,データベース検索から得られたOsFD1(シロイヌナズナFDのイネホモログ)も酵母においてHd3aと相互作用した.GF14cを除く3つの相互作用タンパク質のC末端には共通してSAPモチーフ(Ser-Ala-Pro)が見い出された.この配列はすでに報告されていたFDにおけるFTとの相互作用モチーフ(Thr-Ala-Pro)と類似していた3).いずれのHd3a相互作用タンパク質においても,SAPモチーフのAlaの置換により酵母におけるHd3aとの相互作用は失われた.一方,in vitroでの相互作用実験では,Hd3aとGF14cとのあいだの相互作用は検出されたが,Hd3aとOsFD1との相互作用は検出できなかった.これらの実験結果と,SAPモチーフと14-3-3タンパク質認識配列との類似性,さらにGF14cにはSAPモチーフがないことから,つぎのような仮説をたてた.すなわち,Hd3aとその相互作用タンパク質は14-3-3タンパク質を介し間接的に相互作用していると考えたのである.酵母において観察されたHd3aとその相互作用タンパク質とのあいだの結合は,酵母のもつ内在性の14-3-3タンパク質を介した間接的なものであると説明できる.そこで,OsFD1とGF14cとの相互作用を調べたところ,両者はin vitroにおいて相互作用した.さらに変異解析により,SAPモチーフにあるSerのリン酸化が両者の相互作用において重要であることが示唆された.Hd3aとGF14cとの植物細胞における相互作用は,イネの茎頂細胞の抽出液を用いた共免疫沈殿解析から確かめられた.
2.フロリゲン活性化複合体の結晶構造
Hd3a,GF14c,OsFD1の三者の相互作用の詳細を調べるため,この三者からなるタンパク質複合体の立体構造解析を行い,結晶構造を2.4Å分解能で決定することに成功した(PDB ID:3AXY).結晶化にあたって,OsFD1としては,酵母ツーハイブリッド実験より判明していたGF14cとの結合に必要十分なリン酸化されたSer192を含むC末端の9アミノ酸残基からなる断片を用いた.得られた複合体の構造において,Hd3a,GF14c,OsFD1のそれぞれ2分子ずつからなるW字型のヘテロ六量体が形成されており(図1a),二量体を形成したGF14cのW字型構造の底にあるくぼみにリン酸化されたOsFD1がはまり込み,その上側にHd3aが1分子ずつ左右対称に離れて結合していた(図1b).Hd3aとOsFD1とのあいだに直接的な相互作用はみられず,このことはHd3aとOsFD1はGF14cに対し独立に結合するという酵母ツーハイブリッド実験の結果と一致していた.GSTプルダウンアッセイにおいてもGF14cが存在する場合のみHd3aとOsFD1との結合がみられたことから,14-3-3タンパク質であるGF14cはフロリゲンであるHd3aと転写因子OsFD1とを結びつける役割をはたし,これら三者からなる複合体がフロリゲンシグナル伝達の本体であると考えられた.そこで,この三者複合体をフロリゲン転写活性化複合体(florigen activation complex:FAC)と名づけた.
3.GF14cによるHd3aとOsFD1の認識
14-3-3タンパク質はリン酸化されたアミノ酸を認識するドメインとして知られているが5),GF14cとHd3aとの相互作用はリン酸化に非依存的であり,それらとはかなり異なる結合様式をみせていた.GF14cとHd3aとの相互作用においては,Hd3aのループ領域に存在する2つの突き出た塩基性アミノ酸残基(Arg64およびArg132)がGF14cの上部にある酸性のくぼみに錨のようにはまり込み,さらに,Hd3a本体はGF14cのC末端ヘリックスのあいだにある疎水性の溝と広く相互作用していた(図1c).一方,リン酸化されたOsFD1とGF14cとの相互作用は,これまで多く報告されている14-3-3タンパク質とリン酸化ペプチドとの結合様式に類似していた5).OsFD1のリン酸化されたSer192がGF14cの塩基性のリン酸化ペプチド結合ポケットにはまり込み,さらにSAPモチーフ全体も認識されていた(図1c).一般に立体構造解析では相互作用しているアミノ酸残基がもれなくすべてわかるため,点変異による解析などと比較して,種間での相互作用の保存性を正確に見積もることのできる点が大きな利点のひとつである.そこで,イネのフロリゲン活性化複合体において観察された相互作用にかかわるアミノ酸残基の保存性をほかの植物種とのあいだで比較したところ,Hd3aとGF14cとのあいだおよびGF14cとOsFD1とのあいだとも高等植物においてアミノ酸残基は高度に保存されており,これらのあいだの相互作用がイネと同様に存在する可能性が示唆された.また,シロイヌナズナやトマトにおいてフロリゲンと14-3-3タンパク質とが実際に相互作用することが報告されている6,7).これらのことより,フロリゲン,14-3-3タンパク質,転写因子の相互作用は,植物全般に共通して存在する花成誘導経路であると考えられた.
4.プロモーターDNAにおけるフロリゲン転写活性化複合体
bZip型転写因子としてOsFD1を含むフロリゲン転写活性化複合体は,細胞においては花芽形成遺伝子であるOsMADS15遺伝子(シロイヌナズナAP1遺伝子のイネホモログ)のプロモーター領域に結合して転写を活性化しているものと考えられる8).しかし,得られた結晶構造はDNAを含んでいないため,プロモーターにおいてこのフロリゲン転写活性化複合体が形成されているのかどうかは不明であった.そのため,シロイヌナズナのAP1遺伝子プロモーターのCボックスDNA(GACGTC)を用いて,フロリゲン転写活性化複合体とDNAとの結合をゲルシフトアッセイにより調べた.その結果,DNAに対しOsFD1,GF14c,Hd3aを順にくわえていくとDNAの段階的なシフトがみられ,プロモーターにおいて安定なフロリゲン転写活性化複合体が形成されることが判明した.このフロリゲン転写活性化複合体とDNAとの複合体におけるHd3aの位置づけを確認するため,フロリゲン転写活性化複合体とDNAとの複合体のモデル構造を,報告されている動物のbZip型転写因子とDNAとの複合体の構造をもとに作製した(図1d).このモデルにおいてHd3aはGF14cとOsFD1をDNAに安定に保持するよう位置し,この配置がHd3aによる転写活性化や花成誘導に関係しているものと予想された.
5.フロリゲン転写活性化複合体の形成機構
Hd3a,GF14b,OsFD1の細胞内における局在を観察したところ,Hd3aは核と細胞質に,GF14bはほとんどが細胞質に,OsFD1は核にのみ局在しており,複合体を形成するはずの三者の局在はそれぞれ異なっていることがわかった.そこで,Hd3a-GF14b複合体の形成を2分子蛍光相補(bimolecular fluorescence complementation:BiFC)法により検討したところ,この複合体はGF14bの存在する細胞質で形成されていることがわかった.しかし,OsFD1の核への局在とはオーバーラップしていないため,この複合体を結びつける分子機構の存在することが考えられた.そこで,Hd3a-GF14b複合体の存在下において,さらにOsFD1を共発現させる実験を行った.その結果,Hd3a-GF14b複合体は細胞質から核へとその局在を変え,Hd3a,GF14b,OsFD1の三者が核に集合することが観察された.このことから,Hd3aは最初に細胞質においてHd3a-GF14b複合体を形成したのち,核へと移行してOsFD1と相互作用しているものと考えられた.
フロリゲン転写活性化複合体の形成をさらに検証するため,2分子蛍光相補法と蛍光エネルギー共鳴移動(fluorescence resonance energy transfer:FRET)/蛍光寿命イメージング法(fluorescence lifetime imaging microscopy:FLIM)とを組み合わせたバイオイメージング実験を行った.この実験では,蛍光タンパク質であるCFPとVenusとが近接すると蛍光エネルギーの移動が生じCFPの蛍光寿命が短縮するという現象を利用する.すなわち,Hd3a-GF14b複合体を2分子蛍光相補法により再構成してVenusで可視化し,さらに,CFPにより標識したOsFD1を共発現させると,三者が相互作用していればCFPとVenusとのあいだが近接してCFPの蛍光寿命は短縮することが期待される.蛍光寿命の測定実験を行ったところ,Hd3a-GF14b複合体とCFP標識OsFD1とが共存したときだけCFPの蛍光寿命の短縮が観察された.このことから,細胞内においてもフロリゲン転写活性化複合体がダイナミックな細胞内での局在の変化をともない形成されていることが強く示唆された.
6.14-3-3タンパク質との相互作用はHd3aとOsFD1によるOsMADS15遺伝子の活性化に必要である
シロイヌナズナのAP1遺伝子の転写はFTとFDに依存的である4).イネでは,Hd3a遺伝子をRNAi法によりノックダウンするとOsMADS15遺伝子(シロイヌナズナAP1遺伝子のイネホモログ)の発現量が減少する.そこで,Hd3a,14-3-3タンパク質,OsFD1の三者の相互作用がOsMADS15遺伝子の活性化にかかわっているかどうかをイネのプロトプラストにおける一過的な発現実験により調べた.OsMADS15 mRNA量はHd3aの発現ベクターおよびOsFD1の発現ベクターがともに導入された場合にのみ上昇した.しかし,14-3-3タンパク質との相互作用を欠損した変異型Hd3a,あるいは,14-3-3タンパク質との相互作用を欠損した変異型OsFD1を発現させた場合にはOsMADS15遺伝子の発現上昇はほとんど観察されなかった.さらに,Hd3aとの結合が認められた4種類のイネ14-3-3タンパク質のアイソフォームの発現を一過的なRNAi法により同時にノックダウンした場合もOsMADS15 mRNA量は減少した.以上の実験結果は,フロリゲン転写活性化複合体の形成がその下流の標的遺伝子の活性化に必須であることを示唆していた.
7.Hd3aによる花芽の形成促進には14-3-3タンパク質との相互作用が必要である
さらに,多数の形質転換イネを用いた実験から,フロリゲン転写活性化複合体の形成が花芽の形成に必要であることが明らかになった.Hd3aは葉の維管束で発現することから,維管束に特異的に強い活性をもつrolC遺伝子プロモーターによりHd3aを発現させたところ,形質転換イネの花成は顕著に促進された.このとき,Hd3aに14-3-3タンパク質との相互作用を欠損する変異を導入すると,実験した4種類の変異すべてにおいて花成の促進機能が失われることがわかった.すなわち,Hd3aが開花の促進能を発揮するためには14-3-3タンパク質との相互作用が必須であることがいえた.また,RNAi法によりOsFD1の発現をノックダウンしたところ,シロイヌナズナfd変異体やトウモロコシdlf1変異体と同様に,花成は遅延することがわかった3,4,9).OsFD1の過剰発現は花成に影響をあたえなかったが,OsFD1にリン酸化を模倣する変異を導入して14-3-3タンパク質との恒常的な結合が可能となるようにしたところ花成を促進できるようになった.このことは,OsFD1のリン酸化がフロリゲン転写活性化複合体の形成を促進することを示唆していた.
おわりに
この研究の結果から,14-3-3タンパク質はフロリゲンの細胞内における受容体として機能するものと考えられた.フロリゲンは葉で合成されたのち茎頂まで長距離移動する.茎頂の細胞に到達したのち,細胞質においてフロリゲン受容体である14-3-3タンパク質に受容されフロリゲン-14-3-3タンパク質複合体を形成する.この複合体は核へと移動し,転写因子とともにさらに高次の複合体であるフロリゲン転写活性化複合体を構築して花芽形成遺伝子の発現をスタートさせるのである(図2).また最近,フロリゲンは花成のみならず植物の発生の多様な局面を制御していることが明らかにされつつある10,11).フロリゲン転写活性化複合体の形成モデルはこの多機能性を説明できるとも考えられる.14-3-3タンパク質は多数の転写因子との結合が可能であるから,フロリゲンが14-3-3タンパク質に受容されたのち,フロリゲン転写活性化複合体において構成する転写因子を変化させることで多様な機能を発揮できるという仮説である.したがって,これらの分子機構をふまえてフロリゲン転写活性化複合体の形成と機能とを制御すれば,将来的に作物の生産において重要な形質の改良にも貢献できるであろう.
文 献
- Corbesier, L., Vincent, C., Jang, S. et al.: FT protein movement contributes to long-distance signaling in floral induction of Arabidopsis. Science, 316, 1030-1033 (2007)[PubMed]
- Tamaki, S., Matsuo, S., Wong, H. L. et al.: Hd3a protein is a mobile flowering signal in rice. Science, 316, 1033-1036 (2007)[PubMed]
- Abe, M., Kobayashi, Y., Yamamoto, S. et al.: FD, a bZIP protein mediating signals from the floral pathway integrator FT at the shoot apex. Science, 309, 1052-1056 (2005)[PubMed]
- Wigge, P. A., Kim, M. C., Jaeger, K. E. et al.: Integration of spatial and temporal information during floral induction in Arabidopsis. Science, 309, 1056-1059 (2005)[PubMed]
- Yaffe, M. B., Rittinger, K., Volinia, S. et al.: The structural basis for 14-3-3:phosphopeptide binding specificity. Cell, 91, 961-971 (1997)[PubMed]
- Pnueli, L., Gutfingera, T., Hareven, D. et al.: Tomato SP-interacting proteins define a conserved signaling system that regulates shoot architecture and flowering. Plant Cell, 13, 2687-2702 (2001)[PubMed]
- Lifschitz, E., Eviatear, T., Rozman, A. et al.: The tomato FT ortholog triggers systemic signals that regulate growth and flowering and substitute for diverse environmental stimuli. Proc. Natl. Acad. Sci. USA, 103, 6398-6403 (2006)[PubMed]
- Komiya, R., Ikegami, A., Tamaki, S. et al.: Hd3a and RFT1 are essential for flowering in rice. Development, 135, 767-774 (2008)[PubMed]
- Muszynski, M. G., Dam, T., Li, B. et al.: delayed flowering1 encodes a basic leucine zipper protein that mediates floral inductive signals at the shoot apex in maize. Plant Physiol., 142, 1523-1536 (2006)[PubMed]
- Shalit, A., Rozman, A., Goldshmidt, A. et al.: The flowering hormone florigen functions as a general systemic regulator of growth and termination. Proc. Natl. Acad. Sci. USA, 106, 8392-8397 (2009)[PubMed]
- Krieger, U., Lippman, Z. B., Zamir, D.: The flowering gene SINGLE FLOWER TRUSS drives heterosis for yield in tomato. Nat. Genet., 42, 459-463 (2010)[PubMed]
著者プロフィール
奈良先端科学技術大学院大学バイオサイエンス研究科 助教.
研究テーマ:フロリゲンによる花成の分子機構の解明.
抱負:フロリゲンの基礎研究を発展させて“フロリゲン農業”へと展開させたい.
大木 出(Izuru Ohki)
奈良先端科学技術大学院大学バイオサイエンス研究科 助教.
研究テーマ:真核生物における転写制御機構の生化学および構造生物学.
抱負:X線結晶構造解析とNMR法とを駆使し,分子レベルの視点から開花の新たな制御機構を解明していきたい.また,フロリゲンを改良して自在に花を咲かせる技術を開発したい.
辻 寛之(Hiroyuki Tsuji)
奈良先端科学技術大学院大学バイオサイエンス研究科 助教.
研究テーマ:フロリゲンが花を咲かせる分子機構の解明,植物の成長相転換の全体像を理解する.
抱負:いろいろな切り口から植物科学,さらには,生命科学の基本的な問題を解明したい.理想的な作物の開発に直結する基礎研究を展開したい.
児嶋 長次郎(Chojiro Kojima)
大阪大学蛋白質研究所 准教授.
島本 功(Ko Shimamoto)
奈良先端科学技術大学院大学バイオサイエンス研究科 教授.
© 2011 田岡健一郎・大木 出・辻 寛之・児嶋長次郎・島本 功 Licensed under CC 表示 2.1 日本