糖新生経路ではたらく酵素フルクトース-1,6-ビスリン酸アルドラーゼ/ホスファターゼは“変形”して2つの反応を触媒する
西増弘志1・伏信進矢2・若木高善2
(1東京大学大学院理学系研究科 生物化学専攻,2東京大学大学院農学生命科学研究科 応用生命工学専攻)
email:西増弘志,伏信進矢,若木高善
DOI: 10.7875/first.author.2011.154
Structural basis for the bifunctionality of fructose 1,6-bisphosphate aldolase/phosphatase.
Shinya Fushinobu, Hiroshi Nishimasu, Daiki Hattori, Hyun-Jin Song, Takayoshi Wakagi
Nature, 478, 538-541 (2011)
古細菌や好熱性細菌に存在するフルクトース-1,6-ビスリン酸アルドラーゼ/ホスファターゼは,ジヒドロキシアセトンリン酸とグリセルアルデヒド3-リン酸からフルクトース1,6-ビスリン酸へのアルドラーゼ縮合反応,および,フルクトース1,6-ビスリン酸からフルクトース6-リン酸への脱リン酸化反応,という糖新生経路における2つの異なる化学反応を触媒する.今回,筆者らは,フルクトース-1,6-ビスリン酸アルドラーゼ/ホスファターゼとジヒドロキシアセトンリン酸との複合体のX線結晶構造を決定した.過去に報告していたフルクトース-1,6-ビスリン酸アルドラーゼ/ホスファターゼとフルクトース1,6-ビスリン酸との複合体の構造と比較することにより,フルクトース-1,6-ビスリン酸アルドラーゼ/ホスファターゼの酵素活性部位は“変形”して2つの反応を触媒していることが明らかになった.これは“ひとつの酵素はひとつの反応のみを触媒する”というこれまでの常識をくつがえす発見であった.
生命現象は酵素により触媒される基質および反応に特異的な生化学反応の集積といえる.酵素のなかには二機能性(bifunctional)酵素とよばれるものがあるが,それらは基質特異性のゆるい酵素,または,異なる反応を触媒する別個のドメインから構成された多ドメイン酵素であり,原則として“ひとつの酵素はひとつの反応を触媒する”ものと信じられてきた.しかし最近になり,糖新生経路ではたらく酵素フルクトース-1,6-ビスリン酸アルドラーゼ/ホスファターゼ(FBPA/P)はこの原則に反して,ひとつのドメインからなる酵素であるにもかかわらず,ジヒドロキシアセトンリン酸とグリセルアルデヒド3-リン酸からフルクトース1,6-ビスリン酸へのアルドラーゼ縮合反応,および,フルクトース1,6-ビスリン酸からフルクトース6-リン酸への脱リン酸化反応,というまったく異なる2つの化学反応を触媒することが報告された1).
FBPA/Pは古細菌や好熱性細菌の糖新生経路に関与するクラスVフルクトース-1,6-ビスリン酸ホスファターゼとして,2002年,はじめて同定された2).この酵素は,ほかのクラス(クラスI~クラスIV)やフルクトース-1,6-ビスリン酸アルドラーゼをふくむ,既知のタンパク質との相同性をもたない.2004年,筆者らは,クラスVフルクトース-1,6-ビスリン酸ホスファターゼ(好酸好熱性古細菌Sulfolobus tokodaiiに由来するST0318タンパク質)の結晶構造をフルクトース1,6-ビスリン酸との複合体として決定し,既知のタンパク質とは異なる新しいフォールドをもつこと,環状の四量体が2つ重なった八量体構造をとること,二量体の界面に存在する酵素活性部位にフルクトース1,6-ビスリン酸と4つのMg2+が結合していること,を明らかにした3)(PDB ID:1UMG).さらに,変異体の解析から脱リン酸化反応の触媒機構を提唱した.環状のフルクトース1,6-ビスリン酸が結合するほかのフルクトース-1,6-ビスリン酸ホスファターゼとは異なり,ST0318には直鎖状のフルクトース1,6-ビスリン酸が結合していた(溶液中においてフルクトース1,6-ビスリン酸は環状と直鎖状との平衡状態にあるが,大部分は環状として存在する).いまとなっては,この直鎖状フルクトース1,6-ビスリン酸はアルドラーゼ縮合反応の直後の産物であると解釈でき,この酵素がFBPA/Pであることを暗示しているように思える.しかし当時は,クラスVフルクトース-1,6-ビスリン酸ホスファターゼはたまたま直鎖状フルクトース1,6-ビスリン酸を基質として利用する一風変わった酵素という程度にしか考えておらず,このストーリーは完結したものだと思っていた.
しかし,クラスVフルクトース-1,6-ビスリン酸ホスファターゼをめぐるストーリーには予想外のつづきがあった.フルクトース-1,6-ビスリン酸ホスファターゼと同じく細胞抽出液からはフルクトース-1,6-ビスリン酸アルドラーゼの活性が検出されるにもかかわらず,糖新生経路に関与するこの酵素の遺伝子は古細菌や好熱性細菌のゲノムからは見い出されないことが知られていた.2010年,古細菌の細胞抽出液からこの未知のフルクトース-1,6-ビスリン酸アルドラーゼの精製を試みた過程において偶然に,酵素活性測定の共役酵素として用いたクラスVフルクトース-1,6-ビスリン酸ホスファターゼがフルクトース-1,6-ビスリン酸アルドラーゼ活性を示すことが発見された1).なんと,クラスVフルクトース-1,6-ビスリン酸ホスファターゼこそが探し求めていたフルクトース-1,6-ビスリン酸アルドラーゼであり,これまでの常識に反して,クラスVフルクトース-1,6-ビスリン酸ホスファターゼはアルドラーゼ活性とホスファターゼ活性の両方をもつ“真の”二機能性酵素FBPA/Pだったのである! 生化学的な実験から,筆者らの報告していたST0318とフルクトース1,6-ビスリン酸との複合体の構造3) では,酵素活性部位に結合したフルクトース1,6-ビスリン酸からは遠く離れたST0318のLys232とジヒドロキシアセトンリン酸とによるシッフ塩基の形成がアルドラーゼ活性に必須であり,FBPA/PはクラスIフルクトース-1,6-ビスリン酸アルドラーゼと同様の分子機構によりアルドラーゼ縮合反応を触媒することが示唆された1).しかし,FBPA/Pが2つの異なる化学反応を触媒する分子機構についてはこれまで謎に包まれていた.
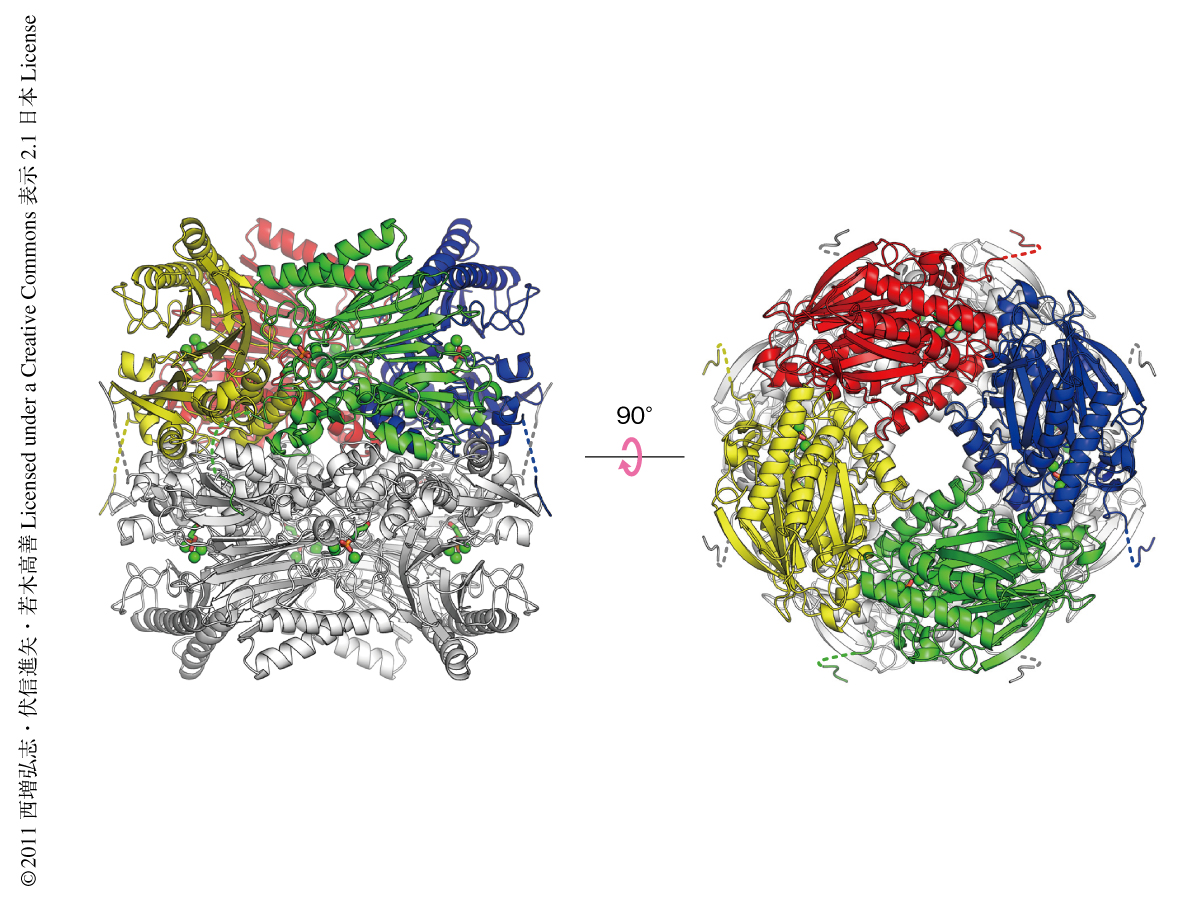
まず,ST0318がフルクトース1,6-ビスリン酸に対しホスファターゼ活性にくわえアルドラーゼ活性をももつことを確認するため,大腸菌組換えタンパク質として調製したST0318のホスファターゼ活性とアルドラーゼ活性を測定した.その結果,ST0318はその両方の活性をもちFBPA/Pであることが確認された.つぎに,FBPA/Pがアルドラーゼ縮合反応を触媒する分子機構を解明するため,ST0318をジヒドロキシアセトンリン酸の存在下で結晶化し,ST0318とジヒドロキシアセトンリン酸との複合体のX線結晶構造を1.5Å分解能で決定した(図1,PDB ID:3R1M).ST0318とジヒドロキシアセトンリン酸との複合体(アルドラーゼ型)の構造は,のちに述べる3つのループ領域を除き,過去に報告していたST0318とフルクトース1,6-ビスリン酸との複合体(ホスファターゼ型)の構造3) と同様であった.アルドラーゼ型複合体はホスファターゼ型複合体と同様の八量体構造をとっており,ジヒドロキシアセトンリン酸はホスファターゼ型の構造におけるフルクトース1,6-ビスリン酸と同様に二量体の界面に存在する酵素活性部位に結合していた.これらのことから,FBPA/Pはアルドラーゼ縮合反応と脱リン酸化反応とを同一の酵素活性部位で触媒することがはっきりと示された.予想どおり,ジヒドロキシアセトンリン酸はLys232とシッフ塩基を形成しており,今回の結晶構造はクラスIフルクトース-1,6-ビスリン酸アルドラーゼ4) でも報告されているアルドラーゼ縮合反応中間体(イミン型)をとらえていることが示唆された(図2).ホスファターゼ型の構造ではフルクトース1,6-ビスリン酸の1位のリン酸基が4つのMg2+(Mg1~Mg4)と結合していた一方で3),アルドラーゼ型の構造ではジヒドロキシアセトンリン酸のリン酸基は3つのMg2+(Mg2~Mg4)と結合していた.ジヒドロキシアセトンリン酸の3位のヒドロキシ基は,Arg266,Asp287,および,Gln242’(となりのプロトマー)と水素結合を形成していた.第2の基質であるグリセルアルデヒド3-リン酸はC3位にヒドロキシ基ではなくカルボニル基をもつことから,これらの水素結合はジヒドロキシアセトンリン酸とグリセルアルデヒド3-リン酸との識別に重要であるものと考えられた.
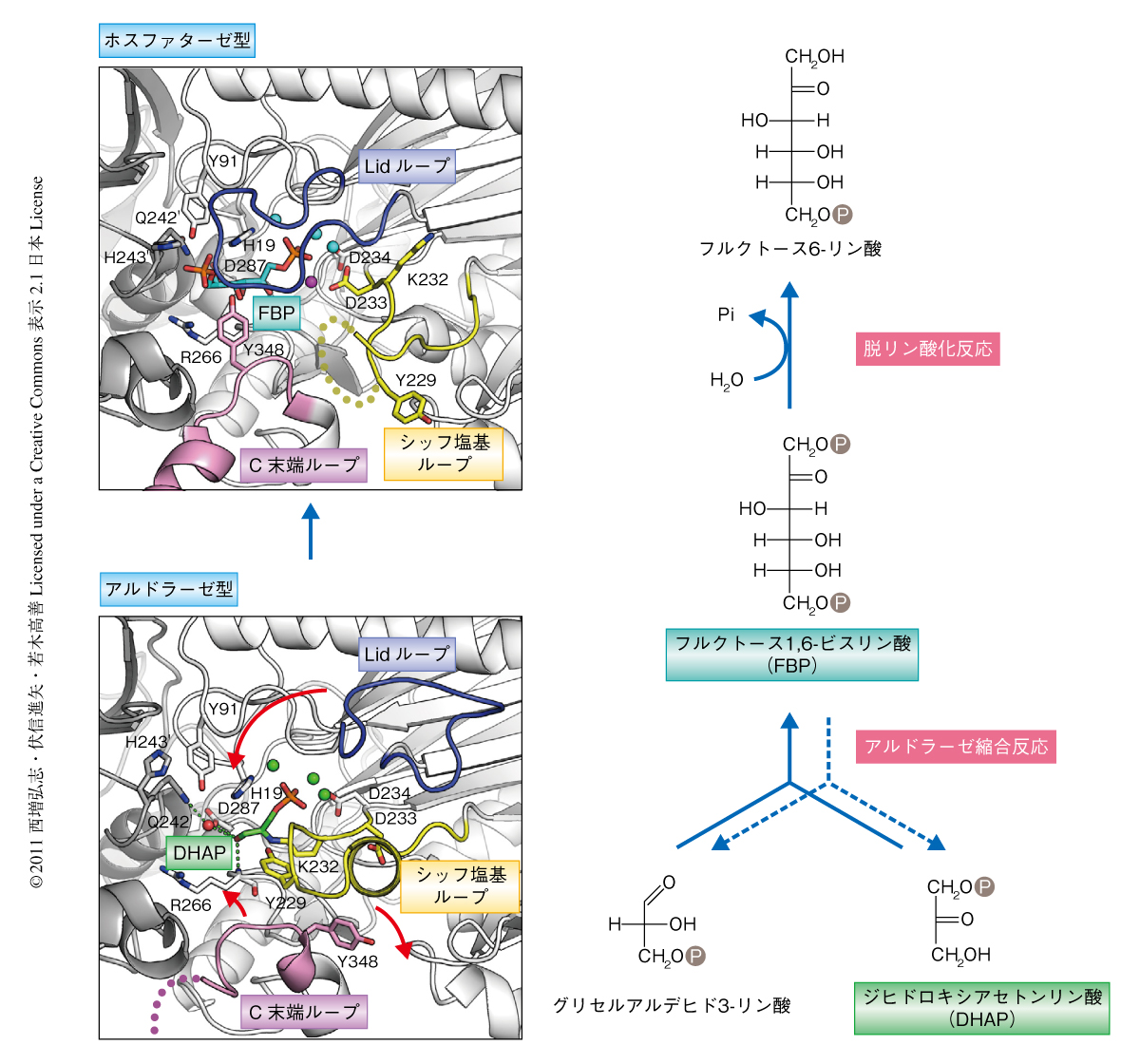
FBPA/Pはどのような分子機構により2つの反応を触媒するのだろうか? アルドラーゼ型とホスファターゼ型の構造比較から,酵素活性部位を形成している3つのループ領域(Lidループ,シッフ塩基ループ,C末端ループ)がその構造を大きく変化させていることがわかった(図2).ホスファターゼ型の構造では,LidループとC末端ループの2つのループが基質であるフルクトース1,6-ビスリン酸と相互作用する一方で,シッフ塩基ループは酵素活性部位から遠くに位置しておりフルクトース1,6-ビスリン酸とは相互作用していなかった3).それに対してアルドラーゼ型の構造では,LidループとC末端ループの2つのループは酵素活性部位から離れており基質であるジヒドロキシアセトンリン酸とは相互作用せず,その一方で,シッフ塩基ループが酵素活性部位に近づいてループにあるTyr229とLys232がジヒドロキシアセトンリン酸と相互作用していた.アルドラーゼ型とホスファターゼ型のどちらの構造でもAsp234はMg2と結合していた一方,アルドラーゼ型の構造では脱リン酸化反応に必須なMg1と結合するAsp233はフリップアウトしておりMg1は結合していなかった.Mg1がないと脱リン酸化反応ののちに生じる負電荷を安定できないためホスファターゼ活性は著しく低下することが示唆されていた3).したがって,アルドラーゼ型の構造にはMg1が結合しないためジヒドロキシアセトンリン酸のリン酸基は脱リン化されないものと考えられた.以上のことから,FBPA/Pは酵素活性部位にある3つのループ領域の立体構造をたくみに“変形”させることにより異なる基質結合部位を形成していることが明らかになった.
FBPA/Pはどのような分子機構によりアルドラーゼ縮合反応を触媒するのだろうか? 今回,決定したST0318とジヒドロキシアセトンリン酸との複合体の構造と,クラスIフルクトース-1,6-ビスリン酸アルドラーゼであるウサギ筋フルクトース-1,6-ビスリン酸アルドラーゼとジヒドロキシアセトンリン酸との複合体4) の構造(PDB ID:2QUT)との比較から,FBPA/PとクラスIフルクトース-1,6-ビスリン酸アルドラーゼの酵素活性部位のあいだの意外な類似性が明らかになった.注目すべきことに,ST0318とウサギ筋フルクトース-1,6-ビスリン酸アルドラーゼとはまったく異なる全体構造をしているにもかかわらず,この2つの構造においてジヒドロキシアセトンリン酸とシッフ塩基との中間体はよく似た構造をとっていた.クラスIフルクトース-1,6-ビスリン酸アルドラーゼの研究から,アルドラーゼ縮合反応は,脱水反応,カルバニオン形成反応,C3-C4結合形成反応,水和反応,の4つのステップからなり,ウサギ筋フルクトース-1,6-ビスリン酸アルドラーゼではGlu187が酸塩基触媒としてはたらくことが示唆されていた.ST0318とウサギ筋フルクトース-1,6-ビスリン酸アルドラーゼとの構造比較から,ST0318のTyr229とウサギ筋フルクトース-1,6-ビスリン酸アルドラーゼのGlu187とは同様の位置に存在し,Tyr229のもつヒドロキシ基はLys232,ジヒドロキシアセトンリン酸のC2原子とC3原子,および,(重ね合わせたホスファターゼ型の構造における)フルクトース1,6-ビスリン酸のO4原子の近くに位置していることがわかった(図2).Tyr229はFBPA/Pのあいだで高度に保存されており,この残基の変異体ではホスファターゼ活性は保持されていたがアルドラーゼ活性は消失していた.これらの結果から,Tyr229がアルドラーゼ縮合反応における酸塩基触媒であることが示唆された.
アルドラーゼ型とホスファターゼ型との構造比較から,今回,決定した複合体にはふくまれない第2の基質であるグリセルアルデヒド3-リン酸の認識機構も推測できた.アルドラーゼ型の構造の酵素活性部位にはジヒドロキシアセトンリン酸のとなりにグリセルアルデヒド3-リン酸を収容するのに十分な空間があり,アルドラーゼ型の構造においてTyr229およびAsp287と水素結合している2つの水分子は,ホスファターゼ型の構造においてフルクトース1,6-ビスリン酸の4位および5位のヒドロキシ基と同様の位置に存在していた.さらに,ホスファターゼ型の構造においてフルクトース1,6-ビスリン酸の6位のリン酸基を認識している残基(His19,Tyr91,Gln242’,His243’)はアルドラーゼ型の構造においても同様の位置にあった.したがって,グリセルアルデヒド3-リン酸のリン酸基はフルクトース1,6-ビスリン酸の6位のリン酸基と同様に認識され,グリセルアルデヒド3-リン酸のカルボニル基とヒドロキシ基はTyr229とAsp287により認識されることが示唆された.
ジヒドロキシアセトンリン酸とグリセルアルデヒド3-リン酸とが縮合したのちフルクトース1,6-ビスリン酸とシッフ塩基との中間体は加水分解され,シッフ塩基ループが酵素活性部位から離れると同時にAsp233がフリップインすることで,脱リン酸化反応に必須なMg1が酵素に結合するものと考えられた.さらに,LidループとC末端ループが酵素活性部位に近づきフルクトース1,6-ビスリン酸との結合を安定化させることで,フルクトース1,6-ビスリン酸の1位のリン酸基の脱リン酸化反応が触媒されるものと推定された.フルクトース1,6-ビスリン酸の脱リン酸化反応(加水分解反応)に関与する求核性の水分子は,アルドラーゼ型の構造において3つのMg2+(Mg2~Mg4)にかこまれたかたちですでに結合しており,4個目のMg2+(Mg1)の結合がトリガーとなって2段階目の脱リン酸化反応がひき起こされるものと考えられた.
原始の環境ではエネルギー源として糖(炭水化物)は希少だったと考えられること,および,FBPA/Pは系統樹の根元の付近に位置する生物のみに存在することから,FBPA/Pは解糖系よりもさきに誕生した原始的な糖新生経路の酵素ではないかと推測されている1).2段階の反応をいちどに触媒できるFBPA/Pは,生合成の観点からも省エネで効率的である.しかし,その巧妙な“変形”の分子機構を目のあたりにすると,はたしてFBPA/Pは本当に原始的な酵素なのだろうかと驚かずにはいられない.
ループやドメインの構造ゆらぎが基質との結合や生成物の解離などの酵素機能に重要であることはこれまでくわしく研究されてきたが,構造ゆらぎと酵素の触媒活性や多機能性との関連についてはほとんどわかっていなかった.筆者らの知るかぎり,今回の研究は,“ひとつの酵素活性部位が2つの反応を触媒する”という分子機構を解明したはじめての報告例であり,酵素機能における構造ゆらぎの新たな重要性を示したものといえる.同一の部位で複数の反応を触媒する未知の酵素がほかにも存在し,これから新たな“真の”二機能性酵素が発見される可能性も考えられる.
今回の研究成果をNature誌に投稿した際,“酵素が変形して2つの反応を触媒する”というコンセプトはまちがいなくおもしろいと思っていたが,その一方で,実験データの少ないシンプルな論文だったためリジェクトされるのではないかという不安もあった.しかし,エディターと3人のレフェリーの反応は想像以上に良好であり,うち2人のレフェリーからは,“The manuscript is short and to the point”,“The authors provided ample data to support a mechanism”と評価された.今回の研究成果は,論文においては主張を支持するのに必要十分なデータを示すことが重要であり,必ずしも膨大なデータが必要なわけではない,ということを示した好例といえる.また,一見すると無関係な研究が結びついて新しい発見が生まれるというサイエンスの醍醐味を体験できたことは本当に幸運だった.
〈追記〉今回の研究には衝撃のラストが待っていた.なんと,FBPA/Pを発見したドイツの研究グループも同様の結晶構造を決定しており,その論文もNature誌に同時に掲載されたのだ5)! 筆者らは,オンライン版の公開日までその論文の存在をまったく知らず,同時掲載の論文があるとは夢にも思っていなかった(論文の公開ののちドイツの研究グループのFuchs博士にメールしたところ,彼らも筆者らの論文を公開日にはじめて知ったとのことだった).ドイツの研究グループも筆者らと同様の結論にいたっており,2つの独立した研究からFBPA/Pの分子機構が確かなものであることが示された.したがって,FBPA/Pをめぐるストーリーは最高のハッピーエンドをむかえたといえる.しかし,ドイツの研究グループは筆者らの3週間前に論文を投稿しており,筆者らの投稿があと数日遅れていたら最高のバッドエンドをむかえていた可能性も考えられた.今回の研究では,サイエンスの楽しさと厳しさの両面をいやというほど体験することとなった.
略歴:2007年 東京大学大学院農学生命科学研究科 修了,同年 東京工業大学大学院生命理工学研究科 GCOE特任助教,2008年 東京大学医科学研究所 助教を経て,2010年より東京大学大学院理学系研究科 特任助教.
研究テーマ:非コードRNA,疾患にかかわるタンパク質.
抱負:立体構造から新しいコンセプトを創出していきたい.
伏信 進矢(Shinya Fushinobu)
略歴:1996年 東京大学大学院農学生命科学研究科 修了,1997年 同 助手を経て,2011年より同 准教授.
研究テーマ:酵素およびタンパク質の構造と機能.
抱負:酵素が好きです.みなさんに“おもしろい”と思ってもらえるような研究をしていきたいです.研究対象としては糖やリン酸がからむ反応を触媒する酵素が多いです.
若木 高善(Takayoshi Wakagi)
東京大学大学院農学生命科学研究科 教授.
© 2011 西増弘志・伏信進矢・若木高善 Licensed under CC 表示 2.1 日本
(1東京大学大学院理学系研究科 生物化学専攻,2東京大学大学院農学生命科学研究科 応用生命工学専攻)
email:西増弘志,伏信進矢,若木高善
DOI: 10.7875/first.author.2011.154
Structural basis for the bifunctionality of fructose 1,6-bisphosphate aldolase/phosphatase.
Shinya Fushinobu, Hiroshi Nishimasu, Daiki Hattori, Hyun-Jin Song, Takayoshi Wakagi
Nature, 478, 538-541 (2011)
要 約
古細菌や好熱性細菌に存在するフルクトース-1,6-ビスリン酸アルドラーゼ/ホスファターゼは,ジヒドロキシアセトンリン酸とグリセルアルデヒド3-リン酸からフルクトース1,6-ビスリン酸へのアルドラーゼ縮合反応,および,フルクトース1,6-ビスリン酸からフルクトース6-リン酸への脱リン酸化反応,という糖新生経路における2つの異なる化学反応を触媒する.今回,筆者らは,フルクトース-1,6-ビスリン酸アルドラーゼ/ホスファターゼとジヒドロキシアセトンリン酸との複合体のX線結晶構造を決定した.過去に報告していたフルクトース-1,6-ビスリン酸アルドラーゼ/ホスファターゼとフルクトース1,6-ビスリン酸との複合体の構造と比較することにより,フルクトース-1,6-ビスリン酸アルドラーゼ/ホスファターゼの酵素活性部位は“変形”して2つの反応を触媒していることが明らかになった.これは“ひとつの酵素はひとつの反応のみを触媒する”というこれまでの常識をくつがえす発見であった.
はじめに
生命現象は酵素により触媒される基質および反応に特異的な生化学反応の集積といえる.酵素のなかには二機能性(bifunctional)酵素とよばれるものがあるが,それらは基質特異性のゆるい酵素,または,異なる反応を触媒する別個のドメインから構成された多ドメイン酵素であり,原則として“ひとつの酵素はひとつの反応を触媒する”ものと信じられてきた.しかし最近になり,糖新生経路ではたらく酵素フルクトース-1,6-ビスリン酸アルドラーゼ/ホスファターゼ(FBPA/P)はこの原則に反して,ひとつのドメインからなる酵素であるにもかかわらず,ジヒドロキシアセトンリン酸とグリセルアルデヒド3-リン酸からフルクトース1,6-ビスリン酸へのアルドラーゼ縮合反応,および,フルクトース1,6-ビスリン酸からフルクトース6-リン酸への脱リン酸化反応,というまったく異なる2つの化学反応を触媒することが報告された1).
FBPA/Pは古細菌や好熱性細菌の糖新生経路に関与するクラスVフルクトース-1,6-ビスリン酸ホスファターゼとして,2002年,はじめて同定された2).この酵素は,ほかのクラス(クラスI~クラスIV)やフルクトース-1,6-ビスリン酸アルドラーゼをふくむ,既知のタンパク質との相同性をもたない.2004年,筆者らは,クラスVフルクトース-1,6-ビスリン酸ホスファターゼ(好酸好熱性古細菌Sulfolobus tokodaiiに由来するST0318タンパク質)の結晶構造をフルクトース1,6-ビスリン酸との複合体として決定し,既知のタンパク質とは異なる新しいフォールドをもつこと,環状の四量体が2つ重なった八量体構造をとること,二量体の界面に存在する酵素活性部位にフルクトース1,6-ビスリン酸と4つのMg2+が結合していること,を明らかにした3)(PDB ID:1UMG).さらに,変異体の解析から脱リン酸化反応の触媒機構を提唱した.環状のフルクトース1,6-ビスリン酸が結合するほかのフルクトース-1,6-ビスリン酸ホスファターゼとは異なり,ST0318には直鎖状のフルクトース1,6-ビスリン酸が結合していた(溶液中においてフルクトース1,6-ビスリン酸は環状と直鎖状との平衡状態にあるが,大部分は環状として存在する).いまとなっては,この直鎖状フルクトース1,6-ビスリン酸はアルドラーゼ縮合反応の直後の産物であると解釈でき,この酵素がFBPA/Pであることを暗示しているように思える.しかし当時は,クラスVフルクトース-1,6-ビスリン酸ホスファターゼはたまたま直鎖状フルクトース1,6-ビスリン酸を基質として利用する一風変わった酵素という程度にしか考えておらず,このストーリーは完結したものだと思っていた.
しかし,クラスVフルクトース-1,6-ビスリン酸ホスファターゼをめぐるストーリーには予想外のつづきがあった.フルクトース-1,6-ビスリン酸ホスファターゼと同じく細胞抽出液からはフルクトース-1,6-ビスリン酸アルドラーゼの活性が検出されるにもかかわらず,糖新生経路に関与するこの酵素の遺伝子は古細菌や好熱性細菌のゲノムからは見い出されないことが知られていた.2010年,古細菌の細胞抽出液からこの未知のフルクトース-1,6-ビスリン酸アルドラーゼの精製を試みた過程において偶然に,酵素活性測定の共役酵素として用いたクラスVフルクトース-1,6-ビスリン酸ホスファターゼがフルクトース-1,6-ビスリン酸アルドラーゼ活性を示すことが発見された1).なんと,クラスVフルクトース-1,6-ビスリン酸ホスファターゼこそが探し求めていたフルクトース-1,6-ビスリン酸アルドラーゼであり,これまでの常識に反して,クラスVフルクトース-1,6-ビスリン酸ホスファターゼはアルドラーゼ活性とホスファターゼ活性の両方をもつ“真の”二機能性酵素FBPA/Pだったのである! 生化学的な実験から,筆者らの報告していたST0318とフルクトース1,6-ビスリン酸との複合体の構造3) では,酵素活性部位に結合したフルクトース1,6-ビスリン酸からは遠く離れたST0318のLys232とジヒドロキシアセトンリン酸とによるシッフ塩基の形成がアルドラーゼ活性に必須であり,FBPA/PはクラスIフルクトース-1,6-ビスリン酸アルドラーゼと同様の分子機構によりアルドラーゼ縮合反応を触媒することが示唆された1).しかし,FBPA/Pが2つの異なる化学反応を触媒する分子機構についてはこれまで謎に包まれていた.
1.フルクトース-1,6-ビスリン酸アルドラーゼ/ホスファターゼとジヒドロキシアセトンリン酸との複合体のX線結晶構造
まず,ST0318がフルクトース1,6-ビスリン酸に対しホスファターゼ活性にくわえアルドラーゼ活性をももつことを確認するため,大腸菌組換えタンパク質として調製したST0318のホスファターゼ活性とアルドラーゼ活性を測定した.その結果,ST0318はその両方の活性をもちFBPA/Pであることが確認された.つぎに,FBPA/Pがアルドラーゼ縮合反応を触媒する分子機構を解明するため,ST0318をジヒドロキシアセトンリン酸の存在下で結晶化し,ST0318とジヒドロキシアセトンリン酸との複合体のX線結晶構造を1.5Å分解能で決定した(図1,PDB ID:3R1M).ST0318とジヒドロキシアセトンリン酸との複合体(アルドラーゼ型)の構造は,のちに述べる3つのループ領域を除き,過去に報告していたST0318とフルクトース1,6-ビスリン酸との複合体(ホスファターゼ型)の構造3) と同様であった.アルドラーゼ型複合体はホスファターゼ型複合体と同様の八量体構造をとっており,ジヒドロキシアセトンリン酸はホスファターゼ型の構造におけるフルクトース1,6-ビスリン酸と同様に二量体の界面に存在する酵素活性部位に結合していた.これらのことから,FBPA/Pはアルドラーゼ縮合反応と脱リン酸化反応とを同一の酵素活性部位で触媒することがはっきりと示された.予想どおり,ジヒドロキシアセトンリン酸はLys232とシッフ塩基を形成しており,今回の結晶構造はクラスIフルクトース-1,6-ビスリン酸アルドラーゼ4) でも報告されているアルドラーゼ縮合反応中間体(イミン型)をとらえていることが示唆された(図2).ホスファターゼ型の構造ではフルクトース1,6-ビスリン酸の1位のリン酸基が4つのMg2+(Mg1~Mg4)と結合していた一方で3),アルドラーゼ型の構造ではジヒドロキシアセトンリン酸のリン酸基は3つのMg2+(Mg2~Mg4)と結合していた.ジヒドロキシアセトンリン酸の3位のヒドロキシ基は,Arg266,Asp287,および,Gln242’(となりのプロトマー)と水素結合を形成していた.第2の基質であるグリセルアルデヒド3-リン酸はC3位にヒドロキシ基ではなくカルボニル基をもつことから,これらの水素結合はジヒドロキシアセトンリン酸とグリセルアルデヒド3-リン酸との識別に重要であるものと考えられた.
2.フルクトース-1,6-ビスリン酸アルドラーゼ/ホスファターゼの酵素活性部位は“変形”する
FBPA/Pはどのような分子機構により2つの反応を触媒するのだろうか? アルドラーゼ型とホスファターゼ型の構造比較から,酵素活性部位を形成している3つのループ領域(Lidループ,シッフ塩基ループ,C末端ループ)がその構造を大きく変化させていることがわかった(図2).ホスファターゼ型の構造では,LidループとC末端ループの2つのループが基質であるフルクトース1,6-ビスリン酸と相互作用する一方で,シッフ塩基ループは酵素活性部位から遠くに位置しておりフルクトース1,6-ビスリン酸とは相互作用していなかった3).それに対してアルドラーゼ型の構造では,LidループとC末端ループの2つのループは酵素活性部位から離れており基質であるジヒドロキシアセトンリン酸とは相互作用せず,その一方で,シッフ塩基ループが酵素活性部位に近づいてループにあるTyr229とLys232がジヒドロキシアセトンリン酸と相互作用していた.アルドラーゼ型とホスファターゼ型のどちらの構造でもAsp234はMg2と結合していた一方,アルドラーゼ型の構造では脱リン酸化反応に必須なMg1と結合するAsp233はフリップアウトしておりMg1は結合していなかった.Mg1がないと脱リン酸化反応ののちに生じる負電荷を安定できないためホスファターゼ活性は著しく低下することが示唆されていた3).したがって,アルドラーゼ型の構造にはMg1が結合しないためジヒドロキシアセトンリン酸のリン酸基は脱リン化されないものと考えられた.以上のことから,FBPA/Pは酵素活性部位にある3つのループ領域の立体構造をたくみに“変形”させることにより異なる基質結合部位を形成していることが明らかになった.
3.フルクトース-1,6-ビスリン酸アルドラーゼ/ホスファターゼはクラスIフルクトース-1,6-ビスリン酸アルドラーゼと類似した反応機構をもつ
FBPA/Pはどのような分子機構によりアルドラーゼ縮合反応を触媒するのだろうか? 今回,決定したST0318とジヒドロキシアセトンリン酸との複合体の構造と,クラスIフルクトース-1,6-ビスリン酸アルドラーゼであるウサギ筋フルクトース-1,6-ビスリン酸アルドラーゼとジヒドロキシアセトンリン酸との複合体4) の構造(PDB ID:2QUT)との比較から,FBPA/PとクラスIフルクトース-1,6-ビスリン酸アルドラーゼの酵素活性部位のあいだの意外な類似性が明らかになった.注目すべきことに,ST0318とウサギ筋フルクトース-1,6-ビスリン酸アルドラーゼとはまったく異なる全体構造をしているにもかかわらず,この2つの構造においてジヒドロキシアセトンリン酸とシッフ塩基との中間体はよく似た構造をとっていた.クラスIフルクトース-1,6-ビスリン酸アルドラーゼの研究から,アルドラーゼ縮合反応は,脱水反応,カルバニオン形成反応,C3-C4結合形成反応,水和反応,の4つのステップからなり,ウサギ筋フルクトース-1,6-ビスリン酸アルドラーゼではGlu187が酸塩基触媒としてはたらくことが示唆されていた.ST0318とウサギ筋フルクトース-1,6-ビスリン酸アルドラーゼとの構造比較から,ST0318のTyr229とウサギ筋フルクトース-1,6-ビスリン酸アルドラーゼのGlu187とは同様の位置に存在し,Tyr229のもつヒドロキシ基はLys232,ジヒドロキシアセトンリン酸のC2原子とC3原子,および,(重ね合わせたホスファターゼ型の構造における)フルクトース1,6-ビスリン酸のO4原子の近くに位置していることがわかった(図2).Tyr229はFBPA/Pのあいだで高度に保存されており,この残基の変異体ではホスファターゼ活性は保持されていたがアルドラーゼ活性は消失していた.これらの結果から,Tyr229がアルドラーゼ縮合反応における酸塩基触媒であることが示唆された.
アルドラーゼ型とホスファターゼ型との構造比較から,今回,決定した複合体にはふくまれない第2の基質であるグリセルアルデヒド3-リン酸の認識機構も推測できた.アルドラーゼ型の構造の酵素活性部位にはジヒドロキシアセトンリン酸のとなりにグリセルアルデヒド3-リン酸を収容するのに十分な空間があり,アルドラーゼ型の構造においてTyr229およびAsp287と水素結合している2つの水分子は,ホスファターゼ型の構造においてフルクトース1,6-ビスリン酸の4位および5位のヒドロキシ基と同様の位置に存在していた.さらに,ホスファターゼ型の構造においてフルクトース1,6-ビスリン酸の6位のリン酸基を認識している残基(His19,Tyr91,Gln242’,His243’)はアルドラーゼ型の構造においても同様の位置にあった.したがって,グリセルアルデヒド3-リン酸のリン酸基はフルクトース1,6-ビスリン酸の6位のリン酸基と同様に認識され,グリセルアルデヒド3-リン酸のカルボニル基とヒドロキシ基はTyr229とAsp287により認識されることが示唆された.
ジヒドロキシアセトンリン酸とグリセルアルデヒド3-リン酸とが縮合したのちフルクトース1,6-ビスリン酸とシッフ塩基との中間体は加水分解され,シッフ塩基ループが酵素活性部位から離れると同時にAsp233がフリップインすることで,脱リン酸化反応に必須なMg1が酵素に結合するものと考えられた.さらに,LidループとC末端ループが酵素活性部位に近づきフルクトース1,6-ビスリン酸との結合を安定化させることで,フルクトース1,6-ビスリン酸の1位のリン酸基の脱リン酸化反応が触媒されるものと推定された.フルクトース1,6-ビスリン酸の脱リン酸化反応(加水分解反応)に関与する求核性の水分子は,アルドラーゼ型の構造において3つのMg2+(Mg2~Mg4)にかこまれたかたちですでに結合しており,4個目のMg2+(Mg1)の結合がトリガーとなって2段階目の脱リン酸化反応がひき起こされるものと考えられた.
おわりに
原始の環境ではエネルギー源として糖(炭水化物)は希少だったと考えられること,および,FBPA/Pは系統樹の根元の付近に位置する生物のみに存在することから,FBPA/Pは解糖系よりもさきに誕生した原始的な糖新生経路の酵素ではないかと推測されている1).2段階の反応をいちどに触媒できるFBPA/Pは,生合成の観点からも省エネで効率的である.しかし,その巧妙な“変形”の分子機構を目のあたりにすると,はたしてFBPA/Pは本当に原始的な酵素なのだろうかと驚かずにはいられない.
ループやドメインの構造ゆらぎが基質との結合や生成物の解離などの酵素機能に重要であることはこれまでくわしく研究されてきたが,構造ゆらぎと酵素の触媒活性や多機能性との関連についてはほとんどわかっていなかった.筆者らの知るかぎり,今回の研究は,“ひとつの酵素活性部位が2つの反応を触媒する”という分子機構を解明したはじめての報告例であり,酵素機能における構造ゆらぎの新たな重要性を示したものといえる.同一の部位で複数の反応を触媒する未知の酵素がほかにも存在し,これから新たな“真の”二機能性酵素が発見される可能性も考えられる.
今回の研究成果をNature誌に投稿した際,“酵素が変形して2つの反応を触媒する”というコンセプトはまちがいなくおもしろいと思っていたが,その一方で,実験データの少ないシンプルな論文だったためリジェクトされるのではないかという不安もあった.しかし,エディターと3人のレフェリーの反応は想像以上に良好であり,うち2人のレフェリーからは,“The manuscript is short and to the point”,“The authors provided ample data to support a mechanism”と評価された.今回の研究成果は,論文においては主張を支持するのに必要十分なデータを示すことが重要であり,必ずしも膨大なデータが必要なわけではない,ということを示した好例といえる.また,一見すると無関係な研究が結びついて新しい発見が生まれるというサイエンスの醍醐味を体験できたことは本当に幸運だった.
〈追記〉今回の研究には衝撃のラストが待っていた.なんと,FBPA/Pを発見したドイツの研究グループも同様の結晶構造を決定しており,その論文もNature誌に同時に掲載されたのだ5)! 筆者らは,オンライン版の公開日までその論文の存在をまったく知らず,同時掲載の論文があるとは夢にも思っていなかった(論文の公開ののちドイツの研究グループのFuchs博士にメールしたところ,彼らも筆者らの論文を公開日にはじめて知ったとのことだった).ドイツの研究グループも筆者らと同様の結論にいたっており,2つの独立した研究からFBPA/Pの分子機構が確かなものであることが示された.したがって,FBPA/Pをめぐるストーリーは最高のハッピーエンドをむかえたといえる.しかし,ドイツの研究グループは筆者らの3週間前に論文を投稿しており,筆者らの投稿があと数日遅れていたら最高のバッドエンドをむかえていた可能性も考えられた.今回の研究では,サイエンスの楽しさと厳しさの両面をいやというほど体験することとなった.
文 献
- Say, R. F. & Fuchs, G.: Fructose 1,6-bisphosphate aldolase/phosphatase may be an ancestral gluconeogenic enzyme. Nature, 464, 1077-1081 (2010)[PubMed]
- Rashid, N., Imanaka, H., Kanai, T. et al.: A novel candidate for the true fructose-1,6-bisphosphatase in archaea. J. Biol. Chem., 277, 30649-30655 (2002)[PubMed]
- Nishimasu, H., Fushinobu, S., Shoun, H. et al.: The first crystal structure of the novel class of fructose-1,6-bisphosphatase present in thermophilic archaea. Structure, 12, 949-959 (2004)[PubMed]
- St-Jean, M. & Sygusch, J.: Stereospecific proton transfer by a mobile catalyst in mammalian fructose-1,6-bisphosphate aldolase. J. Biol. Chem., 282, 31028-31037 (2007)[PubMed]
- Du, J., Say, R. F., Lu, W. et al.: Active-site remodelling in the bifunctional fructose-1,6-bisphosphate aldolase/phosphatase. Nature, 478, 534-537 (2011)[PubMed]
著者プロフィール
略歴:2007年 東京大学大学院農学生命科学研究科 修了,同年 東京工業大学大学院生命理工学研究科 GCOE特任助教,2008年 東京大学医科学研究所 助教を経て,2010年より東京大学大学院理学系研究科 特任助教.
研究テーマ:非コードRNA,疾患にかかわるタンパク質.
抱負:立体構造から新しいコンセプトを創出していきたい.
伏信 進矢(Shinya Fushinobu)
略歴:1996年 東京大学大学院農学生命科学研究科 修了,1997年 同 助手を経て,2011年より同 准教授.
研究テーマ:酵素およびタンパク質の構造と機能.
抱負:酵素が好きです.みなさんに“おもしろい”と思ってもらえるような研究をしていきたいです.研究対象としては糖やリン酸がからむ反応を触媒する酵素が多いです.
若木 高善(Takayoshi Wakagi)
東京大学大学院農学生命科学研究科 教授.
© 2011 西増弘志・伏信進矢・若木高善 Licensed under CC 表示 2.1 日本