ミエリン塩基性タンパク質の局所発現を介したミエリン化の制御
和気 弘明
(米国NIH National Institute of Child Health and Human Development,Nervous System Development & Plasticity Section)
email:和気弘明
DOI: 10.7875/first.author.2011.131
Control of local protein synthesis and initial events in myelination by action potentials.
Hiroaki Wake, Philip R. Lee, R. Douglas Fields
Science, 333, 1647-1651 (2011)
ミエリンは軸索の周囲に存在し,軸索を何層にもとりまくことにより神経伝導速度を速めることに寄与していることが知られている.しかしながら,これまでこのミエリンの形成は細胞間の認識により起こることが知られていたものの,神経活動に対し依存性があるかどうかについてはあまり知られていなかった.そこで筆者らは,ミエリンを構成するもっとも代表的なタンパク質であるミエリン塩基性タンパク質を可視化することにより,ミエリン化の最初のイベントである軸索の選定がどのように行われているのかを解明した.この研究により,ミエリン化する軸索の選定には,これまでに知られていた細胞種や表面マーカーなどのほか,軸索自体の活動電位もかかわっていることが示された.
ミエリンの形成はオリゴデンドロサイトにより行われ,軸索を髄鞘化することにより神経伝導の速度を50倍にまで速めることができる1).また,この軸索のミエリン化には軸索とオリゴデンドロサイトとのあいだのシグナル伝達が必要であることが知られている2).ミエリンは発達期において特定の軸索の周囲に形成される必要がある.しかしながら,この特定の軸索へのミエリン化が神経活動に対し依存性に起こっているかどうかは知られていない.もし,このミエリン化が神経活動に依存性に起こるのであれば,神経活動に依存して神経伝達速度を速めることができ,脳における情報処理や学習,発達を修飾することができるだろう.
これまで,脊髄後根神経節細胞が神経伝達物質であるATPを非小胞性に放出することが知られている3).そこで筆者らは,神経活動に依存性に放出される非小胞性および小胞性の神経伝達物質に注目し,ミエリンの形成がどのような機序で起こるかを調べた.非小胞性および小胞性の神経伝達物質の放出がオリゴデンドロサイトに及ぼす影響を調べるため,ボツリヌス毒素を用いることで小胞性の神経伝達物質の放出を阻害した.
まず,神経活動に依存して放出される非小胞性および小胞性の神経伝達物質のミエリンに及ぼす影響を検討するため,ボツリヌス毒素で処理したもしくは処理していない脊髄後根神経節細胞を3週間にわたりオリゴデンドロサイトと共培養した.ボツリヌス毒素で処理していない脊髄後根神経節細胞ではミエリンが形成されるのに対し,処理した脊髄後根神経節細胞ではミエリンの形成は阻害されることがわかった.また,ボツリヌス毒素で処理した脊髄後根神経節細胞においてオリゴデンドロサイトの分化の度合いには変化のないことから,非小胞性の神経伝達物質であるATPの放出はそのまわりの細胞全体の分化の度合いの規定に寄与していることが推測された.
そこで,それぞれの神経伝達物質に対するオリゴデンドロサイトの機能的な応答を検討するためCa2+イメージング実験を行った.小胞性の神経伝達物質の放出を阻害することにより,オリゴデンドロサイトの突起におけるCa2+応答が阻害された.非小胞性の神経伝達物質の放出は細胞体においてゆっくりとしたCa2+応答を促し,これによりオリゴデンドロサイト前駆細胞の分化が促進されていることがわかった.遺伝子によりコードされたタンパク質性のCa2+センサーであるGCaMPを用い詳細に検討することにより,オリゴデンドロサイトの突起におけるCa2+応答は神経伝達物質のうちグルタミン酸によりひき起こされていることがわかった.また,このCa2+応答は細胞どうしの広い結合によりひき起こされていた.
これまで,軸索とオリゴデンドロサイトとのあいだにはシナプス様の結合のあることが知られている4).オリゴデンドロサイトにおいて即時性のCa2+応答を起こさせる細胞間の結合を見い出すため,コレステロールリッチドメインのマーカーであるトランスフェリンを利用し,オリゴデンドロサイト前駆細胞においてトランスフェリンのターンオーバーを可視化した.細胞膜におけるトランスフェリンの発現は電気刺激により促進され,グルタミン酸受容体の阻害剤,および,ボツリヌス毒素で処理した脊髄後根神経節細胞との共培養により阻害された.これにより,オリゴデンドロサイト前駆細胞においてコレステロールリッチドメインは刺激に依存性に形成されることがわかった.
小胞性の神経伝達物質の放出による軸索とオリゴデンドロサイト前駆細胞とのあいだの結合の形成について,その機能的な意義を見い出すためミエリン塩基性タンパク質に着目した.これまでの研究により,ミエリン塩基性タンパク質はそのmRNAが合成されたのち,オリゴデンドロサイト前駆細胞に運ばれてそこで局所的に発現することが知られている5).しかしながら,その意義および神経活動に対する依存性については知られていない.そこで,このミエリン塩基性タンパク質の局所発現がどのような分子機構で起こっているのかを調べるため,光照射によりその色を変化させるタンパク質Kikume Green-Redを用い,これにミエリン塩基性タンパク質,もしくは,ミエリン塩基性タンパク質をコードするmRNAの3’側非翻訳領域を結合させたものによりその局所発現を可視化した.ミエリン塩基性タンパク質の局所発現は電気刺激により促進され,ボツリヌス毒素により処理した脊髄後根神経節細胞との共培養では抑制されることより,小胞性の神経伝達物質の放出により応答する反応であることがわかった.阻害剤を使用した実験より,この局所発現はNMDA型グルタミン酸受容体および代謝型グルタミン酸受容体に依存することがわかった.さらに,Ca2+イメージングを用いた解析により,NMDA型グルタミン酸受容体および代謝型グルタミン酸受容体はオリゴデンドロサイト前駆細胞の即時性のCa2+応答を担っていることがわかった.
さらに,siRNAを用いたノックダウン解析により,塩基性タンパク質の局所発現にかかわるシグナル伝達において,キナーゼであるFynがコレステロールリッチドメインにおいて活性化される必要のあることがわかった.さらに,このシグナル伝達は軸索において細胞接着分子であるL1 CAMの発現を必要とすることもわかった.L1CAMの細胞膜における発現およびFynの活性化に神経活動に対し依存性があるかどうかを検討するため,刺激の有無のもと細胞膜におけるL1CAMの発現を測定したところ,刺激によりL1CAM発現は増加することがわかった.つぎに,刺激の有無のもとでのFynの活性化を調べるためにリン酸化Fynの量を測定した.その結果,刺激によりリン酸化Fynは増加し,これはボツリヌス毒素により処理した脊髄後根神経節細胞との共培養においては刺激により増加しないことがわかった.
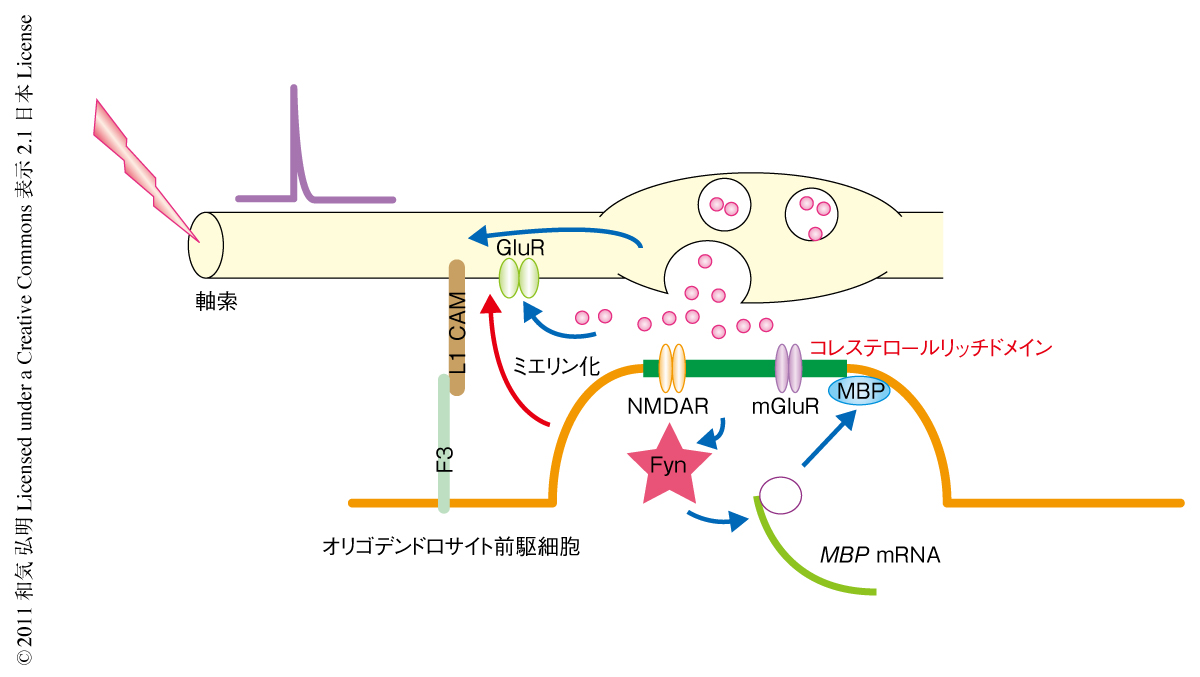
このミエリン塩基性タンパク質の局所発現と,軸索とオリゴデンドロサイト前駆細胞との結合の相関を検討するため,細胞膜におけるトランスフェリンの発現部位とFynの活性化部位を調べたところ,これらは共局在していることがわかった.これより,軸索とオリゴデンドロサイト前駆細胞との結合部位において,Fynが神経活動に対し依存性に活性化され,ミエリン塩基性タンパク質の局所発現を誘導していることがわかった(図1).
以上のことより,ミエリン塩基性タンパク質の局所発現,すなわち,ここではミエリン化を促す最初のイベントは,神経活動に対する依存性があり,軸索はこれらの神経活動電位により優位に選定されていることがわかった.このことより,神経活動電位はミエリンを介し神経回路を修飾できる可能性が示された.
略歴:2007年 名古屋市立大学大学院医学研究科博士課程 修了,同年 生理学研究所CREST研究員を経て,2009年より米国NIH National Institute of Child Health and Human DevelopmentにてVisiting Fellow.
抱負:神経内科の観点からさまざまな研究に取り組んでいます.基礎研究から疾患の治療に役立つような研究のできることをめざしています.
© 2011 和気 弘明 Licensed under CC 表示 2.1 日本
(米国NIH National Institute of Child Health and Human Development,Nervous System Development & Plasticity Section)
email:和気弘明
DOI: 10.7875/first.author.2011.131
Control of local protein synthesis and initial events in myelination by action potentials.
Hiroaki Wake, Philip R. Lee, R. Douglas Fields
Science, 333, 1647-1651 (2011)
要 約
ミエリンは軸索の周囲に存在し,軸索を何層にもとりまくことにより神経伝導速度を速めることに寄与していることが知られている.しかしながら,これまでこのミエリンの形成は細胞間の認識により起こることが知られていたものの,神経活動に対し依存性があるかどうかについてはあまり知られていなかった.そこで筆者らは,ミエリンを構成するもっとも代表的なタンパク質であるミエリン塩基性タンパク質を可視化することにより,ミエリン化の最初のイベントである軸索の選定がどのように行われているのかを解明した.この研究により,ミエリン化する軸索の選定には,これまでに知られていた細胞種や表面マーカーなどのほか,軸索自体の活動電位もかかわっていることが示された.
はじめに
ミエリンの形成はオリゴデンドロサイトにより行われ,軸索を髄鞘化することにより神経伝導の速度を50倍にまで速めることができる1).また,この軸索のミエリン化には軸索とオリゴデンドロサイトとのあいだのシグナル伝達が必要であることが知られている2).ミエリンは発達期において特定の軸索の周囲に形成される必要がある.しかしながら,この特定の軸索へのミエリン化が神経活動に対し依存性に起こっているかどうかは知られていない.もし,このミエリン化が神経活動に依存性に起こるのであれば,神経活動に依存して神経伝達速度を速めることができ,脳における情報処理や学習,発達を修飾することができるだろう.
これまで,脊髄後根神経節細胞が神経伝達物質であるATPを非小胞性に放出することが知られている3).そこで筆者らは,神経活動に依存性に放出される非小胞性および小胞性の神経伝達物質に注目し,ミエリンの形成がどのような機序で起こるかを調べた.非小胞性および小胞性の神経伝達物質の放出がオリゴデンドロサイトに及ぼす影響を調べるため,ボツリヌス毒素を用いることで小胞性の神経伝達物質の放出を阻害した.
1.神経活動に依存して放出される小胞性の神経伝達物質はミエリンの形成に関与する
まず,神経活動に依存して放出される非小胞性および小胞性の神経伝達物質のミエリンに及ぼす影響を検討するため,ボツリヌス毒素で処理したもしくは処理していない脊髄後根神経節細胞を3週間にわたりオリゴデンドロサイトと共培養した.ボツリヌス毒素で処理していない脊髄後根神経節細胞ではミエリンが形成されるのに対し,処理した脊髄後根神経節細胞ではミエリンの形成は阻害されることがわかった.また,ボツリヌス毒素で処理した脊髄後根神経節細胞においてオリゴデンドロサイトの分化の度合いには変化のないことから,非小胞性の神経伝達物質であるATPの放出はそのまわりの細胞全体の分化の度合いの規定に寄与していることが推測された.
2.小胞性の神経伝達物質はオリゴデンドロサイト前駆細胞のCa2+応答に関与する
そこで,それぞれの神経伝達物質に対するオリゴデンドロサイトの機能的な応答を検討するためCa2+イメージング実験を行った.小胞性の神経伝達物質の放出を阻害することにより,オリゴデンドロサイトの突起におけるCa2+応答が阻害された.非小胞性の神経伝達物質の放出は細胞体においてゆっくりとしたCa2+応答を促し,これによりオリゴデンドロサイト前駆細胞の分化が促進されていることがわかった.遺伝子によりコードされたタンパク質性のCa2+センサーであるGCaMPを用い詳細に検討することにより,オリゴデンドロサイトの突起におけるCa2+応答は神経伝達物質のうちグルタミン酸によりひき起こされていることがわかった.また,このCa2+応答は細胞どうしの広い結合によりひき起こされていた.
3.軸索とオリゴデンドロサイトとのあいだの結合
これまで,軸索とオリゴデンドロサイトとのあいだにはシナプス様の結合のあることが知られている4).オリゴデンドロサイトにおいて即時性のCa2+応答を起こさせる細胞間の結合を見い出すため,コレステロールリッチドメインのマーカーであるトランスフェリンを利用し,オリゴデンドロサイト前駆細胞においてトランスフェリンのターンオーバーを可視化した.細胞膜におけるトランスフェリンの発現は電気刺激により促進され,グルタミン酸受容体の阻害剤,および,ボツリヌス毒素で処理した脊髄後根神経節細胞との共培養により阻害された.これにより,オリゴデンドロサイト前駆細胞においてコレステロールリッチドメインは刺激に依存性に形成されることがわかった.
4.ミエリン塩基性タンパク質の局所発現の可視化
小胞性の神経伝達物質の放出による軸索とオリゴデンドロサイト前駆細胞とのあいだの結合の形成について,その機能的な意義を見い出すためミエリン塩基性タンパク質に着目した.これまでの研究により,ミエリン塩基性タンパク質はそのmRNAが合成されたのち,オリゴデンドロサイト前駆細胞に運ばれてそこで局所的に発現することが知られている5).しかしながら,その意義および神経活動に対する依存性については知られていない.そこで,このミエリン塩基性タンパク質の局所発現がどのような分子機構で起こっているのかを調べるため,光照射によりその色を変化させるタンパク質Kikume Green-Redを用い,これにミエリン塩基性タンパク質,もしくは,ミエリン塩基性タンパク質をコードするmRNAの3’側非翻訳領域を結合させたものによりその局所発現を可視化した.ミエリン塩基性タンパク質の局所発現は電気刺激により促進され,ボツリヌス毒素により処理した脊髄後根神経節細胞との共培養では抑制されることより,小胞性の神経伝達物質の放出により応答する反応であることがわかった.阻害剤を使用した実験より,この局所発現はNMDA型グルタミン酸受容体および代謝型グルタミン酸受容体に依存することがわかった.さらに,Ca2+イメージングを用いた解析により,NMDA型グルタミン酸受容体および代謝型グルタミン酸受容体はオリゴデンドロサイト前駆細胞の即時性のCa2+応答を担っていることがわかった.
5.ミエリン塩基性タンパク質の局所発現にかかわるシグナル伝達
さらに,siRNAを用いたノックダウン解析により,塩基性タンパク質の局所発現にかかわるシグナル伝達において,キナーゼであるFynがコレステロールリッチドメインにおいて活性化される必要のあることがわかった.さらに,このシグナル伝達は軸索において細胞接着分子であるL1 CAMの発現を必要とすることもわかった.L1CAMの細胞膜における発現およびFynの活性化に神経活動に対し依存性があるかどうかを検討するため,刺激の有無のもと細胞膜におけるL1CAMの発現を測定したところ,刺激によりL1CAM発現は増加することがわかった.つぎに,刺激の有無のもとでのFynの活性化を調べるためにリン酸化Fynの量を測定した.その結果,刺激によりリン酸化Fynは増加し,これはボツリヌス毒素により処理した脊髄後根神経節細胞との共培養においては刺激により増加しないことがわかった.
6.ミエリン塩基性タンパク質の局所発現の誘導
このミエリン塩基性タンパク質の局所発現と,軸索とオリゴデンドロサイト前駆細胞との結合の相関を検討するため,細胞膜におけるトランスフェリンの発現部位とFynの活性化部位を調べたところ,これらは共局在していることがわかった.これより,軸索とオリゴデンドロサイト前駆細胞との結合部位において,Fynが神経活動に対し依存性に活性化され,ミエリン塩基性タンパク質の局所発現を誘導していることがわかった(図1).
おわりに
以上のことより,ミエリン塩基性タンパク質の局所発現,すなわち,ここではミエリン化を促す最初のイベントは,神経活動に対する依存性があり,軸索はこれらの神経活動電位により優位に選定されていることがわかった.このことより,神経活動電位はミエリンを介し神経回路を修飾できる可能性が示された.
文 献
- Sanders, F. K. & Whitteridge, D.: Conduction velocity and myelin thickness in regenerating nerve fibres. J. Physiol., 105, 152-174 (1946)[PubMed]
- Nave, K. A.: Myelination and support of axonal integrity by glia. Nature, 468, 244-252 (2010)[PubMed]
- Fields, R. D. & Ni, Y.: Nonsynaptic communication through ATP release from volume-activated anion channels in axons. Sci. Signal., 3, ra73 (2010)[PubMed]
- De Biase, L. M., Nishiyama, A. & Bergles, D. E.: Excitability and synaptic communication within the oligodendrocyte lineage. J. Neurosci., 30, 3600-3611 (2010)[PubMed]
- Laursen, L. S., Chan, C. W. & Ffrench-Constant, C.: Translation of myelin basic protein mRNA in oligodendrocytes is regulated by integrin activation and hnRNP-K. J. Cell Biol., 192, 797-811 (2011)[PubMed]
著者プロフィール
略歴:2007年 名古屋市立大学大学院医学研究科博士課程 修了,同年 生理学研究所CREST研究員を経て,2009年より米国NIH National Institute of Child Health and Human DevelopmentにてVisiting Fellow.
抱負:神経内科の観点からさまざまな研究に取り組んでいます.基礎研究から疾患の治療に役立つような研究のできることをめざしています.
© 2011 和気 弘明 Licensed under CC 表示 2.1 日本