哺乳類のGcmは能動的なDNA脱メチル化によりHes5遺伝子の発現を誘導する
等 誠司
(生理学研究所 分子神経生理部門)
email:等 誠司
DOI: 10.7875/first.author.2011.125
Mammalian Gcm genes induce Hes5 expression by active DNA demethylation and induce neural stem cells.
Seiji Hitoshi, Yugo Ishino, Akhilesh Kumar, Salma Jasmine, Kenji F. Tanaka, Takeshi Kondo, Shigeaki Kato, Toshihiko Hosoya, Yoshiki Hotta, Kazuhiro Ikenaka
Nature Neuroscience, 14, 957-964 (2011)
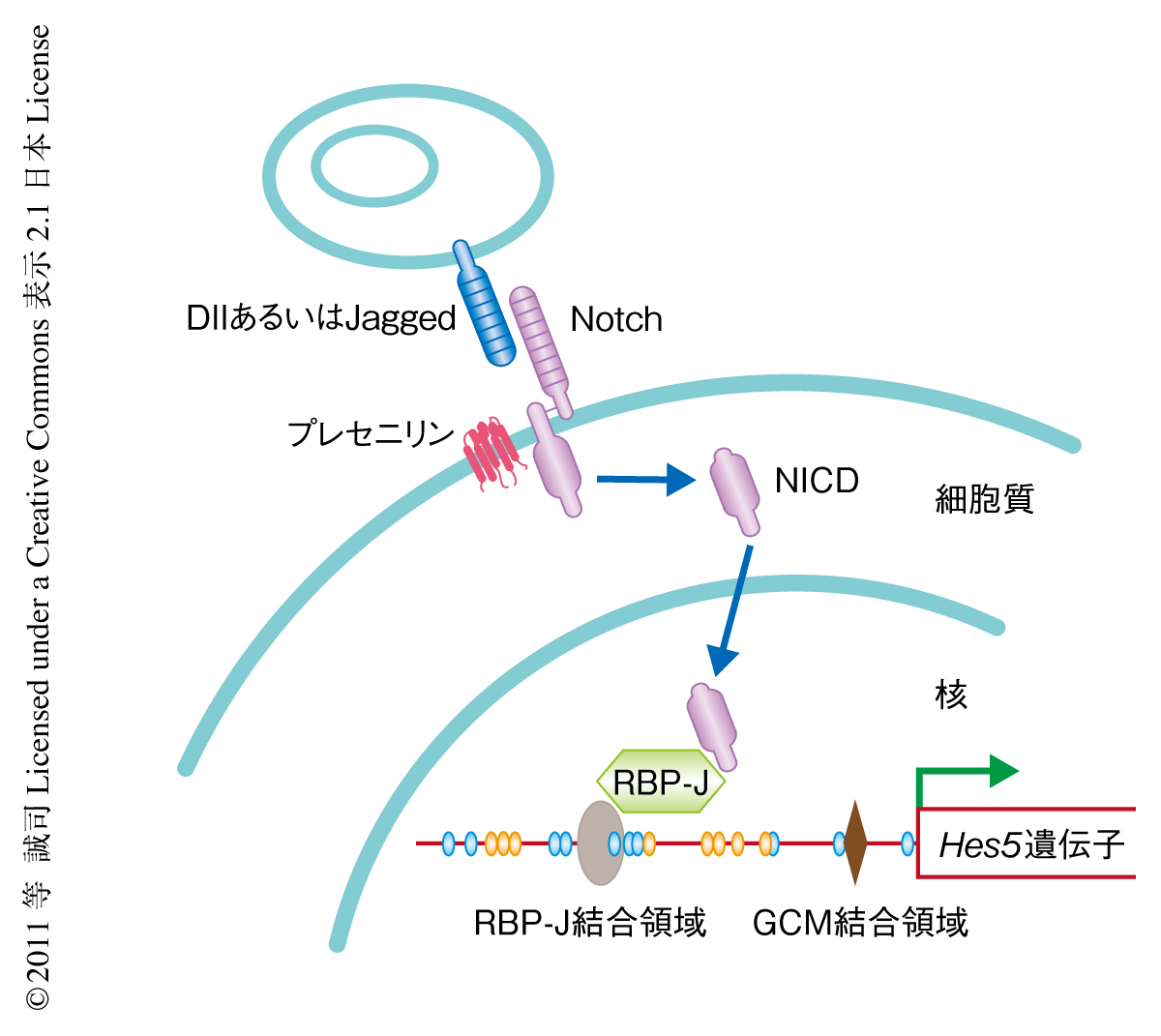
Notchシグナルはさまざまな臓器に存在する組織幹細胞の未分化性を維持するのに必須である.マウスの早期胚の神経管で神経幹細胞の形成される胎生8.5日において,Notchシグナルの標的遺伝子であるHes5遺伝子の発現が誘導されるが,その分子機構は不明であった.今回,筆者らは,Hes5遺伝子の発現誘導はそのプロモーター領域のDNAメチル化により制御されていること,このDNA脱メチル化にGcm1およびGcm2のかかわることを見い出した.Gcm1 Gcm2ダブルノックアウトマウスの胚ではHes5遺伝子のプロモーター領域にDNA脱メチル化が起こらず,野生型マウスの胚ではHes5遺伝子の発現が観察される胎生8.33日の中脳および後脳でも発現は認められなかった.Gcm1およびGcm2によるHes5遺伝子プロモーター領域のDNA脱メチル化は,ゲノム複製を必要としない能動的なDNA脱メチル化であることが示唆された.これらの結果は,Gcm1およびGcm2によるHes5遺伝子プロモーター領域のDNA脱メチル化がNotchシグナルの活性化に先行し,神経幹細胞の形成に重要であることを示していた.
神経幹細胞を含むさまざまなタイプの組織幹細胞では,その未分化性を維持するのにNotchシグナルが重要な役割をはたしている1,2)(図1).FGF2(fibroblast growth factor 2,線維芽細胞増殖因子2)に反応して増殖する神経幹細胞は,マウスでは胎生8.5日ごろにはじめて検出される3).それより早期の胚にはFGF2ではなくLIF(leukemia inhibitory factor,白血病抑制因子)に反応性をもつ未分化神経幹細胞が存在し,筆者らは,LIF反応性の未分化神経幹細胞からFGF2反応性の神経幹細胞への分化の過程でNotchシグナルが活性化されることを報告してきた3).しかし,胎生7.5日の時点において,Notchシグナル経路を構成するタンパク質はHes5を除きすべてが神経系で発現しており,なぜ胎生8.5日になるまでHes5遺伝子の発現が認められないのかは不明であった.このような発現制御を可能にする分子機構のひとつとして,最近,エピジェネティクスが注目を集めている.そこで,マウスの早期胚の神経組織におけるHes5遺伝子の発現誘導においても,エピジェネティクスによる制御が起こっているのではないかと考え研究を行った.
マウスの胎生7.5~9.5日の神経上皮組織を採取し,Hes5遺伝子プロモーター領域のDNAメチル化の状態を調べた.Hes5遺伝子のプロモーター領域にはNotchシグナルをRBP-Jを介してうけとるRBP-J結合領域があり,その周囲にはCpGアイランドが存在する(図1).そのなかのいくつかのCpG配列がDNAメチル化修飾をうけ,胎生7.5日の神経組織では20%以上がDNAメチル化されているが,胎生9.5日までにはこれらは完全にDNA脱メチル化されることが判明した.この結果は,Hes5遺伝子プロモーター領域のDNA脱メチル化にともない胎生8.5日からHes5遺伝子の発現が認められるというこれまでの観察結果と一致した.培養細胞を利用したクロマチン免疫沈降アッセイの結果から,Hes5遺伝子プロモーター領域がDNAメチル化されると,DNAメチル化自体による転写抑制とともに,RBP-J結合領域にRBP-Jが結合できなくなることによりNotchシグナルがうけとれなくなることが示唆された.
Hes5遺伝子プロモーター領域のDNA脱メチル化にかかわるタンパク質を同定するためこの領域に結合しうるタンパク質を検索したところ,RBP-J結合領域の近傍にGCM結合領域4) の存在することを発見した(図1).gcm(glial cells missing)遺伝子はショウジョウバエにおいて最初に同定された遺伝子で,その機能喪失変異体では神経前駆細胞から分化してくるはずのグリア細胞(glial cell)が消失(missing)するという表現型を示し,神経細胞とグリア細胞との運命決定のスイッチをつかさどるものと考えられていた5).しかし,ショウジョウバエでの劇的な表現型と重要な役割にもかかわらず,哺乳類でのホモログ(Gcm1とGcm2がある)の機能はよくわかっていなかった.
筆者らは,Gcmのノックアウトマウスを作製して解析を行ってきたが,Gcm1 Gcm2ダブルノックアウトマウスの胚は胎生早期に致死となるため,中枢神経系の構築やグリア細胞の発生における機能はよくわからなかった.そこで,Hes5遺伝子の発現が中脳および後脳などで観察される胎生8.33日の神経上皮組織を採取し,Hes5遺伝子プロモーター領域のDNAメチル化の状態を調べたところ,Gcm1 Gcm2ダブルノックアウトマウスの胚では高いDNAメチル化状態を維持していることがわかった.そのことにより,胎生8.33日のGcm1 Gcm2ダブルノックアウトマウスの胚ではHes5遺伝子の発現がまったく認められなかった.これまでの筆者らの結果から,Hes5遺伝子の発現誘導が起こらないと神経幹細胞も十分に形成されないことが予想された.Gcm1 Gcm2ダブルノックアウトマウスの胚が胎生8.5~9.0日のあいだに致死になることから神経幹細胞の形成を直接的に検証することはできなかったが,胎生7.5日からの培養において神経幹細胞を誘導する実験を行ったところ,Gcm1 Gcm2ダブルノックアウトマウスの胚からの神経幹細胞の誘導は著しく障害されていた.
GcmがHes5遺伝子プロモーター領域のDNA脱メチル化にかかわることをさらに検証するため,マウス線維芽細胞STO細胞にGcm1およびGcm2を強制発現させ,Hes5遺伝子プロモーター領域のDNAメチル化の状態を検討した.STO細胞ではHes5遺伝子プロモーター領域は高度にDNAメチル化されており,RBP-Jがリクルートされないため活性型Notchを導入してもHes5遺伝子の発現は認められない.しかし,Gcm1およびGcm2を強制発現させるとDNAメチル化が低下しNotchシグナルがうけとれる状態となった.
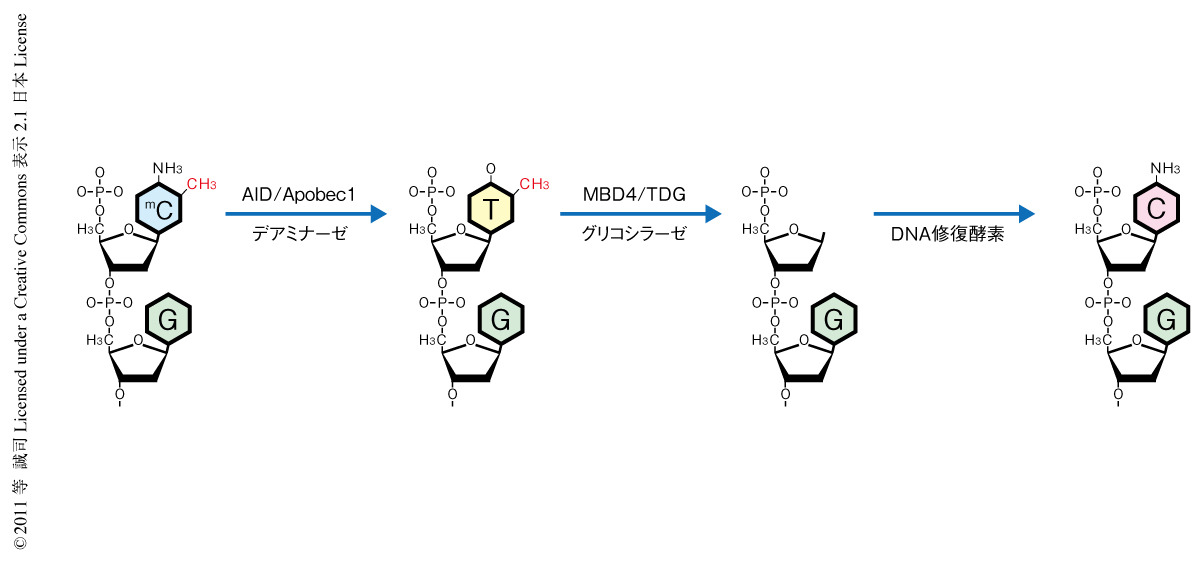
DNA脱メチル化には2つのモードが知られている.そのうちのひとつ受動的なDNA脱メチル化はゲノムの複製に依存して起こるものである.細胞分裂の際にゲノムが複製されると,新規に生合成されたDNA鎖は当初はメチル化されていないが,DNAメチルトランスフェラーゼDnmt1のはたらきにより鋳型となったDNA鎖のメチル化の状態を反映してすみやかにDNAメチル化されていく.ここで,Dnmt1のはたらきが抑制されると新規に生合成されたDNA鎖のメチル化は低下するため,数回の細胞分裂ののちにDNAは脱メチル化された状態になる.一方,能動的なDNA脱メチル化はゲノムの複製なしに起こるもので,その実体には不明な点が多い6).現在,提唱されている有力なモデルのひとつは,メチルシトシンがAID/Apobec1などのデアミナーゼの作用でチミンに変換され,その結果,相補DNA鎖とG::Tミスマッチ状態になる.このミスマッチのチミンがMBD4やTDGのはたらきで除去され,DNA修復機能によりもとのシトシンになることでDNAが脱メチル化されるという説である(図2).しかし,すべての能動的なDNA脱メチル化がこの分子機構で起こっているのか,ほかの分子機構があるのかはわかっていない.
GcmによるHes5遺伝子プロモーター領域のDNA脱メチル化が能動的な脱メチル化なのか受動的な脱メチル化なのかを調べるため,マイトマイシンC処理により細胞分裂を停止させたSTO細胞においてGcm1およびGcm2を強制発現させたところ,Hes5遺伝子プロモーター領域のDNAメチル化は有意に低下していた.さらに,胎生7.5日において採取した培養神経組織でも,Hes5遺伝子プロモーター領域のDNA脱メチル化は細胞分裂を必要としないこと,このDNA脱メチル化がGcm2ノックアウトマウスの胚では減弱していることを確認した.これらの結果は,Gcm(とくに,Gcm2)が能動的なDNA脱メチル化に関与することを強く支持するものであった.
近年,神経発生において,神経幹細胞の増殖や維持,あるいは,神経細胞やグリア細胞への分化の運命決定などの場面で,エピジェネティクスによる制御が重要な役割を演じていることがわかってきた.さらに,成体の脳においても,エピジェネティクスによる制御がその高次機能や気分あるいは情動の調節にかかわっている可能性が高い.とくに,DNAのメチル化および脱メチル化はこれまで考えられてきた以上にダイナミックにはたらいていると予想され,能動的なDNA脱メチル化はその一翼を担っているものと考えられる.
今後は,Gcmによる能動的なDNA脱メチル化が,Hes5遺伝子プロモーター領域に特異的にはたらいているのか,あるいは,ほかの遺伝子プロモーターでも起こっている現象なのかを調べていく必要がある.また,Gcmがどのような分子機構でDNAを脱メチル化するのか,さらに詳細に検討する予定である.この研究が,中枢神経組織で起こっているエピジェネティクスによる制御と脳の機能との関係を解き明かす出発点となることを期待している.
略歴:1997年 東京大学大学院医学系研究科博士課程 修了,理化学研究所国際フロンティア研究システム 基礎科学特別研究員,1999年 カナダToronto大学,東京大学医学部附属病院 助手を経て,2003年より生理学研究所 准教授.
研究テーマ:神経幹細胞にまつわるすべての現象.
抱負:障害をうけた脳の修復および再生を遠いゴールにおいた基礎研究をしたい.
© 2011 等 誠司 Licensed under CC 表示 2.1 日本
(生理学研究所 分子神経生理部門)
email:等 誠司
DOI: 10.7875/first.author.2011.125
Mammalian Gcm genes induce Hes5 expression by active DNA demethylation and induce neural stem cells.
Seiji Hitoshi, Yugo Ishino, Akhilesh Kumar, Salma Jasmine, Kenji F. Tanaka, Takeshi Kondo, Shigeaki Kato, Toshihiko Hosoya, Yoshiki Hotta, Kazuhiro Ikenaka
Nature Neuroscience, 14, 957-964 (2011)
要 約
Notchシグナルはさまざまな臓器に存在する組織幹細胞の未分化性を維持するのに必須である.マウスの早期胚の神経管で神経幹細胞の形成される胎生8.5日において,Notchシグナルの標的遺伝子であるHes5遺伝子の発現が誘導されるが,その分子機構は不明であった.今回,筆者らは,Hes5遺伝子の発現誘導はそのプロモーター領域のDNAメチル化により制御されていること,このDNA脱メチル化にGcm1およびGcm2のかかわることを見い出した.Gcm1 Gcm2ダブルノックアウトマウスの胚ではHes5遺伝子のプロモーター領域にDNA脱メチル化が起こらず,野生型マウスの胚ではHes5遺伝子の発現が観察される胎生8.33日の中脳および後脳でも発現は認められなかった.Gcm1およびGcm2によるHes5遺伝子プロモーター領域のDNA脱メチル化は,ゲノム複製を必要としない能動的なDNA脱メチル化であることが示唆された.これらの結果は,Gcm1およびGcm2によるHes5遺伝子プロモーター領域のDNA脱メチル化がNotchシグナルの活性化に先行し,神経幹細胞の形成に重要であることを示していた.
はじめに
神経幹細胞を含むさまざまなタイプの組織幹細胞では,その未分化性を維持するのにNotchシグナルが重要な役割をはたしている1,2)(図1).FGF2(fibroblast growth factor 2,線維芽細胞増殖因子2)に反応して増殖する神経幹細胞は,マウスでは胎生8.5日ごろにはじめて検出される3).それより早期の胚にはFGF2ではなくLIF(leukemia inhibitory factor,白血病抑制因子)に反応性をもつ未分化神経幹細胞が存在し,筆者らは,LIF反応性の未分化神経幹細胞からFGF2反応性の神経幹細胞への分化の過程でNotchシグナルが活性化されることを報告してきた3).しかし,胎生7.5日の時点において,Notchシグナル経路を構成するタンパク質はHes5を除きすべてが神経系で発現しており,なぜ胎生8.5日になるまでHes5遺伝子の発現が認められないのかは不明であった.このような発現制御を可能にする分子機構のひとつとして,最近,エピジェネティクスが注目を集めている.そこで,マウスの早期胚の神経組織におけるHes5遺伝子の発現誘導においても,エピジェネティクスによる制御が起こっているのではないかと考え研究を行った.
1.マウスの早期胚の神経組織においてHes5遺伝子プロモーター領域はエピジェネティクスによる制御をうけている
マウスの胎生7.5~9.5日の神経上皮組織を採取し,Hes5遺伝子プロモーター領域のDNAメチル化の状態を調べた.Hes5遺伝子のプロモーター領域にはNotchシグナルをRBP-Jを介してうけとるRBP-J結合領域があり,その周囲にはCpGアイランドが存在する(図1).そのなかのいくつかのCpG配列がDNAメチル化修飾をうけ,胎生7.5日の神経組織では20%以上がDNAメチル化されているが,胎生9.5日までにはこれらは完全にDNA脱メチル化されることが判明した.この結果は,Hes5遺伝子プロモーター領域のDNA脱メチル化にともない胎生8.5日からHes5遺伝子の発現が認められるというこれまでの観察結果と一致した.培養細胞を利用したクロマチン免疫沈降アッセイの結果から,Hes5遺伝子プロモーター領域がDNAメチル化されると,DNAメチル化自体による転写抑制とともに,RBP-J結合領域にRBP-Jが結合できなくなることによりNotchシグナルがうけとれなくなることが示唆された.
2.Hes5遺伝子プロモーター領域のDNA脱メチル化にGcmが関与する
Hes5遺伝子プロモーター領域のDNA脱メチル化にかかわるタンパク質を同定するためこの領域に結合しうるタンパク質を検索したところ,RBP-J結合領域の近傍にGCM結合領域4) の存在することを発見した(図1).gcm(glial cells missing)遺伝子はショウジョウバエにおいて最初に同定された遺伝子で,その機能喪失変異体では神経前駆細胞から分化してくるはずのグリア細胞(glial cell)が消失(missing)するという表現型を示し,神経細胞とグリア細胞との運命決定のスイッチをつかさどるものと考えられていた5).しかし,ショウジョウバエでの劇的な表現型と重要な役割にもかかわらず,哺乳類でのホモログ(Gcm1とGcm2がある)の機能はよくわかっていなかった.
筆者らは,Gcmのノックアウトマウスを作製して解析を行ってきたが,Gcm1 Gcm2ダブルノックアウトマウスの胚は胎生早期に致死となるため,中枢神経系の構築やグリア細胞の発生における機能はよくわからなかった.そこで,Hes5遺伝子の発現が中脳および後脳などで観察される胎生8.33日の神経上皮組織を採取し,Hes5遺伝子プロモーター領域のDNAメチル化の状態を調べたところ,Gcm1 Gcm2ダブルノックアウトマウスの胚では高いDNAメチル化状態を維持していることがわかった.そのことにより,胎生8.33日のGcm1 Gcm2ダブルノックアウトマウスの胚ではHes5遺伝子の発現がまったく認められなかった.これまでの筆者らの結果から,Hes5遺伝子の発現誘導が起こらないと神経幹細胞も十分に形成されないことが予想された.Gcm1 Gcm2ダブルノックアウトマウスの胚が胎生8.5~9.0日のあいだに致死になることから神経幹細胞の形成を直接的に検証することはできなかったが,胎生7.5日からの培養において神経幹細胞を誘導する実験を行ったところ,Gcm1 Gcm2ダブルノックアウトマウスの胚からの神経幹細胞の誘導は著しく障害されていた.
3.GcmによるHes5遺伝子プロモーター領域の能動的なDNA脱メチル化
GcmがHes5遺伝子プロモーター領域のDNA脱メチル化にかかわることをさらに検証するため,マウス線維芽細胞STO細胞にGcm1およびGcm2を強制発現させ,Hes5遺伝子プロモーター領域のDNAメチル化の状態を検討した.STO細胞ではHes5遺伝子プロモーター領域は高度にDNAメチル化されており,RBP-Jがリクルートされないため活性型Notchを導入してもHes5遺伝子の発現は認められない.しかし,Gcm1およびGcm2を強制発現させるとDNAメチル化が低下しNotchシグナルがうけとれる状態となった.
DNA脱メチル化には2つのモードが知られている.そのうちのひとつ受動的なDNA脱メチル化はゲノムの複製に依存して起こるものである.細胞分裂の際にゲノムが複製されると,新規に生合成されたDNA鎖は当初はメチル化されていないが,DNAメチルトランスフェラーゼDnmt1のはたらきにより鋳型となったDNA鎖のメチル化の状態を反映してすみやかにDNAメチル化されていく.ここで,Dnmt1のはたらきが抑制されると新規に生合成されたDNA鎖のメチル化は低下するため,数回の細胞分裂ののちにDNAは脱メチル化された状態になる.一方,能動的なDNA脱メチル化はゲノムの複製なしに起こるもので,その実体には不明な点が多い6).現在,提唱されている有力なモデルのひとつは,メチルシトシンがAID/Apobec1などのデアミナーゼの作用でチミンに変換され,その結果,相補DNA鎖とG::Tミスマッチ状態になる.このミスマッチのチミンがMBD4やTDGのはたらきで除去され,DNA修復機能によりもとのシトシンになることでDNAが脱メチル化されるという説である(図2).しかし,すべての能動的なDNA脱メチル化がこの分子機構で起こっているのか,ほかの分子機構があるのかはわかっていない.
GcmによるHes5遺伝子プロモーター領域のDNA脱メチル化が能動的な脱メチル化なのか受動的な脱メチル化なのかを調べるため,マイトマイシンC処理により細胞分裂を停止させたSTO細胞においてGcm1およびGcm2を強制発現させたところ,Hes5遺伝子プロモーター領域のDNAメチル化は有意に低下していた.さらに,胎生7.5日において採取した培養神経組織でも,Hes5遺伝子プロモーター領域のDNA脱メチル化は細胞分裂を必要としないこと,このDNA脱メチル化がGcm2ノックアウトマウスの胚では減弱していることを確認した.これらの結果は,Gcm(とくに,Gcm2)が能動的なDNA脱メチル化に関与することを強く支持するものであった.
おわりに
近年,神経発生において,神経幹細胞の増殖や維持,あるいは,神経細胞やグリア細胞への分化の運命決定などの場面で,エピジェネティクスによる制御が重要な役割を演じていることがわかってきた.さらに,成体の脳においても,エピジェネティクスによる制御がその高次機能や気分あるいは情動の調節にかかわっている可能性が高い.とくに,DNAのメチル化および脱メチル化はこれまで考えられてきた以上にダイナミックにはたらいていると予想され,能動的なDNA脱メチル化はその一翼を担っているものと考えられる.
今後は,Gcmによる能動的なDNA脱メチル化が,Hes5遺伝子プロモーター領域に特異的にはたらいているのか,あるいは,ほかの遺伝子プロモーターでも起こっている現象なのかを調べていく必要がある.また,Gcmがどのような分子機構でDNAを脱メチル化するのか,さらに詳細に検討する予定である.この研究が,中枢神経組織で起こっているエピジェネティクスによる制御と脳の機能との関係を解き明かす出発点となることを期待している.
文 献
- Chiba, S.: Notch signaling in stem cell systems. Stem Cells, 24, 2437-2447 (2006)[PubMed]
- Hitoshi, S., Alexon, T., Tropepe V. et al.: Notch pathway molecules are essential for the maintenance, but not for the generation, of mammalian neural stem cells. Genes Dev., 16, 846-858 (2002)[PubMed]
- Hitoshi, S., Seaberg, R. M., Koscik, C. et al.: Primitive neural stem cells from the mammalian epiblast differentiate to definitive neural stem cells under the control of Notch signaling. Genes Dev., 18, 1806-1811 (2004)[PubMed]
- Schreiber, J., Enderich, J. & Wegner, M.: Structural requirement for DNA binding of GCM proteins. Nucleic Acids Res., 26, 2337-2343 (1998)[PubMed]
- Jones, B. W.: Transcriptional control of glial cell development in Drosophila. Dev. Biol., 278, 265-273 (2005)[PubMed]
- Zhu, J. -K.: Active DNA demethylation mediated by DNA glycosylases. Annu. Rev. Genet., 43, 143-166 (2009)[PubMed]
著者プロフィール
略歴:1997年 東京大学大学院医学系研究科博士課程 修了,理化学研究所国際フロンティア研究システム 基礎科学特別研究員,1999年 カナダToronto大学,東京大学医学部附属病院 助手を経て,2003年より生理学研究所 准教授.
研究テーマ:神経幹細胞にまつわるすべての現象.
抱負:障害をうけた脳の修復および再生を遠いゴールにおいた基礎研究をしたい.
© 2011 等 誠司 Licensed under CC 表示 2.1 日本