社会性アメーバの自己と非自己の認識はtgrB1-tgrC1遺伝子座の配列多型に依存する
廣瀬滋規・Adam Kuspa・Gad Shaulsky
(米国Baylor College of Medicine)
email:廣瀬滋規
DOI: 10.7875/first.author.2011.113
Self-recognition in social amoebae is mediated by allelic pairs of tiger genes.
Shigenori Hirose, Rocio Benabentos, Hsing-I Ho, Adam Kuspa, Gad Shaulsky
Science, 333, 467-470 (2011)
細胞性粘菌は遺伝的な背景の異なる集団のあいだの生存戦略についての良好な研究モデルである.遺伝的な類似性に依存した血縁選択は,潜在的な集団のあいだの対立により起こりうる破滅的な結果を回避し安定した生存戦略を保証する.細胞性粘菌は自己と非自己の認識にもとづいた細胞選別を行い,遺伝的な類似性の低い細胞を非自己として取り除いて血縁選択を具現化する.筆者らは,自己と非自己の認識を担うタンパク質として,免疫グロブリンドメインをもつ膜貫通型タンパク質TgrB1とTgrC1を同定した.これらの遺伝子座には細胞集団のあいだで高頻度の配列多型が観察され,同じ細胞集団に由来する多型をもつtgrB1-tgrC1遺伝子座が相互作用する細胞のあいだに存在することが,自己認識の適合性に必要十分であった.おのおのの集団に由来するTgrB1とTgrC1の組みの結合親和性は,同様に適合する組みのあいだでのみ保証され,細胞のあいだでのTgrB1とTgrC1とのトランス相互作用が機能的な複合体を形成することが示唆された.この現象はもっとも原始的な真核生物における自己と非自己の認識機構であり,この機構の進化的な起源を知る手がかりとなる.
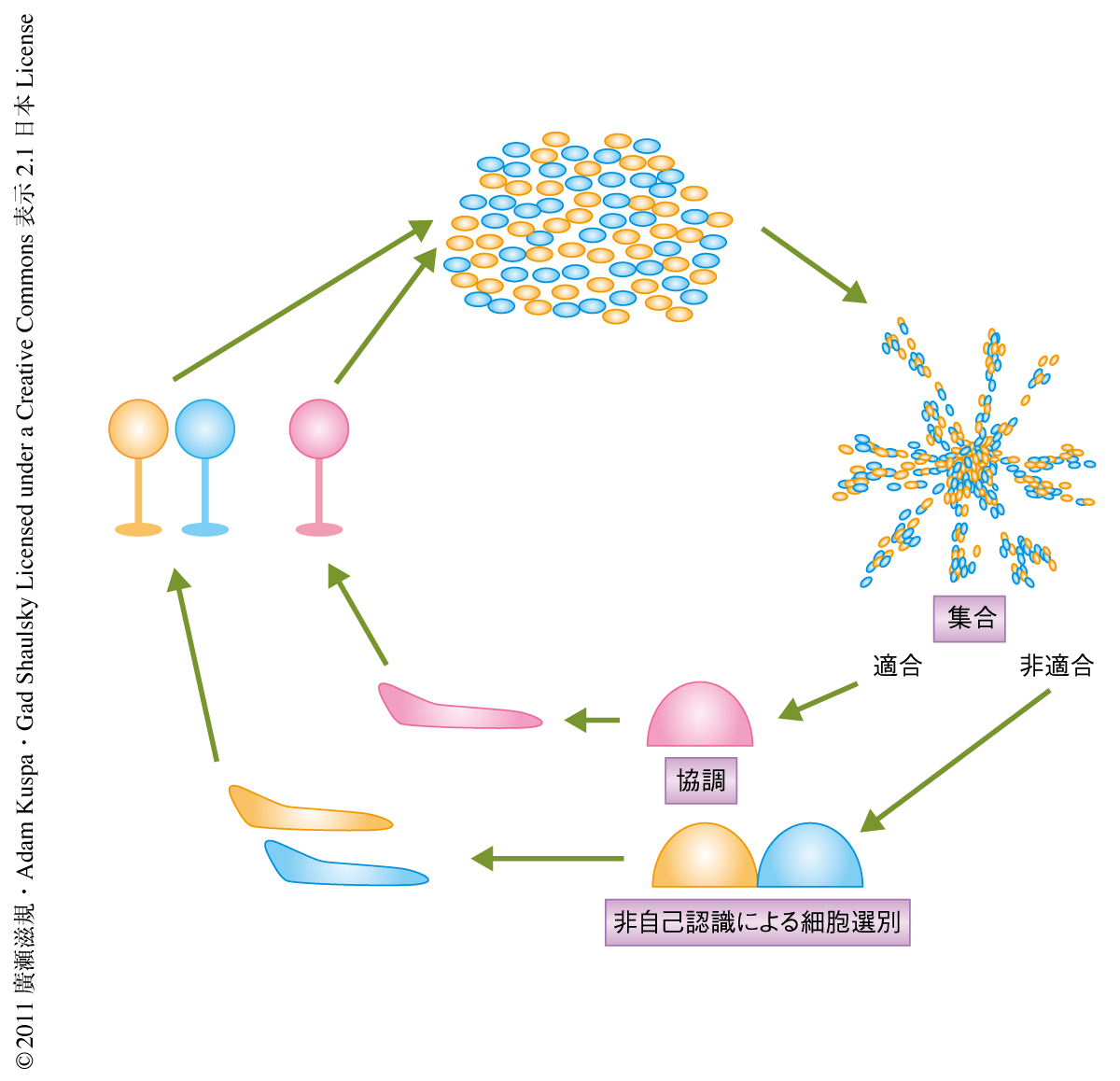
細胞性粘菌(Dictyostelium discoideum)は社会性アメーバともよばれるように非常にユニークな生活環をもつ.自然条件においては土壌に生息し,単細胞アメーバとして細菌を食作用により体内に取り込み分裂することによりその数を増やす.栄養源である細菌が減少してくると飢餓応答によりそのふるまいを切り換え,形態形成を開始して飢餓ストレスに強い胞子に分化し栄養条件が改善するまで休眠する(図1).高等生物における発生は単一の受精卵からはじまり複数回の細胞分裂ののち分化し形態形成が開始する.細胞性粘菌の形態形成システムに特徴的な点は,形態形成に必要な数の細胞の獲得を細胞分裂により達成するのではなく,周辺の細胞の協調的な集合により達成するところにある.この過程においてはそれぞれの細胞のあいだでのcAMPを介した相互コミュニケーションが必要とされる.これが社会性アメーバとよばれるゆえんである.集合により形態形成に必要な量(およそ105細胞)に達した細胞塊はひとつの多細胞体としてのふるまいをはじめる.最初は細胞の塊であったものが予定柄細胞と予定胞子細胞からなるナメクジ状の構造に変化し,さらには球状の胞子塊とそれをささえる柄からなる子実体を形成する.柄は死細胞からなり,胞子に分化した細胞のみが次世代へと遺伝子を残すことができる.それぞれの細胞が胞子と柄のどちらになるのかは細胞のあいだの相互作用により決定される1).
以上が同質の細胞集団における形態形成となるが,異なる遺伝背景をもつ集団が同じ集合塊を形成したときには細胞集団のあいだでより複雑で興味深い競争関係が観察される.さきにも述べたように,細胞性粘菌の形態形成は近隣の細胞の集合により開始するため,遺伝的な背景の異なる細胞の混ざる可能性がつねにある.混入した異細胞は協調した社会的な発生システムにしばしば攪乱をひき起こす.たとえば,cheaterとよばれる細胞は社会的な発生システムにおいて自らを優先的に胞子に分化させほかの細胞を柄に分化させることにより利己的な利益を得て次世代により多くの個体を残そうとする2,3).一方で,cheaterとは逆に遺伝的な類似性の高い個体のあいだでの高い協調性により相互に利益をあたえあう血縁選択(kin selection)も観察され4),遺伝的な類似性の判断は緑髭効果(green beard effect)をもつタンパク質が担う5).
細胞レベルでの血縁選択のひとつの形式と定義できる自己と非自己の認識は,高等生物においては免疫機構として外来生物の感染に対する防衛機構としての役割をもつ.その基本機構は免疫細胞の表面に提示されたMHC(major histocompatibility complex,主要組織適合遺伝子複合体)が非自己のタンパク質を認識することで達成されている6).また,形態形成の過程においても,異なる分化形質を獲得した細胞は自己と非自己の認識により選別されることで特定の機能を担う組織を確立する.
自己と非自己の認識の進化的な起源のひとつは細胞性粘菌の社会的な形態形成システムに見い出すことができる.遺伝的に異なる細胞集団が混合状態で発生を開始した場合,すべての細胞はcAMPへの走化性により協調して集合することができるが,単細胞の集団から多細胞の構造体としてのふるまいをはじめるまえに,おのおのの遺伝的な背景にしたがい空間的に選別される.この現象により細胞集団は遺伝的な背景の異なる細胞の集団が混入する可能性を最小限とすることが可能になり,安定した発生を遂行できる(図1).この現象を担う認識タンパク質は血縁選択における強力な緑髭効果をもつタンパク質であるのと同時に,原始的な自己と非自己の認識タンパク質ともとらえることができる.筆者らは,その同定をめざした.
異なる地域に生息する細胞性粘菌の集団はそれぞれ独自の歴史をもち独立した変異をゲノムに蓄積している.それは集団のあいだでの遺伝子の配列多型(polymorphism)として観察される.免疫反応にかかわる遺伝子には高頻度の配列多型が観察されるので7),細胞性粘菌の自己と非自己の認識にかかわる遺伝子にも高頻度の配列多型が存在すると仮定し,次世代シークエンサーを用いて異なる地域から単離されたおよそ30種類の細胞性粘菌の集団のゲノム配列を解読し比較することで高頻度の配列多型の観察される遺伝子のリストを作成した.また,目的のタンパク質が認識タンパク質として機能するためには細胞膜に局在して細胞外に認識ドメインを提示する必要があり,また,免疫反応にかかわるタンパク質には免疫グロブリンドメインが頻繁に観察されるため,この2つの特徴をもつ遺伝子をリストから検索した結果,tgrB1-tgrC1遺伝子座がうかびあがった.
tgrB1遺伝子とtgrC1遺伝子は1回膜貫通型タンパク質をコードしており,複数の免疫グロブリンドメインを保有していた.この2つの遺伝子の配列多型は細胞外に提示されるN末端側の領域に集中しており,逆に,C末端側の領域には多型はほとんど存在しなかった.この2つの遺伝子はおよそ600 bpのプロモーター領域を共有するかたちでゲノムに存在し,非適合の細胞集団が選別される時期に共発現した.tgrB1遺伝子の欠損株およびtgrC1遺伝子の欠損株はこの時期の形態形成に異常を示し,tgrB1-tgrC1遺伝子座の欠損株は親株を非自己と認識して選別される8).これらの知見をもとに,tgrB1-tgrC1遺伝子座は細胞性粘菌の自己と非自己の認識タンパク質をコードしている可能性が高いと考えその証明を試みた.
さきにも述べたように,それぞれの細胞集団は気の遠くなるような時間をかけて独自の遺伝的な多型を蓄積しており,可能性としてそれらすべてが細胞集団のアイデンティティを定義する要素となりうる.すべてをひとつひとつ調べることは不可能であるため,実験系をくふうして単純化する必要があった.ここで採用したアプローチは遺伝子置換であった.第3染色体にあるtgrB1-tgrC1遺伝子座を取り除きこの場所に別の細胞集団に由来する同じ遺伝子座を挿入した.この一連の操作により得られた株はtgrB1-tgrC1遺伝子座を除いて親株と完全に同一の遺伝子配列をもつことになり,この遺伝子置換体と親株との比較により得られた知見の原因はtgrB1-tgrC1遺伝子座に求められる.親株のtgrB1-tgrC1遺伝子座を除いたのち親株に由来する同じ遺伝子座をもとの部位に再挿入した対照株はすべての実験において親株とまったく同じ表現型を示したため,このアプローチには想定どおりに機能することが確認された.
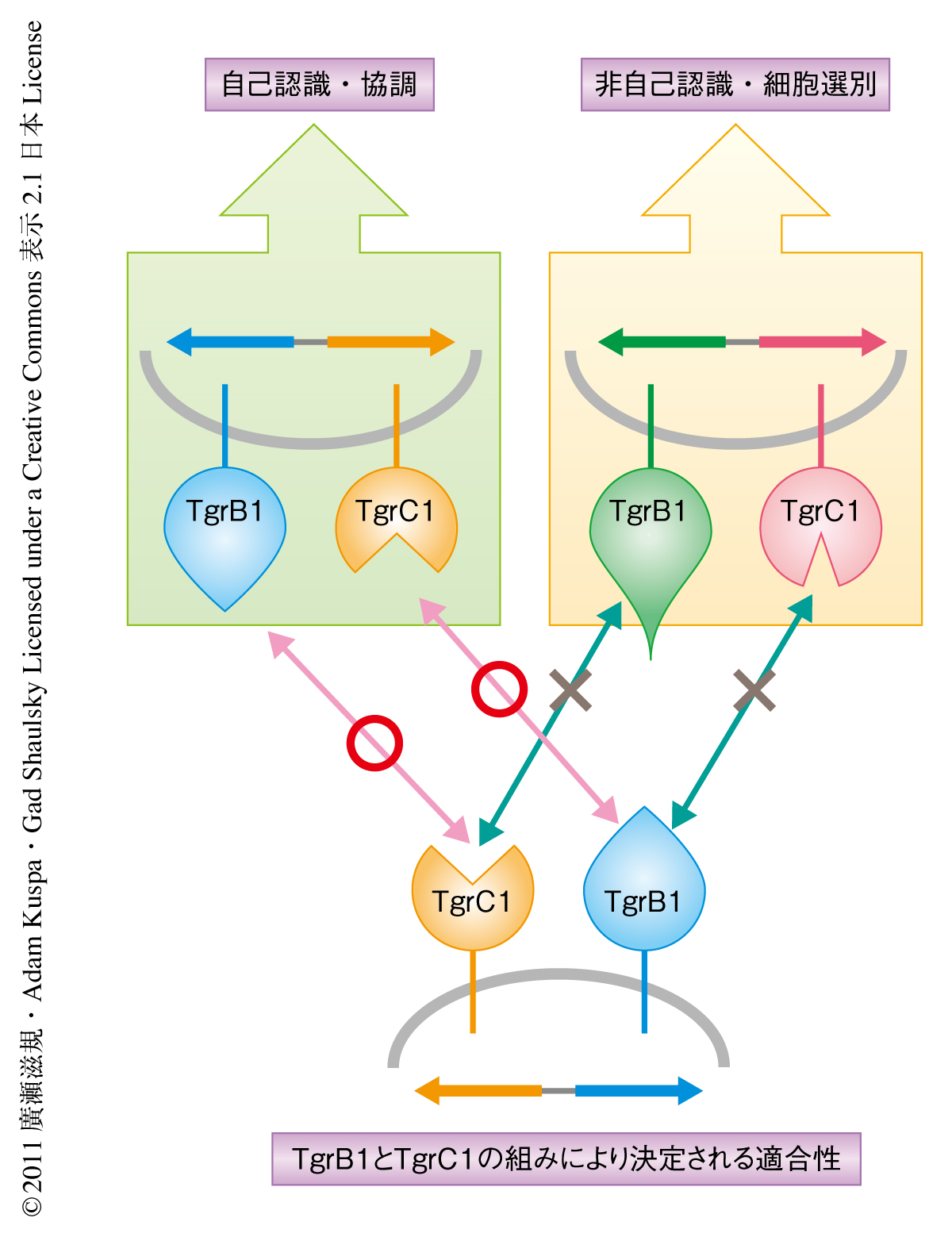
興味深いことに,この遺伝子置換体は正常な発生を遂行できた.調べたかぎりすべての細胞集団に由来するtgrB1-tgrC1遺伝子座は配列多型の種類にかかわらず親株のtgrB1-tgrC1遺伝子座を機能的に補償することが可能であった.自己の認識に異常をもつ細胞性粘菌の株は発生異常を示すことを考えると,この遺伝子置換株は自己を自己と認識することが可能であることが示唆された.一方で,同様の手法で作製されたtgrB1遺伝子のみが置換された1遺伝子置換体,もしくは,tgrC1遺伝子のみが置換された1遺伝子置換体は発生に異常を示したことから,適合するtgrB1遺伝子とtgrC1遺伝子の組みが機能的に必須であった.作製したすべての2遺伝子置換株は親株を非自己と認識して選別した.また,異なるtgrB1-tgrC1遺伝子座をもつ2遺伝子置換株どうしも決して互いを自己と認識することはなかった(図2).この結果は,tgrB1-tgrC1遺伝子座の由来となる細胞集団のあいだでみられた自己と非自己の適合性と一致していた.
別のアプローチとして,配列多型をもつtgrB1-tgrC1遺伝子座を親株の半数体ゲノムに挿入した部分倍数体(merodiploid)を作製した.この部分倍数体はtgrB1-tgrC1遺伝子座を含んだ親株の遺伝的な背景にくわえて,もうひとつの異なる配列多型をもつtgrB1-tgrC1遺伝子座を保有する.部分倍数体はそれぞれの細胞表面に2種類のTgrB1およびTgrC1を発現する.部分倍数体は同じ配列をもつtgrB1-tgrC1遺伝子座を保有するかぎり自己と認識して協調的なふるまいを示す一方,共通のtgrB1-tgrC1遺伝子座をもたない株すべてを非自己と認識して選別した.
これらの結果により,TgrB1とTgrC1とが細胞性粘菌における認識タンパク質の組みであること,かつ,この2つのタンパク質における配列多型が細胞集団のアイデンティティを定義していることが証明された.
TgrB1とTgrC1が自己と非自己の認識タンパク質の組みであることが判明したが,ほかに細胞選別にかかわる認識タンパク質が存在する可能性は否定できなかった.なぜならば,遺伝子置換アプローチにより確認されたのはtgrB1-tgrC1遺伝子座が自己と非自己の認識反応を媒介できるという事実であり,それ以外の遺伝的な多型には第2,第3の認識タンパク質の存在する可能性も考えられたからである.類似の機能をもつ認識タンパク質がほかにもあるとすれば,親株の遺伝的な背景をもつ遺伝子置換株および部分倍数体は同じ型のtgrB1-tgrC1遺伝子座をもつ細胞集団とは適合しない.結論から述べると,この2つの株のあいだにはtgrB1遺伝子とtgrC1遺伝子のほかにも多くの遺伝子に配列多型が存在したにもかかわらず,tgrB1-tgrC1遺伝子座が同じ型であるかぎり遺伝子置換株および部分倍数体は細胞集団と適合した.つまり,細胞性粘菌における自己と非自己の認識反応はTgrB1とTgrC1の組みのみにより制御されていた.
免疫反応にかかわるMHC遺伝子は個体のあいだで高頻度の配列多型が観察され,それにより生じるMHCのアミノ配列の差異により結合する基質への特異性が決定される.適合するTgrB1とTgrC1の組みの配列多型は,同様にタンパク質のあいだの親和性に影響をあたえるものと考えられた.異なるtgrB1-tgrC1遺伝子座を保有する2遺伝子置換体を多細胞の体制を構築するまで発生させたのち,単細胞レベルにまでバラバラにして混ぜ合わせ懸濁条件で振とう培養した.この条件では細胞はそれぞれの細胞接着の親和性に依存して集合塊をつくる.固形培地での集合と異なる点は,懸濁条件において細胞は能動的に移動することはなく,細胞どうしの受動的な衝突により接触が行われることである.そして,接着力が異なる複数の細胞はそれに応じた選別パターンをかたちづくる.それぞれ異なるTgrB1とTgrC1の組みを細胞表面に提示する細胞は,発現する組みにしたがって個別の集合塊を形成し混ざり合うことはなかった.このことから,適合する組みにおける親和性は非適合の組みの親和性に比べ十分に高いことが示唆された.
また,TgrB1とTgrC1の組みの機能がどのような相互作用により保証されているのかを確認した.さきに述べたように,tgrB1遺伝子の1遺伝子置換体またはtgrC1遺伝子の1遺伝子置換体は発生に異常をもつ.しかしながら,同じ細胞集団に由来するtgrB1遺伝子もしくはtgrC1遺伝子をもつ1遺伝子置換体を混合して発生させると表現型の回復がみられた.この株の組合せにおいて1細胞レベルでは非適合tgrB1-tgrC1遺伝子座をもつために自己認識に問題が生じたが,異種細胞のあいだの相互作用により適合するTgrB1とTgrC1との相互作用が保証されていることで細胞のあいだでの機能的な補完が達成されている(図2).この結果から,適合するTgrB1とTgrC1のトランス相互作用によりそれらの下流のシグナル経路の活性化が起こり発生の制御が行われていることも示唆された.
この研究により,細胞性粘菌の自己と非自己の認識を統御する認識タンパク質を同定することができた.細胞性粘菌のゲノムはおよそ23,000の遺伝子を保持し,そのなかには数多くの膜タンパク質の遺伝子および配列多型をもつ遺伝子があるにもかかわらず,驚くべきことにTgrB1とTgrC1の組みの配列多型のみにより細胞集団のアイデンティティが定義されていた.筆者らは,この特徴を利用してこの2つの遺伝子を組み換えるだけで細胞のふるまいを制御することに成功した.現在,脊椎動物を除く自己と非自己の認識タンパク質はホヤ(Botryllus schlosseri)やウミヒドラ(Hydractinia symbiolongicarpus)で報告されており9,10),細胞性粘菌における発見は自己認識機構の進化的な起源としてもっとも原始的なものとなった.
今後の展望としては,異なるtgrB1-tgrC1遺伝子座をもつ集団がほかの集団を非自己と認識して空間的な分離を達成する機構を解明したい.この問題は細胞選別の問題として非常に興味深い.適合するTgrB1とTgrC1の組みの結合親和性が非適合の組みと比べて高くなることによる細胞のあいだの接着性の差異が選別の一因となる可能性は高いが,接着分子をコードする遺伝子の破壊株は親株とは選別されなかったことから,シンプルな細胞接着力のみが細胞選別の原動力となっているわけではないだろう.TgrB1およびTgrC1の下流におけるなんらかの分子機構が能動的な細胞選別を担っている可能性が高い.
細胞選別の機構は多細胞生物の形態形成の過程に欠かすことはできない.分化により特定の形質を獲得した細胞は同質の細胞どうしに選別され機能単位としての組織を確立する.細胞性粘菌の自己と非自己の認識反応は認識タンパク質による細胞選別,および,異質な細胞と同質な細胞とのあいだの非協調と協調による集団としての機能的な確立のすべてをシンプルなかたちで保持している.この研究により,進化の過程において単細胞生物が多細胞体制を獲得していく過程とその必要条件の理解に近づくことができる.
略歴:2004年 東北大学大学院生命科学研究科博士課程 修了,同年 米国California大学San Diego校Postdoctoral Associateを経て,2006年より米国Baylor College of MedicineにてPostdoctoral Associate.
研究テーマ:自己と非自己の認識にもとづいた細胞選別の機構.
関心事:単細胞生物が多細胞体制を確立する必要条件を探索し定義する.
Adam Kuspa
米国Baylor College of MedicineにてVice PresidentおよびProfessor.
Gad Shaulsky
米国Baylor College of MedicineにてProfessor.
© 2011 廣瀬滋規・Adam Kuspa・Gad Shaulsky Licensed under CC 表示 2.1 日本
(米国Baylor College of Medicine)
email:廣瀬滋規
DOI: 10.7875/first.author.2011.113
Self-recognition in social amoebae is mediated by allelic pairs of tiger genes.
Shigenori Hirose, Rocio Benabentos, Hsing-I Ho, Adam Kuspa, Gad Shaulsky
Science, 333, 467-470 (2011)
要 約
細胞性粘菌は遺伝的な背景の異なる集団のあいだの生存戦略についての良好な研究モデルである.遺伝的な類似性に依存した血縁選択は,潜在的な集団のあいだの対立により起こりうる破滅的な結果を回避し安定した生存戦略を保証する.細胞性粘菌は自己と非自己の認識にもとづいた細胞選別を行い,遺伝的な類似性の低い細胞を非自己として取り除いて血縁選択を具現化する.筆者らは,自己と非自己の認識を担うタンパク質として,免疫グロブリンドメインをもつ膜貫通型タンパク質TgrB1とTgrC1を同定した.これらの遺伝子座には細胞集団のあいだで高頻度の配列多型が観察され,同じ細胞集団に由来する多型をもつtgrB1-tgrC1遺伝子座が相互作用する細胞のあいだに存在することが,自己認識の適合性に必要十分であった.おのおのの集団に由来するTgrB1とTgrC1の組みの結合親和性は,同様に適合する組みのあいだでのみ保証され,細胞のあいだでのTgrB1とTgrC1とのトランス相互作用が機能的な複合体を形成することが示唆された.この現象はもっとも原始的な真核生物における自己と非自己の認識機構であり,この機構の進化的な起源を知る手がかりとなる.
はじめに
細胞性粘菌(Dictyostelium discoideum)は社会性アメーバともよばれるように非常にユニークな生活環をもつ.自然条件においては土壌に生息し,単細胞アメーバとして細菌を食作用により体内に取り込み分裂することによりその数を増やす.栄養源である細菌が減少してくると飢餓応答によりそのふるまいを切り換え,形態形成を開始して飢餓ストレスに強い胞子に分化し栄養条件が改善するまで休眠する(図1).高等生物における発生は単一の受精卵からはじまり複数回の細胞分裂ののち分化し形態形成が開始する.細胞性粘菌の形態形成システムに特徴的な点は,形態形成に必要な数の細胞の獲得を細胞分裂により達成するのではなく,周辺の細胞の協調的な集合により達成するところにある.この過程においてはそれぞれの細胞のあいだでのcAMPを介した相互コミュニケーションが必要とされる.これが社会性アメーバとよばれるゆえんである.集合により形態形成に必要な量(およそ105細胞)に達した細胞塊はひとつの多細胞体としてのふるまいをはじめる.最初は細胞の塊であったものが予定柄細胞と予定胞子細胞からなるナメクジ状の構造に変化し,さらには球状の胞子塊とそれをささえる柄からなる子実体を形成する.柄は死細胞からなり,胞子に分化した細胞のみが次世代へと遺伝子を残すことができる.それぞれの細胞が胞子と柄のどちらになるのかは細胞のあいだの相互作用により決定される1).
以上が同質の細胞集団における形態形成となるが,異なる遺伝背景をもつ集団が同じ集合塊を形成したときには細胞集団のあいだでより複雑で興味深い競争関係が観察される.さきにも述べたように,細胞性粘菌の形態形成は近隣の細胞の集合により開始するため,遺伝的な背景の異なる細胞の混ざる可能性がつねにある.混入した異細胞は協調した社会的な発生システムにしばしば攪乱をひき起こす.たとえば,cheaterとよばれる細胞は社会的な発生システムにおいて自らを優先的に胞子に分化させほかの細胞を柄に分化させることにより利己的な利益を得て次世代により多くの個体を残そうとする2,3).一方で,cheaterとは逆に遺伝的な類似性の高い個体のあいだでの高い協調性により相互に利益をあたえあう血縁選択(kin selection)も観察され4),遺伝的な類似性の判断は緑髭効果(green beard effect)をもつタンパク質が担う5).
細胞レベルでの血縁選択のひとつの形式と定義できる自己と非自己の認識は,高等生物においては免疫機構として外来生物の感染に対する防衛機構としての役割をもつ.その基本機構は免疫細胞の表面に提示されたMHC(major histocompatibility complex,主要組織適合遺伝子複合体)が非自己のタンパク質を認識することで達成されている6).また,形態形成の過程においても,異なる分化形質を獲得した細胞は自己と非自己の認識により選別されることで特定の機能を担う組織を確立する.
自己と非自己の認識の進化的な起源のひとつは細胞性粘菌の社会的な形態形成システムに見い出すことができる.遺伝的に異なる細胞集団が混合状態で発生を開始した場合,すべての細胞はcAMPへの走化性により協調して集合することができるが,単細胞の集団から多細胞の構造体としてのふるまいをはじめるまえに,おのおのの遺伝的な背景にしたがい空間的に選別される.この現象により細胞集団は遺伝的な背景の異なる細胞の集団が混入する可能性を最小限とすることが可能になり,安定した発生を遂行できる(図1).この現象を担う認識タンパク質は血縁選択における強力な緑髭効果をもつタンパク質であるのと同時に,原始的な自己と非自己の認識タンパク質ともとらえることができる.筆者らは,その同定をめざした.
1.TgrB1とTgrC1の配列多型
異なる地域に生息する細胞性粘菌の集団はそれぞれ独自の歴史をもち独立した変異をゲノムに蓄積している.それは集団のあいだでの遺伝子の配列多型(polymorphism)として観察される.免疫反応にかかわる遺伝子には高頻度の配列多型が観察されるので7),細胞性粘菌の自己と非自己の認識にかかわる遺伝子にも高頻度の配列多型が存在すると仮定し,次世代シークエンサーを用いて異なる地域から単離されたおよそ30種類の細胞性粘菌の集団のゲノム配列を解読し比較することで高頻度の配列多型の観察される遺伝子のリストを作成した.また,目的のタンパク質が認識タンパク質として機能するためには細胞膜に局在して細胞外に認識ドメインを提示する必要があり,また,免疫反応にかかわるタンパク質には免疫グロブリンドメインが頻繁に観察されるため,この2つの特徴をもつ遺伝子をリストから検索した結果,tgrB1-tgrC1遺伝子座がうかびあがった.
tgrB1遺伝子とtgrC1遺伝子は1回膜貫通型タンパク質をコードしており,複数の免疫グロブリンドメインを保有していた.この2つの遺伝子の配列多型は細胞外に提示されるN末端側の領域に集中しており,逆に,C末端側の領域には多型はほとんど存在しなかった.この2つの遺伝子はおよそ600 bpのプロモーター領域を共有するかたちでゲノムに存在し,非適合の細胞集団が選別される時期に共発現した.tgrB1遺伝子の欠損株およびtgrC1遺伝子の欠損株はこの時期の形態形成に異常を示し,tgrB1-tgrC1遺伝子座の欠損株は親株を非自己と認識して選別される8).これらの知見をもとに,tgrB1-tgrC1遺伝子座は細胞性粘菌の自己と非自己の認識タンパク質をコードしている可能性が高いと考えその証明を試みた.
2.TgrB1とTgrC1が自己と非自己の認識タンパク質であることの証明
さきにも述べたように,それぞれの細胞集団は気の遠くなるような時間をかけて独自の遺伝的な多型を蓄積しており,可能性としてそれらすべてが細胞集団のアイデンティティを定義する要素となりうる.すべてをひとつひとつ調べることは不可能であるため,実験系をくふうして単純化する必要があった.ここで採用したアプローチは遺伝子置換であった.第3染色体にあるtgrB1-tgrC1遺伝子座を取り除きこの場所に別の細胞集団に由来する同じ遺伝子座を挿入した.この一連の操作により得られた株はtgrB1-tgrC1遺伝子座を除いて親株と完全に同一の遺伝子配列をもつことになり,この遺伝子置換体と親株との比較により得られた知見の原因はtgrB1-tgrC1遺伝子座に求められる.親株のtgrB1-tgrC1遺伝子座を除いたのち親株に由来する同じ遺伝子座をもとの部位に再挿入した対照株はすべての実験において親株とまったく同じ表現型を示したため,このアプローチには想定どおりに機能することが確認された.
興味深いことに,この遺伝子置換体は正常な発生を遂行できた.調べたかぎりすべての細胞集団に由来するtgrB1-tgrC1遺伝子座は配列多型の種類にかかわらず親株のtgrB1-tgrC1遺伝子座を機能的に補償することが可能であった.自己の認識に異常をもつ細胞性粘菌の株は発生異常を示すことを考えると,この遺伝子置換株は自己を自己と認識することが可能であることが示唆された.一方で,同様の手法で作製されたtgrB1遺伝子のみが置換された1遺伝子置換体,もしくは,tgrC1遺伝子のみが置換された1遺伝子置換体は発生に異常を示したことから,適合するtgrB1遺伝子とtgrC1遺伝子の組みが機能的に必須であった.作製したすべての2遺伝子置換株は親株を非自己と認識して選別した.また,異なるtgrB1-tgrC1遺伝子座をもつ2遺伝子置換株どうしも決して互いを自己と認識することはなかった(図2).この結果は,tgrB1-tgrC1遺伝子座の由来となる細胞集団のあいだでみられた自己と非自己の適合性と一致していた.
別のアプローチとして,配列多型をもつtgrB1-tgrC1遺伝子座を親株の半数体ゲノムに挿入した部分倍数体(merodiploid)を作製した.この部分倍数体はtgrB1-tgrC1遺伝子座を含んだ親株の遺伝的な背景にくわえて,もうひとつの異なる配列多型をもつtgrB1-tgrC1遺伝子座を保有する.部分倍数体はそれぞれの細胞表面に2種類のTgrB1およびTgrC1を発現する.部分倍数体は同じ配列をもつtgrB1-tgrC1遺伝子座を保有するかぎり自己と認識して協調的なふるまいを示す一方,共通のtgrB1-tgrC1遺伝子座をもたない株すべてを非自己と認識して選別した.
これらの結果により,TgrB1とTgrC1とが細胞性粘菌における認識タンパク質の組みであること,かつ,この2つのタンパク質における配列多型が細胞集団のアイデンティティを定義していることが証明された.
3.自己と非自己の認識反応はtgrB1-tgrC1遺伝子座のみに依存する
TgrB1とTgrC1が自己と非自己の認識タンパク質の組みであることが判明したが,ほかに細胞選別にかかわる認識タンパク質が存在する可能性は否定できなかった.なぜならば,遺伝子置換アプローチにより確認されたのはtgrB1-tgrC1遺伝子座が自己と非自己の認識反応を媒介できるという事実であり,それ以外の遺伝的な多型には第2,第3の認識タンパク質の存在する可能性も考えられたからである.類似の機能をもつ認識タンパク質がほかにもあるとすれば,親株の遺伝的な背景をもつ遺伝子置換株および部分倍数体は同じ型のtgrB1-tgrC1遺伝子座をもつ細胞集団とは適合しない.結論から述べると,この2つの株のあいだにはtgrB1遺伝子とtgrC1遺伝子のほかにも多くの遺伝子に配列多型が存在したにもかかわらず,tgrB1-tgrC1遺伝子座が同じ型であるかぎり遺伝子置換株および部分倍数体は細胞集団と適合した.つまり,細胞性粘菌における自己と非自己の認識反応はTgrB1とTgrC1の組みのみにより制御されていた.
4.配列多型による特異性の決定と機能単位
免疫反応にかかわるMHC遺伝子は個体のあいだで高頻度の配列多型が観察され,それにより生じるMHCのアミノ配列の差異により結合する基質への特異性が決定される.適合するTgrB1とTgrC1の組みの配列多型は,同様にタンパク質のあいだの親和性に影響をあたえるものと考えられた.異なるtgrB1-tgrC1遺伝子座を保有する2遺伝子置換体を多細胞の体制を構築するまで発生させたのち,単細胞レベルにまでバラバラにして混ぜ合わせ懸濁条件で振とう培養した.この条件では細胞はそれぞれの細胞接着の親和性に依存して集合塊をつくる.固形培地での集合と異なる点は,懸濁条件において細胞は能動的に移動することはなく,細胞どうしの受動的な衝突により接触が行われることである.そして,接着力が異なる複数の細胞はそれに応じた選別パターンをかたちづくる.それぞれ異なるTgrB1とTgrC1の組みを細胞表面に提示する細胞は,発現する組みにしたがって個別の集合塊を形成し混ざり合うことはなかった.このことから,適合する組みにおける親和性は非適合の組みの親和性に比べ十分に高いことが示唆された.
また,TgrB1とTgrC1の組みの機能がどのような相互作用により保証されているのかを確認した.さきに述べたように,tgrB1遺伝子の1遺伝子置換体またはtgrC1遺伝子の1遺伝子置換体は発生に異常をもつ.しかしながら,同じ細胞集団に由来するtgrB1遺伝子もしくはtgrC1遺伝子をもつ1遺伝子置換体を混合して発生させると表現型の回復がみられた.この株の組合せにおいて1細胞レベルでは非適合tgrB1-tgrC1遺伝子座をもつために自己認識に問題が生じたが,異種細胞のあいだの相互作用により適合するTgrB1とTgrC1との相互作用が保証されていることで細胞のあいだでの機能的な補完が達成されている(図2).この結果から,適合するTgrB1とTgrC1のトランス相互作用によりそれらの下流のシグナル経路の活性化が起こり発生の制御が行われていることも示唆された.
おわりに
この研究により,細胞性粘菌の自己と非自己の認識を統御する認識タンパク質を同定することができた.細胞性粘菌のゲノムはおよそ23,000の遺伝子を保持し,そのなかには数多くの膜タンパク質の遺伝子および配列多型をもつ遺伝子があるにもかかわらず,驚くべきことにTgrB1とTgrC1の組みの配列多型のみにより細胞集団のアイデンティティが定義されていた.筆者らは,この特徴を利用してこの2つの遺伝子を組み換えるだけで細胞のふるまいを制御することに成功した.現在,脊椎動物を除く自己と非自己の認識タンパク質はホヤ(Botryllus schlosseri)やウミヒドラ(Hydractinia symbiolongicarpus)で報告されており9,10),細胞性粘菌における発見は自己認識機構の進化的な起源としてもっとも原始的なものとなった.
今後の展望としては,異なるtgrB1-tgrC1遺伝子座をもつ集団がほかの集団を非自己と認識して空間的な分離を達成する機構を解明したい.この問題は細胞選別の問題として非常に興味深い.適合するTgrB1とTgrC1の組みの結合親和性が非適合の組みと比べて高くなることによる細胞のあいだの接着性の差異が選別の一因となる可能性は高いが,接着分子をコードする遺伝子の破壊株は親株とは選別されなかったことから,シンプルな細胞接着力のみが細胞選別の原動力となっているわけではないだろう.TgrB1およびTgrC1の下流におけるなんらかの分子機構が能動的な細胞選別を担っている可能性が高い.
細胞選別の機構は多細胞生物の形態形成の過程に欠かすことはできない.分化により特定の形質を獲得した細胞は同質の細胞どうしに選別され機能単位としての組織を確立する.細胞性粘菌の自己と非自己の認識反応は認識タンパク質による細胞選別,および,異質な細胞と同質な細胞とのあいだの非協調と協調による集団としての機能的な確立のすべてをシンプルなかたちで保持している.この研究により,進化の過程において単細胞生物が多細胞体制を獲得していく過程とその必要条件の理解に近づくことができる.
文 献
- Kessin, R. H.: Dictyostelium: Evolution, Cell Biology, and the Development of Multicellularity. Cambridge University Press, Cambridge (2001)
- Shaulsky, G. & Kessin, R. H.: The cold war of the social amoebae. Curr. Biol., 17, R684-R692 (2007)[PubMed]
- Ostrowski, E. A., Katoh, M., Shaulsky, G. et al.: Kin discrimination increases with genetic distance in a social amoeba. PLoS Biol., 6, e287 (2008)[PubMed]
- Mehdiabadi, N. J., Jack, C. N., Farnham, T. T. et al.: Social evolution: kin preference in a social microbe. Nature, 442, 881-882 (2006)[PubMed]
- Queller, D. C., Ponte, E., Bozzaro, S. et al.: Single-gene greenbeard effects in the social amoeba Dictyostelium discoideum. Science, 299, 105-106 (2003)[PubMed]
- Rodgers, J. R. & Cook, R. G.: MHC class Ib molecules bridge innate and acquired immunity. Nat. Rev. Immunol., 5, 459-471 (2005)[PubMed]
- Hughes, L., Nei, M.: Pattern of nucleotide substitution at major histocompatibility complex class I loci reveals overdominant selection. Nature, 335, 167-170 (1988)[PubMed]
- Benabentos, R., Hirose, S., Sucgang, R. et al.: Polymorphic members of the lag gene family mediate kin discrimination in Dictyostelium. Curr. Biol., 19, 567-572 (2009)[PubMed]
- De Tomaso, A. W., Nyholm, S. V., Palmeri, K. J. et al.: Isolation and characterization of a protochordate histocompatibility locus. Nature, 438, 454-459 (2005)[PubMed]
- Rosa, S. F., Powell, A. E., Rosengarten, R. D. et al.: Hydractinia allodeterminant alr1 resides in an immunoglobulin superfamily-like gene complex. Curr. Biol., 20, 1122-1127 (2010)[PubMed]
著者プロフィール
略歴:2004年 東北大学大学院生命科学研究科博士課程 修了,同年 米国California大学San Diego校Postdoctoral Associateを経て,2006年より米国Baylor College of MedicineにてPostdoctoral Associate.
研究テーマ:自己と非自己の認識にもとづいた細胞選別の機構.
関心事:単細胞生物が多細胞体制を確立する必要条件を探索し定義する.
Adam Kuspa
米国Baylor College of MedicineにてVice PresidentおよびProfessor.
Gad Shaulsky
米国Baylor College of MedicineにてProfessor.
© 2011 廣瀬滋規・Adam Kuspa・Gad Shaulsky Licensed under CC 表示 2.1 日本