脱ユビキチン化酵素Ubp6はプロテアソームの分子集合を制御する
佐伯 泰・田中啓二
(東京都医学総合研究所 蛋白質代謝研究室)
email:佐伯 泰,田中啓二
DOI: 10.7875/first.author.2011.105
The catalytic activity of Ubp6 enhances maturation of the proteasomal regulatory particle.
Eri Sakata, Florian Stengel, Keisuke Fukunaga, Min Zhou, Yasushi Saeki, Friedrich Förster, Wolfgang Baumeister, Keiji Tanaka, Carol V. Robinson
Molecular Cell, 42, 637-649 (2011)
26Sプロテアソームはユビキチン化されたタンパク質を選択的に分解する巨大なタンパク質分解酵素複合体であり,タンパク質分解を介して細胞のあらゆる生命現象を制御している.26Sプロテアソームは66個の構成サブユニットおよび一過性の結合タンパク質から構築されるが,近年,プロテアソームの分子集合に関する研究は大きなトピックのひとつになっている.筆者らは,ネイティブ質量分析法により出芽酵母の26Sプロテアソームのストイキオメトリーと分子集合中間体の解析を行った.その結果,19S制御因子複合体の基底部を構成する大サブユニットのRpn1を含むプロテアソーム中間体より新たに脱ユビキチン化酵素Ubp6が見い出された.Ubp6の非存在下ではプロテアソーム中間体にユビキチン化タンパク質が蓄積しプロテアソームの形成が抑制された.よって,Ubp6はプロテアソームの形成に有害なユビキチン化タンパク質が会合中間体に非特異的に結合することを阻止することで,プロテアソームの分子集合を正に制御していることが明らかになった.
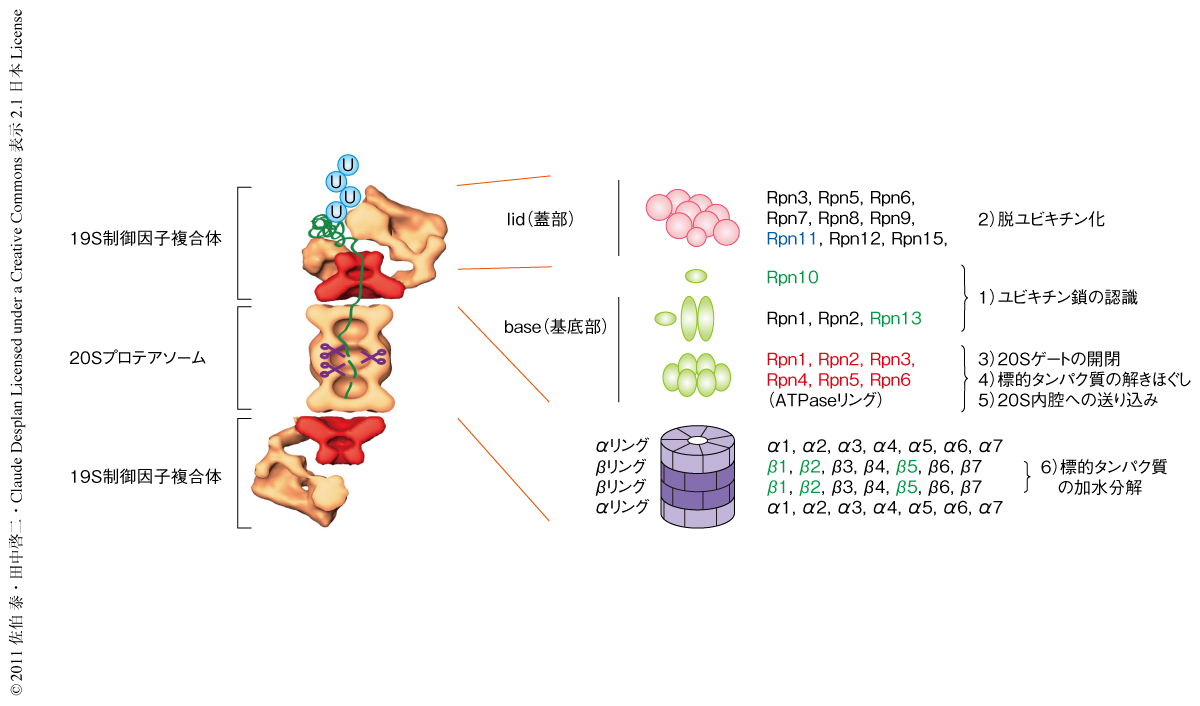
26Sプロテアソームは細胞内に生じたユビキチン化タンパク質を選択的かつすみやかに分解し除去する約2.5 MDaのタンパク質分解酵素複合体であり,不良品タンパク質のみならず機能性タンパク質を時期特異的に代謝することで細胞のさまざまな生命現象を制御している1).26Sプロテアソームは触媒ユニットである20Sプロテアソーム(別称CP:core particle)に1つまたは2つの19S制御因子複合体(RP:regulatory particle,蓋部(lid)と基底部(base)とに細分される)が会合した構造をとり,33種類66個以上のサブユニットから構成されている(図1).さらに,脱ユビキチン化酵素Ubp6やユビキチン受容体Rad23など,プロテアソームと一過的に結合し機能するタンパク質(proteasome-interacting protein:PIP)が存在しプロテアソームの機能を正負に制御している.20Sプロテアソームの単独ではユビキチン化タンパク質を分解することができず,19S制御因子複合体に存在するユビキチン受容体サブユニットや脱ユビキチン化酵素サブユニット,標的タンパク質のときほぐしを実行するATPaseサブユニットが協調的にはたらくことで,はじめてユビキチン化タンパク質を迅速かつ安全に代謝することができる(図1).いい換えれば,26Sプロテアソームがすみやかかつ正確に形成されることは,秩序だったタンパク質分解を保証する重大な局面である.
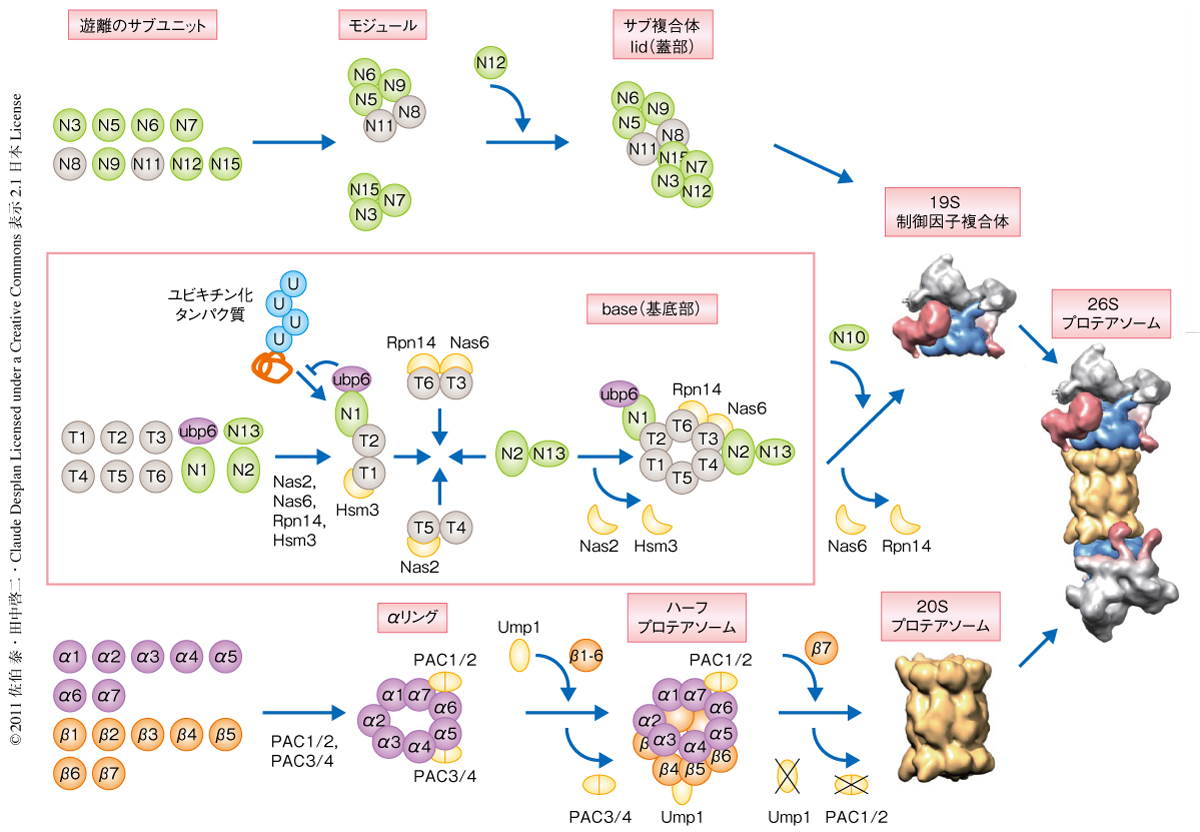
プロテアソームの分子集合は隣接する2つないし3つのサブユニットのペアによるサブユニット間の相互作用からはじまるが,ここでまちがった組合せが生じると,完成品には取り込まれない行き止まりの産物や,まちがった組成と構造をもつ有害なプロテアソームを生じてしまい細胞にとり致命的である2).とくに,7つのよく似ているが異なるサブユニットからなる20Sプロテアソームのαリングやβリング,6つのよく似たATPaseサブユニットからなる19S制御因子複合体のATPaseリングは,理論上,それぞれ720通り,120通りのサブユニット配置の組合せが可能であり,単純なサブユニット間の相互作用のみで形成されているとは考えにくい.実際に,大腸菌などで隣接するサブユニットどうしを共発現しても多くの場合は自己凝集してしまうことが知られており,これらのリングがいかにして正確にかたちづくられるかは大きな問題であった.ところが,2005年,PAC1およびPAC2(PAC:proteasome assembling chaperone)の発見により,細胞にはプロテアソームの形成のための専用のシャペロンが存在しプロテアソームの分子集合を支援する分子機構の存在することが明らかになった3).これまで,20Sプロテアソームの専用シャペロンとしてPAC1,PAC2,PAC3,PAC4,Ump1の5つのタンパク質が,19S制御因子複合体の専用シャペロンとしてNas2/p27,Nas6/gankyrin,Rpn14/PAAF1,Hsm3/S5bの4つのタンパク質が同定されており,プロテアソームの分子集合の機構の研究はひとつの大きなトピックになっている2-6)(図2).
今回,筆者らは,ネイティブ質量分析法を用いた26Sプロテアソームの構造解析の過程で,一過性の結合タンパク質のひとつ脱ユビキチン化酵素Ubp6がプロテアソーム中間体と結合していることを見い出し,Ubp6がプロテアソームの分子集合を制御するという知見を得た.
タンパク質複合体の構造解析法としてX線結晶構造解析がもっとも有効であるものの,プロテアソームのように数多くのサブユニットから構成される複雑な複合体は安定性などの問題から結晶化が非常にむずかしい.そのような高難易度タンパク質複合体のための構造解析法としてクライオ電子顕微鏡による単粒子解析法やインタクトな複合体のネイティブ質量分析法がある7).今回,出芽酵母の26Sプロテアソームをアフィニティー精製法による穏和な条件で調製し8),ネイティブ質量分析法によりその解析を試みた.ネイティブ質量分析法では,インタクトな複合体の質量の決定により構成サブユニットとそのストイキオメトリーが,さらに,有機溶媒や塩を添加し複合体を部分的に解離させることで複合体の正確な4次構造の情報を得ることが可能である.スクロース密度勾配により単離した両側にキャップをもつ26Sプロテアソーム(19S-20S-19S)をネイティブ質量分析により解析したところその質量は2,587,352 Daと決定され,これは33種類の構成サブユニットを2分子ずつ含んだ理論値とほぼ完全に一致した.これは,いままで行われたなかでもっとも精密かつ正確な26Sプロテアソームのストイキオメトリック解析の結果である.
つぎに,19S制御因子複合体およびその中間体の存在するスクロース密度勾配の画分について,ひきつづきネイティブ質量分析解析を行った.その結果,19S制御因子複合体のサブ複合体である基底部(base)に19S制御因子複合体の専用シャペロンであるNas6およびRpn14が結合していること,さらに,脱ユビキチン化酵素Ubp6が結合していることが明らかになった.19S制御因子複合体の基底部は6つのATPaseサブユニット(Rpt1~Rpt6)と3つの非ATPaseサブユニット(Rpn1,Rpn2,Rpn13)の9つの構成サブユニットから構成されているが,その空間配置はほとんど不明である.そこで,質量分析の際の溶媒に有機溶媒を添加し,インタクトな19S制御因子複合体の基底部を積極的に部分的に解離させ質量分析解析を行ったところ,Rpn2-Rpn13,Rpt6-Rpn14,Rpt4-Rpt5-Rpn2-Rpn13,Rpt3-Rpt4-Rpt5-Rpt6-Nas6-Rpn14など,構成サブユニットや専用のシャペロンを含むさまざまな部分集合体が検出された.これは,筆者らが提唱している基底部の分子集合モデルとよく一致し,さらに,3つのRpnサブユニットの位置情報については重要かつ新しい知見であった(図2).
26Sプロテアソームは,構成サブユニットであるRpn11のほか,一過性の結合タンパク質のひとつであるUbp6/USP14,Uch37の計3種類の脱ユビキチン化酵素をもつ1).Rpn11が標的タンパク質の分解と協調してユビキチン鎖を切断するのに対し,Ubp6/USP14やUch37はユビキチン鎖をトリミングすることで標的タンパク質の分解を阻害するプロテアソームの負の制御タンパク質である.興味深いことに,Ubp6は単独では脱ユビキチン化活性をもたないが,19S制御因子複合体の基底部に存在する大サブユニットRpn1と結合しプロテアソームに取り込まれることで活性化される9).従来,Ubp6は完成した26Sプロテアソームとのみ結合すると考えられていたが,さきに述べたネイティブ質量分析の解析の結果より,Ubp6が19S制御因子複合体の基底部やその前駆体の段階で結合し機能することが示唆された.Rpn1は分子集合の過程においてまずRpt2とヘテロ二量体を形成し,つぎにRpt1-Hsm3複合体と結合することでHsm3モジュールとよばれる比較的安定な中間体を形成する4-6).そこで,Rpn1-FLAGタグ融合株より調製した26Sプロテアソームをスクロース密度勾配で分画し,抗Ubp6抗体を用いたウェスタンブロット解析および定量的な質量分析解析を行った.その結果,Ubp6はRpn1-Rpt2複合体においてすでに結合していること,さらに,Hsm3モジュールでは構成サブユニットとほぼ等モルで存在することが明らかになった.
Ubp6が基底部の前駆体においてどのような役割をはたしているのか,まず,遺伝学的な手法を用いて解析を行った.UBP6遺伝子と4つの制御因子複合体の専用シャペロンの遺伝子について二重破壊株を作製し表現型を解析したところ,UBP6遺伝子はHSM3遺伝子とのみ強く相互作用すること,UBP6遺伝子とHSM3遺伝子の二重破壊株において26Sプロテアソームの形成や基底部の形成に大きな欠損を生じることが明らかになった.これは,Ubp6がHsm3と協調して基底部の分子集合を正に制御していることを強く示唆していた.Rpn1はUbp6だけでなくRpn10やRad23などのユビキチン受容体サブユニットと結合することが知られている1).そこで,UBP6遺伝子の破壊株に由来するプロテアソーム中間体にユビキチン化タンパク質が蓄積するかどうか検討した.Rpn1-FLAGタグ融合株より調製した26Sプロテアソームをスクロース密度勾配で分画し抗ユビキチン抗体を用いたウェスタンブロット解析を行った結果,Rpn1-Rpt2複合体の画分から基底部の画分にかけてユビキチン化タンパク質の蓄積がみられた.大腸菌より発現精製した組換えUbp6をこの前駆体の画分にくわえたところ,蓄積していたユビキチン化タンパク質はすみやかに消失した.一方,活性中心のシステイン残基をアラニン残基に置換した変異型Ubp6ではユビキチン化タンパク質の消失がみられないこと,さらに,HSM3遺伝子との遺伝学的な相互作用はキャンセルされないことから,分子集合におけるUbp6の機能は脱ユビキチン化酵素活性に依存することが示された.以上の結果より,プロテアソームは分子集合の過程においてユビキチン化タンパク質が結合することは有害であること(とくに,種々のユビキチン受容体の結合するRpn1を含む前駆体は脆弱であること),Ubp6はそのような分子集合の障害となるユビキチン化タンパク質を除去することで正確な分子集合を保証することが明らかになった.
この数年間で26Sプロテアソームの分子集合に関する研究は劇的に進展し,全体像が明らかになろうとしている.しかしながら,プロテアソームが細胞のどこで形成するのかプロテアソームの誕生の場について,さらには,プロテアソームの局在の制御機構については大きな未解決の問題として残されており今後の解析が待たれる.最後に,この研究は国内外3つの研究グループの共同研究であり,異なる技術を互いに相補しあうことで重要かつおもしろい研究成果の得られたことを付記する.
略歴:2003年 北海道大学大学院薬学研究科 修了,同年 東京大学大学院理学系研究科 研究員,2006年 東京都臨床医学総合研究所 研究員などを経て,2011年より東京都医学総合研究所 主席研究員.
研究テーマ:プロテアソームの分子集合とダイナミクス.
抱負:新しい手法(イメージングや質量分析など)と古い手法(酵母遺伝学など)を組み合わせることで,さまざまな視点からプロテアソームの研究を進展させたい.
田中 啓二(Keiji Tanaka)
東京都医学総合研究所 所長.
© 2011 佐伯 泰・田中啓二 Licensed under CC 表示 2.1 日本
(東京都医学総合研究所 蛋白質代謝研究室)
email:佐伯 泰,田中啓二
DOI: 10.7875/first.author.2011.105
The catalytic activity of Ubp6 enhances maturation of the proteasomal regulatory particle.
Eri Sakata, Florian Stengel, Keisuke Fukunaga, Min Zhou, Yasushi Saeki, Friedrich Förster, Wolfgang Baumeister, Keiji Tanaka, Carol V. Robinson
Molecular Cell, 42, 637-649 (2011)
要 約
26Sプロテアソームはユビキチン化されたタンパク質を選択的に分解する巨大なタンパク質分解酵素複合体であり,タンパク質分解を介して細胞のあらゆる生命現象を制御している.26Sプロテアソームは66個の構成サブユニットおよび一過性の結合タンパク質から構築されるが,近年,プロテアソームの分子集合に関する研究は大きなトピックのひとつになっている.筆者らは,ネイティブ質量分析法により出芽酵母の26Sプロテアソームのストイキオメトリーと分子集合中間体の解析を行った.その結果,19S制御因子複合体の基底部を構成する大サブユニットのRpn1を含むプロテアソーム中間体より新たに脱ユビキチン化酵素Ubp6が見い出された.Ubp6の非存在下ではプロテアソーム中間体にユビキチン化タンパク質が蓄積しプロテアソームの形成が抑制された.よって,Ubp6はプロテアソームの形成に有害なユビキチン化タンパク質が会合中間体に非特異的に結合することを阻止することで,プロテアソームの分子集合を正に制御していることが明らかになった.
はじめに
26Sプロテアソームは細胞内に生じたユビキチン化タンパク質を選択的かつすみやかに分解し除去する約2.5 MDaのタンパク質分解酵素複合体であり,不良品タンパク質のみならず機能性タンパク質を時期特異的に代謝することで細胞のさまざまな生命現象を制御している1).26Sプロテアソームは触媒ユニットである20Sプロテアソーム(別称CP:core particle)に1つまたは2つの19S制御因子複合体(RP:regulatory particle,蓋部(lid)と基底部(base)とに細分される)が会合した構造をとり,33種類66個以上のサブユニットから構成されている(図1).さらに,脱ユビキチン化酵素Ubp6やユビキチン受容体Rad23など,プロテアソームと一過的に結合し機能するタンパク質(proteasome-interacting protein:PIP)が存在しプロテアソームの機能を正負に制御している.20Sプロテアソームの単独ではユビキチン化タンパク質を分解することができず,19S制御因子複合体に存在するユビキチン受容体サブユニットや脱ユビキチン化酵素サブユニット,標的タンパク質のときほぐしを実行するATPaseサブユニットが協調的にはたらくことで,はじめてユビキチン化タンパク質を迅速かつ安全に代謝することができる(図1).いい換えれば,26Sプロテアソームがすみやかかつ正確に形成されることは,秩序だったタンパク質分解を保証する重大な局面である.
プロテアソームの分子集合は隣接する2つないし3つのサブユニットのペアによるサブユニット間の相互作用からはじまるが,ここでまちがった組合せが生じると,完成品には取り込まれない行き止まりの産物や,まちがった組成と構造をもつ有害なプロテアソームを生じてしまい細胞にとり致命的である2).とくに,7つのよく似ているが異なるサブユニットからなる20Sプロテアソームのαリングやβリング,6つのよく似たATPaseサブユニットからなる19S制御因子複合体のATPaseリングは,理論上,それぞれ720通り,120通りのサブユニット配置の組合せが可能であり,単純なサブユニット間の相互作用のみで形成されているとは考えにくい.実際に,大腸菌などで隣接するサブユニットどうしを共発現しても多くの場合は自己凝集してしまうことが知られており,これらのリングがいかにして正確にかたちづくられるかは大きな問題であった.ところが,2005年,PAC1およびPAC2(PAC:proteasome assembling chaperone)の発見により,細胞にはプロテアソームの形成のための専用のシャペロンが存在しプロテアソームの分子集合を支援する分子機構の存在することが明らかになった3).これまで,20Sプロテアソームの専用シャペロンとしてPAC1,PAC2,PAC3,PAC4,Ump1の5つのタンパク質が,19S制御因子複合体の専用シャペロンとしてNas2/p27,Nas6/gankyrin,Rpn14/PAAF1,Hsm3/S5bの4つのタンパク質が同定されており,プロテアソームの分子集合の機構の研究はひとつの大きなトピックになっている2-6)(図2).
今回,筆者らは,ネイティブ質量分析法を用いた26Sプロテアソームの構造解析の過程で,一過性の結合タンパク質のひとつ脱ユビキチン化酵素Ubp6がプロテアソーム中間体と結合していることを見い出し,Ubp6がプロテアソームの分子集合を制御するという知見を得た.
1.ネイティブ質量分析を用いた26Sプロテアソームの構造解析
タンパク質複合体の構造解析法としてX線結晶構造解析がもっとも有効であるものの,プロテアソームのように数多くのサブユニットから構成される複雑な複合体は安定性などの問題から結晶化が非常にむずかしい.そのような高難易度タンパク質複合体のための構造解析法としてクライオ電子顕微鏡による単粒子解析法やインタクトな複合体のネイティブ質量分析法がある7).今回,出芽酵母の26Sプロテアソームをアフィニティー精製法による穏和な条件で調製し8),ネイティブ質量分析法によりその解析を試みた.ネイティブ質量分析法では,インタクトな複合体の質量の決定により構成サブユニットとそのストイキオメトリーが,さらに,有機溶媒や塩を添加し複合体を部分的に解離させることで複合体の正確な4次構造の情報を得ることが可能である.スクロース密度勾配により単離した両側にキャップをもつ26Sプロテアソーム(19S-20S-19S)をネイティブ質量分析により解析したところその質量は2,587,352 Daと決定され,これは33種類の構成サブユニットを2分子ずつ含んだ理論値とほぼ完全に一致した.これは,いままで行われたなかでもっとも精密かつ正確な26Sプロテアソームのストイキオメトリック解析の結果である.
つぎに,19S制御因子複合体およびその中間体の存在するスクロース密度勾配の画分について,ひきつづきネイティブ質量分析解析を行った.その結果,19S制御因子複合体のサブ複合体である基底部(base)に19S制御因子複合体の専用シャペロンであるNas6およびRpn14が結合していること,さらに,脱ユビキチン化酵素Ubp6が結合していることが明らかになった.19S制御因子複合体の基底部は6つのATPaseサブユニット(Rpt1~Rpt6)と3つの非ATPaseサブユニット(Rpn1,Rpn2,Rpn13)の9つの構成サブユニットから構成されているが,その空間配置はほとんど不明である.そこで,質量分析の際の溶媒に有機溶媒を添加し,インタクトな19S制御因子複合体の基底部を積極的に部分的に解離させ質量分析解析を行ったところ,Rpn2-Rpn13,Rpt6-Rpn14,Rpt4-Rpt5-Rpn2-Rpn13,Rpt3-Rpt4-Rpt5-Rpt6-Nas6-Rpn14など,構成サブユニットや専用のシャペロンを含むさまざまな部分集合体が検出された.これは,筆者らが提唱している基底部の分子集合モデルとよく一致し,さらに,3つのRpnサブユニットの位置情報については重要かつ新しい知見であった(図2).
2.プロテアソーム中間体に脱ユビキチン化酵素Ubp6が存在する
26Sプロテアソームは,構成サブユニットであるRpn11のほか,一過性の結合タンパク質のひとつであるUbp6/USP14,Uch37の計3種類の脱ユビキチン化酵素をもつ1).Rpn11が標的タンパク質の分解と協調してユビキチン鎖を切断するのに対し,Ubp6/USP14やUch37はユビキチン鎖をトリミングすることで標的タンパク質の分解を阻害するプロテアソームの負の制御タンパク質である.興味深いことに,Ubp6は単独では脱ユビキチン化活性をもたないが,19S制御因子複合体の基底部に存在する大サブユニットRpn1と結合しプロテアソームに取り込まれることで活性化される9).従来,Ubp6は完成した26Sプロテアソームとのみ結合すると考えられていたが,さきに述べたネイティブ質量分析の解析の結果より,Ubp6が19S制御因子複合体の基底部やその前駆体の段階で結合し機能することが示唆された.Rpn1は分子集合の過程においてまずRpt2とヘテロ二量体を形成し,つぎにRpt1-Hsm3複合体と結合することでHsm3モジュールとよばれる比較的安定な中間体を形成する4-6).そこで,Rpn1-FLAGタグ融合株より調製した26Sプロテアソームをスクロース密度勾配で分画し,抗Ubp6抗体を用いたウェスタンブロット解析および定量的な質量分析解析を行った.その結果,Ubp6はRpn1-Rpt2複合体においてすでに結合していること,さらに,Hsm3モジュールでは構成サブユニットとほぼ等モルで存在することが明らかになった.
3.Ubp6は脱ユビキチン化酵素として19S制御因子複合体の分子集合を制御する
Ubp6が基底部の前駆体においてどのような役割をはたしているのか,まず,遺伝学的な手法を用いて解析を行った.UBP6遺伝子と4つの制御因子複合体の専用シャペロンの遺伝子について二重破壊株を作製し表現型を解析したところ,UBP6遺伝子はHSM3遺伝子とのみ強く相互作用すること,UBP6遺伝子とHSM3遺伝子の二重破壊株において26Sプロテアソームの形成や基底部の形成に大きな欠損を生じることが明らかになった.これは,Ubp6がHsm3と協調して基底部の分子集合を正に制御していることを強く示唆していた.Rpn1はUbp6だけでなくRpn10やRad23などのユビキチン受容体サブユニットと結合することが知られている1).そこで,UBP6遺伝子の破壊株に由来するプロテアソーム中間体にユビキチン化タンパク質が蓄積するかどうか検討した.Rpn1-FLAGタグ融合株より調製した26Sプロテアソームをスクロース密度勾配で分画し抗ユビキチン抗体を用いたウェスタンブロット解析を行った結果,Rpn1-Rpt2複合体の画分から基底部の画分にかけてユビキチン化タンパク質の蓄積がみられた.大腸菌より発現精製した組換えUbp6をこの前駆体の画分にくわえたところ,蓄積していたユビキチン化タンパク質はすみやかに消失した.一方,活性中心のシステイン残基をアラニン残基に置換した変異型Ubp6ではユビキチン化タンパク質の消失がみられないこと,さらに,HSM3遺伝子との遺伝学的な相互作用はキャンセルされないことから,分子集合におけるUbp6の機能は脱ユビキチン化酵素活性に依存することが示された.以上の結果より,プロテアソームは分子集合の過程においてユビキチン化タンパク質が結合することは有害であること(とくに,種々のユビキチン受容体の結合するRpn1を含む前駆体は脆弱であること),Ubp6はそのような分子集合の障害となるユビキチン化タンパク質を除去することで正確な分子集合を保証することが明らかになった.
おわりに
この数年間で26Sプロテアソームの分子集合に関する研究は劇的に進展し,全体像が明らかになろうとしている.しかしながら,プロテアソームが細胞のどこで形成するのかプロテアソームの誕生の場について,さらには,プロテアソームの局在の制御機構については大きな未解決の問題として残されており今後の解析が待たれる.最後に,この研究は国内外3つの研究グループの共同研究であり,異なる技術を互いに相補しあうことで重要かつおもしろい研究成果の得られたことを付記する.
文 献
- Finley, D.: Recognition and processing of ubiquitin-protein conjugates by the proteasome. Annu. Rev. Biochem., 78, 477-513 (2009)[PubMed]
- Murata, S., Yashiroda, H. & Tanaka, K.: Molecular mechanisms of proteasome assembly. Nat. Rev. Mol. Cell Biol., 10, 104-115 (2009)[PubMed]
- Hirano, Y., Hendil, K. B., Yashiroda, H. et al.: A heterodimeric complex that promotes the assembly of mammalian 20S proteasome. Nature, 437, 1381-1385 (2005)[PubMed]
- Saeki, Y., Toh-e, A., Kudo, T. et al.: Multiple proteasome-interacting proteins assist the assembly of the yeast 19S regulatory particle. Cell, 900-913 (2009)[PubMed]
- Kaneko, T., Hamazaki, J., Iemura, S. et al.: Assembly pathway of the mammalian proteasome base complex is mediated by multiple specific chaperones. Cell, 137, 914-925 (2009)[PubMed]
- Tomko, R. J. Jr., Funakoshi, M., Schneider, K. et al.: Heterohexameric ring arrangement of the eukaryotic proteasomal ATPases: implications for proteasome structure and assembly. Mol Cell, 38, 393-403 (2010)[PubMed]
- Robinson, C. V., Sali, A. & Baumeister, W.: The molecular sociology of the cell. Nature, 450, 973-982 (2007)[PubMed]
- Saeki, Y., Isono, E. & Toh-e, A.: Preparation of ubiquitinated substrates by the PY motif-insertion method for monitoring 26S proteasome activity. Methods Enzymol., 399, 215-217 (2005)[PubMed]
- Leggett, D. S., Hanna, J., Borodovsky, A. et al.: Multiple associated proteins regulate proteasome structure and function. Mol Cell, 10, 495-507 (2002)[PubMed]
著者プロフィール
略歴:2003年 北海道大学大学院薬学研究科 修了,同年 東京大学大学院理学系研究科 研究員,2006年 東京都臨床医学総合研究所 研究員などを経て,2011年より東京都医学総合研究所 主席研究員.
研究テーマ:プロテアソームの分子集合とダイナミクス.
抱負:新しい手法(イメージングや質量分析など)と古い手法(酵母遺伝学など)を組み合わせることで,さまざまな視点からプロテアソームの研究を進展させたい.
田中 啓二(Keiji Tanaka)
東京都医学総合研究所 所長.
© 2011 佐伯 泰・田中啓二 Licensed under CC 表示 2.1 日本