陸上植物に固有の膜交通制御タンパク質が植物の新たな細胞内輸送経路を開拓した
海老根一生・上田貴志
(東京大学大学院理学系研究科 生物科学専攻発生生物学研究室)
email:海老根一生,上田貴志
DOI: 10.7875/first.author.2011.108
A membrane trafficking pathway regulated by the plant-specific RAB GTPase ARA6.
Kazuo Ebine, Masaru Fujimoto, Yusuke Okatani, Tomoaki Nishiyama, Tatsuaki Goh, Emi Ito, Tomoko Dainobu, Aiko Nishitani, Tomohiro Uemura, Masa H. Sato, Hans Thordal-Christensen, Nobuhiro Tsutsumi, Akihiko Nakano, Takashi Ueda
Nature Cell Biology, 13, 853-859 (2011)
真核生物のオルガネラのあいだでは小胞や小管を介した物質輸送系,いわゆる膜交通により物質の輸送が行われている.RAB GTPaseとSNAREはともに膜融合を制御するタンパク質であり,物質輸送の実行とともに輸送経路の特異性の維持にもかかわっている.膜交通経路は真核生物の系統のあいだで大きく多様化していることが知られているが,その多様性がいかに獲得されたかについてはこれまでほとんど明らかにされていなかった.この研究では,モデル植物であるシロイヌナズナを用いて植物に固有のRAB GTPase(ARA6)とSNARE(VAMP727)の機能を解析し,これらが協調して独自の輸送経路においてはたらいていることをつきとめた.この結果は,植物が進化の過程で独自のRABとSNAREとを獲得することにより新たな膜交通経路を獲得したことを示していた.さらに,この植物に固有の膜交通経路が塩ストレスに対する耐性に関与していることも発見した.植物の進化の過程においてこの膜交通経路がストレス耐性の獲得に重要な役割を担ったのかもしれない.
真核生物の細胞には多様なオルガネラが存在しており,それらのあいだでは小胞や小管を介して物質のやりとりが行われている.この物質輸送系は膜交通(メンブレントラフィック)とよばれている.膜交通が正確に営まれるためには,輸送小胞への積み荷の積み込みと,輸送小胞と標的膜との融合のステップが厳密に制御されている必要がある.
一方,進化の過程ではオルガネラの多様化にともない新たに多くの膜交通経路が開拓されてきたものと推測される.近年の研究は,小胞の形成と繋留および融合のステップで機能する進化的に保存された一連のタンパク質がオルガネラと膜交通経路の特異性を規定するとともに,それらの多様化が真核生物における膜交通経路の多様化の原動力となったことを示唆している1).しかしながら,膜交通制御タンパク質の多様化と新規の膜交通経路の獲得との関連を実証的に証明した研究はこれまでほとんど例がない.
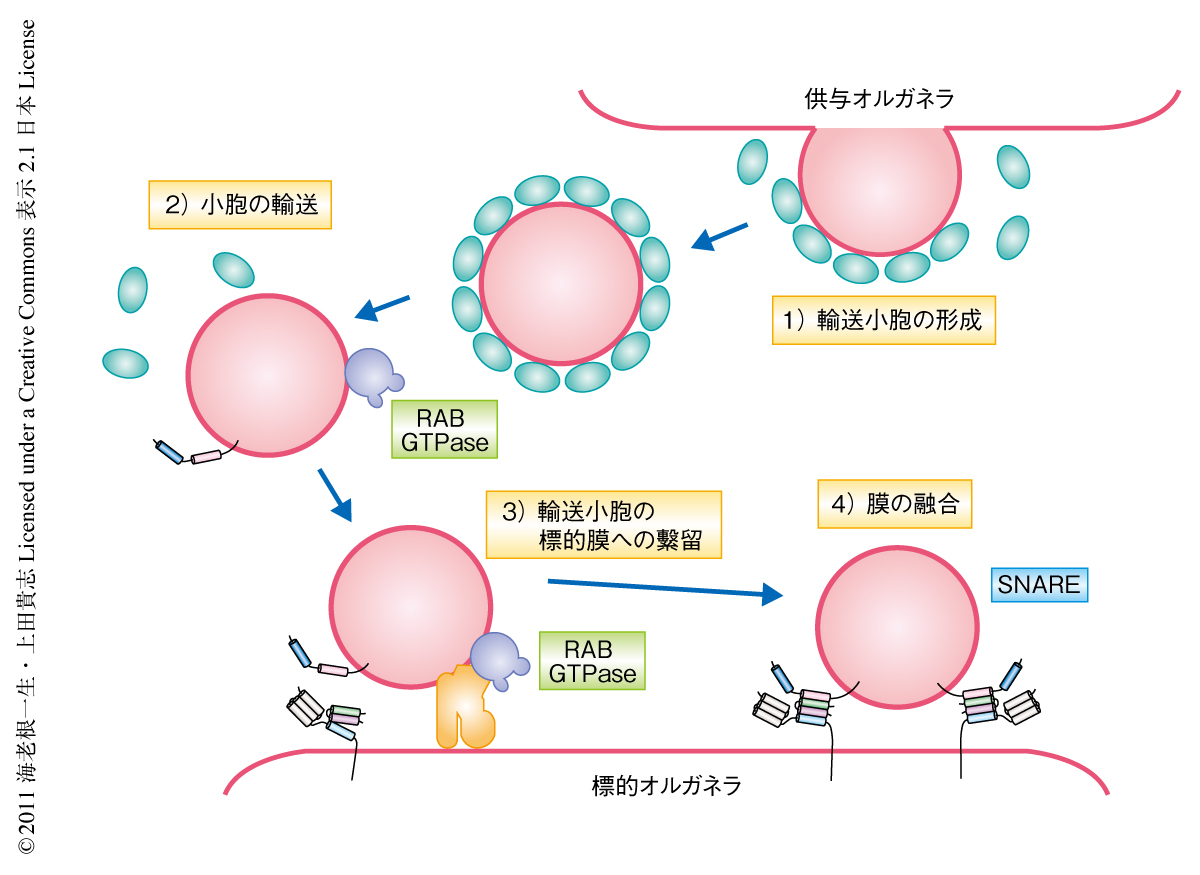
RAB GTPaseとSNAREは輸送小胞の標的膜への繋留と融合を制御するタンパク質である.活性化したRAB GTPaseはエフェクターとよばれるタンパク質を介して輸送小胞を標的膜に繋留する.そののち,輸送小胞に局在するR-SNAREと標的膜に局在するQ-SNAREとが複合体を形成し,これにより膜融合が実行される2)(図1).RAB GTPaseの個々のメンバーは特定の膜交通経路においてのみ機能し,さらにその制御のもとSNARE複合体によるオルガネラに特異的な膜融合が実行されている.このように,RAB GTPaseとSNAREは細胞における物質輸送を正確に行うにあたり重要な役割を担うタンパク質である.
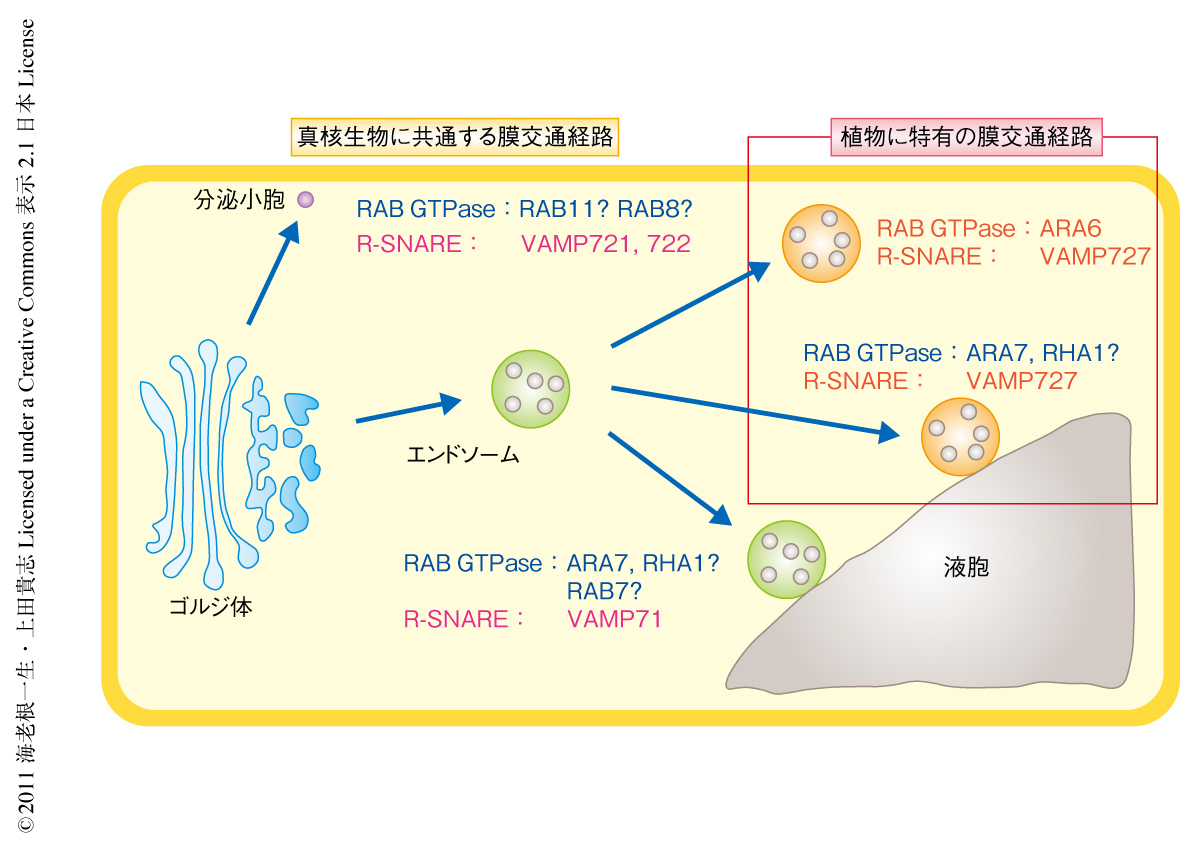
RAB GTPaseのなかでもRAB5とよばれるサブグループは動物や酵母などを含め真核生物に広く保存されており,エンドソームとよばれるオルガネラにおいて機能している.動物のRAB5については多様なエフェクタータンパク質を使い分けることで膜融合以外にもさまざまなエンドソーム機能の調節を行っていることが知られている3).陸上植物には,ほかの生物のRAB5に類似したRAB5ホモログ(保存型RAB5)にくわえ,非常に特徴的な構造をもつ植物に独自のRAB5(ARA6)が存在している.保存型RAB5についてはシロイヌナズナの保存型RAB5であるARA7とRHA1がエンドソームに局在しエンドサイトーシス経路と液胞輸送経路で機能していることが示され,植物においてもRAB5がエンドソームで機能することが明らかになっていた.一方,ARA6については,ARA7やRHA1と共通の活性化タンパク質(VPS9a)により活性化されるものの,それらとは一部が異なるエンドソームに局在することから,保存型RAB5とは異なる機能をもつことが示唆されていた4,5).しかしながら,植物が保存型RAB5とARA6の2つのRAB5をいかに使い分けているのか,そのことにどのような生理的な意義があるのかについては,これまでまったく明らかになっていなかった.
植物はSNAREについても進化の過程で植物に固有のタンパク質を獲得している.植物のR-SNAREの特徴としてまずあげられるのがVAMP7メンバーの多様化である.植物のVAMP7はVAMP71とVAMP72の2つのグループに大別される.それらにくわえ,陸上植物にはさらにVAMP72から派生したVAMP727とよばれるサブグループが存在する6).シロイヌナズナを用いた解析からこれらVAMP7のサブグループはそれぞれ異なるオルガネラに局在し異なる膜交通経路で機能していることが示唆されていた7).筆者らは,とくにVAMP727に注目して解析を行ってきており,これまでにVAMP727がエンドソームから液胞への輸送経路において機能すること,この輸送経路が種子の形成において重要な役割を担っていることを明らかにしている8).この研究においては,陸上植物に固有の膜交通制御タンパク質であるARA6とVAMP727の機能をさらに明らかにするとともに,これらが機能する膜交通経路が陸上植物のどのような形質に関与しているのかを明らかにすることを試みた.
ARA6の機能を明らかにするためノックアウト変異体を作出し表現型の解析を行ったが,通常の栽培条件では異常な表現型は観察されなかった.また,保存型RAB5と機能が重複している可能性を考え保存型RAB5のノックアウト変異体との多重変異体を作製したが,ARA6遺伝子と保存型RAB5遺伝子とのあいだに遺伝学的な相互作用は観察されなかった.そこでさらに,液胞の膜融合を制御するQ-SNAREをコードするSYP22/VAM3遺伝子をはじめとする液胞輸送経路およびエンドサイトーシス経路で機能する遺伝子との遺伝学的な相互作用を解析した.その結果,ARA6遺伝子および保存型RAB5遺伝子とSYP22遺伝子とのあいだに非常に興味深い遺伝学的な相互作用が観察された.SYP22のノックアウト変異体であるsyp22-1変異体は個体の矮化,花成の遅延,葉の形態の異常などさまざまな表現型を示す.保存型RAB5遺伝子の変異はこれらsyp22-1変異体の表現型を昂進したのに対し,ARA6遺伝子の変異は驚いたことにsyp22-1変異体の異常な表現型をほぼ完全に抑圧した.また,同様のまったく逆の遺伝学的な相互作用が,RAB5の活性化タンパク質をコードするVPS9a遺伝子とのあいだにおいても観察された.これらの結果から,ARA6は保存型RAB5とはまったく異なる機能をもつことが明らかになった.
保存型RAB5とSYP22はともにエンドソームから液胞への輸送を正に制御するタンパク質であると考えられている.一方,エンドサイトーシスにおけるこれらのタンパク質の機能はこれまで不明であった.そこで,細胞膜から液胞へとエンドサイトーシス経路により輸送されるホウ素輸送体BOR1の挙動をそれぞれの変異体において観察した.その結果,syp22-1変異体ではBOR1のエンドソームから液胞への輸送に遅延がみられ,ARA6遺伝子の変異はこの表現型を抑圧することが示された.以上の結果から,ARA6はエンドソームから液胞への輸送経路と拮抗する輸送経路において機能していることが示された.
さきに述べた遺伝学的な解析から,保存型RAB5とARA6の2つのRAB5が拮抗する輸送経路において機能していることが示唆された.では,ARA6は具体的にどのような輸送経路で機能しているのだろうか.
活性型固定変異を導入したRAB GTPaseは膜から解離しにくくなるため,しばしば標的オルガネラに蓄積することが知られている.以前のプロトプラストを用いた一過的な発現実験では,活性型固定変異を導入したARA6および保存型RAB5はともに液胞膜に蓄積することが観察されていた.この研究ではさらに,形質転換植物を用いて活性型固定変異を導入したARA6および保存型RAB5の細胞内局在を比較した.その結果,活性型の保存型RAB5はエンドソームと液胞にのみ局在が観察されたのに対し,活性型のARA6は液胞膜にくわえ細胞膜にも局在することが明らかになった.これは,ARA6が細胞膜を目的地とする輸送経路において機能しており,そのあと細胞膜からエンドサイトーシスされた活性型ARA6が液胞に蓄積しているという可能性を示していた.そこで,ウォルトマンニン処理によるエンドサイトーシスの阻害の影響を調べたところウォルトマンニン処理が細胞膜に局在する活性型ARA6の量を有意に増加させることが明らかになった.さらに,全反射顕微鏡により細胞膜のごく近傍のみを選択的に観察したところ,野生型ARA6が細胞膜に局在していることも示された.これらのことから,ARA6が細胞膜において膜融合を制御していることが強く示唆された.
つづいて,植物に特異的なR-SNAREであるVAMP727についても詳細な解析を行った.筆者らのこれまでの研究により,VAMP727はSYP22と複合体を形成することにより液胞とエンドソームとのあいだの膜融合を実行していることが明らかになっている8).今回さらに,VAMP727が細胞膜のQ-SNAREであるSYP121とも複合体を形成していることを共免疫沈降法とFRET(fluorescence resonance energy transfer,蛍光共鳴エネルギー移動)解析により明らかにした.このことから,VAMP727は液胞膜と細胞膜において異なるSNARE複合体を形成することが示された.SYP22遺伝子のノックアウト変異体であるsyp22-1変異体の表現型がVAMP727の過剰発現により抑圧されること,および,syp22-1変異体にVAMP727遺伝子の変異を導入すると合成致死となることから8),syp22-1変異体の異常な表現型はVAMP727-SYP22複合体が関与する輸送経路の損傷に起因することが示唆された.そこで,ARA6遺伝子の変異によるsyp22-1変異体の表現型の抑圧がどのような輸送経路における損傷を反映したものであるかを明らかにするため,ARA6遺伝子の変異体および活性型ARA6の過剰発現体において,VAMP727とSYP22またはSYP121との結合量を共免疫沈降法により比較した.その結果,ARA6遺伝子の変異体ではVAMP727-SYP121複合体の量が減少し,活性型ARA6の過剰発現体ではこの複合体の量が増加していることが明らかになった.一方,液胞において膜融合を実行するVAMP727-SYP22複合体の量はARA6の有無により影響をうけなかった.これらの結果は,ARA6はVAMP727とSYP121との効率的な複合体の形成のみに必要であることを示していた.さらに,全反射顕微鏡を用いて細胞膜の近傍におけるこれらのタンパク質の挙動を観察した結果,細胞膜の近傍のドット状のコンパートメントにおいてVAMP727とSYP121とが複合体を形成していること,ARA6もこのコンパートメントに局在していることなどが明らかになった.これらのことから,ARA6はVAMP727とSYP121との細胞膜における複合体の形成を促進することにより,エンドソームから細胞膜への輸送を制御していることが明らかになった(図2).
以上の解析から,植物はARA6とVAMP727を獲得したことにより新たな膜交通経路を開拓したことが明らかになった.では,この輸送経路は植物のどのような形質と関連しているのだろうか.自然条件において植物はさまざまなストレスにさらされているが,動物とは異なり自ら移動することでストレスからのがれることはできない.そのため,植物は細胞レベルでの複雑な環境応答系を発達させているものと考えられる.また,好塩性植物であるアイスプラント(Mesembryanthemum crystallinum)では高NaCl条件においてARA6の発現の上昇することが報告されている9).そこで,ARA6と環境応答とのかかわりを探るため,NaClストレス環境において野生型,ARA6遺伝子の変異体,活性型ARA6の過剰発現体の生育を比較した.その結果,ARA6遺伝子の変異体では野生型と比べ有意な生育阻害が,活性型ARA6の過剰発現体では逆にNaCl耐性が観察された.さらに,塩ストレス環境において活性型ARA6の細胞内局在を観察したところ,細胞膜の近傍に通常ではみられないパッチ状の活性型ARA6の凝集体が観察された.これらの結果から,NaClストレス環境においてはARA6が細胞膜の近傍に特殊なドメインを形成し,これが植物のNaCl応答に重要な役割を担っている可能性が示唆された.
この研究により,モデル植物であるシロイヌナズナにおいてARA6とVAMP727という植物に固有の膜交通制御タンパク質がエンドソームから細胞膜への輸送経路で機能していることが明らかになった.これらのタンパク質は広く陸上植物に保存されていることから,シロイヌナズナ以外の植物においてもこれらのホモログが協調して植物に独自の膜交通経路で機能しているものと考えられる.シロイヌナズナにおいてはこの経路が耐塩性に寄与していることが示された.このことは,ARA6が機能する膜交通経路が植物の環境応答において重要な役割を担っていることを示唆していた.今後,ARA6のエフェクタータンパク質の解析などをつうじた分子機構のより詳細な解析,さらには,単子葉植物やコケ植物といった多様な植物におけるARA6ホモログの機能解析から,この植物に固有の輸送経路の意義と起源をよりいっそう明らかにすることができるものと期待している.
略歴:2010年 東京大学大学院理学系研究科 修了,同年 同 特任研究員を経て,2011年より国立感染症研究所寄生動物部 研究員.
研究テーマ:生物の進化におけるRab5の多様化の意義.
上田 貴志(Takashi Ueda)
東京大学大学院理学系研究科 准教授.
© 2011 海老根一生・上田貴志 Licensed under CC 表示 2.1 日本
(東京大学大学院理学系研究科 生物科学専攻発生生物学研究室)
email:海老根一生,上田貴志
DOI: 10.7875/first.author.2011.108
A membrane trafficking pathway regulated by the plant-specific RAB GTPase ARA6.
Kazuo Ebine, Masaru Fujimoto, Yusuke Okatani, Tomoaki Nishiyama, Tatsuaki Goh, Emi Ito, Tomoko Dainobu, Aiko Nishitani, Tomohiro Uemura, Masa H. Sato, Hans Thordal-Christensen, Nobuhiro Tsutsumi, Akihiko Nakano, Takashi Ueda
Nature Cell Biology, 13, 853-859 (2011)
要 約
真核生物のオルガネラのあいだでは小胞や小管を介した物質輸送系,いわゆる膜交通により物質の輸送が行われている.RAB GTPaseとSNAREはともに膜融合を制御するタンパク質であり,物質輸送の実行とともに輸送経路の特異性の維持にもかかわっている.膜交通経路は真核生物の系統のあいだで大きく多様化していることが知られているが,その多様性がいかに獲得されたかについてはこれまでほとんど明らかにされていなかった.この研究では,モデル植物であるシロイヌナズナを用いて植物に固有のRAB GTPase(ARA6)とSNARE(VAMP727)の機能を解析し,これらが協調して独自の輸送経路においてはたらいていることをつきとめた.この結果は,植物が進化の過程で独自のRABとSNAREとを獲得することにより新たな膜交通経路を獲得したことを示していた.さらに,この植物に固有の膜交通経路が塩ストレスに対する耐性に関与していることも発見した.植物の進化の過程においてこの膜交通経路がストレス耐性の獲得に重要な役割を担ったのかもしれない.
はじめに
真核生物の細胞には多様なオルガネラが存在しており,それらのあいだでは小胞や小管を介して物質のやりとりが行われている.この物質輸送系は膜交通(メンブレントラフィック)とよばれている.膜交通が正確に営まれるためには,輸送小胞への積み荷の積み込みと,輸送小胞と標的膜との融合のステップが厳密に制御されている必要がある.
一方,進化の過程ではオルガネラの多様化にともない新たに多くの膜交通経路が開拓されてきたものと推測される.近年の研究は,小胞の形成と繋留および融合のステップで機能する進化的に保存された一連のタンパク質がオルガネラと膜交通経路の特異性を規定するとともに,それらの多様化が真核生物における膜交通経路の多様化の原動力となったことを示唆している1).しかしながら,膜交通制御タンパク質の多様化と新規の膜交通経路の獲得との関連を実証的に証明した研究はこれまでほとんど例がない.
RAB GTPaseとSNAREは輸送小胞の標的膜への繋留と融合を制御するタンパク質である.活性化したRAB GTPaseはエフェクターとよばれるタンパク質を介して輸送小胞を標的膜に繋留する.そののち,輸送小胞に局在するR-SNAREと標的膜に局在するQ-SNAREとが複合体を形成し,これにより膜融合が実行される2)(図1).RAB GTPaseの個々のメンバーは特定の膜交通経路においてのみ機能し,さらにその制御のもとSNARE複合体によるオルガネラに特異的な膜融合が実行されている.このように,RAB GTPaseとSNAREは細胞における物質輸送を正確に行うにあたり重要な役割を担うタンパク質である.
RAB GTPaseのなかでもRAB5とよばれるサブグループは動物や酵母などを含め真核生物に広く保存されており,エンドソームとよばれるオルガネラにおいて機能している.動物のRAB5については多様なエフェクタータンパク質を使い分けることで膜融合以外にもさまざまなエンドソーム機能の調節を行っていることが知られている3).陸上植物には,ほかの生物のRAB5に類似したRAB5ホモログ(保存型RAB5)にくわえ,非常に特徴的な構造をもつ植物に独自のRAB5(ARA6)が存在している.保存型RAB5についてはシロイヌナズナの保存型RAB5であるARA7とRHA1がエンドソームに局在しエンドサイトーシス経路と液胞輸送経路で機能していることが示され,植物においてもRAB5がエンドソームで機能することが明らかになっていた.一方,ARA6については,ARA7やRHA1と共通の活性化タンパク質(VPS9a)により活性化されるものの,それらとは一部が異なるエンドソームに局在することから,保存型RAB5とは異なる機能をもつことが示唆されていた4,5).しかしながら,植物が保存型RAB5とARA6の2つのRAB5をいかに使い分けているのか,そのことにどのような生理的な意義があるのかについては,これまでまったく明らかになっていなかった.
植物はSNAREについても進化の過程で植物に固有のタンパク質を獲得している.植物のR-SNAREの特徴としてまずあげられるのがVAMP7メンバーの多様化である.植物のVAMP7はVAMP71とVAMP72の2つのグループに大別される.それらにくわえ,陸上植物にはさらにVAMP72から派生したVAMP727とよばれるサブグループが存在する6).シロイヌナズナを用いた解析からこれらVAMP7のサブグループはそれぞれ異なるオルガネラに局在し異なる膜交通経路で機能していることが示唆されていた7).筆者らは,とくにVAMP727に注目して解析を行ってきており,これまでにVAMP727がエンドソームから液胞への輸送経路において機能すること,この輸送経路が種子の形成において重要な役割を担っていることを明らかにしている8).この研究においては,陸上植物に固有の膜交通制御タンパク質であるARA6とVAMP727の機能をさらに明らかにするとともに,これらが機能する膜交通経路が陸上植物のどのような形質に関与しているのかを明らかにすることを試みた.
1.ARA6のノックアウト変異体は保存型RAB5のノックアウト変異体とは逆の表現型を示す
ARA6の機能を明らかにするためノックアウト変異体を作出し表現型の解析を行ったが,通常の栽培条件では異常な表現型は観察されなかった.また,保存型RAB5と機能が重複している可能性を考え保存型RAB5のノックアウト変異体との多重変異体を作製したが,ARA6遺伝子と保存型RAB5遺伝子とのあいだに遺伝学的な相互作用は観察されなかった.そこでさらに,液胞の膜融合を制御するQ-SNAREをコードするSYP22/VAM3遺伝子をはじめとする液胞輸送経路およびエンドサイトーシス経路で機能する遺伝子との遺伝学的な相互作用を解析した.その結果,ARA6遺伝子および保存型RAB5遺伝子とSYP22遺伝子とのあいだに非常に興味深い遺伝学的な相互作用が観察された.SYP22のノックアウト変異体であるsyp22-1変異体は個体の矮化,花成の遅延,葉の形態の異常などさまざまな表現型を示す.保存型RAB5遺伝子の変異はこれらsyp22-1変異体の表現型を昂進したのに対し,ARA6遺伝子の変異は驚いたことにsyp22-1変異体の異常な表現型をほぼ完全に抑圧した.また,同様のまったく逆の遺伝学的な相互作用が,RAB5の活性化タンパク質をコードするVPS9a遺伝子とのあいだにおいても観察された.これらの結果から,ARA6は保存型RAB5とはまったく異なる機能をもつことが明らかになった.
保存型RAB5とSYP22はともにエンドソームから液胞への輸送を正に制御するタンパク質であると考えられている.一方,エンドサイトーシスにおけるこれらのタンパク質の機能はこれまで不明であった.そこで,細胞膜から液胞へとエンドサイトーシス経路により輸送されるホウ素輸送体BOR1の挙動をそれぞれの変異体において観察した.その結果,syp22-1変異体ではBOR1のエンドソームから液胞への輸送に遅延がみられ,ARA6遺伝子の変異はこの表現型を抑圧することが示された.以上の結果から,ARA6はエンドソームから液胞への輸送経路と拮抗する輸送経路において機能していることが示された.
2.ARA6はVAMP727とSYP121との複合体の形成の制御を介してエンドソームから細胞膜への輸送において機能する
さきに述べた遺伝学的な解析から,保存型RAB5とARA6の2つのRAB5が拮抗する輸送経路において機能していることが示唆された.では,ARA6は具体的にどのような輸送経路で機能しているのだろうか.
活性型固定変異を導入したRAB GTPaseは膜から解離しにくくなるため,しばしば標的オルガネラに蓄積することが知られている.以前のプロトプラストを用いた一過的な発現実験では,活性型固定変異を導入したARA6および保存型RAB5はともに液胞膜に蓄積することが観察されていた.この研究ではさらに,形質転換植物を用いて活性型固定変異を導入したARA6および保存型RAB5の細胞内局在を比較した.その結果,活性型の保存型RAB5はエンドソームと液胞にのみ局在が観察されたのに対し,活性型のARA6は液胞膜にくわえ細胞膜にも局在することが明らかになった.これは,ARA6が細胞膜を目的地とする輸送経路において機能しており,そのあと細胞膜からエンドサイトーシスされた活性型ARA6が液胞に蓄積しているという可能性を示していた.そこで,ウォルトマンニン処理によるエンドサイトーシスの阻害の影響を調べたところウォルトマンニン処理が細胞膜に局在する活性型ARA6の量を有意に増加させることが明らかになった.さらに,全反射顕微鏡により細胞膜のごく近傍のみを選択的に観察したところ,野生型ARA6が細胞膜に局在していることも示された.これらのことから,ARA6が細胞膜において膜融合を制御していることが強く示唆された.
つづいて,植物に特異的なR-SNAREであるVAMP727についても詳細な解析を行った.筆者らのこれまでの研究により,VAMP727はSYP22と複合体を形成することにより液胞とエンドソームとのあいだの膜融合を実行していることが明らかになっている8).今回さらに,VAMP727が細胞膜のQ-SNAREであるSYP121とも複合体を形成していることを共免疫沈降法とFRET(fluorescence resonance energy transfer,蛍光共鳴エネルギー移動)解析により明らかにした.このことから,VAMP727は液胞膜と細胞膜において異なるSNARE複合体を形成することが示された.SYP22遺伝子のノックアウト変異体であるsyp22-1変異体の表現型がVAMP727の過剰発現により抑圧されること,および,syp22-1変異体にVAMP727遺伝子の変異を導入すると合成致死となることから8),syp22-1変異体の異常な表現型はVAMP727-SYP22複合体が関与する輸送経路の損傷に起因することが示唆された.そこで,ARA6遺伝子の変異によるsyp22-1変異体の表現型の抑圧がどのような輸送経路における損傷を反映したものであるかを明らかにするため,ARA6遺伝子の変異体および活性型ARA6の過剰発現体において,VAMP727とSYP22またはSYP121との結合量を共免疫沈降法により比較した.その結果,ARA6遺伝子の変異体ではVAMP727-SYP121複合体の量が減少し,活性型ARA6の過剰発現体ではこの複合体の量が増加していることが明らかになった.一方,液胞において膜融合を実行するVAMP727-SYP22複合体の量はARA6の有無により影響をうけなかった.これらの結果は,ARA6はVAMP727とSYP121との効率的な複合体の形成のみに必要であることを示していた.さらに,全反射顕微鏡を用いて細胞膜の近傍におけるこれらのタンパク質の挙動を観察した結果,細胞膜の近傍のドット状のコンパートメントにおいてVAMP727とSYP121とが複合体を形成していること,ARA6もこのコンパートメントに局在していることなどが明らかになった.これらのことから,ARA6はVAMP727とSYP121との細胞膜における複合体の形成を促進することにより,エンドソームから細胞膜への輸送を制御していることが明らかになった(図2).
3.ARA6は塩ストレス応答に重要なタンパク質である
以上の解析から,植物はARA6とVAMP727を獲得したことにより新たな膜交通経路を開拓したことが明らかになった.では,この輸送経路は植物のどのような形質と関連しているのだろうか.自然条件において植物はさまざまなストレスにさらされているが,動物とは異なり自ら移動することでストレスからのがれることはできない.そのため,植物は細胞レベルでの複雑な環境応答系を発達させているものと考えられる.また,好塩性植物であるアイスプラント(Mesembryanthemum crystallinum)では高NaCl条件においてARA6の発現の上昇することが報告されている9).そこで,ARA6と環境応答とのかかわりを探るため,NaClストレス環境において野生型,ARA6遺伝子の変異体,活性型ARA6の過剰発現体の生育を比較した.その結果,ARA6遺伝子の変異体では野生型と比べ有意な生育阻害が,活性型ARA6の過剰発現体では逆にNaCl耐性が観察された.さらに,塩ストレス環境において活性型ARA6の細胞内局在を観察したところ,細胞膜の近傍に通常ではみられないパッチ状の活性型ARA6の凝集体が観察された.これらの結果から,NaClストレス環境においてはARA6が細胞膜の近傍に特殊なドメインを形成し,これが植物のNaCl応答に重要な役割を担っている可能性が示唆された.
おわりに
この研究により,モデル植物であるシロイヌナズナにおいてARA6とVAMP727という植物に固有の膜交通制御タンパク質がエンドソームから細胞膜への輸送経路で機能していることが明らかになった.これらのタンパク質は広く陸上植物に保存されていることから,シロイヌナズナ以外の植物においてもこれらのホモログが協調して植物に独自の膜交通経路で機能しているものと考えられる.シロイヌナズナにおいてはこの経路が耐塩性に寄与していることが示された.このことは,ARA6が機能する膜交通経路が植物の環境応答において重要な役割を担っていることを示唆していた.今後,ARA6のエフェクタータンパク質の解析などをつうじた分子機構のより詳細な解析,さらには,単子葉植物やコケ植物といった多様な植物におけるARA6ホモログの機能解析から,この植物に固有の輸送経路の意義と起源をよりいっそう明らかにすることができるものと期待している.
文 献
- Dacks, J. B. & Field, M. C.: Evolution of the eukaryotic membrane-trafficking system: origin, tempo and mode. J. Cell Sci., 120, 2977-2985 (2007)[PubMed]
- Wickner, W. & Schekman, R.: Membrane fusion. Nat. Struct. Mol. Biol., 15, 658-664 (2008)[PubMed]
- Grosshans, B. L., Ortiz, D. & Novick, P.: Rabs and their effectors: achieving specificity in membrane traffic. Proc. Natl. Acad. Sci. USA, 103, 11821-11827 (2006)[PubMed]
- Ueda, T., Uemura, T., Sato, M. H. et al.: Functional differentiation of endosomes in Arabidopsis cells. Plant J., 40,783-789 (2004)[PubMed]
- Goh, T., Uchida, W., Arakawa, S. et al.: VPS9a, the common activator for two distinct types of Rab5 GTPases, is essential for the development of Arabidopsis thaliana. Plant Cell, 19, 1-12 (2007)[PubMed]
- Sanderfoot, A.: Increases in the number of SNARE genes parallels the rise of multicellularity among the green plants. Plant Physiol., 144, 6-17 (2007)[PubMed]
- Uemura, T., Ueda, T., Ohniwa, R. L. et al.: Systematic analysis of SNARE molecules in Arabidopsis: dissection of the post-Golgi network in plant cells. Cell Struct. Funct., 29, 49-65 (2004)[PubMed]
- Ebine, K., Okatani, Y., Uemura, T. et al.: A SNARE complex unique to seed plants is required for protein storage vacuole biogenesis and seed development of Arabidopsis thaliana. Plant Cell, 20, 3006-3021 (2008)[PubMed]
- Bolte, S., Schiene, K. & Dietz, K. J.: Characterization of a small GTP-binding protein of the rab 5 family in Mesembryanthemum crystallinum with increased level of expression during early salt stress. Plant Mol. Biol., 42, 923-936 (2000)[PubMed]
著者プロフィール
略歴:2010年 東京大学大学院理学系研究科 修了,同年 同 特任研究員を経て,2011年より国立感染症研究所寄生動物部 研究員.
研究テーマ:生物の進化におけるRab5の多様化の意義.
上田 貴志(Takashi Ueda)
東京大学大学院理学系研究科 准教授.
© 2011 海老根一生・上田貴志 Licensed under CC 表示 2.1 日本